На съвременните катализатори конверсията на въглеводородите протича при условия доближаващи се до термодинамическото равновесие. Реакциите на парова конверсия са обратими. Състава и добива на продуктите се определя от термодинамическото равновесие на протичащите реакции.
Конверсията на метана с водна пара може да се опише с реакциите:
CH4 + H2O 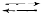 CO + 3H2 – 206,4 kJ (1)
CO + 3H2 – 206,4 kJ (1)
CO + H 2 O 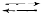 CO 2 + H 2 + 41,0 kJ (2)
CO 2 + H 2 + 41,0 kJ (2)
Константите на равновесие на реакциите (K1 и K2) се изразяват с уравненията:

където PCO, PH2, PCO2, PH2O, PCH4 – парциалните налягания на съответстващите компоненти в равновесната смес.
Началният и крайният състав на конвертирания газ, а също парциалните налягания на неговите компоненти при установяване на равновесие се изразяват с уравненията, приведени в табл. 5.
Табл. 5 Уравнения на равновесния състав на конвертирания газ и парциалните налянагия на неговите компоненти при конвесия на метана
| Компоненти | Обем на газовата смес, м3 | Парциално налягане на компонентите в конвертирания газ, MPa | |
| Начален | След конверсията | ||
| CH4 H2O CO CO2 H2 | 1 a - - - | 1 – α a – α – β α – β β 3α + β | ( 1 – α ) . Р 1 + a +2α (a – α – β).P 1 + a + 2α (α – β).P 1 + a + 2α β.P 1 + a + 2α (3α + β).P 1 + a + 2α |
| Общо | 1 + a | 1 + a + 2α = V | P |
Легенда: a – обем на подадената пара за единица от обема CH4; α – част на реагиралия CH4; β – част на реагиралия CO; Р – налягане в систе-мата; V – общ обем на конвертирания газ.
Замествайки съответно на парциалните налягания на компонентите в уравненията на константите на равновесие на реакциите се получава:
K 1 = [(α – β).(3α + β)3].P2
(1 – α ).( a – α – β ).(1 + a + 2 a )2 (5)
K 2 = β.(3α + β)
( α – β ).( a – α – β ) (6)
Хомолозите на метана C2 – C10 са по-неустойчиви при еднакви температурни условия отколкото метана, което е видно от данните за константите на равновесие на реакциите на конверсия на метана, етана и пропана с водна пара, приведени в табл. 6. Термодинамичните разчети са показали, че при 300 0С и по-висши хомолози на метана присъвстват в конвертирания газ в нищожни количества.
Табл. 6 Константи на равновесие на реакцията на кон версия на метана, етана и пропана в водна пара
| Температура, 0С | KCH4 | KC2H6 | KC3H8 |
| 327 427 527 627 727 827 | 5,058.10-7 2,687.10-4 3,120.10-2 1,306 26,56 3,133.102 | 3,805.10-7 1,467.10-2 43,281 2,268.104 3,505.106 2,184.108 | 5,686.10-8 0,2015 1,775.104 1,331.108 1,716.1011 6,084.1013 |
Термодинамичните изчисления на паровата конверсия на алифатните въглеводороди, започваща от 300 0С, може да бъде водена използвайки уравненията за парова конверсия на метана (2) и окиси на въглеро-да (3), а също и уравнението за парова конверсия на хомолозите на метана в метан (1). Предвид последните уравнения за стехиометричните съотношения на компонентите и техните парциални налягания при паровата конверсия на алифатните въглеводороди приемат значенията, приведени в табл.7.
Табл. 7 Уравнение за равновесния състав на конвертирания газ и парциалните налягания на неговите компоненти при конверсия на алифатните въглеводороди
| Компо-ненти | Обем на газовата смес, м3 | Парциално налягане на компонентите, MPa | |
| Начален | След конверия | ||
| CnH2n+2 CH4 H2O CO CO2 H2 | 1 - (n-1)/2 + [(3n + 1)a]/4 - - - | - (3n + 1)/4.(1 – α) (3n + 1)/4.(a – α – β) (3n + 1)/4.(α – β) (3n + 1)/4.β + (n – 1)/4 (3n + 1)/4.(3α + β) | - (3n + 1)/4.(1 – α).P/V (3n + 1)/4.(a – α – β).P/V (3n + 1)/4.(α – β).P/V [(3n + 1)/4.β + (n – 1)/4].P/V (3n + 1)/4.(3α + β).P/V |
| Общо | 1 + (n – 1)/2 + + (3n + 1)/4.a | (n – 1)/4 + (3n + 1)/4. .(1 + a + 2α) = V | P |
Замествайки парциялните налягания със значенията им от таблицата, в уравненията за константите на равновисие ще получим
K 1 = (α – β).(3α + β) 3 . [(3 n – 1)/4. P / V ]2
(1 – α ).( a – α – β ) (7)
K 2 = [(n – 1)/(3n +1) + β](3α + β)
( α – β ).( a – α – β ) (8)
Уравнения (5) и (6) са частен случай на уравнения (7) и (8), когато n=1.
Последните уравнения позволяват да се изчисляват състава и добива на конвертиран газ не само за процеса на пълна конверсия на въглеводородите, когато преобладаващи компонент стават H2, CO, CO2, а съдържанието на CH4 неголямо, но и за частична конверсия на въглеводородите, когато преобладаващ продукт на реакциите се явява CH4.
С помощта на горните уравнения и таблици с метода за последователното приближение се извършват дигитални изчисления за условията на протичане на реакциите на парова конверсия за съвременните схеми за производство на водород. Във връзка с това, че в реални условия рав-новесието на реакциите на конверсия на метана с пара не се достига, за практически изчисления на K1 се приема температура, по-ниска от темпе-ратурата на изход от реактора. При провеждане на процеса под налягане 2 – 3MPa разликата е 20 -30 0С.
Паровата конверсия на въглеводородите се провежда така, че на катализатора да не се отлага водород. Закоксуването с въглерод върху катализатора може да доведе до неговото разрушение и увеличаване на съпротивлението на катализаторния слой. Затова едновременно с описаните по-горе изчисления се правят и разчети на термодинамичното равновесие на реакциите с възможно образуване на въглерод в системата по една от следващите реакции:
CnH2n+2 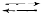 nC +(n + 1)H2 – Q
nC +(n + 1)H2 – Q
CO + H2 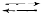 C + H2O + Q
C + H2O + Q
2 CO  C + CO 2 + Q
C + CO 2 + Q
Константите на равновесие на реакциите на разпадане на въглеводородите приведени в приложение в табл. 8. Константите на равновесие на последните две реакции K3 и K4 са следните:
Температура K3 = PCOPH 2 K4 = ( PCO )2
PH2O PCO2
300 1,43.10-5 3,60.10-7
500 2,01.10-2 4,51.10-3
700 2,00 1,32
900 2,97.101 3,90.101
1100 2,25.102 4,72.102
Табл. 8 Константи на равновесие на реакциите на разпадане на въглеводородие
| Тем- пера- тура, 0С | KCH4 | KC2H6 | KC3H8 | KC2H4 | KC3H6 | KC2H2 |
| 200 400 600 800 1000 1200 1400 | 9,3.103 2,0.10 6,9.10-1 8,5.10-2 2,0.10-2 7,1.10-3 3,2.10-3 | 1,4.10 3,3.10-3 3,3.10-5 1,9.10-6 2,6.10-7 6,3.10-8 2,1.10-8 | 32.10-2 1,0.10-6 1,5.10-9 1,1.10-10 9,8.10-12 1,7.10-12 4,7.10-13 | 5,5.10-8 3,5.10-7 9,1.10-7 1,7.10-6 2,5.10-6 3,5.10-6 4,4.10-6 | 3,2.10-10 2,5.10-10 2,2.10-10 2,0.10-10 1,9.10-10 1,8.10-10 1,7.10-10 | 2,5.10-23 1,4.10-14 1,7.10-11 6,3.10-9 3,6.10-7 6,9.10-6 6,6.10-5 |
За определяне на термодинамичните условия за отложение на въглерод по реакция CO + H2  C + H2O намираме константата на равновесие по формулата:
C + H2O намираме константата на равновесие по формулата:
K 3 = PCOPH2
PH 2 O
Използвайки парциалните налягания на реакцията на конверсия от табл. 7 ще получим за K3 следното уравнение:
K3 = (α – β)(3α + β)(1 + a + 2α) .V
(a – α – β) P
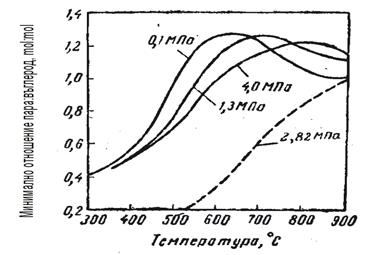
Минималният разход на пара в процеса на парова конверсия на нефтени газове и бензини, под който е възможно закоксуване, се определя като се решат съвместно последното уравнение с уравнения (7) и (8). Тогава ще получим:
K 3 = (α – β)(3α + β)(3n + 1) . V
( a – α – β ) P
Тези уравнения обаче не се отнасят за конверсия на газове, съдържащи ненаситени и ароматни въглеводороди, които на вход в реакторната зона могат да се разпаднат с отделяне на въглерод.
Процесът на парова конверсия се извършва с топлообмен през стените на реактора. Количеството на подаваната топлинна енергия може да се изчисли след като са определени добива и състава на конвертирания газ. Сметките се правят възоснова на първия закон на термодинамиката по уравнението на топлинния баланс:
q = Q н ’ + t ’.( c ’ + ac ’) – V .( Q н ’’ + c ’’ t ’’)
, където q – топлината подадена отвън в процеса на парова конверсия (ПК) на 1 м3 изходящ газ, kJ/m3; Qн’ – топлината на изгаряне на изходния газ, kJ/m3; Qн’’ – топлината на изгаряне на влажния конвертиран газ, kJ/m3; t’ и t’’ – температура на парогазовата смес на вход в реактора и температура на конвертирания газ на изход от реактора, 0С; c’ – средна топлоемкост на изходния газ и водната пара при постоянно налягане и температура на вход в реактора, kJ/(m3.0C); c’’ – средна топлоемкост на влажния конвертиран газ при постоянно налягане и температура на изход от реактора, kJ/(m3.0C); V – обем на влажния конвертиран газ, получен за 1 м3 от изходния газ, м3; a – обем на водната пара, подавана за 1 м3 от изходния газ, м3.
Режим на процеса
Режимът на паро-каталитичната конверсия на въглеводородите трябва да осигурява получаване на технически водород със съдържание 95 – 98% H2. При по-ниска концентрация се повишават разходите на инсталацията за хидрокрекинг. Производството на водород с висока концентрация изисква големи капита-ловложения и не е оправдано икономически. Технически водород с концентра-ция около 95% водород може да се получи при съдържание в сухия конвертиран газ 2 – 2,5% метан, тъй като в следващите процеси на очистване от CO2 след конверсията на въглеродния оксид и метаниране съдържанието на метана в газа нараства до 4 – 5%. Степента на конверсия на метана в такъв случай е 0,9. Технически водород със съдържание 98% Н2 се получава при съдържание в конверти-рания газ на 1 – 1,3% СН4 или степен на конверсия на метана 0,95.
Водород със съответната концентрация може да бъде получен чрез изменение на налягането, температурата и отношението пара/метан. Връзката между тези параметри е илюстрирана на фигура 1 и 2.
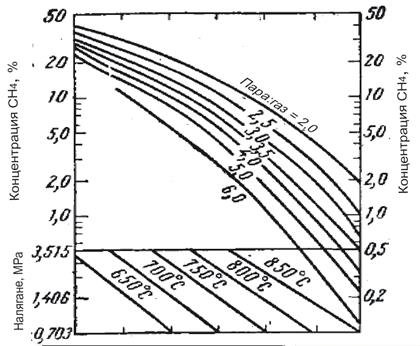
Фиг. 1 Зависимост на конц. СН4 в сухия газ от температурата, на негането, отношението пара/метан в условията на достигнато термодинамично равновесие
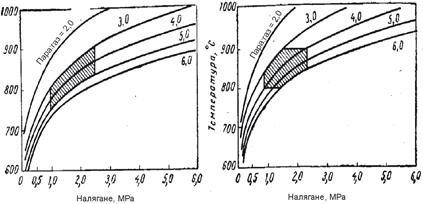
Фиг.2 Режими на процеса на ПК на метана, осигуряващи в условията на ТД равновесие получаване на 95% Н2 и 96% Н2 (съответно първата и втора графика; защрихованите об ласти са условията, при които се работи в съществуващи те инсталации)
Както се вижда от фигурите, режимът може да се променя в широки диапазони, но техническите възможности на оборудването, а също и режимите на другите стадии на производство и отделянето на въглерод при определени гранични условия, значително стесняват този диапазон. Резултатите от пресмятането за минимален разход на пара, под които се отделя въглерод, са показани във фи-гура 3.
Дата: 2019-05-28, просмотров: 323.