ТЕМА 7. Реакционная способность шестичленных ароматических гетероциклов, содержащих азот. Шестичленные кислородсодержащие гетероциклические соединения группы пирана. Понятие о семичленных гетероциклах.
ПЛАН.
1. Примеры шестичленных ароматических гетероциклов с одним и двумя гетероатомами.
2. Основные свойства.
3. Нуклеофильные свойства пиридина. Химическая основа действия кофермента НАД+.
4. Реакции замещения в ароматическом ядре.
5. β-Гидрокси- и β–аминопроизводные пиридина. 8-Гидроксихинолин.
6. Лактам-лактимная таутомерия α-гидроксипроизводных.
7. Барбитуровая кислота. Барбитураты.
8. Реакции окисления и восстановления. Окисление гомологов пиридина.
9. Примеры лекарственных веществ и витаминов на основе шестичленных гетероциклов.
10.Обзор гетероциклических соединений группы пирана.
11. Примеры реакций пиронов и бензопиронов.
12.Цианидиновая проба на флавоноиды. Восстановление цианидина. 13.Понятие о семичленных гетероциклических соединениях.
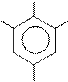
Примеры шестичленных ароматических гетероциклов с одним и двумя гетероатомами.
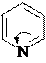
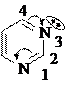
 4
4
5 5 3
4
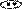 5 N 3
5 N 3
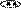
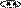 ЭА 6 6
ЭА 6 6
N N 2 6 12
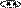
|
пиридин пиримидин пиридазин пиразин
(азин) (диазин-1,3) (диазин-1,2) (диазин-1,4)
5 4 5 4

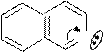 6 3 6 3
6 3 6 3
 2 7 N 2
2 7 N 2
 1 8 1
1 8 1
больше элект- больше элект-
ронная плотность ронная плотность
хинолин изохинолин
(бензо-[в]-пиридин) (бензо-[с]-пиридин)
Гетероатомы в составе шестичленных ароматических гетероциклов имеют пиридиновое строение, неподеленная пара электронов гетероатома не участвует в ароматической π-электронной системе молекулы, она занимает гибридную орбиталь в плоскости цикла и может образовывать связи с электронодефицитными частицами, например, протоном, без нарушения
ароматического строения цикла. Поэтому шестичленные ароматические гетероциклы неацидофобны.
Электронное влияние пиридинового гетероатома на атомы углерода цикла является электроноакцепторным (-IN, -МN), электронная плотность на атомах углерода в цикле понижена (в сравнении с бензолом). Поэтому шестичленные ароматические гетероциклы – π-недостаточные системы.
Ароматичность шестичленных ароматических гетероциклических соединений довольно высокая. Например, ароматичность пиридина выше, чем у пятичленных тиофена, фурана, пиррола, но уступает бензолу. Второй и третий гетероатом в цикле могут как увеличивать, так и уменьшать термодинамическую устойчивость соединения. Относительно высокой ароматичностью, обычно, обладают гетероциклы с более «равномерным», симметричным распределением гетероатомов в структуре цикла.
Основные свойства.
Основные свойства шестичленных ароматических гетероциклических соединений обусловлены основным центром на пиридиновых гетероатомах и в целом выражены слабо. Сравнительная характеристика основных свойств некоторых гетероциклических соединений показана на схеме.
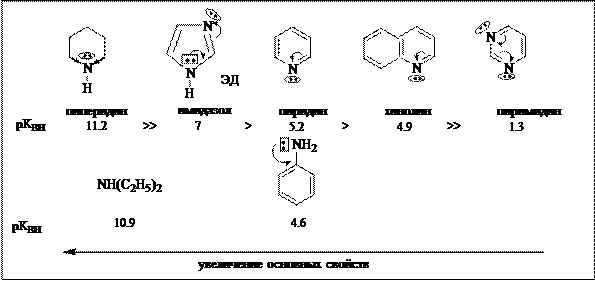 |
Сравнительная характеристика основных свойств:
Пиридин – слабое основание. Его основные свойства заметно уступают имидазолу и являются существенно более слабыми, чем у насыщенного пиперидина. Основные свойства пиридина сопоставимы со свойствами первичного ароматического амина анилина. Конденсация пиридинового цикла с бензольным ядром и, особенно, введение в цикл еще одного гетероатома (ЭА) уменьшают основные свойства соединения.
Примеры реакций:
пиридин растворим в воде, его раствор имеет слабо-щелочную среду:


 + HOH
+ HOH
 N N
N N
H
+ OH , pH > 7
катион пиридиния
 + H2SO4
+ H2SO4
N

HSO -



|
 O
O
 O2N
O2N
N
OH
 NO2
NO2
NO2

 N H
N H
O2N
 x
x
 NO2
NO2
NO2
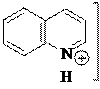 пикрат пиридиния (желтый осадок)
пикрат пиридиния (желтый осадок)
 |
+ HCl Cl
 |  | ||

 хлорид хинолиния (хинолина гидрохлорид)
хлорид хинолиния (хинолина гидрохлорид)
Пиримидин имеет в молекуле два основных центра, но образует соль только с одним эквивалентом кислоты, т.е. является однокислотным основанием:
 + HCl
+ HCl
HCl

 Cl
Cl

 |  | ||
1 эквивалент избыток нет реакции
хлорид пиримидиния
Катионный центр катиона пиримидиния оказывает настолько сильное электроноакцепторное действие на второй основный центр, что лишает его таким образом способности вступать в дальнейшую реакцию.
3. Нуклеофильные свойства пиридина. Химическая основа окислительно-восстановительного действия кофермента НАД+.
Нуклеофильные свойства пиридина, так же как и основные, обусловлены неподеленной электронной парой атома азота. Пиридин легко алкилируется и ацилируется выполняя в реакциях нуклеофильного замещения (SN) роль
нуклеофильного реагента. Для алкилирования пиридина используют в качестве субстрата алкилгалогениды и диалкилсульфаты, для ацилирования – ангидриды и ацилгалогениды. Если реакция проводится при комнатной температуре или охлаждении, образуются соли N-алкил- и N-ацилпиридиния.
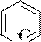
 Примеры реакций:
Примеры реакций:
 +d SN
+d SN

 + CH3 I
+ CH3 I
 N CH3
N CH3
I алкилирование
 реагент субстрат иодид N-метилпиридиния
реагент субстрат иодид N-метилпиридиния
 +d
+d
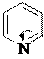

 CH3-CH2 O O
CH3-CH2 O O
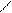
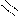 2 + S
2 + S
 SO 2-
SO 2-
4
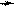 CH -CH O O
CH -CH O O
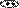
 3 2 2
3 2 2
 C2H5
C2H5

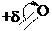
 + CH3-C
+ CH3-C
N Cl

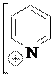

 C=O CH3
C=O CH3
Cl ацилирование
хлорид N-ацетилпиридиния
Химическая основа действия НАД + .
Положительный заряд катиона N-алкилпиридиния делокализован:
 |  |  | |||
N N N N



 R R R R
R R R R
Дефицит электронов в катионе делает его легко восприимчивым к нуклефильной атаке, например, гидрид-анионом Н:– (реакция восстановления). Продукт присоединения гидрид-аниона не имеет ароматического строения, относительно неустойчив, поэтому легко протекает обратная реакция (реакция окисления):
 H восстановление
H восстановление

 +d + H:
+d + H:
 |
N - H:-

 окисление
окисление
R
H H
 sp3
sp3
 N R
N R
нет ароматического строения
Обратимая реакция восстановления N-алкилпиридиниевого катиона рассматривается как химическая основа действия кофермента НАД+. НАД+ (никотинамидадениндинуклеотид) – один из коферментов, с помощью
 |
 которых в организме осуществляются ферментативные окислительно- восстановительные процессы:
которых в организме осуществляются ферментативные окислительно- восстановительные процессы:
НАД+ + Н: НАДН
окисленная восстановленная
форма форма
кофермента кофермента
В этих процессах химическим изменениям подвергается никотинамидный структурный фрагмент НАД+, который имеет
природу N-алкилпиридиниевого катиона:
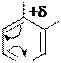
 H O
H O
 C
C
NH2

 N
N
R
остаток амида никотиновой кислоты в составе кофермента НАД+
Обратимое окисление S(+)-молочной кислоты в пировиноградную кислоту – пример одной из окислительно-восстановительных реакций, которые осуществляет НАД+ в организме:
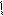
 CH3-CH-COOH
CH3-CH-COOH
OH
 НАД+ + Н: + Н+
НАД+ + Н: + Н+
CH3-C-COOH
 НАДН + Н+
НАДН + Н+
 H
H
+d C
 N R
N R
O

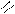
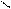
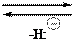 NH2 +H:
NH2 +H:
H H O C
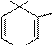

 NH2
NH2
 N R
N R
Примеры лекарственных средств и витаминов на основе шестичленных гетероциклов.
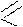 O
O
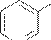 C
C
NH2
N
Витамин РР (амид никотиновой кислоты); применяется при заболеваниях пеллагрой, гепатитом и некоторых других болезнях.
 O
O
C
NH-NH2
N
Изониазид (гидразид изоникотиновой кислоты); противотуберкулезное средство.
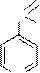
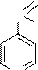 O
O
 C
C
NH-N=CH OH
OCH3
N
Фтивазид (4-гидрокси-3-метоксибензилиденгидразид изоникотиновой кислоты); противотуберкулезное средство.
 NO2
NO2
N
OH
Нитроксолин (8-гидрокси-5-нитрохинолин); антибактериальное средство, применяют при инфекциях урогенитального тракта.
 Cl
Cl
I N
OH
Энтеросептол (8-гидрокси-7-иодо-5-хлорхинолин); местнодействующее антибактериальное средство.
 O
O
 H R'
H R'
N
R''
 O N O H
O N O H
Барбитураты (5,5-производные барбитуровой кислоты); оказывают успокаивающее, снотворное и противосудорожное действие.

 O
O


 O C CH3
O C CH3
COO

 OH
OH
 N H
N H
Ацеклидин (3-ацетоксихинуклидина салицилат); является
холиномиметическим веществом, стимулирует преимущественно м- холинореактивные системы организма.


 C6H5
C6H5
 C
C
 C6H5
C6H5
 OH
OH
 N Cl
N Cl
H
Фенкарол (хинукледил-3-дифенилметанола гидрохлорид); противогистаминный препарат для лечения различных аллергий.

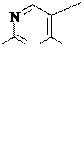
 H3C N N
H3C N N
S CH2
CH2

 OH
OH
Br x HBr
 Тиамин (витамин В1); один из важнейших витаминов.
Тиамин (витамин В1); один из важнейших витаминов.
Примеры реакций пиронов и бензопиронов.
Пироны и бензопироны – реакционноспособные соединения. Их реакции достаточно разнообразны.
Возможные реакционные центры, некоторые типы реакций:
 основный, Образование солей с кислотами,
основный, Образование солей с кислотами,
O нуклеофильный алкилирование
 (+d)
(+d)
-d -d
реакции электрофильного замещения (SE)
+d O +d реакции с нуклеофилами,приводящие к
раскрытию цикла
 g-пирон
g-пирон
O +d O
лактон
a-пирон
реакции нуклеофильного замещения с раскрытием цикла
g-Пирон, хромон и их производные образуют соли с кислотами и алкилируются по атому кислорода оксогруппы. Продуктами этих реакций являются соли замещенного катиона пирилия и бензопирилия.
Образование солей пирилия:

 H3C O
H3C O
CH3
HCl
H3C
OH

 O CH3
O CH3
2,6-диметилпирон- 4
Cl
 4-гидрокси-2,6-диметил-пирилия хлорид
4-гидрокси-2,6-диметил-пирилия хлорид
 O-CH3
O-CH3
 H3C O
H3C O
Cl
CH3
4-метокси-2,6 -диметил-пирилия хлорид
С магнийорганическими соединениями (реактив Гриньяра) сначала происходит типичная для кетонов реакция нуклеофильного присоединения
(АN), но при подкислении продукт присоединения теряет гидроксил и образуется катион пирилия.
 Реакция с магнийорганическими соединениями:
Реакция с магнийорганическими соединениями:
 -d +d
-d +d
OMgCl

 CH3-CH2- MgCl
CH3-CH2- MgCl
C2H5 HCl
H3C
CH3 AN OH
H3C
O
 C2H5
C2H5
CH3

-MgCl2
C2H5 HCl
H3C O
CH3

-H2O
H3C
CH3

 Cl
Cl
Другие реакции кетонов, обычно, не характерны для пиронов и бензопиронов.
Реакции электрофильного замещения (SE) происходят в положения 3 и 5 у g-пиронов и по бензольному кольцу у хромона, если в молекуле есть электронодонорные заместители:
 O
O
H
R O R
O

 Br2, FeCl3 Br
Br2, FeCl3 Br
R O R

 O
O
 CH3 HNO3, H2SO4 O2N O CH3
CH3 HNO3, H2SO4 O2N O CH3
O
CH3 CH3
Реакции с сильными нуклеофильными реагентами приводят к расщеплению гетероцикла пиронов и бензопиронов при атаке нуклеофила в
a-положение:

 O
O
KOH
+d
O R
 KOH
KOH
O
C OH
OK R
O
 H
H
 H
H
C O
OK R




|
OH OK
O O
Гетероцикл пиронов сравнительно легко восстанавливается в условиях гетерогенного катализа. Конечными продуктами восстановления являются тетрагидропиранолы:
 O
O
R O R
OH
 3H2, Pd H
3H2, Pd H

R O R
замещенный
g-пирон
замещенный тетрагидро-g
-пиранол
ТЕМА 7. Реакционная способность шестичленных ароматических гетероциклов, содержащих азот. Шестичленные кислородсодержащие гетероциклические соединения группы пирана. Понятие о семичленных гетероциклах.
ПЛАН.
1. Примеры шестичленных ароматических гетероциклов с одним и двумя гетероатомами.
2. Основные свойства.
3. Нуклеофильные свойства пиридина. Химическая основа действия кофермента НАД+.
4. Реакции замещения в ароматическом ядре.
5. β-Гидрокси- и β–аминопроизводные пиридина. 8-Гидроксихинолин.
6. Лактам-лактимная таутомерия α-гидроксипроизводных.
7. Барбитуровая кислота. Барбитураты.
8. Реакции окисления и восстановления. Окисление гомологов пиридина.
9. Примеры лекарственных веществ и витаминов на основе шестичленных гетероциклов.
10.Обзор гетероциклических соединений группы пирана.
11. Примеры реакций пиронов и бензопиронов.
12.Цианидиновая проба на флавоноиды. Восстановление цианидина. 13.Понятие о семичленных гетероциклических соединениях.
Примеры шестичленных ароматических гетероциклов с одним и двумя гетероатомами.
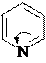
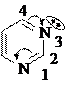
 4
4
5 5 3
4

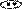 5 N 3
5 N 3
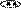
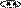 ЭА 6 6
ЭА 6 6
N N 2 6 12
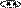
|
пиридин пиримидин пиридазин пиразин
(азин) (диазин-1,3) (диазин-1,2) (диазин-1,4)
5 4 5 4

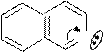 6 3 6 3
6 3 6 3
 2 7 N 2
2 7 N 2
 1 8 1
1 8 1
больше элект- больше элект-
ронная плотность ронная плотность
хинолин изохинолин
(бензо-[в]-пиридин) (бензо-[с]-пиридин)
Гетероатомы в составе шестичленных ароматических гетероциклов имеют пиридиновое строение, неподеленная пара электронов гетероатома не участвует в ароматической π-электронной системе молекулы, она занимает гибридную орбиталь в плоскости цикла и может образовывать связи с электронодефицитными частицами, например, протоном, без нарушения
ароматического строения цикла. Поэтому шестичленные ароматические гетероциклы неацидофобны.
Электронное влияние пиридинового гетероатома на атомы углерода цикла является электроноакцепторным (-IN, -МN), электронная плотность на атомах углерода в цикле понижена (в сравнении с бензолом). Поэтому шестичленные ароматические гетероциклы – π-недостаточные системы.
Ароматичность шестичленных ароматических гетероциклических соединений довольно высокая. Например, ароматичность пиридина выше, чем у пятичленных тиофена, фурана, пиррола, но уступает бензолу. Второй и третий гетероатом в цикле могут как увеличивать, так и уменьшать термодинамическую устойчивость соединения. Относительно высокой ароматичностью, обычно, обладают гетероциклы с более «равномерным», симметричным распределением гетероатомов в структуре цикла.
Основные свойства.
Основные свойства шестичленных ароматических гетероциклических соединений обусловлены основным центром на пиридиновых гетероатомах и в целом выражены слабо. Сравнительная характеристика основных свойств некоторых гетероциклических соединений показана на схеме.
 |
Сравнительная характеристика основных свойств:
Пиридин – слабое основание. Его основные свойства заметно уступают имидазолу и являются существенно более слабыми, чем у насыщенного пиперидина. Основные свойства пиридина сопоставимы со свойствами первичного ароматического амина анилина. Конденсация пиридинового цикла с бензольным ядром и, особенно, введение в цикл еще одного гетероатома (ЭА) уменьшают основные свойства соединения.
Примеры реакций:
пиридин растворим в воде, его раствор имеет слабо-щелочную среду:



 + HOH
+ HOH
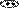
 N N
N N
H
+ OH , pH > 7
катион пиридиния
 + H2SO4
+ H2SO4
N

HSO -




|
 O
O

 O2N
O2N
N
OH
 NO2
NO2
NO2

 N H
N H
O2N

 x
x
 NO2
NO2
NO2
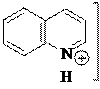 пикрат пиридиния (желтый осадок)
пикрат пиридиния (желтый осадок)
 |
+ HCl Cl
 |  | ||

 хлорид хинолиния (хинолина гидрохлорид)
хлорид хинолиния (хинолина гидрохлорид)
Пиримидин имеет в молекуле два основных центра, но образует соль только с одним эквивалентом кислоты, т.е. является однокислотным основанием:
 + HCl
+ HCl
HCl

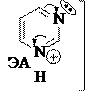
 Cl
Cl

 |  | ||
1 эквивалент избыток нет реакции
хлорид пиримидиния
Катионный центр катиона пиримидиния оказывает настолько сильное электроноакцепторное действие на второй основный центр, что лишает его таким образом способности вступать в дальнейшую реакцию.
3. Нуклеофильные свойства пиридина. Химическая основа окислительно-восстановительного действия кофермента НАД+.
Нуклеофильные свойства пиридина, так же как и основные, обусловлены неподеленной электронной парой атома азота. Пиридин легко алкилируется и ацилируется выполняя в реакциях нуклеофильного замещения (SN) роль
нуклеофильного реагента. Для алкилирования пиридина используют в качестве субстрата алкилгалогениды и диалкилсульфаты, для ацилирования – ангидриды и ацилгалогениды. Если реакция проводится при комнатной температуре или охлаждении, образуются соли N-алкил- и N-ацилпиридиния.
 Примеры реакций:
Примеры реакций:
 +d SN
+d SN

 + CH3 I
+ CH3 I
 N CH3
N CH3
I алкилирование

 реагент субстрат иодид N-метилпиридиния
реагент субстрат иодид N-метилпиридиния
 +d
+d

 CH3-CH2 O O
CH3-CH2 O O
 2 + S
2 + S
 SO 2-
SO 2-
4
 CH -CH O O
CH -CH O O
 3 2 2
3 2 2
 C2H5
C2H5


 + CH3-C
+ CH3-C
N Cl

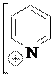

 C=O CH3
C=O CH3
Cl ацилирование
хлорид N-ацетилпиридиния
Химическая основа действия НАД + .
Положительный заряд катиона N-алкилпиридиния делокализован:
 |  |  | |||
N N N N



 R R R R
R R R R
Дефицит электронов в катионе делает его легко восприимчивым к нуклефильной атаке, например, гидрид-анионом Н:– (реакция восстановления). Продукт присоединения гидрид-аниона не имеет ароматического строения, относительно неустойчив, поэтому легко протекает обратная реакция (реакция окисления):
 H восстановление
H восстановление

 +d + H:
+d + H:
 |
N - H:-

 окисление
окисление
R
H H
 sp3
sp3
 N R
N R
нет ароматического строения
Обратимая реакция восстановления N-алкилпиридиниевого катиона рассматривается как химическая основа действия кофермента НАД+. НАД+ (никотинамидадениндинуклеотид) – один из коферментов, с помощью
 |
 которых в организме осуществляются ферментативные окислительно- восстановительные процессы:
которых в организме осуществляются ферментативные окислительно- восстановительные процессы:
НАД+ + Н: НАДН
окисленная восстановленная
форма форма
кофермента кофермента
В этих процессах химическим изменениям подвергается никотинамидный структурный фрагмент НАД+, который имеет
природу N-алкилпиридиниевого катиона:
 H O
H O
 C
C
NH2

 N
N
R
остаток амида никотиновой кислоты в составе кофермента НАД+
Обратимое окисление S(+)-молочной кислоты в пировиноградную кислоту – пример одной из окислительно-восстановительных реакций, которые осуществляет НАД+ в организме:
 CH3-CH-COOH
CH3-CH-COOH
OH
 НАД+ + Н: + Н+
НАД+ + Н: + Н+
CH3-C-COOH
 НАДН + Н+
НАДН + Н+
 H
H
+d C
 N R
N R
O

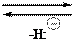 NH2 +H:
NH2 +H:
H H O C
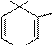

 NH2
NH2
 N R
N R
Реакции замещения в ароматическом кольце.
π-Недостаточность ароматических шестичленных гетероциклических соединений делает реакции электрофильного замещения (SE) для них трудно осуществимыми и, одновременно, увеличивает возможности протекания реакций нуклеофильного замещения (SN). В ряду соединений пятичленные ароматические гетероциклы → арены → шестичленные ароматические гетероциклы – характерность реакций SE уменьшается, а реакций SN увеличивается:
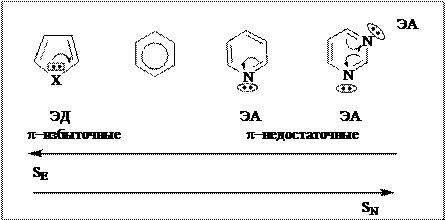
Электроноакцепторное влияние двух пиридиновых гетероатомов в молекулах шестичленных ароматических гетероциклов оказывается настолько сильным, что реакции электрофильного замещения SE у незамещенных гетероциклов с двумя гетероатомами не происходят. Только присутствие электронодонорных (ЭД) заместителей делает реакции SE осуществимыми у этого класса гетероциклических соединений.
Реакции SE и SN происходят в разные положения шестичленного гетероцикла, в соответствии с распределением электронной плотности в молекуле. Например, в молекуле пиридина электрофильное замещение осуществляется в β-положения относительно гетероатома (положения 3 и 5), а нуклеофильное замещение – в α- и γ-положения (2 и 4).
 |
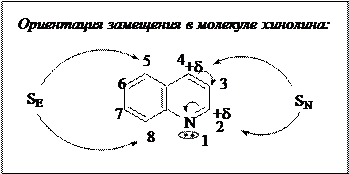 |
В молекуле хинолина реакции замещения происходят в разных циклах: электрофильное замещение, преимущественно,- в бензольное кольцо (положения 5,8 в кинитически- и 6, 7 в термодинамически контролируемых реакциях), нуклеофильное замещение – в пиридиновое кольцо.
Электрофильное замещение.
Реакции электрофильного замещения у шестичленных гетероциклических соединений протекают достаточно трудно и в жестких условиях. Большинство этих реакций происходят в кислой среде, в условиях, в которых молекулы гетероциклов превращаются в катионы, поскольку все они являются основаниями. Протонирование пиридинового гетероатома и превращение в катионный центр увеличает его электроноакцепторное влияние и дополнительно затрудняет таким образом реакции с электрофилами. По механизму SE протекают нитрование, сульфирование и галогенирование.
Схемы реакций SE.
 -d -d
-d -d
N
KNO3,H2SO4 конц.
NO2 SO3H
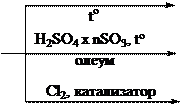
 Cl
Cl
N
нитрование сульфирование
галогенирование
|



 N -HOH N
N -HOH N
H H
NO2
более сильный ЭА
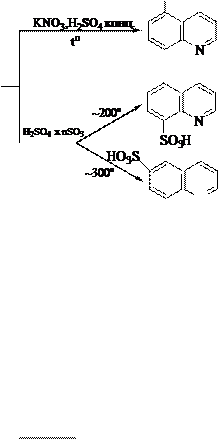 N
N
 электронная ЭА плотность больше
электронная ЭА плотность больше
NO2
 +
+
N
NO2
N
Электродонорные заместители в гетероциклическом ароматическом кольце способствуют протеканию реакций электрофильного замещения и определяют ориентацию замещения. Например, незамещенный пиримидин не реагирует с бромом, но 2-амино-пиримидин бромируется в n-положение относительно электронодонорного заместителя:
 Br2 (SE) нет реакции
Br2 (SE) нет реакции
ЭА
 N NH2
N NH2
Br2 (SE) Br

 NH2
NH2
Нуклеофильное замещение.
Реакции нуклеофильного замещения в молекуле пиридина осуществляются в α- и γ- положения (преимущественно в α-положение) сильными нуклеофилами, такими как амид калия или натрия (реакции аминирования по Чичибабину), твердая щелочь (гидроксилирование) при нагревании. Хинолин аминируется и гидроксилируется в пиридиновый цикл.
Примеры реакций SN:
 +d
+d
 |
+d N +d
KNH2, to (NH -)

|
аминирование
 N NH2
N NH2
 гидроксилирование
гидроксилирование
N OH
 +d
+d
N
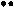 |
+d N +d
SN KNH2, to
 +d
+d
+d
 +d
+d
 N
N
N NH2
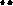
SN KNH2, to
-d
H2N
N OH
 SE
SE
 N Br 2
N Br 2
N NH2
Br
 H2N
H2N
N
N NH2
5. β-Гидрокси- и β-аминопроизводные пиридина. 8-Гидроксихинолин.
β-Амино- и β-гидроксипиридин могут быть получены, например, через продукты нитрования и сульфирования пиридина:
 NO2
NO2
6 [H]
 NH2
NH2
N=O
 HO-N=O,H+
HO-N=O,H+
SN
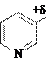
 N2 HOH OH
N2 HOH OH
 восстановление
восстановление
-2H2O N
диазотирование
-2H2O
-N2 ,
 -H+
-H+
3-нитропиридин 3-аминопиридин катион 3-гидроксипиридин (b-аминопиридин) 3-пиридиндиазония (b-гидроксипиридин)
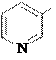

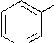 SO3H NaOH
SO3H NaOH
образование соли N
+d SO3Na
 2NaOH тв., to
2NaOH тв., to
плавление
-Na2SO3 N
-H2O
ONa
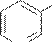
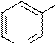 H+ OH
H+ OH

-Na+
N
пиридин-3- пиридин-3- пиридил-3- 3-гидроксипиридин сульфокислота сульфонат натрия оксид натрия (β-гидроксипиридин)
В молекулах β-амино- и β-гидроксипиридинов нет прямого сопряжения функциональной группы (-NH2, -OH) с гетероатомом в цикле, их влияние в цикле несогласованно. Например:

 N
N
Эти производные пиридина ведут себя как гетерофункциональные соединения, т.е. показывают свойства, обусловленные как функциональной группой (первичный ароматический амин, фенол), так и гетероатомом (основание, нуклеофил). Поэтому β-аминопиридин является двухкислотным основанием (образует два ряда солей), диазотируется с образованием в определенных условиях соли диазония, которая затем дает обычные для солей диазония реакции как с выделением азота, так и реакции по диазогруппе:
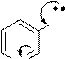
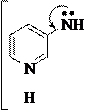
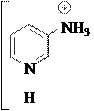
 основный центр
основный центр
NH
 N
N
более сильный основный центр
2
HCl
2

 HCl
HCl
 |  | ||
Cl
 |  | ||
2Cl
β-Гидроксипиридин амфотерен, он имеет слабые кислотные свойства (подобно фенолам) и является основанием, поэтому образует как катионные, так и анионные соли. Например:
 N
N
 основный центр
основный центр
H кислотный центр
NaOH
-H2O

 ONa
ONa
N

 OH
OH
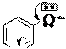


 O Cl
O Cl
 N биполярная
N биполярная
H структура
8-Гидроксихинолин также может быть получен через стадию сульфирования (SE) хинолина. 8-Гидроксихинолин образует прочные комплексы с катионами некоторых металлов, например, магния, кобальта. На этом свойстве 8-гидроксихинолина основано его использование как аналитического реагента и противомикробного средства.
5 4

 6 3 H2SO4 nSO3, to 7 N 2
6 3 H2SO4 nSO3, to 7 N 2
8 1
SO3H
2NaOH, to

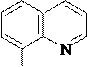
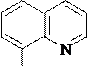 -Na2SO3
-Na2SO3
-HOH
OH
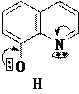
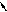
 2
2
6. Лактим-лактамная таутомерия α-гидроксипроизводных пиридина.
Свойства гидрокси- и аминопроизводных пиридина зависят от положения функциональной группы как заместителя в пиридиновом цикле: α- и γ- производные имеют особые свойства и отличаются от β-производных, например, способностью к таутомерным превращениям. В молекулах α- и γ- гидрокси и аминопиридинов осуществляется прямое сопряжение функциональной группы и гетероатома в цикле, поэтому перенос протона от функциональной группы на основный центр гетероатома сопровождается перераспределением электронной плотности в молекуле и образованием другого таутомера. Таутомерия α-гидроксипиридина является лактим- лактамной.
Схема лактим-лактамной таутомерии α-гидроксипиридина:

 N O H
N O H
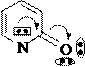
 кислотный
кислотный
основный центр
основный центр
центр
H
кислотный
центр

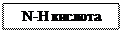
 лактимная форма лактамная форма (иминол) (циклический амид)
лактимная форма лактамная форма (иминол) (циклический амид)
Обычно, в нещелочной среде более устойчива лактамная форма (более слабая кислота). Лактимная форма проявляет более сильные О-Н кислотные свойства, поэтому она образует соли с основаниями:
 N O
N O
H

 N O H
N O H
NaOH
 -HOH
-HOH
 N ONa
N ONa
α- и γ- Амино- и –гидроксипроизводные пиридина имеют и другие отличия в свойствах от β-производных. Например, α- и γ-аминопиридины образуют соли с одним эквивалентом кислоты, в условиях диазотирования выделяют азот N2↑ и в качестве продукта дают гидроксипиридин:
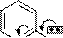
 N NH2
N NH2
HCl


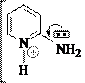

 N NH2
N NH2



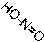 H Cl
H Cl

 N OH
N OH
Дата: 2019-05-28, просмотров: 377.