Процесс репродукции вирусов может быть условно разделен на две фазы. Первая фаза охватывает события, которые ведут к адсорбции и проникновению вируса в клетку, освобождению его внутреннего компонента и модификации его таким образом, что он способен вызвать инфекцию. Соответственно, первая фаза включает в себя три стадии: 1) адсорбция вируса на клетках; 2) проникновение вируса в клетки; 3) раздевание вируса в клетке. Эти стадии направлены на то, чтобы вирус был доставлен в соответствующие клеточные структуры, и его внутренний компонент был освобожден от защитных оболочек. Как только эта цель достигнута, начинается вторая фаза репродукции, в течение которой происходит экспрессия вирусного генома. Эта фаза включает в себя стадии: 1) транскрипции, 2) трансляции информационных РНК, 3) репликации генома, 4) сборки вирусных компонентов. Заключительной стадией репродукции является выход вируса из клетки.
ПЕРВАЯ ФАЗА РЕПРОДУКЦИИ
АДСОРБЦИЯ ВИРУСА НА КЛЕТКАХ
Взаимодействие вируса с клеткой начинается с процесса адсорбции, т. е. прикрепления вирусных частиц к клеточной поверхности. Процесс адсорбции возможен при наличии соответствующих рецепторов на поверхности клетки и «узнающих» их субстанций на поверхности вируса. Самые начальные процессы адсорбции имеют неспецифический характер, и в основе их может лежать электростатическое взаимодействие положительно и отрицательно заряженных группировок на поверхности вируса и клетки. Однако узнавание клеточных рецепторов вирусными белками, ведущее к прикреплению вирусной частицы к клетке, является высоко специфическим процессом. Белки на поверхности вируса, узнающие специфические группировки на плазматической мембране клетки и обусловливающие прикрепление к ним вирусной частицы, называются прикрепительными белками.
Вирусы используют рецепторы, предназначенные для прохождения в клетку необходимых для ее жизнедеятельности веществ: питательных веществ, гормонов, факторов роста и т. д. Рецепторы могут иметь разную химическую природу и представлять собой белки, углеводный компонент белков и липидов, липиды. Рецепторами для вирусов гриппа и парамиксовирусов является сиаловая кислота в составе гликопротеидов и гликолипидов (ганглиозидов), для рабдовирусов и реовирусов — также углеводный компонент в составе белков и липидов, для пикорнавирусов и аденовирусов — белки, для некоторых вирусов — липиды. Специфические рецепторы играют роль не только в прикреплении вирусной частицы к клеточной поверхности. Они определяют дальнейшую судьбу вирусной частицы, ее внутриклеточный транспорт и доставку в определенные участки цитоплазмы и ядра, где вирус способен инициировать инфекционный процесс. Вирус может прикрепиться и к неспецифическим рецепторам и даже проникнуть в клетку, однако только прикрепление к специфическому рецептору приведет к возникновению инфекции.
Прикрепление вирусной частицы к клеточной поверхности вначале происходит путем образования единичной связи вирусной частицы с рецептором. Однако такое прикрепление непрочно, и вирусная частица может легко оторваться от клеточной поверхности — обратимая адсорбция (рис. 7, а). Для того чтобы наступила необратимая адсорбция, должны появиться множественные связи между вирусной частицей и многими молекулами рецепторов, т. е. должно произойти стабильное мультивалентное прикрепление. Количество молекул клеточных рецепторов в участках адсорбции может доходить до 3000. Стабильное связывание вирусной частицы с клеточной поверхностью в результате мультивалентного прикрепления происходит благодаря возможности свободного перемещения молекул рецепторов в липидном бислое плазматической мембраны, которое определяется подвижностью, «текучестью» белково-липидного слоя. Увеличение текучести липидов является одним из наиболее ранних событий при взаимодействии вируса с клеткой, следствием которого является формирование рецепторных полей в месте контакта вируса с клеточной поверхностью и стабильное прикрепление вирусной частицы к возникшим группировкам — необра
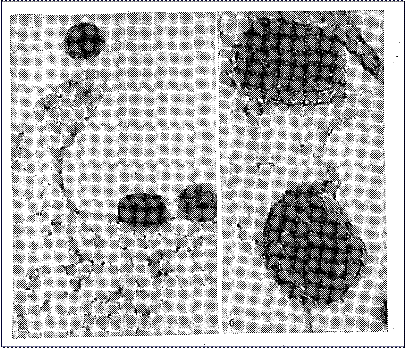 |
тимая адсорбция (рис. 7, б).
Рис. 7. Адсорбция вируса осповакцины на клетке (электронно-микроскопическое изображение): а – обратимая; б – необратимая.
Количество специфических рецепторов на поверхности клетки колеблется между 104 и 105 на одну клетку. Рецепторы ряда вирусов могут быть представлены лишь в ограниченном наборе клеток-хозяев, и этим может определяться чувствительность организма к данному вирусу. Например, пикорнавирусы адсорбируются только на клетках приматов. Рецепторы для других вирусов, напротив, широко представлены на поверхности клеток различных видов, как, например, рецепторы для ортомиксовирусов и парамиксовирусов, представляющие собой сиалил-содержащие соединения. Поэтому эти вирусы имеют относительно широкий диапазон клеток, на которых может происходить адсорбция вирусных частиц. Рецепторами для ряда тогавирусов обладают клетки исключительно широкого круга хозяев: эти вирусы могут адсорбироваться и инфицировать клетки как позвоночных, так и беспозвоночных.
Наличие специфических рецепторов на поверхности клетки в ряде случаев обусловливает феномен зависимого от хозяина ограничения, т. е. способность вируса заражать лишь определенные виды животных. В целом ограничения при взаимодействии рецепторных систем вируса и клетки биологически оправданы и целесообразны, хотя в ряде случаев они являются «перестраховкой». Так, многие линии клеток, устойчивых к вирусам полиомиелита и Коксаки, можно заразить депротеинизированными препаратами РНК, выделенными из этих вирусов. Такое заражение клеток идет в обход естественных входных путей инфекции через взаимодействие с клеточными рецепторами. Известна потенциальная способность вирусов животных реплицироваться в протопластах дрожжей, грибов и бактерий, а бактериофагов — в клетках животных. Таким образом, вирусные ДНК и РНК обладают способностью заражать и более широкий круг хозяев, чем вирусы.
ПРОНИКНОВЕНИЕ ВИРУСОВ В КЛЕТКУ
Исторически сложилось представление о двух альтернативных механизмах проникновения в клетку вирусов животных — путем виропексиса (эндоцитоза) и путем слияния вирусной и клеточной мембран. Однако оба эти механизма не исключают, а дополняют друг друга.
Термин «виропексис», означает, что вирусная частица попадает в цитоплазму в результате инвагинации участка плазматической мембраны и образования вакуоли, которая содержит вирусную частицу.
Рецепторный эндоцитоз. Виропексис представляет собой частный случай рецепторного или адсорбционного эндоцитоза. Этот процесс является обычным механизмом, благодаря которому в клетку поступают питательные и регуляторные белки, гормоны, липопротеины и другие вещества из внеклеточной жидкости. Рецепторный эндоцитоз происходит в специализированных участках плазматической мембраны, где имеются специальные ямки, покрытые со стороны цитоплазмы особым белком с большой молекулярной массой — клатрином. На дне ямки располагаются специфические рецепторы. Ямки обеспечивают быструю инвагинацию и образование покрытых клатрином внутриклеточных вакуолей. Полупериод проникновения вещества внутрь клетки по этому механизму не превышает 10 мин с момента адсорбции. Количество образующихся в одну минуту вакуолей достигает более 2000. Таким Образом, рецепторный эндоцитоз представляет собой хорошо слаженный механизм, который обеспечивает быстрое проникновение в клетку чужеродных веществ.
Покрытые вакуоли сливаются с другими, более крупными цитоплазматическими вакуолями, образуя рецептосомы, содержащие рецепторы, но не содержащие клатрин, а те в свою очередь сливаются с лизосомами. Таким путем проникшие в клетку белки обычно транспортируются в лизосомы, где происходит их распад на аминокислоты; они могут и миновать лизосомы, и накапливаться в других участках клетки в недеградированной форме. Альтернативой рецепторного эндоцитоза является жидкостный эндоцитоз, когда инвагинация происходит не в специализированных участках мембраны. Большинство оболочечных и безоболочечных вирусов животных проникает в клетку по механизму рецепторного эндоцитоза. Эндоцитоз обеспечивает внутриклеточный транспорт вирусной частицы в составе эндоцитарной вакуоли, поскольку вакуоль может двигаться в любом направлении и сливаться с клеточными мембранами (включая ядерную мембрану), освобождая вирусную частицу в соответствующих внутриклеточных участках. Таким путем, например, ядерные вирусы попадают в ядро, а реовирусы — в лизосомы. Однако проникшие в клетку вирусные частицы находятся в составе вакуоли и отделены от цитоплазмы ее стенками. Им предстоит пройти ряд этапов, прежде чем они смогут вызвать инфекционный процесс.
Слияние вирусной, и клеточной мембран. Для того чтобы внутренний компонент вируса мог пройти через клеточную мембрану, вирус использует механизм слияния мембран. У оболочечных вирусов слияние обусловлено точечным взаимодействием вирусного белка слияния с липидами клеточной мембраны, в результате которого вирусная липопротеидная оболочка интегрирует с клеточной мембраной, а внутренний компонент вируса оказывается по другую ее сторону. У безоболочечных вирусов один из поверхностных белков также взаимодействует с липидами клеточных мембран, в результате чего внутренний компонент проходит через мембрану. Большинство вирусов животных выходит в цитозол из рецептосомы.
Если при эндоцитозе вирусная частица является пассивным пассажиром, то при слиянии она становится активным участником процесса. Белком слияния является один из ее поверхностных белков. К настоящему времени этот белок идентифицирован лишь у парамиксовирусов и ортомиксовирусов. У парамиксовирусов этот белок (Р-белок) представляет собой один из двух гликопротеидов, находящихся на поверхности вирусной частицы. Функцию белка слияния у вируса гриппа выполняет малая гемагглютинирующая субъединица.
Парамиксовирусы вызывают слияние мембран при нейтральном рН, и внутренний компонент этих вирусов может проникать в клетку непосредственно через плазматическую мембрану. Однако большинство оболочечных и безоболочечных вирусов вызывают слияние мембран только при низком значении рН — от 5,0 до 5,75. Если к клеткам добавить слабые основания (хлорид аммония, хлороквин и др.), которые в эндоцитарных вакуолях повышают рН до 6,0, слияния мембран не происходит, вирусные частицы остаются в вакуолях, и инфекционный процесс не возникает. Строгая зависимость слияния мембран от значений рН обусловлена конформационными изменениями вирусных белков слияния.
В лизосоме постоянно имеется низкое значение рН (4,9). В эндоцитарной вакуоли (рецептосоме) закисление создается за счет АТФ-зависимого «протонового насоса» еще на клеточной поверхности при образовании покрытой вакуоли. Закисление эндоцитарной вакуоли имеет большое значение для проникающих в клетку физиологических лигандов, так как низкое значение рН способствует диссоциации лиганда от рецептора и рециркуляции рецепторов.
Схематическое изображение возможных способов проникновения вирусов в клетку показано на рис. 8.
 |  |
Рис. 8. Проникновение вируса в клетку:
а — проникновение вируса путем слияния оболочки с плазматической мембраной;
б — проникновение вируса в цитоплазму путем рецепторного эндоцитоза:
1 - клеточная ворсинка;
2 – вирион;
3 - покрытая ямка, содержащая рецепторы;
4 - цитоплазматическая вакуоль;
5 - вакуоль, содержащая вирион;
6 - рецептосома, образовавшаяся в результате слияния покрытой вакуоли с цитоплазматической вакуолью;
7 - слияние вирусной оболочки со стенкой рецептосомы;
8 - выход внутреннего компонента вируса в цитоплазму;
в — проникновение вируса в ядро посредством рецепторного эндоцитоза:
1 - клеточные ворсинки;
2 - внеклеточный вирион;
3 - адсорбция вируса на рецепторах покрытой ямки;
4 - покрытая вакуоль;
5 - образование рецептосомы и ее слияние с наружной ядерной оболочкой;
6 - высвободившаяся вирусная ДНК.
Тот же механизм, который лежит в основе слияния вирусных и клеточных мембран, обусловливает индуцированный вирусами гемолиз и слияние плазматических мембран прилежащих друг к другу клеток с образованием многоядерных клеток, симпластов и синцитиев. Вирусы вызывают два типа слияния клеток: 1) «слияние снаружи» и 2) «слияние изнутри». «Слияние снаружи» происходит при высокой множественности инфекции и обнаруживается в течение первых часов после заражения. Этот тип слияния, описанный для парамиксовирусов, обусловлен белками заражающего вируса и не требует внутриклеточного синтеза вирусных компонентов. Напротив, «слияние изнутри» происходит при низкой множественности инфекции, обнаруживается на сравнительно поздних стадиях инфекционного процесса и обусловлено вновь синтезированными вирусными белками (рис. 9). «Слияние изнутри» описано для многих вирусов: вирусов герпеса, онковирусов, возбудителей медленных инфекций и др. Этот тип слияния вызывают те же вирусные гликопротеиды, которые обеспечивают проникновение вируса в клетку.
 |
Рис. 9. Слияние клеточных мембран при заражении клеток вирусом:
а - слияние извне; б - слияние изнутри.
РАЗДЕВАНИЕ ВИРУСА В КЛЕТКЕ
Проникшие в клетку вирусные частицы должны раздеться для того, чтобы вызвать инфекционный процесс. Смысл раздевания заключается в удалении вирусных защитных оболочек, которые препятствуют экспрессии вирусного генома. В результате раздевания освобождается внутренний компонент вируса, который способен вызвать инфекционный процесс. Раздевание сопровождается рядом характерных особенностей: в результате распада вирусной частицы исчезает инфекционная активность, в ряде случаев появляется чувствительность к нуклеазам, возникает устойчивость к нейтрализующему действию антител, теряется фоточувствительность при использовании ряда препаратов.
Конечными продуктами раздевания являются сердцевины, нуклеокапсиды или нуклеиновые кислоты. Для ряда вирусов было показано, что продуктом раздевания являются не голые нуклеиновые кислоты, а нуклеиновые кислоты, связанные с внутренним вирусным белком. Например, конечным продуктом раздевания пикорнавирусов является РНК, ковалентно связанная с белком VРg, конечным продуктом раздевания аденовирусов является ДНК, ковалентно связанная с одним из внутренних вирусных белков.
В ряде случаев способность вирусов вызвать инфекционный процесс определяется возможностью их раздевания в клетке данной системы. Тем самым эта стадия является одной из стадий, лимитирующих инфекцию.
Раздевание ряда вирусов происходит в специализированных участках внутри клетки (лизосомах, структурах аппарата Гольджи, околоядерном пространстве, ядерных порах на ядерной мембране). При слиянии вирусной и клеточной мембран проникновение в клетку сочетается с раздеванием.
Раздевание и внутриклеточный транспорт являются взаимосвязанными процессами: при нарушении правильного внутриклеточного транспорта к местам раздевания вирусная частица попадает в лизосому и разрушается лизосомальными ферментами.
ВТОРАЯ ФАЗА РЕПРОДУКЦИИ
ТРАНСКРИПЦИЯ
 |
Транскрипция — это переписывание ДНК на РНК по законам генетического кода. Это означает, что РНК состоит из нуклеотидных последовательностей, комплементарных ДНК. Нити ДНК в участке транскрипции разделяются и функционируют как матрицы, к которым присоединяются комплементарные нуклеотиды благодаря спариванию комплементарных оснований (аденин связывается с тимином, урацил — с аденином, гуанин — с цитозином и цитозин — с гуанином) (рис. 10).
 |
Рис. 10. Транскрипция ДНК и образование комплементарной РНК-цепочки:
а - спаривание комплементарных нуклеотидов при полимеризации;
А, Ц, Г, Т, У- сокращенные обозначения аденина, цитозина, гуанина, тимина, урацила;
б - схема транскрипции ДНК:
1 - ДНК; 2 - растущая нить РНК; 3 - ДНК-зависимая РНК-полимераза.
Транскрипция осуществляется с помощью специального фермента — РНК-полимеразы, который связывает нуклеотиды путем образования 3-5´фосфодиэфирных мостиков. Такое связывание происходит лишь в присутствии ДНК-матрицы.
Продуктами транскрипции в клетке являются иРНК. Сама клеточная ДНК, являющаяся носителем генетической информации, не может непосредственно программировать синтез белка. Передачу генетической информации от ДНК к рибосомам осуществляет РНК-посредник. На этом основана центральная догма молекулярной биологии, которая выражается следующей формулой:
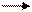 ДНК транскрипция РНК трансляция белок,
ДНК транскрипция РНК трансляция белок,
где стрелки показывают направление переноса генетической информации.
Реализация генетической информации у вирусов. Стратегия вирусного генома в отношении синтеза иРНК у разных вирусов различна. У ДНК-содержащих вирусов иРНК синтезируется на матрице одной из нитей ДНК. Формула переноса генетической информации у них такая же, как и в клетке:
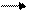
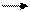

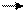 ДНК транскрипция РНК трансляция белок.
ДНК транскрипция РНК трансляция белок.
ДНК-содержащие вирусы, репродукция которых происходит в ядре, используют для транскрипции клеточную полимеразу. К этим вирусам относятся паповавирусы, аденовирусы, вирусы герпеса. ДНК-содержащие вирусы, репродукция которых происходит в цитоплазме, не могут использовать клеточный фермент, находящийся в ядре. Транскрипция их генома осуществляется вирусспецифическим ферментом — ДНК-полимеразой, которая проникает в клетку в составе вируса. К этим вирусам относятся вирусы оспы и иридовирусы.
РНК-содержащие вирусы, у которых хранителем генетической информации является не ДНК, а РНК, решают эту проблему особым образом. У РНК-содержащих «плюс»-нитевых вирусов, у которых функции иРНК выполняет сам геном, передача генетической информации осуществляется по наиболее простой формуле:
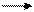 РНК белок.
РНК белок.
К этой группе вирусов относятся пикорнавирусы, тогавирусы, коронавирусы. У них нет необходимости в акте транскрипции для синтеза вирусспецифических белков. Поэтому транскрипцию как самостоятельный процесс у этих вирусов не выделяют.
Иначе дело обстоит у вирусов, геном которых не может выполнять функцию иРНК. В клетке синтезируется комплементарная геному РНК, которая и является информационной. Передача генетической информации у этих вирусов осуществляется по формуле:
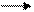
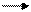 РНК - РНК белок
РНК - РНК белок
У этих вирусов транскрипция выделена как самостоятельный процесс в инфекционном цикле. К ним относятся две группы вирусов животных.
1. Вирусы, геном которых представлен однонитчатой РНК: ортомиксовирусы, парамиксовирусы, рабдовирусы, буньявирусы. Поскольку геномная РНК этих вирусов является «минус»-нитью, указанную группу вирусов называют «минус»-нитевыми вирусами.
2. Вирусы, геном которых представлен двунитчатой РНК (диплоРНК-вирусы). Среди вирусов животных к ним относятся реовирусы.
В клетке нет фермента, который может полимеризовать нуклеотиды на матрице РНК. Эту функцию выполняет вирусспецифический фермент — РНК-полимераза, или транскриптаза, которая находится в составе вирусов и вместе с ними проникает в клетку.
Среди РНК-содержащих вирусов животных есть семейство ретровирусов, которые имеют уникальный путь передачи генетической информации. РНК этих вирусов переписывается на ДНК, ДНК интегрирует с клеточным геномом и в его составе переписывается на РНК, которая обладает информационными функциями. Путь передачи генетической информации в этом случае осуществляется по более сложной формуле:
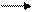
 РНК - ДНК РНК белок
РНК - ДНК РНК белок
В составе этих вирусов есть уникальный вирусспецифический фермент, который переписывает РНК на ДНК. Этот процесс называется обратной транскрипцией, а фермент — обратная транскриптаза, или ревертаза. Тот же фермент синтезирует нить ДНК на матрице ДНК. Двунитчатая ДНК после замыкания в кольцо интегрирует с клеточным геномом, и транскрипцию интегрированной ДНК в составе клеточных геномов осуществляет клеточная РНК-полимераза. Поскольку иРНК ретровирусов гомологична геномной РНК (а не комплементарна ей), ретровирусы являются «плюс»-нитевыми вирусами.
Ферменты, транскрибирующие вирусный геном. Транскрипция ряда ДНК-содержащих вирусов — паповавирусов, аденовирусов, вирусов герпеса, парвовирусов, гепаднавирусов Осуществляется в ядре клетки, и в этом процессе широко используются механизмы клеточной транскрипции — ферменты транскрипции и дальнейшей модификации транскриптов. Транскрипция этих вирусов осуществляется клеточной РНК-полимеразой II — ферментом, который осуществляет транскрипцию клеточного генома. Однако особая группа транскриптов аденовируса синтезируется с помощью другого клеточного фермента — РНК-полимеразы III. У двух других семейств ДНК-содержащих вирусов животных — вирусов оспы и иридовирусов — транскрипция происходит в цитоплазме. Поскольку в цитоплазме нет клеточных полимераз, транскрипция этих вирусов нуждается в специальном вирусном ферменте — вирусной РНК-полимеразе. Этот фермент является структурным вирусным белком.
У РНК-содержащих вирусов транскрипция осуществляется вирус-специфическими транскриптазами, т. е. ферментами, закодированными в вирусном геноме. Вирусспецифические транскриптазы могут быть как структурными белками, входящими в состав вириона (эндогенная транскриптаза), так и неструктурными белками, которые синтезируются в зараженной клетке, но не включаются в вирион.
Транскрипция в зараженной клетке. Синтез комплементарных РНК на родительских матрицах с помощью родительской транскриптазы носит название первичной транскрипции в отличие от вторичной транскрипции, происходящей на более поздних стадиях инфекционного цикла на вновь синтезированных, дочерних матрицах, с помощью вновь синтезированной транскриптазы. Большая часть иРНК в зараженной клетке является продуктом вторичной транскрипции.
Транскриптивные комплексы. У сложно устроенных РНК-содержащих вирусов животных транскрипция происходит не на матрице голой РНК, а в составе вирусных нуклеокапсидов или сердцевин (транскриптивные комплексы). Связанные с геномом капсидные белки не только не препятствуют транскрипции, но и необходимы для нее, обеспечивая правильную конформацию тяжа РНК, защиту его от клеточных протеаз, связь отдельных фрагментов генома друг с другом, а также регуляцию транскрипции.
Вновь синтезированные иРНК выходят из транскриптивных комплексов и транспортируются к рибосомам.
На модели реовирусов было показано, что обе нити двунитчатых молекул РНК остаются в составе сердцевины, а вновь синтезированные иРНК выталкиваются из сердцевины через отверстия в 12 полых цилиндров, находящихся в составе сердцевины (рис. 11).
 |
Рис. 11. Вытеснение вновь синтезированной РНК из сердцевины вирионов реовирусов. Вид в электронном микроскопе (а) и схема строения вирионов (б).
Регуляция транскрипции. Транскрипция вирусного генома строго регулируется на протяжении инфекционного цикла. Регуляция осуществляется как клеточными, так и вирусспецифическими механизмами. У некоторых вирусов, в основном ДНК-содержащих, существует три периода транскрипций — сверхранняя, ранняя и поздняя. К этим вирусам относятся вирусы оспы, герпеса, паповавирусы, аденовирусы. В результате сверхранней и ранней транскрипции избирательно считываются сверхранние и ранние гены с образованием сверхранних или ранних иРНК. При поздней транскрипции считывается другая часть вирусного генома — поздние гены, с образованием поздних иРНК. Количество поздних генов обычно превышает количество ранних генов. Многие сверхранние гены являются генами для неструктурных белков — ферментов и регуляторов транскрипции и репликации вирусного генома. Напротив, поздние гены обычно являются генами для структурных белков. Обычно при поздней транскрипции считывается весь геном, но с преобладанием транскрипции поздних генов.
Фактором регуляции транскрипции у ядерных вирусов является транспорт транскриптов из ядра в цитоплазму, к месту функционирования иРНК — полисомам.
Продуктом сверхранней транскрипции вирусов герпеса являются А-белки. Функция одного или нескольких из них необходима для транскрипции следующей группы генов, кодирующих Р-белки. В свою очередь Р-белки включают транскрипцию последней группы поздних генов, кодирующих У-белки. Такой тип регуляции получил название «каскадной».
У РНК-содержащих вирусов синтез транскриптов также строго контролируется в отношении как количества каждого класса транскриптов, так и периода инфекции, когда определенные транскрипты синтезируются с максимальной скоростью. На ранней стадии инфекции преимущественно синтезируются транскрипты двух генов вируса гриппа — NР и NS, на поздней стадии инфекции — транскрипты генов М, НА и NА. Остальные три гена для Р-белков синтезируются примерно с одинаковой скоростью на протяжении всего периода инфекции. У реовирусов на ранней стадии инфекции преимущественно транскрибируется 4 из 10 фрагментов генома и лишь на поздней стадии транскрибируется весь геном. Однако если поместить геном вируса в бесклеточную РНК-синтезирующую систему, будет происходить равномерная транскрипция всех 10 фрагментов генома. Эти факты говорят о жестком контроле транскрипции со стороны клетки-хозяина и возможном наличии специфических клеточных регуляторов.
У парамиксовирусов и рабдовирусов весь геном представляет собой одну транскрипционную единицу с единственным промотором (участок связывания транскриптазы и начала транскрипции) у 3'-конца. Вдоль генома существует как бы градиент эффективности транскрипции. Ближайший к 3'- концу ген (ген наиболее обильного белка КР) считывается наиболее часто. Напротив, ген для самого высокомолекулярного белка — транскриптазы,— содержащегося лишь в количестве нескольких молекул на вирион, находится на противоположном конце генома и транскрибируется значительно реже. Такая регуляция экспрессии генов путем порядка их расположения в геноме носит название «полярность». При этом способе регуляции количество молекул полипептидов определяется полярностью гена, т.е. расстоянием его от промотора.
ТРАНСЛЯЦИЯ
Синтез белка в клетке происходит в результате трансляции иРНК. Трансляцией называется процесс перевода генетической информации, содержащейся в иРНК, на специфическую последовательность аминокислот. Иными словами, в процессе трансляции осуществляется перевод 4-буквенного языка азотистых оснований на 20-буквенный язык аминокислот.
Транспортные РНК. Свою аминокислоту тРНК узнают по конфигурации ее боковой цепи, а специфический фермент аминоацил-синтетаза катализирует ассоциацию тРНК с аминокислотой. В клетке существует большое количество разнообразных видов тРНК. Поскольку для каждой аминокислоты должна быть своя тРНК, количество видов тРНК должно быть не меньше 20, однако в клетке их значительно больше. Это связано с тем, что для каждой аминокислоты существует не один, а несколько видов тРНК. Молекула тРНК представляет собой однонитчатую РНК со сложной структурой в виде кленового листа (рис. 12). Один ее конец связывается с аминокислотой (конец а), а противоположный — с нуклеотидами иРНК, которым они комплементарны (конец б). Три нуклеотида на иРНК кодируют одну аминокислоту и называются «триплет» или «кодон», комплементарные кодону три нуклеотида на конце тРНК называются «антикодон».
 |
Рис. 12. Строение транспортной РНК:
а - участок связывания с аминокислотой;
б - участок связывания с иРНК (антикодон).
Рибосомы. Синтез белка в клетке осуществляется на рибосоме. Рибосома состоит из двух субъединиц, большой и малой, малая субъединица примерно в два раза меньше большой. Обе субъединицы содержат по одной молекуле рибосомальной РНК и ряд белков. Рибосомальные РНК синтезируются в ядре на матрице ДНК с помощью РНК-полимеразы I. В малой рибосомальной субъединице есть канал, в котором находится информационная РНК. В большой рибосомальной субъединице есть две полости, захватывающие также малую рибосомальную субъединицу. Одна из них содержит аминоацильный центр (А-центр), другая — пептидильный центр (П-центр) (рис. 13).

Рис. 13. Формирование и функционирование рибосомы:
1 - малая рибосомальная субъединица с присоединенной инициаторной метионил-тРНК;
2 - большая рибосомальная субъединица;
3 - инициаторный комплекс, содержащий малую рибосомальную субъединицу, метионил-тРНК и иРНК;
заштрихованные прямоугольники - белковые факторы инициации (9 факторов в эукариотических клетках);
4 - функционально активная рибосома: А — аминоацильный центр, П— пептидильный центр в большой рибосомальной субъединице;
5, 6, 7 - процесс элонгации полипептидной цепи; показан перенос аминоацил-тРНК между двумя центрами на большой рибосомальной субъединице, осуществляемый с помощью пептидил-трансферазы.
Фазы трансляции. Процесс трансляции состоит из трех фаз: 1) инициации, 2) элонгации и 3) терминации.
Инициация трансляции. Это наиболее ответственный этап в процессе трансляции, основанный на узнавании рибосомой иРНК и связывании с ее особыми участками. Рибосома узнает иРНК благодаря «шапочке» на 5'-конце и скользит к 3'-концу, пока не достигнет инициаторного кодона, с которого начинается трансляция. В эукариотической клетке инициаторным кодоном является кодон АУГ или ГУГ, кодирующие метионин. С метионина начинается синтез всех полипептидных цепей.
В начале с иРНК связывается малая рибосомальная субъединица. К комплексу иРНК с малой рибосомальной субъединицей присоединяются другие компоненты, необходимые для начала трансляции. Это несколько молекул белка, которые называются «инициаторные факторы». Их по крайней мере три в прокариотической клетке и более девяти в эукариотической клетке.
Инициаторные факторы определяют узнавание рибосомой специфических иРНК и, таким образом, являются определяющим фактором в дискриминации между различными иРНК, присутствующими в клетке, как правило, в избыточном количестве.
В результате формируется комплекс, необходимый для инициации трансляции, который называется инициаторным комплексом. В инициаторный комплекс входят:
1) иРНК;
2) малая рибосомальная субъединица;
3) аминоацил-тРНК, несущая инициаторную аминокислоту;
4) инициаторные факторы;
5) несколько молекул ГТФ.
В рибосоме осуществляется слияние потока информации с потоком аминокислот. Аминоацил-тРНК входит в А-центр большой рибосомальной субъединицы, и ее антикодон взаимодействует с кодоном иРНК, находящейся в малой рибосомальной субъединице. При продвижении иРНК на один кодон тРНК перебрасывается в пептидильный центр, и ее аминокислота присоединяется к инициаторной аминокислоте с образованием первой пептидной связи. Свободная от аминокислоты тРНК, выходит из рибосомы, и может опять функционировать в транспорте специфических аминокислот. На ее место из А-центра в П-центр перебрасывается новая тРНК и образуется новая пептидная связь. В А-центре появляется вакантный кодон иРНК, к которому немедленно присоединяется соответствующая тРНК и происходит присоединение новых аминокислот к растущей полипептидной цепи (рис. 13).
Элонгация трансляции. Это процесс удлинения, наращивания полипептидной цепи, основанный на присоединении новых аминокислот с помощью пептидной связи. Происходит постоянное протягивание нити иРНК через рибосому и «декодирование» заложенной в ней генетической информации (рис. 14). иРНК функционирует на нескольких рибосомах, каждая из которых синтезирует одну и ту же полипептидную нить, кодируемую данной иРНК. Группа рибосом, работающих на одной молекуле иРНК, называется полирибосомой, или полисомой. Размер полисом значительно варьирует в зависимости от длины молекулы иРНК, а также от расстояния между рибосомами. Так, полисомы, которые синтезируют гемоглобин, состоят из 4-6 рибосом, высокомолекулярные белки синтезируются на полирибосомах, содержащих 20 и более рибосом.
 |
Рис. 14. Синтез белков на полисомах:
1 - большая рибосомальная субъединица;
2 - малая рибосомальная субъединица;
3 - иРНК;
4 - растущая полипептидная нить.
Терминация трансляции. Терминация трансляции происходит в тот момент, когда рибосома доходит до терминирующего кодона в составе иРНК. Трансляция прекращается, и полипептидная цепь освобождается из полирибосомы. После окончания трансляции полирибосомы распадаются на субъединицы, которые могут войти в состав новых полирибосом.
Свойства полирибосом. По топографии в клетке полирибосомы делят на две большие группы — свободные и связанные с мембранами эндоплазматической сети, которые составляют соответственно 75 и 25 %.
Между двумя группами полирибосом нет принципиальных структурных и функциональных различий, они формируются из одного и того же пула субъединиц и в процессе трансляции могут обмениваться субъединицами. Мембраны, с которыми связаны полирибосомы, называются грубыми или шероховатыми мембранами в отличие от гладких мембран, не содержащих полирибосомы. Связь полирибосом с мембранами осуществляется с помощью сигнального пептида — специфической последовательности на аминоконце синтезирующихся гликопротеидов. На связанных с мембранами полирибосомах синтезируются внутримембранные белки, которые, сразу же после синтеза, оказываются в составе мембран.
Трансляция в зараженных вирусом клетках. Стратегия вирусного генома, использующего клеточный аппарат трансляции, должна быть направлена на создание механизма для подавления трансляции собственных клеточных иРНК и для избирательной трансляции вирусных иРНК, которые всегда находятся в значительно меньшем количестве, чем клеточные матрицы. Этот механизм реализуется на уровне специфического узнавания малой рибосомальной субъединицей вирусных иРНК, т. е. на уровне формирования инициирующего комплекса. Поскольку многие вирусы не подавляют синтез клеточных иРНК, в зараженных клетках возникает парадоксальная ситуация: прекращается трансляция огромного фонда функционально активных клеточных иРНК, и на освободившихся рибосомах начинается трансляция одиночных молекул вирусных иРНК. Специфическое узнавание рибосомой вирусных иРНК осуществляется за счет вирусспецифических инициаторных факторов.
Два способа формирования вирусных белков. Поскольку геном вируса животных представлен молекулой, кодирующей более чем один белок, вирусы поставлены перед необходимостью синтеза либо длинной иРНК, кодирующей один гигантский полипептид-предшественник, который затем должен быть нарезан в специфических точках на функционально активные белки, либо коротких моноцистронных иРНК, каждая из которых кодирует один белок.
Таким образом, существуют два способа формирования вирусных белков: 1) иРНК транслируется в гигантский полипептид-предшественник, который после синтеза последовательно нарезается на зрелые функционально активные белки; 2) иРНК транслируется с образованием зрелых белков, или белков, которые лишь незначительно модифицируются после синтеза.
Первый способ трансляции характерен для РНК-содержащих «плюс»-нитевых вирусов — пикорнавирусов и тогавирусов. Их иРНК транслируется в гигантскую полипептидную цепь, так называемый полипротеид, который сползает в виде непрерывной ленты с рибосомного «конвейера» и нарезается на индивидуальные белки нужного размера. Нарезание вирусных белков является многоступенчатым процессом, осуществляемым как вирусспецифическими, так и клеточными протеазами. В клетках, зараженных пикорнавирусами, на конце полипротеина-предшественника находится белок с протеазной активностью. Вирусная протеаза осуществляет нарезание предшественника на 3 фрагмента, один из которых является предшественником для структурных белков, второй — для неструктурных белков, функции третьего фрагмента неизвестны. В дальнейшем нарезании участвуют вирус-специфические и клеточные протеазы.
Интересный вариант первого способа трансляции обнаруживается у альфа-вирусов. Геномная РНК с коэффициентом седиментации 42 S транслируется с образованием полипептида-предшественника для неструктурных белков. Однако доминирующей в зараженных клетках иРНК является РНК с коэффициентом седиментации 26 S, составляющая одну треть геномной РНК. Эта иРНК транслируется с образованием предшественника для структурных белков.
Второй способ формирования белков характерен для ДНК-содержащих вирусов и большинства РНК-содержащих вирусов. При этом способе синтезируются короткие моноцистронные иРНК в результате избирательной транскрипции одного участка генома (гена). Однако все вирусы широко используют механизм посттрансляционного нарезания белка.
Вирусспецифические полисомы. Поскольку длина вирусных иРНК варьирует в широких пределах, размер вирусспецифических полисом также широко варьирует: от 3-4 до нескольких десятков рибосом на одной нити иРНК. При инфекциях, вызванных пикорнавирусами, формируются крупные полисомы, представляющие собой агрегаты, состоящие из 20-60 рибосом. При инфекциях, вызванных другими вирусами животных, использующими второй способ трансляции, формируются полисомы небольшого размера. Между размерами иРНК и величиной полисом существует определенная корреляция, однако в ряде Случаев полисомы имеют больший или меньший размер по сравнению с ожидаемым. Эта особенность вирусных полисом объясняется необычным пространственным расположением рибосом на вирусных матрицах, связанных с меньшей плотностью упаковки рибосом на молекуле иРНК.
Вирусспецифические полисомы могут быть как свободными, так и связанными с мембранами. В зараженных вирусом полиомиелита клетках полипротеид синтезируется на связанных с мембранами полисомах; при инфекциях, вызванных сложно устроенными вирусами, формируются как свободные, так и связанные с мембранами полисомы, которые вовлечены в синтез разных классов вирусных полипептидов. Внутренние белки обычно синтезируются на свободных полисомах, гликопротеиды всегда синтезируются на полисомах, связанных с мембранами.
Модификация вирусных белков. В эукариотической клетке многие белки, в том числе вирусные, подвергаются посттрансляционным модификациям, и зрелые функционально активные белки часто не идентичны их вновь синтезированным предшественникам. Широко распространены такие посттрансляционные ковалентные модификации, как гликозилирование, ацилирование, метилирование, сульфирование (образование дисульфидных связей), протеолитическое нарезание и, наконец, фосфорилирование. В результате вместо 20 генетически закодированных аминокислот из различных клеток разных органов эукариотов выделено около 140 дериватов аминокислот.
Среди широкого спектра модифицированных реакций лишь небольшое количество процессов является обратимыми:
1) фосфорилирование — дефосфорилирование;
2) ацилирование — деацилирование;
3) метилирование — деметилирование;
4) образование дисульфидных связей.
Среди подобных обратимых модификаций белков следует искать процессы, обусловливающие механизм регуляции активности белков в эукариотической клетке.
Гликозилирование. В составе сложно устроенных РНК- и ДНК-содержащих вирусов имеются белки, содержащие ковалентно присоединенные боковые цепочки углеводов — гликопротеиды. Гликопротеиды расположены в составе вирусных оболочек и находятся на поверхности вирусных частиц. Своей гидрофобной частью они погружены в двойной слой липидов, а некоторые гликопротеиды проникают через него и взаимодействуют с внутренним компонентом вируса. Гидрофильная часть молекулы обращена наружу.
Синтез и внутриклеточный транспорт гликопротеидов характеризуется рядом особенностей, присущих клеточным внутримембранным белкам. Их синтез осуществляется на полисомах, ассоциированных с мембранами, и белки сразу же после синтеза попадают в шероховатые мембраны, откуда транспортируются в мембраны эндоплазматической сети и в комплекс Гольджи, где происходит модификация и комплектование углеводной цепочки, а затем — в плазматическую мембрану в ряде случаев путем слияния с ней везикул комплекса Гольджи. Такой целенаправленный транспорт осуществляется благодаря имеющейся на аминоконце белка специфической последовательности из 20-30 аминокислот (сигнальному пептиду). Сигнальный пептид отрезается от белковой молекулы после того, как гликопротеид достигает плазматической мембраны.
Гликозилирование полипептидов является сложным многоступенчатым процессом, первые этапы которого начинаются уже в процессе синтеза полипептидов, и первый сахар присоединяется к полипептидной цепи, еще не сошедшей с рибосомы. Последующие этапы гликози-лирования происходят путем последовательного присоединения Сахаров в виде блоков к углеводной цепочке в процессе транспорта полипептида к плазматической мембране.
Окончательное формирование углеводной цепочки может завершаться на плазматической мембране перед сборкой вирусной частицы. Процесс гликозилирования не влияет на транспорт полипептида к плазматической мембране, но имеет существенное значение для экспрессии биологической активности белка. При подавлении гликозилирования соответствующими ингибиторами (аналоги сахаров типа 2-дезоксиглюкозы, антибиотик туникамицин) нарушается синтез полипептидов, блокируется сборка вирионов миксовирусов, рабдовирусов, альфа-вирусов или образуются неинфекционные вирионы герпеса и онковирусов.
Сульфирование. Некоторые белки сложно устроенных РНК- и ДНК-содержащих вирусов сульфируются после трансляции. Чаще всего сульфированию подвергаются гликопротеиды, при этом сульфатная группа связывается с сахарным компонентом гликопротеида.
Ацилирование. Ряд гликопротеидов сложно устроенных РНК-содержащих вирусов (НА2 вируса гриппа, белок G вируса везикулярного стоматита, белок НN вируса ньюкаслской болезни и др.) содержат ковалентно связанные 1-2 молекулы жирных кислот.
Нарезание. Многие вирусные белки ив первую очередь гликопротеиды приобретают функциональную активность лишь после того, как произойдет их нарезание в специфических точках протеолитическими ферментами. Нарезание происходит либо с образованием двух функциональных белковых субъединиц (например, большая и малая субъединицы гемагглютинина вируса гриппа, два гликопротеида, E2 и Е3, вируса леса Семлики) либо с образованием одного функционально активного белка и неактивного фрагмента, например белки F и HN парамиксовирусов. Нарезание обычно осуществляется клеточными ферментами. У многих сложно устроенных вирусов животных, имеющих гликопротеид, нарезание необходимо для формирования активных прикрепительных белков и белков слияния и, следовательно, для приобретения вирусом способности инфицировать клетку. Лишь после нарезания этих белков вирусная частица приобретает инфекционную активность. Таким образом, можно говорить о протеолитической активации ряда вирусов, осуществляемой с помощью клеточных ферментов.
Фосфорилирование. Фосфорпротеиды содержатся практически в составе всех вирусов животных, РНК- и ДНК-содержащих, просто и сложно устроенных. В составе большинства вирусов обнаружены протеинкиназы, однако фосфорилирование может осуществляться как вирусными, так и клеточными ферментами. Обычно фосфорилируются белки, связанные с вирусным геномом и осуществляющие регулирующую роль в его экспрессии.
С процессом фосфорилирования связан механизм антивирусного действия интерферона. В зараженных вирусом клетках интерферон индуцирует синтез протеинкиназы, которая фосфорилирует субъединицу инициирующего фактора трансляции ЭИФ-2, в результате чего блокируется трансляция вирусных информационных РНК. Фосфорилирование белков играет регулирующую роль в транскрипции и трансляции вирусных иРНК, специфическом узнавании вирусных иРНК рибосомой, белок-нуклеиновом и белок-белковом узнавании на стадии сборки вирусных частиц.
РЕПЛИКАЦИЯ
 |
Репликацией называется синтез молекул нуклеиновой кислоты, гомологичных геному. В клетке происходит репликация ДНК, в результате которой образуются дочерние двунитчатые ДНК. Репликация происходит на расплетенных участках ДНК и идет одновременно на обеих нитях от 5'-конца к 3'-концу (рис. 15).
Рис. 15. Полинуклеотидные цепи двойной спирали ДНК расплетаются и образуются две новые двойные спирали. Каждая из них состоит из родительской (1) и вновь синтезированной (2) цепи.
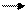
 Поскольку две нити ДНК имеют противоположную полярность 5' 3' и 3' 5', а участок репликации («вилка») движется в одном направлении, одна цепь строится в обратном направлении отдельными фрагментами, которые называются фрагментами Оказаки (по имени ученого, впервые предложившего такую модель). После синтеза фрагменты Оказаки «сшиваются» лигазой в единую нить.
Поскольку две нити ДНК имеют противоположную полярность 5' 3' и 3' 5', а участок репликации («вилка») движется в одном направлении, одна цепь строится в обратном направлении отдельными фрагментами, которые называются фрагментами Оказаки (по имени ученого, впервые предложившего такую модель). После синтеза фрагменты Оказаки «сшиваются» лигазой в единую нить.
Репликация ДНК осуществляется ДНК-полимеразами. Для начала репликации необходим предварительный синтез короткого участка РНК на матрице ДНК, который называется затравкой. С затравки начинается синтез нити ДНК, после чего РНК быстро удаляется с растущего участка.
Репликация вирусных ДНК. Репликация генома ДНК-содержащих вирусов в основном катализируется клеточными фрагментами и механизм ее сходен с механизмом репликации клеточной ДНК.
Каждая вновь синтезированная молекула ДНК состоит из одной родительской и одной вновь синтезированной нити. Такой механизм репликации называется полуконсервативным.
 |
У вирусов, содержащих кольцевые двунитчатые ДНК (паповавирусы), разрезается одна из нитей ДНК, что ведет к раскручиванию и снятию супервитков на определенном участке молекулы (рис. 16).
Рис. 16. Молекула ДНК вируса в процессе репликации. Вверху — электронная микрофотография, внизу — схема.
Видна нижняя суперспирализованная часть молекулы (3), расплетенная часть на большом участке и вновь образуемые репликационные петли (1 и 2).
При репликации однонитчатых ДНК (семейство парвовирусов) происходит образование двунитчатых форм, которые представляют собой промежуточные репликативные формы.
Репликация вирусных РНК. В клетке нет ферментов, способных осуществить репликацию РНК. Поэтому ферменты, участвующие в репликации, всегда вирусспецифические. Репликацию осуществляет тот же фермент, что и транскрипцию; репликаза является либо модифицированной транскриптазой, либо при репликации соответствующим образом модифицируется матрица.
Репликация однонитчатых РНК осуществляется в два этапа: вначале синтезируются комплементарные геному нити, которые в свою очередь становятся матрицами для синтеза копий генома. У «минус»-нитевых вирусов первый этап репликации — образование комплементарных нитей сходен с процессом транскрипции. Однако между ними есть существенное отличие: если при транскрипции считываются определенные участки генома, то при репликации считывается весь геном. Например, иРНК парамиксовирусов и рабдовирусов являются короткими молекулами, комплементарными разным участкам генома, а иРНК вируса гриппа на 20-30 нуклеотидов короче каждого фрагмента генома. В то же время матрицы для репликации являются полной комплементарной последовательностью генома и называются антигеномом.
В зараженных клетках существует механизм переключения транскрипции на репликацию.
При репликации растущая «плюс»-нить вытесняет ранее синтезированную «плюс»-нить либо двухспиральная матрица консервируется (рис. 17). Более распространен первый механизм репликации.
 |
Рис. 17. Два способа репликации «плюс-нитевой» РНК:
I— вытеснение ранее синтезированной нити растущей «плюс-нитью»;
II— консервирование двухспиральной матрицы; 1, 2, 3-вновь синтезированные нити РНК.
Репликативные комплексы. Поскольку образующиеся нити ДНК и РНК некоторое время остаются связанными с матрицей, в зараженной клетке формируются репликативные комплексы, в которых осуществляется весь процесс репликации (а в ряде случаев также и транскрипции) генома. Репликативный комплекс содержит геном, репликазу и связанные с матрицей вновь синтезированные цепи нуклеиновых кислот. Вновь синтезированные геномные молекулы немедленно ассоциируются с вирусными белками, поэтому в репликативных комплексах обнаруживаются антигены. В процессе репликации возникает частично двунитчатая структура с однонитчатыми «хвостами», так называемый репликативный предшественник.
Репликативные комплексы ассоциированы с клеточными структурами либо с предсуществующими, либо вирусиндуцируемыми. Например, репликативные комплексы пикорнавирусов ассоциированы с мембранами эндоплазматической сети, вирусов оспы — с цитоплазматическим матриксом, репликативные комплексы аденовирусов и вирусов герпеса в ядрах находятся в ассоциации со вновь сформированными волокнистыми структурами и связаны с ядерными мембранами. В зараженных клетках может происходить усиленная пролиферация клеточных структур, с которыми связаны репликативные комплексы, или их формирование из предсуществующего материала. Например, в клетках, зараженных пикорнавирусами, происходит пролиферация гладких мембран. В клетках, зараженных реовирусами, наблюдается скопление микротрубочек; в клетках, зараженных вирусами оспы, происходит формирование цитоплазматического матрикса.
В репликативных комплексах одновременно с синтезом геномных молекул осуществляется транскрипция и происходит сборка нуклеокапсидов и сердцевин, а при некоторых инфекциях — и вирусных частиц.
Регуляция репликации. Вновь образованная молекула геномной РНК может быть использована различным образом. Она может ассоциироваться с капсидными белками и войти в состав вириона, служить матрицей для синтеза новых геномных молекул, либо — для образования иРНК, наконец, у «плюс»-нитевых вирусов она может выполнять функции иРНК и связываться с рибосомами. В клетке существуют механизмы, регулирующие использование геномных молекул. Регуляция идет по принципу саморегуляции и реализуется путем взаимодействия вирусных РНК и белков благодаря возможности белок-нуклеинового и белок-белкового узнавания. Например, роль терминального белка пикорнавирусов заключается в запрещении трансляции иРНК и отборе молекул для формирования вирионов. Белок, связывающийся с 5'-концом геномной РНК, в свою очередь узнается капсидными белками и служит сигналом для сборки вирусной частицы с участием данной молекулы РНК. По тому же принципу отбираются геномные молекулы РНК у «минус»-нитевых вирусов. Молекула РНК входит в состав вириона или служит матрицей для репликации. Для переключения ее на транскрипцию должен возникнуть запрет белок-нуклеинового взаимодействия. В репликации ДНК аденовирусов участвует молекула белка, которая связывается с концом вирусной ДНК и необходима для начала репликации. Таким образом, для начала репликации необходим синтез вирусных белков: в присутствии ингибиторов белкового синтеза отсутствует переключение транскрипции на репликацию.
СБОРКА ВИРУСНЫХ ЧАСТИЦ
Синтез компонентов вирусных частиц в клетке разобщен и может протекать в разных структурах ядра и цитоплазмы. Вирусы, репликация которых проходит в ядрах, условно называют ядерными. В основном это ДНК-содержащие вирусы: аденовирусы, паповавирусы, парвовирусы, вирусы герпеса.
Вирусы, реплицирующиеся в цитоплазме, называют цитоплазматическими. К ним относятся из ДНК-содержащих вирус оспы и большинство РНК-содержащих вирусов, за исключением ортомиксовирусов и ретровирусов. Однако это разделение весьма относительно, потому что в репродукции тех и других вирусов есть стадии, протекающие соответственно в цитоплазме и ядре.
Внутри ядра и цитоплазмы синтез вирусспецифических молекул также может быть разобщен. Так, например, синтез одних белков осуществляется на свободных полисомах, а других — на полисомах, связанных с мембранами. Вирусные нуклеиновые кислоты синтезируются в ассоциации с клеточными структурами вдали от полисом, которые синтезируют вирусные белки. При таком дисъюнктивном способе репродукции образование вирусной частицы возможно лишь в том случае, если вирусные нуклеиновые кислоты и белки обладают способностью при достаточной концентрации узнавать друг друга в многообразии клеточных белков и нуклеиновых кислот и самопроизвольно соединяться друг с другом, т. е. способны к самосборке.
В основе самосборки лежит специфическое белок-нуклеиновое и белок-белковое узнавание, которое может происходить в результате гидрофобных, солевых и водородных связей, а также стерического соответствия. Белок-нуклеиновое узнавание ограничено небольшим участком молекулы нуклеиновой кислоты и определяется уникальными последовательностями нуклеотидов в некодирующей части вирусного генома. С этого узнавания участка генома вирусными капсидными белками начинается процесс сборки вирусной частицы. Присоединение остальных белковых молекул осуществляется за счет специфических белок-белковых взаимодействий или неспецифических белок-нуклеиновых взаимодействий.
В связи с разнообразием структуры вирусов животных разнообразны и способы формирования вирионов, однако можно сформулировать следующие общие принципы сборки:
1. У просто устроенных вирусов формируются провирионы, которые затем в результате модификаций белков превращаются в вирионы. У сложно устроенных вирусов сборка осуществляется многоступенчато. Сначала формируются нуклеокапсиды или сердцевины, с которыми взаимодействуют белки наружных оболочек.
2. Сборка сложно устроенных вирусов (за исключением сборки вирусов оспы и реовирусов) осуществляется на клеточных мембранах. Сборка ядерных вирусов происходит с участием ядерных мембран, сборка цитоплазматических вирусов — с участием мембран эндоплазматической сети или плазматической мембраны, куда независимо друг от друга прибывают все компоненты вирусной частицы.
3. У ряда сложно устроенных вирусов существуют специальные гидрофобные белки, выполняющие функции посредников между сформированными нуклеокапсидами и вирусными оболочками. Такими белками являются матриксные белки у ряда «минус»-нитевых вирусов (ортомиксовирусов, парамиксовирусов, рабдовирусов).
4. Сборка нуклеокапсидов, сердцевин, провирионов и вирионов происходит не во внутриклеточной жидкости, а в специальных структурах, предсуществующих в клетке или индуцированных вирусом («фабриках»).
5. Сложно устроенные вирусы для построения своих частиц используют ряд элементов клетки-хозяина, например липиды, некоторые ферменты, у ДНК-геномного 5V40 — гистоны, у оболочечных РНК-геномных вирусов — актин, а в составе ареновирусов обнаружены даже рибосомы. Клеточные молекулы несут определенные функции в вирусной частице, однако включение их в вирион может явиться и следствием случайной контаминации, как, например, включение ряда ферментов клеточных оболочек или клеточных нуклеиновых кислот.
Сборка РНК-содержащих вирусов. Сборка просто устроенных РНК-содержащих вирусов заключается в ассоциации вирусного генома с вирусными капсидными белками с образованием нуклеокапсида.
У сложно устроенных РНК-содержащих вирусов процессы сборки нуклеокапсидов, сердцевин и зрелых вирионов обычно разобщены. Нуклеокапсиды мигрируют к месту сборки вирусных частиц — плазматической мембране (или мембранам эндоплазматической сети) и упорядочение выстраиваются под участками мембран, с наружной стороны которых уже встроены вирусные суперкапсидные белки. Сборка заключается в том, что участки, содержащие гликопротеиды с примыкающими к ним нуклеокапсидами, постепенно выпячиваются через модифицированную клеточную мембрану. В результате выпячивания образуется «почка», содержащая нуклеокапсид и оболочку с суперкапсидными белками. «Почка» отделяется от клеточной мембраны с образованием свободной вирусной частицы. Такой способ формирования вирусных частиц называется почкованием. Почкование может происходить через плазматическую мембрану клетки в наружную среду, как у ортомиксовирусов, парамиксовирусов, рабдовирусов и альфа-вирусов, либо через мембраны эндоплазматической сети в вакуоли, как у аренавирусов и буньявирусов. В основе выпячивания почки через мембрану лежат обычные клеточные процессы, направленные на отторжение непригодного для клетки материала и обновление мембран. Участок будущей почки содержит фиксированный нуклеокапсид, ассоциированный с суперкапсидными белками, но движение мембранных липидов продолжается в силу их текучести, липиды обволакивают будущую почку и вместе с ними из «почки» вытесняются клеточные мембранные белки. В результате этого движения происходит выбухание «почки» над клеточной мембраной. Механизм образования «почки» объясняет, почему в составе почкующихся вирусов не содержится клеточных мембранных белков.
Все вирусные компоненты — нуклеокапсиды и суперкапсидные белки прибывают к месту сборки независимо друг от друга. Первыми к месту сборки прибывают суперкапсидные белки. Обычно этими белками являются гликопротеиды, которые синтезируются в полисомах, связанных с мембранами, и через шероховатые, а затем гладкие мембраны в результате слияния с ними везикул комплекса Гольджи транспортируются на наружную поверхность плазматических мембран или остаются в составе везикул.
Включение гликопротеидов в определенные зоны клеточных мембран приводит к модификациям мембран. Нуклеокапсид узнает эти участки и подходит к ним с внутренней стороны липидного бислоя. Узнавание осуществляется с помощью одного из двух механизмов:
1) нуклеокапеид взаимодействует с участком гликопротеида, пронизывающим клеточную мембрану и вышедшим на ее внутреннюю поверхность. Такой механизм имеет место у альфа-вирусов; гидрофобный фрагмент гликопротеида Е1 проникает через липидный слой на его внутреннюю поверхность, и с этим фрагментом связываются нуклеокапсиды, которые позже войдут в состав «почки»;
2) в сборку вовлекается еще один вирусный белок, являющийся медиатором сборки, который называется мембранным, или матриксным белком. М-белок синтезируется на свободных полисомах, но сразу после синтеза встраивается в клеточные мембраны с внутренней цитоплазматической стороны липидного бислоя. Этот белок в высокой степени гидрофобен и поэтому способен к белок-белковым и белок-липидным взаимодействиям.
Включение М-белка в клеточные мембраны является сигналом для сборки вирусной частицы: вслед за включением немедленно следует связывание нуклеокапсидов с мембранами и почкование вирусной частицы. Тем самым М-белок обладает функцией лимитирующего сборку фактора.
Сборка ДНК-содержащих вирусов. В сборке ДНК-содержащих вирусов есть некоторые отличия от сборки РНК-содержащих вирусов. Как и у РНК-содержащих вирусов, сборка ДНК-содержащих вирусов является многоступенчатым процессом с образованием промежуточных форм, отличающихся от зрелых вирионов по составу полипептидов. Первый этап сборки заключается в ассоциации ДНК с внутренними белками и формировании сердцевин или нуклеокапсидов. При этом ДНК соединяется с предварительно сформированными «пустыми» капсидами.
В результате связывания ДНК с капсидами появляется новый класс промежуточных форм, которые называются неполными формами. Помимо неполных форм с разным содержанием ДНК, существует другая промежуточная форма в морфогенезе — незрелые вирионы, отличающиеся от зрелых тем, что содержат ненарезанные предшественники полипептидов. Таким образом, морфогенез вирусов тесно связан с модификацией (процессингом) белков.
Сборка ядерных вирусов начинается в ядре, обычно — с ассоциации с ядерной мембраной. Формирующиеся в ядре промежуточные формы вируса герпеса почкуются в перинуклеарное пространство через внутреннюю ядерную мембрану, и вирус приобретает таким путем оболочку, которая является дериватом ядерной мембраны. Дальнейшая достройка и созревание вирионов происходит в мембранах эндоплазматической сети и в аппарате Гольджи, откуда вирус в составе цитоплазматических везикул транспортируется на клеточную поверхность.
У непочкующихся липидсодержащих вирусов — вирусов оспы сборка вирионов происходит в уже описанных цитоплазматических вирусных «фабриках». Липидная оболочка вирусов в «фабриках» формируется из клеточных липидов путем автономной самосборки, поэтому липидный состав оболочек значительно отличается от состава липидов в клеточных мембранах.
ВЫХОД ВИРУСНЫХ ЧАСТИЦ ИЗ КЛЕТКИ
Существуют два способа выхода вирусного потомства из клетки: 1) путем «взрыва»; 2) путем почкования.
Выход из клетки путем взрыва связан с деструкцией клетки, нарушением ее целостности, в результате чего находящиеся внутри клетки зрелые вирусные частицы оказываются в окружающей среде. Такой способ выхода из клетки присущ вирусам, не содержащим липопротеидной оболочки (пикорна-, рео-, парво-, папова-, аденовирусы). Однако некоторые из этих вирусов могут транспортироваться на клеточную поверхность до гибели клетки. Выход из клеток путем почкования присущ вирусам, содержащим липопротеидную мембрану, которая является дериватом клеточных мембран. При этом способе клетка может длительное время сохранять жизнеспособность и продуцировать вирусное потомство, пока не произойдет полное истощение ее ресурсов.
ГЛАВА 5. ГЕНЕТИКА ВИРУСОВ
Величайшие достижения середины XX века — открытие дискретных единиц наследственности (генов), разработка хромосомной теории наследственности, развитие биохимической генетики микроорганизмов и установление принципа «один ген — один белок», открытие регуляции активности генов прокариотов Ф. Жакобом и Ж. Моно, открытие двойной спирали ДНК Дж. Уотсоном и Ф. Криком и др., — создали основу для превращения генетики классической в генетику молекулярную, где законы наследственности и изменчивости изучаются на молекулярном и субмолекулярном уровнях.
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ ГЕНОМА ВИРУСА
Вирусы являются одним из излюбленных объектов молекулярной генетики благодаря простому строению и малой молекулярной массе их геномов, которая в 106 раз меньше массы генома эукариотической клетки. Организация генетического аппарата у ряда вирусов, например у SV40, настолько сходна с таковой генов эукариотической клетки, что получила название минихромосомы. Минихромосома широко используется для изучения организации и репликации ДНК.
Число генов у вирусов значительно варьирует: от 3-4 генов у просто устроенных вирусов (парвовирусы) до 150 генов и больше у сложно устроенных (вирус оспы). Геном вирусов животных является гаплоидным, за исключением ретровирусов, которые имеют диплоидный геном, представленный двумя идентичными молекулами РНК. У вирусов с фрагментарным геномом (вирусы гриппа, реовирусы) каждый фрагмент обычно представляет собой один ген.
Так же, как и геном эукариотической клетки, ДНК-геном ряда вирусов животных имеет мозаичную структуру, при которой смысловые последовательности чередуются с неинформативными последовательностями. Механизм сплайсинга при формировании иРНК широко распространен и среди вирусов, имеющих ядерную локализацию транскрипции (адено-, папова-, герпесвирусы), поскольку ферменты, осуществляющие сплайсинг, находятся в ядре. Однако сплайсинг был обнаружен и у РНК-содержащих вирусов. Например, у вирусов гриппа происходит сплайсинг транскриптов 7-го и 8-го генов; в результате сплайсинга и сдвига рамки трансляции продуктами каждого из этих генов являются по два уникальных белка.
В составе генов ДНК-содержащих вирусов есть регуляторные участки, в том числе промотор, контролирующие функцию структурных генов. Сильными промоторами являются концы многих вирусных ДНК, представляющие собой длинные концевые повторы, сильный промотор имеют гены тимидинкиназы вирусов оспы и герпеса. Эти промоторы используются в генной инженерии для усиления транскрипции изучаемого гена.
ГЕНЕТИЧЕСКИЕ И НЕГЕНЕТИЧЕСКИЕ ВЗАИМОДЕЙСТВИЯ ВИРУСОВ
Взаимодействия между вирусами возникают в условиях смешанной инфекции, когда два вируса или более, родственных или неродственных, заражают одну и ту же клетку. Различают генетические и негенетические взаимодействия вирусов.
К генетическим взаимодействиям относят только те, в результате которых происходит обмен генетического материала, и возникают геномы, содержащие фрагменты обоих вирусов-родителей. К генетическим взаимодействиям относят множественную реактивацию, рекомбинацию, кросс- реактивацию, реассортацию и гетерозиготность.
Множественная реактивация. Вирусная инфекция может возникнуть при заражении клетки несколькими вирионами с поврежденными геномами вследствие того, что функцию поврежденного гена может выполнять вирус, у которого этот ген не поврежден. Этот феномен был вначале обнаружен на бактериофагах и получил название множественной реактивации. В основе множественной реактивации лежит кооперативный процесс, при котором вирионы с поражением разных генов дополняют друг друга путем генетической рекомбинации, в результате чего репродуцируется исходный неповрежденный вирус.
Эффективность множественности реактивации зависит от многих причин: степени повреждения генома вирионов, числа проникших в клетку вирионов, концентрации их в определенных участках клетки, аутоинтерференции поврежденных вирионов. Для множественной реактивации важное значение имеет расстояние между вирионами с поврежденными геномами внутри клетки. Обработка вирионов двухвалентными ионами металлов, ведущая к их агрегации, усиливает множественную реактивацию.
Рекомбинацией называют обмен частями генома, включающей ковалентное встраивание участка (или участков) генома одного вируса в геном другого.
Под реассортацией понимают обмен геномными сегментами, когда не происходит ковалентного встраивания, и который возможен только у тех вирусов, чей геном представлен раздельными сегментами, каждый из которых включает один или несколько генов (вирусы с сегментированным геномом). Она наблюдается при генетических взаимодействиях между вирусами, имеющими сегментированный геном. Образующиеся при этом гибридные формы вирусов называют реассортантами. Реассортанты вирусов гриппа получают при совместном культивировании вирусов с разными генами гемагглютинина и нейраминидазы. В этом случае из общего потомства путем нейтрализации соответствующих антигенов можно выделить интересующие исследователя варианты.
Существуют определенные группировки (констелляции или созвездия) генов, которые в данной системе клеток более стойки и делают вирус более жизнеспособным.
Сходные процессы пересортировки генов имеют место у вирусов гриппа типов А, В и С и у других вирусов с фрагментарным геном — у буньявирусов, аренавирусов (однонитчатые РНК) и реовирусов (ротавирусов) (двунитчатая РНК). Однако эти процессы не столь интенсивны и доступны изучению, как у вирусов гриппа.
Перекрестная реактивация. Перекрестная реактивация, кросс-реактивация или реактивация при скрещивании, происходит в том случае, когда у одного из штаммов вируса часть генома повреждена, а другой геном интактен. При смешанной инфекции двумя такими вирусами возможна рекомбинация неповрежденных участков генома инактивированного вируса с геномом интактного вируса, и в результате этого процесса появляются штаммы вируса со свойствами обоих родителей. Описываемый феномен также обозначается как «спасение маркера», поскольку реактивируется (рекомбинирует) лишь часть генома инактивированного вируса, несущая какой-нибудь признак (маркер).
Гетерозиготность. При совместном культивировании двух штаммов вируса может происходить формирование вирионов, содержащих в своем составе два разных генома или по крайней мере один полный геном и часть второго генома. Это явление названо гетерозиготностью.
Негенетическими взаимодействиями называют взаимодействия между белками разных вирусов (или с участием белков одного вируса и генетического материала другого вируса), не ведущие к наследуемым изменениям. При смешанной инфекции имеют место, как правило, и генетические и негенетические взаимодействия, причем последние могут принимать участие в генерации наследуемых перестроек генома, т.е. в генетических взаимодействиях. К негенетическим взаимодействиям вирусов относят комплементацию, фенотипическое смешивание и интерференцию.
Комплеменатацией называют взаимодействие белков разных вирусов в зараженной клетке, а также взаимодействие белков одного вируса с генетическим материалом (ДНК или РНК) другого, в результате которого репродукция вируса усиливается. Если ген одного из вирусов имеет мутацию, в результате которой соответствующий белок нефункционален, аналогичный белок другого вируса может восполнить недостающую функцию. Комплементация может быть неаллельной, межгенной, если каждый из двух вирусов имеет мутацию, которая не позволяет ему репродуцироваться в непермиссивных условиях, но мутации локализованы в двух разных генах, так что каждый вирус продуктом своего нормального, не имеющего мутации гена помогает вирусу-партнеру эффективно репродуцироваться. Возможна и неаллельная, внутригенная комплементация, в тех случаях, когда мутации у двух вирусов находятся в одном и том же гене, но в разных его участках, соответствующих разным доменам молекулы белка, кодируемого этим геном. Такая комплементация наблюдается в тех случаях, когда белок осуществляет свою функцию в виде олиго- или мультимера. Оба случая имеют место при комплементации между близкородственными вирусами. Комплементация возможна и между неродственными вирусами: например, вирусы-сателлиты (дельтавирус, аденоассоциированные вирусы и т.п.) способны к репродукции лишь в присутствии вируса-помощника.
Фенотипическим смешиванием называют формирование вириона, содержащего структурные белки двух вирусов. Вирусы, участвующие в фенотипическом смешивании, могут быть как близкородственными, так и неродственными. При фенотипическом смешивании гетерогенными, т.е. происходящими от разных вирусов, могут быть пепломеры в липопротеидной оболочке или капсомеры в капсиде. Частный случай фенотипического смешивания – транскапсидация, при которой геном одного вируса оказывается заключенным в капсид другого.
Интерференцией называют подавление размножения одного вируса другим. К негенетическим взаимодействиям обычно относят не опосредованную интерференцию (через индукцию интерферона или других факторов), а только ту, которая возникает при непосредственном взаимодействии вирусов, репродуцирующихся в одной клетке. К таким случаям относится подавление репродукции вируса дикого типа мутантом или холодо-адаптированным вариантом.
ОСНОВНЫЕ ПРОЦЕССЫ, КОНТРОЛИРУЮЩИЕ НАСЛЕДСТВЕННОСТЬ И ИЗМЕНЧИВОСТЬ ВИРУСОВ
Модификации. Модификациями называются не наследуемые (фенотипические) изменения у вирусов, обусловленные клеткой-хозяином. Эти изменения лежат в основе адаптации вируса к новому хозяину и преодоления зависимого от хозяина ограничения. Модификации нуклеиновых кислот вирусов осуществляют клеточные ферменты, ответственные за ограничение (рестрикцию) репродукции вируса.
Мутации. В основе изменчивости вирусов лежат мутации, т. е. изменения состава и последовательностей нуклеотидов вирусного генома. Мутации происходят у всех вирусов, независимо от того, является ли их генетическим аппаратом ДНК или РНК. В результате мутаций отдельные вирионы могут приобретать новые свойства. Дальнейшая судьба таких вирусов зависит от естественного отбора, сохраняющего популяцию, наиболее приспособленную к условиям существования. Мутации могут иметь разные последствия. В одних случаях они ведут к изменению фенотипических проявлений в нормальных условиях. Например, увеличивается или уменьшается размер бляшек под агаровым покрытием; увеличивается или ослабляется нейровирулентность для определенного вида животных; вирус становится более чувствительным к действию химиотерапевтического агента и т. п. В других случаях мутация является летальной, так как вследствие ее нарушается синтез или функция жизненно важного вирусспецифического белка, например вирусной полимеразы.
В некоторых случаях мутации являются условно летальными, так как вирусспецифический белок сохраняет свои функции в определенных, оптимальных для него, условиях и теряет эту способность в неразрешающих (непермиссивных) условиях. Типичным примером таких мутаций являются температурно-чувствительные (tempe rature sensitive) — ts-мутации, при которых вирус теряет способность размножения при повышенных температурах (39-42 °С), сохраняя эту способность при обычных температурах выращивания (36-37 °С).
По своему механизму мутации могут быть тоже разными. В одних случаях происходит деления, т. е. выпадение одного или нескольких нуклеотидов, в других случаях происходит встраивание одного или нескольких нуклеотидов, а в некоторых случаях — замена одного нуклеотида другим. Мутации могут быть прямыми и обратными. Прямые мутации меняют фенотип, а обратные мутации — реверсии — его восстанавливают. Возможны истинные реверсии, когда обратная мутация происходит в месте первичного повреждения, и псевдореверсии, если мутация происходит в другом участке дефектного гена (интрагенная супрессия) или в другом гене (экстрагенная супрессия). Реверсия не является редким событием, так как ревертанты обычно более приспособлены к данной клеточной системе. Поэтому при получении мутантов с заданными свойствами, например, вакцинных штаммов, приходится считаться с возможной их реверсией к дикому типу. Мутации носят случайный характер и объясняются статистическими законами.
В качестве физических мутагенов наиболее часто применяется ультрафиолетовое облучение, так как его энергия сопоставима с энергией химических связей. Реже применяются более жесткие виды облучения — рентгеновское и гамма-облучение, а также обработка вирусных суспензий нейтронами, протонами, электронами и ядрами гелия, так как они вызывают сильные разрушения вирусных геномов и их инактивацию.
В качестве химических мутагенов применяют аналоги оснований (бромурацил, бромдезоксиуридин, 2-аминопурин, нитрозогуанидин и пр.), алкилирующие и флуоресцирующие соединения (профлавин), интеркалирующие агенты (актиномицин, этидин бромид), азотистую кислоту, гидроксиламин и многие другие.
Дата: 2019-04-23, просмотров: 368.