Конспекты лекций по молекулярной биологии.
Раздел 2. Молекулярная биология гена.
Образование связей между основаниями.
Каждое основание на одной из цепей связывается с одним определённым основанием на второй цепи. Такое специфическое связывание называется комплементарным. Пурины комплементарны пиримидинам (то есть способны к образованию водородных связей с ними): аденин образует связи только с тимином, а цитозин - с гуанином. В двойной спирали цепочки также связаны с помощью гидрофобных взаимодействий и стэкинга, которые не зависят от последовательности оснований ДНК.
Комплементарность двойной спирали означает, что информация, содержащаяся в одной цепи, содержится и в другой цепи. Обратимость и специфичность взаимодействий между комплементарными парами оснований важна для репликации ДНК и всех остальных функций ДНК в живых организмах.
Так как водородные связи нековалентны, они легко разрываются и восстанавливаются. Цепочки двойной спирали могут расходиться как замок-молния под действием ферментов (хеликазы) или при высокой температуре. Разные пары оснований образуют разное количество водородных связей. АТ связаны двумя, ГЦ - тремя водородными связями, поэтому на разрыв ГЦ требуется больше энергии. Процент ГЦ-пар и длина молекулы ДНК определяют количество энергии, необходимой для диссоциации цепей: длинные молекулы ДНК с большим содержанием ГЦ более тугоплавки.
Части молекул ДНК, которые из-за их функций должны быть легко разделяемы, например, ТАТА последовательность в бактериальных промоторах, обычно содержат большое количество А и Т.
Химические модификации оснований.
Метилирование ДНК
| 
| 
|
| Цитозин | 5-метилцитозин | Тимин |
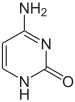
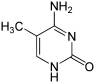
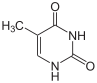
Структура цитозина, 5-метилцитозина и тимина. Тимин может возникать путём деаминирования 5-метилцитозина
Азотистые основания в составе ДНК могут быть ковалентно модифицированы, что используется при регуляции экспрессии генов. Например, в клетках позвоночных метилирование цитозина с образованием 5-метилцитозина используется соматическими клетками для передачи профиля генной экспрессии дочерним клеткам. Метилирование цитозина не влияет на спаривание оснований в двойной спирали ДНК. У позвоночных метилирование ДНК в соматических клетках ограничивается метилированием цитозина в последовательности ЦГ. Средний уровень метилирования отличается у разных организмов от 0 до 1 %. Другие модификации оснований включают метилирование аденина у бактерий и гликозилирование урацила с образованием «J-основания» в кинетопластах.
Метилирование цитозина с образованием 5-метилцитозина в промоторной части гена коррелирует с его неактивным состоянием. Метилирование цитозина важно также для инактивации Х-хромосомы у млекопитающих. Метилирование ДНК используется в геномном импринтинге. Значительные нарушения профиля метилирования ДНК происходят при канцерогенезе.
Несмотря на биологическую роль, 5-метилцитозин может спонтанно утрачивать аминную группу (деаминироваться), превращаясь в тимин, поэтому метилированные цитозины являются источником повышенного числа мутаций.
Повреждения ДНК.
ДНК может повреждаться разнообразными мутагенами, к которым относятся окисляющие и алкилирующие вещества, а также высокоэнергетическая электромагнитная радиация - ультрафиолетовое и рентгеновское излучение. Тип повреждения ДНК зависит от типа мутагена. Например, ультрафиолет повреждает ДНК путём образования в ней димеров тимина, которые возникают при образовании ковалентных связей между соседними основаниями.
Оксиданты, такие как свободные радикалы или пероксид водорода, приводят к нескольким типам повреждения ДНК, включая модификации оснований, в особенности гуанозина, а также двухцепочечные разрывы в ДНК. По некоторым оценкам, в каждой клетке человека окисляющими соединениями ежедневно повреждается порядка 500 оснований. Среди разных типов повреждений наиболее опасные - это двухцепочечные разрывы, потому что они трудно репарируются и могут привести к потерям участков хромосом (делециям) и транслокациям.
Многие молекулы мутагенов вставляются (интеркалируют) между двумя соседними парами оснований. Большинство этих соединений, например, бромистый этидий, даунорубицин, доксорубицин и талидомид, имеет ароматическую структуру. Для того чтобы интеркалирующее соединение могло поместиться между основаниями, они должны разойтись, расплетая и нарушая структуру двойной спирали. Эти изменения в структуре ДНК мешают транскрипции и репликации, вызывая мутации. Поэтому интеркалирующие соединения часто являются канцерогенами, наиболее известные из которых - бензопирен, акридины, афлатоксин и бромистый этидий. Несмотря на эти негативные свойства, в силу их способности подавлять транскрипцию и репликацию ДНК, интеркалирующие соединения используются в химиотерапии для подавления быстро растущих клеток рака.
Некоторые вещества (цисплатин, митомицин C, псорален) образуют поперечные сшивки между нитями ДНК и подавляют синтез ДНК, благодаря чему используются в химиотерапии некоторых видов рака (см. Химиотерапия злокачественных новообразований).
Суперскрученная ДНК.
 Если взяться за концы верёвки и начать скручивать их в разные стороны, она становится короче и на верёвке образуются «супервитки». Так же может быть суперскручена и ДНК. В обычном состоянии цепочка ДНК делает один оборот на каждые 10,459 основания, но в суперскрученном состоянии спираль может быть свёрнута туже или расплетена. Выделяют два типа суперскручивания: положительное - в направлении нормальных витков, при котором основания расположены ближе друг к другу; и отрицательное - в противоположном направлении. В природе молекулы ДНК обычно находятся в отрицательном суперскручивании, которое вносится ферментами - топоизомеразами. Эти ферменты удаляют дополнительное скручивание, возникающее в ДНК в результате транскрипции репликации.
Если взяться за концы верёвки и начать скручивать их в разные стороны, она становится короче и на верёвке образуются «супервитки». Так же может быть суперскручена и ДНК. В обычном состоянии цепочка ДНК делает один оборот на каждые 10,459 основания, но в суперскрученном состоянии спираль может быть свёрнута туже или расплетена. Выделяют два типа суперскручивания: положительное - в направлении нормальных витков, при котором основания расположены ближе друг к другу; и отрицательное - в противоположном направлении. В природе молекулы ДНК обычно находятся в отрицательном суперскручивании, которое вносится ферментами - топоизомеразами. Эти ферменты удаляют дополнительное скручивание, возникающее в ДНК в результате транскрипции репликации.
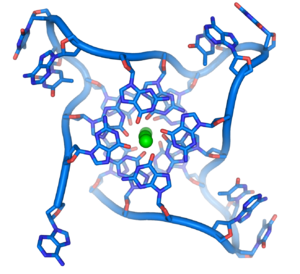 Структуры на концах хромосом
Структуры на концах хромосом
Структура теломер. Зелёным цветом показан ион металла, хелатированный в центре структуры.
На концах линейных хромосом находятся специализированные структуры ДНК, называемые теломерами. Основная функция этих участков - поддержание целостности концов хромосом. Теломеры также защищают концы ДНК от деградации экзонуклеазами и предотвращают активацию системы репарации. Поскольку обычные ДНК-полимеразы не могут реплицировать 3' концы хромосом, это делает специальный фермент - теломераза.
В клетках человека теломеры часто представлены одноцепочечной ДНК и состоят из нескольких тысяч повторяющихся единиц последовательности ТТАГГГ. Эти последовательности с высоким содержанием гуанина стабилизируют концы хромосом, формируя очень необычные структуры, называемые G-квадруплексами и состоящие из четырёх, а не двух взаимодействующих оснований. Четыре гуаниновых основания, все атомы которых находятся в одной плоскости, образуют пластинку, стабилизированную водородными связями между основаниями и хелатированием в центре неё иона металла (чаще всего калия). Эти пластинки располагаются стопкой друг над другом.
На концах хромосом могут образовываться и другие структуры: основания могут быть расположены в одной цепочке или в разных параллельных цепочках. Кроме этих «стопочных» структур теломеры формируют большие петлеобразные структуры, называемые Т-петли или теломерные петли. В них одноцепочечная ДНК располагается в виде широкого кольца, стабилизированного теломерными белками. В конце Т-петли одноцепочечная теломерная ДНК присоединяется к двухцепочечной ДНК, нарушая спаривание цепочек в этой молекуле и образуя связи с одной из цепей. Это трёхцепочечное образование называется Д-петля (от англ. displacement loop).
Биологические функции
ДНК является носителем генетической информации, записанной в виде последовательности нуклеотидов с помощью генетического кода. С молекулами ДНК связаны два основополагающих свойства живых организмов - наследственность и изменчивость. В ходе процесса, называемого репликацией ДНК, образуются две копии исходной цепочки, наследуемые дочерними клетками при делении, отсюда следует, что образовавшиеся клетки оказываются генетически идентичны исходной.
Генетическая информация реализуется при экспрессии генов в процессах транскрипции (синтеза молекул РНК на матрице ДНК) и трансляции (синтеза белков на матрице РНК).
Последовательность нуклеотидов кодирует информацию о различных типах РНК: информационных, или матричных (мРНК), рибосомальных (рРНК) и транспортных (тРНК). Все эти типы РНК синтезируются на основе ДНК в процессе транскрипции. Роль их в биосинтезе белков (процессе трансляции) различна. Информационная РНК содержит информацию о последовательности аминокислот в белке, рибосомальные РНК служат основой для рибосом (сложных нуклеопротеиновых комплексов, основная функция которых - сборка белка из отдельных аминокислот на основе иРНК), транспортные РНК доставляют аминокислоты к месту сборки белков - в активный центр рибосомы, «ползущей» по иРНК.
Структура генома.
Транскрипция и трансляция.
Генетический код, Транскрипция (биология), Трансляция (биология)
Генетическая информация, закодированная в ДНК, должна быть прочитана и в конечном итоге выражена в синтезе различных биополимеров, из которых состоят клетки. Последовательность оснований в цепочке ДНК напрямую определяет последовательность оснований в РНК, на которую она «переписывается» в процессе, называемом транскрипцией. В случае мРНК эта последовательность определяет аминокислоты белка. Соотношение между нуклеотидной последовательностью мРНК и аминокислотной последовательностью определяется правилами трансляции, которые называются генетическим кодом. Генетический код состоит из трёхбуквенных «слов», называемых кодонами, состоящих из трёх нуклеотидов (то есть ACT, CAG, TTT и т. п.). Во время транскрипции нуклеотиды гена копируются на синтезируемую РНК РНК-полимеразой. Эта копия в случае мРНК декодируется рибосомой, которая «читает» последовательность мРНК, осуществляя спаривание матричной РНК с транспортными РНК, которые присоединены к аминокислотам. Поскольку в трёхбуквенных комбинациях используются 4 основания, всего возможны 64 кодона (4³ комбинации). Кодоны кодируют 20 стандартных аминокислот, каждой из которых соответствует в большинстве случаев более одного кодона. Один из трёх кодонов, которые располагаются в конце мРНК, не означает аминокислоту и определяет конец белка, это «стоп» или «нонсенс» кодоны - TAA, TGA, TAG.
Репликация ДНК.
Деление клеток необходимо для размножения одноклеточного и роста многоклеточного организма, но до деления клетка должна удвоить геном, чтобы дочерние клетки содержали ту же генетическую информацию, что и исходная клетка. Из нескольких теоретически возможных механизмов удвоения (репликации) ДНК реализуется полуконсервативный. Две цепочки разделяются, а затем каждая недостающая комплементарная последовательность ДНК воспроизводится ферментом ДНК-полимеразой. Этот фермент синтезирует полинуклеотидную цепь, находя правильный нуклеотид через комплементарное спаривание оснований и присоединяя его к растущей цепочке. ДНК-полимераза не может начинать новую цепь, а может лишь наращивать уже существующую, поэтому она нуждается в короткой цепочке нуклеотидов - (праймере), синтезируемом праймазой. Так как ДНК-полимеразы могут синтезировать цепочку только в направлении 5' --> 3', антипараллельные цепи ДНК копируются по-разному: одна цепь (лидирующая) синтезируется непрерывно, а вторая (запаздывающая) прерывчато.
Топоизомеразы и хеликазы.
В клетке ДНК находится в компактном, т. н. суперскрученном состоянии, иначе она не смогла бы в ней уместиться. Для протекания жизненно важных процессов ДНК должна быть раскручена, что производится двумя группами белков - топоизомеразами и хеликазами.
Топоизомеразы - ферменты, которые имеют и нуклеазную, и лигазную активности. Они изменяют степень суперскрученности в ДНК. Некоторые из этих ферментов разрезают спираль ДНК и позволяют вращаться одной из цепей, тем самым уменьшая уровень суперскрученности, после чего фермент заделывает разрыв. Другие ферменты могут разрезать одну из цепей и проводить вторую цепь через разрыв, а потом лигировать разрыв в первой цепи. Топоизомеразы необходимы во многих процессах, связанных с ДНК, таких как репликация и транскрипция.
Хеликазы - белки, которые являются одним из молекулярных моторов. Они используют химическую энергию нуклеотидтрифосфатов, чаще всего АТФ, для разрыва водородных связей между основаниями, раскручивая двойную спираль на отдельные цепочки. Эти ферменты важны для большинства процессов, где белкам необходим доступ к основаниям ДНК.
Нуклеазы и лигазы.
 В различных процессах, происходящих в клетке, например, рекомбинации и репарации, участвуют ферменты, способные разрезать и восстанавливать целостность нитей ДНК. Ферменты, разрезающие ДНК, носят название нуклеаз. Нуклеазы, которые гидролизуют нуклеотиды на концах молекулы ДНК, называются экзонуклеазами, а эндонуклеазы разрезают ДНК внутри цепи. Наиболее часто используемые в молекулярной биологии и генетической инженерии нуклеазы - это эндонуклеазы рестрикции (рестриктазы), которые разрезают ДНК около специфических последовательностей. Например, фермент EcoRV (рестрикционный фермент № 5 из 'E. coli') узнаёт шестинуклеотидную последовательность 5'-GAT|ATC-3' и разрезает ДНК в месте, указанном вертикальной линией. В природе эти ферменты защищают бактерии от заражения бактериофагами, разрезая ДНК фага, когда она вводится в бактериальную клетку. В этом случае нуклеазы - часть системы модификации-рестрикции. ДНК-лигазы «сшивают» концы фрагментов ДНК между собой, катализируя формирование фосфодиэфирной связи с использованием энергии АТФ. Рестрикционные нуклеазы и лигазы используются в клонировании и фингерпринтинге.
В различных процессах, происходящих в клетке, например, рекомбинации и репарации, участвуют ферменты, способные разрезать и восстанавливать целостность нитей ДНК. Ферменты, разрезающие ДНК, носят название нуклеаз. Нуклеазы, которые гидролизуют нуклеотиды на концах молекулы ДНК, называются экзонуклеазами, а эндонуклеазы разрезают ДНК внутри цепи. Наиболее часто используемые в молекулярной биологии и генетической инженерии нуклеазы - это эндонуклеазы рестрикции (рестриктазы), которые разрезают ДНК около специфических последовательностей. Например, фермент EcoRV (рестрикционный фермент № 5 из 'E. coli') узнаёт шестинуклеотидную последовательность 5'-GAT|ATC-3' и разрезает ДНК в месте, указанном вертикальной линией. В природе эти ферменты защищают бактерии от заражения бактериофагами, разрезая ДНК фага, когда она вводится в бактериальную клетку. В этом случае нуклеазы - часть системы модификации-рестрикции. ДНК-лигазы «сшивают» концы фрагментов ДНК между собой, катализируя формирование фосфодиэфирной связи с использованием энергии АТФ. Рестрикционные нуклеазы и лигазы используются в клонировании и фингерпринтинге.
ДНК-лигаза I (кольцеобразная структура, состоящая из нескольких одинаковых молекул белка, показанных разными цветами), лигирующая повреждённую цепь ДНК
Полимеразы.
Существует также важная для метаболизма ДНК группа ферментов, которые синтезируют цепи полинуклеотидов из нуклеозидтрифосфатов - ДНК-полимеразы. Они добавляют нуклеотиды к 3'-гидроксильной группе предыдущего нуклеотида в цепи ДНК, поэтому все полимеразы работают в направлении 5'--> 3'. В активном центре этих ферментов субстрат - нуклеозидтрифосфат - спаривается с комплементарным основанием в составе одноцепочечной полинуклеотидной цепочки - матрицы.
В процессе репликации ДНК ДНК-зависимая ДНК-полимераза синтезирует копию исходной последовательности ДНК. Точность очень важна в этом процессе, так как ошибки в полимеризации приведут к мутациям, поэтому многие полимеразы обладают способностью к «редактированию» - исправлению ошибок. Полимераза узнаёт ошибки в синтезе по отсутствию спаривания между неправильными нуклеотидами. После определения отсутствия спаривания активируется 3'--> 5' экзонуклеазная активность полимеразы, и неправильное основание удаляется. В большинстве организмов ДНК-полимеразы работают в виде большого комплекса, называемого реплисомой, которая содержит многочисленные дополнительные субъединицы, например, хеликазы.
РНК-зависимые ДНК-полимеразы - специализированный тип полимераз, которые копируют последовательность РНК на ДНК. К этому типу относятся обратная транскриптаза, которая содержится в ретровирусах и используется при инфекции клеток, а также теломераза, необходимая для репликации теломер. Теломераза - необычный фермент, потому что она содержит собственную матричную РНК.
Транскрипция осуществляется ДНК-зависимой РНК-полимеразой, которая копирует последовательность ДНК одной цепочки на мРНК. В начале транскрипции гена РНК-полимераза присоединяется к последовательности в начале гена, называемой промотором, и расплетает спираль ДНК. Потом она копирует последовательность гена на матричную РНК до тех пор, пока не дойдёт до участка ДНК в конце гена - терминатора, где она останавливается и отсоединяется от ДНК. Также как ДНК-зависимая ДНК-полимераза человека, РНК-полимераза II, которая транскрибирует большую часть генов в геноме человека, работает в составе большого белкового комплекса, содержащего регуляторные и дополнительные единицы.
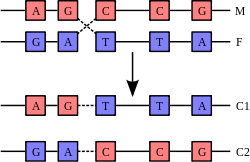 Генетическая рекомбинация.
Генетическая рекомбинация.
Рекомбинация происходит в результате физического разрыва в хромосомах (М) и (F) и их последующего соединения с образованием двух новых хромосом (C1 и C2)
Двойная спираль ДНК обычно не взаимодействует с другими сегментами ДНК, и в человеческих клетках разные хромосомы пространственно разделены в ядре. Это расстояние между разными хромосомами важно для способности ДНК действовать в качестве стабильного носителя информации. В процессе рекомбинации с помощью ферментов две спирали ДНК разрываются, обмениваются участками, после чего непрерывность спиралей восстанавливается, поэтому обмен участками негомологичных хромосом может привести к повреждению целостности генетического материала.
Рекомбинация позволяет хромосомам обмениваться генетической информацией, в результате этого образуются новые комбинации генов, что увеличивает эффективность естественного отбора и важно для быстрой эволюции новых белков. Генетическая рекомбинация также играет роль в репарации, особенно в ответе клетки на разрыв обеих цепей ДНК.
Самая распространённая форма кроссинговера - это гомологичная рекомбинация, когда принимающие участие в рекомбинации хромосомы имеют очень похожие последовательности. Иногда в качестве участков гомологии выступают транспозоны. Негомологичная рекомбинация может привести к повреждению клетки, поскольку в результате такой рекомбинации возникают транслокации. Реакция рекомбинации катализируется ферментами, которые называются рекомбиназы, например, Cre. На первом этапе реакции рекомбиназа делает разрыв в одной из цепей ДНК, позволяя этой цепи отделиться от комплементарной цепи и присоединиться к одной из цепей второй хроматиды. Второй разрыв в цепи второй хроматиды позволяет ей также отделиться и присоединиться к оставшейся без пары цепи из первой хроматиды, формируя структуру Холлидея. Структура Холлидея может передвигаться вдоль соединённой пары хромосом, меняя цепи местами. Реакция рекомбинации завершается, когда фермент разрезает соединение, а две цепи лигируются.
Лекция 3. Виды генов.
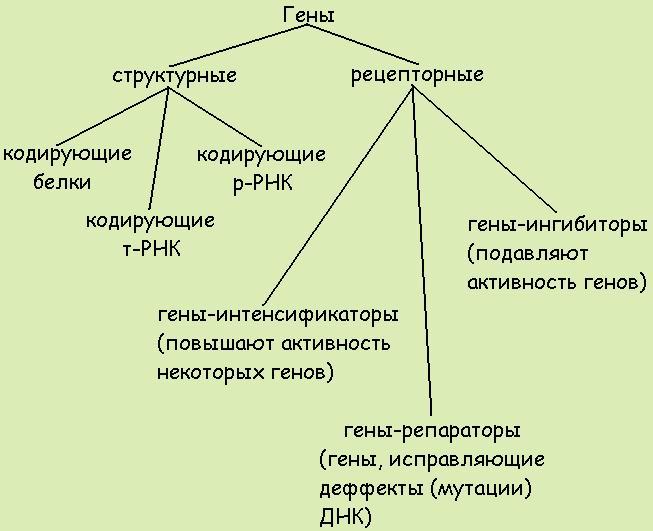
По функциям гены классифицируют на структурные и функциональные. Структурные гены содержат информацию о белках-ферментах, гистонах, о последовательности нуклеотидов в разных видах РНК.
Функциональные гены оказывают влияние на работу структурных генов. Функциональными являются гены-модуляторы и гены-регуляторы. Гены-модуляторы – это ингибиторы, интенсификаторы, модификаторы. Они усиливают, ослабляют или изменяют работу структурных генов. Регулируют работу структурных генов гены-регуляторы и гены-операторы.
Генотип всех соматических клеток организма одного вида одинаков. Но клетки разных тканей отличаются друг от друга. Вероятно, это связано с тем, что в них работают разные блоки генов. Область проявления действия данного гена называется полем его действия (например, распределение волосяного покрова на теле человека). Как правило, гены, детерминирующие определенные признаки, «работают» непостоянно (например, гены, определяющие синтез половых гормонов); их функция значительно снижается с возрастом. Период функционирования гена называется временем его действия.
По месту действия гены подразделяют на три группы
1) функционирующие во всех клетках (например, гены, кодирующие ферменты энергетического обмена);
2) функционирующие в клетках одной ткани (детерминирующие синтез белка миозина в мышечной ткани);
3) специфичные для одного типа клеток (гены гемоглобина в незрелых эритроцитах).
Гены выполняют в клетке две основные функции.
Гетеросинтетическая функция – это программирование биосинтеза белка в клетке.
Аутосинтетическая функция – репликация спирали ДНК (самоудвоение ДНК).
После открытия структуры ДНК долгое время полагали, что бактериальная хромосома представляет собой чистую ДНК в виде двойной спирали. Однако позднее выяснилось, что хромосома прокариот содержит в своей структуре примерно 20% белков. Их роль - обеспечить определенную компактизацию и прикрепление ДНК к оболочке бактерии. В настоящее время белки прокариотической хромосомы известны. Показано, что мутации в соответствующих генах не приводят к заметным фенотипическим проявлениям. По-видимому, роль этих белков вспомогательная, и они могут заменять друг друга в создании определенной структуры. Таким образом, прокариоты, в отличие от эукариот, не имеют высокоспециализированной системы организации хромосомы.
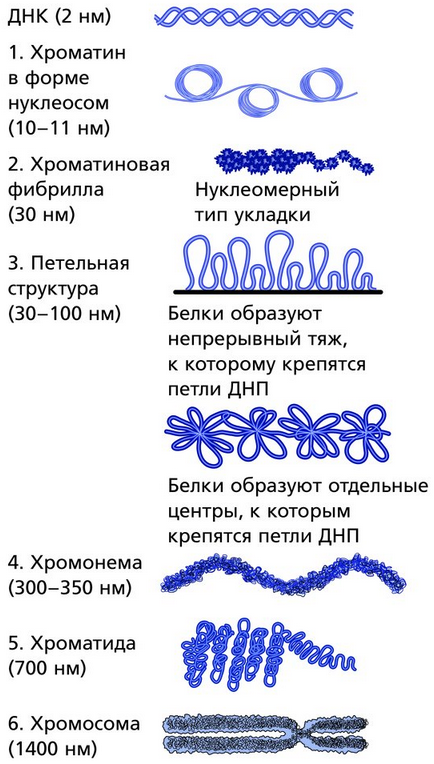
Существуют две наиболее известные модели, объясняющие механизм упаковки хроматина. Согласно одной из них, наиболее известной в зарубежной литературе, нить ДНК претерпевает пять уровней компактизации от 2 нм (ее собственный диаметр) до 1400 нм (высококонденсированная метафазная хромосома).
Низшим уровнем иерархической организации хромосом считается нуклеосомный. Нуклеосома состоит из кора (сердцевины, стержня) и намотанной на него ДНК (146 п.н„ 1,8 витка). Кор представляет собой гистоновый октамер Н2А, Н2В, НЗ, Н4 (по две молекулы каждого). Хроматин на этой стадии имеет вид «бусин» (глобул диаметром 11 нм), нанизанных на «нить» (молекулярную ДНК). Такая структура обеспечивает компактизацию примерно в 6-7 раз.
Вторая ступень компактизации - формирование хроматиновой фибриллы диаметром 30 нм. В этом процессе участвует гистон HI, который связывается с ДНК между нуклеосомными корами и сворачивает нуклеосомную фибриллу в спираль, наподобие соленоида, с шагом в 6-8 нуклеосом. Уровень компактизации на этом этапе достигает примерно 40.
Третий этап - петельно-доменный - наиболее сложный. Соленоидная фибрилла складывается, образуя петли различной длины. Общий уровень компактизации возрастает до 1000, но, очевидно, может различаться в различных районах хромосомы. Диаметр такой структуры в среднем составляет 300 нм., по-видимому, она наиболее типична для интерфазной хромосомы.
На четвертом этапе компактизации 300 нм-фибриллы дополнительно сворачиваются, образуя хроматиды диаметром примерно 600-700 нм.
Последняя, пятая, ступень компактизации (в 7000 раз) характерна для метафазной хромосомы; ее диаметр равен 1400 нм.
Известна и другая схема компактизации хроматина, предложенная Ю.С. Ченцовым. Она основана на данных световой и электронной микроскопии. Согласно этой модели, первым уровнем также является нуклеосомный. На втором этапе 8 нуклеосом образуют глобулу, называемую нуклеомером. Ряд сближенных нуклсомеров формируют 20-30-нанометровую фибриллу. Третий уровень - хромомерный. Петли фибрилл ДНП, скрепленные негистоновыми белками, образуют розетковидные структуры. На четвертом - хромонемном уровне происходит их сближение с образованием структур, состоящих из петлевых доменов. Предполагается, что на следующем, пятом, уровне компактизации, характерном для хроматид, происходит спиральная укладка хромонемных нитей.
Лекция 4. Генетический код.
Генетический код имеет много определений, например, - это система записи информации о последовательности аминокислот в белках с помощью последовательности нуклеотидов части ДНК или РНК. Более узкое определение и все таблицы генетического кода представляют его как последовательность кодонов в части молекулы мРНК. Каждый кодон состоит из трёх нуклеотидов и соответствует единственной аминокислоте. Рибосома синтезирует белок согласно инструкции, записанной в зрелой мРНК, причём соответствие между кодоном и аминокислотой определяется генетическим кодом.
Генетический код (англ. Genetic code) - совокупность правил, согласно которым в живых клетках последовательность нуклеотидов (ген и мРНК) переводится в последовательность аминокислот (белок). Собственно, перевод (трансляцию) осуществляет рибосома, которая соединяет аминокислоты в цепочку согласно инструкции, записанной в кодонах мРНК. Соответствующие аминокислоты доставляются в рибосому молекулами тРНК. Генетический код всех живых организмов Земли един (имеются лишь незначительные вариации), что свидетельствует о наличии общего предка или творца.
Правила генетического кода определяют, какой аминокислоте соответствует триплет (три подряд идущих нуклеотида) в мРНК. За редкими исключениями, каждому кодону соответствует только одна аминокислота. Конкретная аминокислота может кодироваться более чем одним кодоном, есть также кодоны, означающие начало и конец белка. Вариант генетического кода, который используется подавляющим большинством живых организмов, называют стандартным, или каноническим, генетическим кодом. Однако известно несколько десятков исключений из стандартного генетического кода, например, при трансляции в митохондриях используются несколько изменённые правила генетического кода. Простейшим представлением генетического кода может служить таблица из 64 ячеек, в которой каждая ячейка соответствует одному из 64 возможных кодонов.
Попытки понять, каким образом последовательность ДНК кодирует аминокислотную последовательность белков, начали предприниматься почти сразу же после того, как в 1953 году была установлена структура ДНК. Георгий Гамов предположил, что кодоны должны состоять из трёх нуклеотидов, чтобы кодонов хватило для всех 20 аминокислот (всего же возможно 64 различных кодона из трёх нуклеотидов). В 1961 году триплетность генетического кода удалось подтвердить экспериментально. В том же году Маршалл Ниренберг и его коллега Генрих Маттеи использовали бесклеточную систему для трансляции in vitro. В качестве матрицы был взят олигонуклеотид, состоящий из остатков урацила (UUUU…). Пептид, синтезированный с него, содержал только аминокислоту фенилаланин. Так впервые было установлено значение кодона: кодон UUU кодирует фенилаланин. Дальнейшие правила соответствия между кодонами и аминокислотами были установлены в лаборатории Северо Очоа. Было показано, что полиадениновая РНК (ААА…) транслируется в полилизиновый пептид, а на матрице полицитозиновой РНК (ССС…) синтезируется пептид, состоящий только из остатков пролина. Значение остальных кодонов было установлено при помощи разнообразных сополимеров в ходе экспериментов, проведённых в лаборатории Хара Гобинда Кораны. Вскоре после этого Роберт Холли установил структуру молекулы тРНК, которая служит посредником при трансляции. В 1968 году Ниренберг, Корана и Холли были удостоены Нобелевской премии по физиологии и медицине.
После установления правил генетического кода многие учёные занялись его искусственными преобразованиями. Так, начиная с 2001 года в генетический код были внедрены 40 аминокислот, которые в природе не входят в состав белков. Для каждой аминокислоты создавались свой кодон и соответствующая аминоацил-тРНК-синтетаза. Искусственное расширение генетического кода и создание белков с новыми аминокислотами могут помочь глубже изучить структуру белковых молекул, а также получить искусственные белки с заданными свойствами. Х. Мураками и М. Сисидо смогли превратить некоторые кодоны из трёхнуклеотидных в четырёх- и пятинуклеотидные. Стивен Бреннер получил 65-й кодон, который был функционален in vivo.
В 2015 году у бактерии Escherichia coli удалось изменить значение всех кодонов UGG с триптофана на тиенопиррол-аланин, не встречающийся в природе. В 2016 году был получен первый полусинтетический организм - бактерия, геном которой содержал два искусственных азотистых основания (X и Y), сохраняющихся при делении. В 2017 году исследователи из Южной Кореи заявили о создании мыши с расширенным генетическим кодом, способной синтезировать белки с аминокислотами, не встречающимися в природе.
Рамка считывания.
Гены кодируются в направлении 5'→3'нуклеотидной последовательности. Рамка считывания определяется самым первым триплетом, с которого начинается трансляция. Последовательность неперекрывающихся кодонов, начинающуюся со старт-кодона и заканчивающуюся стоп-кодоном, называют открытой рамкой считывания. Например, последовательность 5'-AAATGAACG-3' (см. рис.) при чтении с первого нуклеотида разбивается на кодоны AAA, TGA и ACG. Если чтение начинается со второго нуклеотида, то ей соответствуют кодоны AAT и GAA. Наконец, при чтении с третьего нуклеотида используются кодоны ATG и AAC. Таким образом, любую последовательность можно прочесть в направлении 5' → 3' тремя разными способами (с тремя разными рамками считывания), причём в каждом случае последовательность белкового продукта будет отличаться из-за распознавания рибосомой разных кодонов. Если учесть, что ДНК имеет двуцепочечную структуру, то возможны 6 рамок считывания: три на одной цепи и три на другой. Однако считывание генов с ДНК не является случайным. Все другие рамки считывания в пределах одного гена обычно содержат многочисленные стоп-кодоны, чтобы быстро остановить и уменьшить метаболическую стоимость неправильного синтеза.
Старт - и стоп-кодоны.
Трансляция информации с последовательности мРНК в аминокислотную последовательность начинается с так называемого старт-кодона - как правило, AUG, причём у эукариот он читается как метионин, а у бактерий - как формилметионин. Одного старт-кодона недостаточно для запуска трансляции; для него необходимы факторы инициации трансляции, а также особые элементы в соседних последовательностях, например, последовательность Шайна - Дальгарно у бактерий. У некоторых организмов в роли старт-кодонов используются кодоны GUG, который в норме кодирует валин, и UUG, который в стандартном коде соответствует лейцину.
После инициационного (инициирующего) кодона трансляция продолжается через последовательное считывание кодонов и присоединение аминокислот друг к другу рибосомой до достижения сигнала к прекращению трансляции - стоп-кодона. Существуют три стоп-кодона, каждый из которых имеет своё название: UAG (янтарь), UGA (опал) и UAA (охра). Стоп-кодоны также называют терминаторными. В клетках нет тРНК, соответствующих стоп-кодонам, поэтому, когда рибосома доходит до стоп-кодона, вместо тРНК с ним взаимодействуют факторы терминации трансляции, которые гидролизуют (отрывают) последнюю тРНК от аминокислотной цепочки, а затем заставляют рибосому диссоциировать. У бактерий в терминации трансляции принимают участие три белковых фактора: RF-1, RF-2 и RF-3: RF-1 узнаёт кодоны UAG и UAA, а RF-2 распознаёт UAA и UGA. Фактор RF-3 выполняет вспомогательную работу. Трёхмерная структура RF-1 и RF-2 напоминает формой и распределением заряда тРНК и, таким образом, представляет собой пример молекулярной мимикрии. У эукариот фактор терминации трансляции eRF1 распознаёт все три стоп-кодона. Зависимая от рибосомы ГТФаза eRF3, которую рассматривают как второй фактор терминации трансляции эукариот, помогает eRF1 в высвобождении с рибосомы готового полипептида.
Помимо собственно стоп-кодона, важнейшее значение для терминации трансляции имеет его окружение. Наиболее велика роль нуклеотида, расположенного сразу за стоп-кодоном (+4). Вероятно, нуклеотид +4 и другие нуклеотиды, следующие за ним, влияют на терминацию трансляции, обеспечивая сайты связывания факторов терминации трансляции. По этой причине некоторые исследователи предлагают рассматривать четырёхнуклеотидный стоп-сигнал вместо трёхнуклеотидного стоп-кодона. Нуклеотиды, расположенные выше стоп-кодонов, также влияют на трансляцию. Например, для дрожжей было показано, что аденин, располагающийся на 2 позиции выше первого нуклеотида стоп-кодона, стимулирует обрыв трансляции на стоп-кодоне UAG (возможно, и на остальных кодонах).
Иногда стоп-кодоны выступают в роли смысловых. Например, кодон UGA кодирует нестандартную аминокислоту селеноцистеин, если рядом с ним в транскрипте находится так называемый SECIS-элемент. Стоп-кодон UAG может кодировать другую нестандартную аминокислоту - пирролизин. Иногда стоп-кодон распознаётся как смысловой при мутациях, затрагивающих тРНК. Наиболее часто это явление наблюдается у вирусов, но оно также описано у бактерий, дрожжей, дрозофилы и человека, у которых играет регуляторную роль.
Генетический код и мутации
В ходе репликации ДНК изредка возникают ошибки при синтезе дочерней цепи. Эти ошибки, называемые мутациями, могут повлиять на фенотип организма, особенно если они затрагивают кодирующую область гена. Ошибки происходят с частотой 1 на каждые 10-100 миллионов пар оснований (п. о.), так как ДНК-полимеразы могут эффективно исправлять свои ошибки.
Под точечными мутациями понимают единичные замены одного азотистого основания. Если новое основание относится к тому же классу, что и исходное (оба пурины или оба пиримидины), то мутацию относят к транзициям. Если происходит замена пурина на пиримидин или пиримидина на пурин, то говорят о трансверсиях. Транзиции встречаются чаще трансверсий. Примерами точечных мутаций являются миссенс- и нонсенс-мутации. Они могут вызывать такие заболевания, как серповидноклеточная анемия и талассемия соответственно. Клинически значимые миссенс-мутации приводят к замене аминокислотного остатка на остаток с другими физико-химическими свойствами, а нонсенс-мутации заключаются в появлении преждевременного стоп-кодона.
Мутации, при которых нарушается правильная рамка считывания из-за вставок и делеций-выпадений (в совокупности они называются инделами), содержащих некратное трём число нуклеотидов, называются мутациями сдвига рамки считывания. При этих мутациях белковый продукт получается совершенно иной, чем в диком типе. Как правило, при сдвигах рамки считывания появляются преждевременные стоп-кодоны, которые вызывают образование усечённых белков. Поскольку эти мутации значительно нарушают функцию белка, они довольно редко закрепляются отбором: нередко отсутствие белка приводит к гибели организма ещё до рождения. Мутации сдвига рамки считывания связаны с такими заболеваниями, как болезнь Тея - Сакса.
Подавляющее число мутаций вредны или нейтральны, некоторые оказываются полезными. Если они могут давать организму лучшую приспособленность по сравнению с диким типом к определённым условиям окружающей среды они дают ему возможность размножаться быстрее особей дикого типа. В этом случае мутация будет постепенно распространяться в популяции в ходе нейтрального отбора. Вирусы, геномы которых представлены РНК, мутируют очень быстро, что нередко приносит им пользу, потому что иммунная система, эффективно распознающая одни варианты вирусных антигенов, оказывается бессильна против слегка изменённых. В больших популяциях организмов, размножающихся бесполым путём, например, E. coli, одновременно может происходить несколько полезных мутаций. Этот феномен получил название клональной интерференции и вызывает конкуренцию между мутациями.
Нестандартные аминокислоты.
В некоторых белках нестандартные аминокислоты кодируются стоп-кодонами в зависимости от наличия особой сигнальной последовательности в мРНК. Например, стоп-кодон UGA может кодировать селеноцистеин, а UAG - пирролизин. Селеноцистеин и пирролизин рассматривают как 21-ю и 22-ю протеиногенную аминокислоту соответственно. В отличие от селеноцистеина, у пирролизина есть собственная аминоацил-тРНК-синтетаза. Хотя обычно генетический код, используемый клетками одного организма, фиксирован, архея Acetohalobium arabaticum может переключаться с 20-аминокислотного кода на 21-аминокислотный (включая пирролизин) при разных условиях роста.
Существование отклонений от стандартного генетического кода предсказывалось ещё в 1970-х. Первое отклонение было описано в 1979 году в митохондриях человека. Впоследствии было описано ещё несколько альтернативных генетических кодов, слегка отличающихся от стандартного, в том числе альтернативные митохондриальные коды.
Например, у бактерий рода Mycoplasma стоп-кодон UGA кодирует триптофан, а у дрожжей из так называемой «CTG-клады» (в том числе патогенного вида Candida albicans) кодон CUG кодирует серин, а не лейцин, как в стандартном генетическом коде. Поскольку вирусы используют тот же генетический код, что и клетки-хозяева, отклонения от стандартного генетического кода могут нарушить размножение вирусов. Впрочем, некоторые вирусы, например, вирусы рода Totivirus, используют тот же альтернативный генетический код, что и организм-хозяин.
У бактерий и архей GUG и UUG нередко выступают старт-кодонами. Некоторые отклонения от стандартного генетического кода есть и в ядерном геноме человека: так, в 4 % мРНК фермента малатдегидрогеназы один из стоп-кодонов кодирует триптофан или аргинин. Значение стоп-кодона зависит от его окружения. Отклонения в генетическом коде организма можно обнаружить, если найти в его геноме очень консервативные гены и сравнить их кодоны с соответствующими аминокислотами гомологичных белков близкородственных организмов. Впрочем, несмотря на все перечисленные отличия, генетические коды, используемые всеми организмами, в общих чертах схожи.
Насчитывают более 20 нестандартных генетических кода, причём наиболее частым отличием от стандартного генетического кода является превращение стоп-кодона UGA в смысловой, кодирующий триптофан.
Предпочтение кодонов.
В геномах многих организмов наблюдается так называемое предпочтение кодонов, то есть частота встречаемости всех синонимичных кодонов, соответствующих определённой аминокислоте, неравна и для одних кодонов выше, чем для других. Эволюционные основы возникновения предпочтения кодонов неясны. Согласно одной гипотезе, реже встречаются те кодоны, которые наиболее часто мутируют. Другая гипотеза утверждает, что предпочтение кодонов регулируется естественным отбором в пользу тех, которые обеспечивают наибольшую эффективность и точность экспрессии генов. Предпочтение кодонов в значительной мере связано с GC-составом генома, и в некоторых случаях по GC-составу можно даже предсказать частоту использования кодонов. С функциональной точки зрения предпочтение кодонов связано с эффективностью и точностью трансляции и, следовательно, уровнем экспрессии гена.
Гипотеза мира РНК.
В настоящее время наиболее общепринятой гипотезой о происхождении жизни на Земле является гипотеза мира РНК. Любая модель возникновения генетического кода использует гипотезу о передаче основных функций от РНК-ферментов (рибозимов) к белковым ферментам. Как и предполагает гипотеза мира РНК, тРНК появились раньше аминоацил-тРНК-синтетаз, поэтому эти ферменты не могли оказать влияние на свойства тРНК.
Генетический код последнего универсального общего предка (LUCA) был основан, вероятнее всего, на ДНК, а не РНК. Генетический код состоял из трёхнуклеотидных кодонов, и всего было возможно 64 различных кодона. Поскольку для построения белков использовалось только 20 аминокислот, некоторые аминокислоты кодировались несколькими кодонами.
Если бы соответствие между кодонами и аминокислотами было случайным, в природе существовало бы 1,5 × 1084 генетических кодов. Это число получилось в результате расчёта количества способов, которыми можно 21 предмет (20 кодонов, кодирующих аминокислоты, и один стоп-кодон) разложить в 64 корзины, так, чтобы каждый предмет был использован по крайней мере единожды. Однако соответствия кодонов и аминокислот неслучайны. Аминокислоты, которые имеют общий путь биосинтеза, как правило, имеют общую первую позицию кодонов. Этот факт может быть пережитком раннего, более простого генетического кода, который содержал меньше аминокислот, чем современный, и постепенно включил в свой состав все 20 аминокислот. Кодоны аминокислот со схожими физико-химическими свойствами также, как правило, похожи, что смягчает последствия точечных мутаций и нарушений трансляции.
Поскольку генетический код неслучаен, правдоподобная гипотеза о его возникновении должна объяснять такие свойства стандартного генетического кода, как отсутствие кодонов для D-аминокислот, включение всего лишь 20 аминокислот из возможных 64, ограничение синонимичных замен третьей позицией кодонов, функционирование в качестве стоп-кодонов именно кодонов UAG, UGA и UAA. Существуют три основные гипотезы происхождения генетического кода. Каждая из них представлена множеством моделей, многие модели гибридны.
· Замороженная случайность: генетический код возник случайно и в таком виде закрепился. Возможно, древние рибозимы, подобные современным тРНК, имели разное сродство к аминокислотам, причём кодоны из разных частей одного и того же рибозима могли обладать наибольшим сродством к разным аминокислотам. После того, как появились первые функциональные пептиды, любое изменение генетического кода было бы летальным, поэтому он оказался «заморожен».
· Стереохимическое сродство: генетический код определяется высоким сродством каждой аминокислоты с соответствующими ей кодонами и антикодонами. Сродство аминокислоты и антикодона означает, что предковым тРНК соответствовали те аминокислоты, с которыми они связывались с наибольшим сродством. В ходе эволюции соответствие антикодонов и аминокислот заменилось соответствием аминоацил-тРНК-синтетаз и аминокислот.
· Оптимальность: генетический код продолжал некоторое время изменяться после своего появления, поэтому современный код обеспечивает максимальную приспособленность и минимизирует последствия мутаций, то есть является лучшим из возможных генетических кодов.
Однако, все эти гипотезы не в состоянии объяснить низкую статистическую вероятность возникновения функционирующего и, тем более воспроизводящегося живого организма.
Лекция 5. Репликация ДНК.
Р епликация (от лат. replicatio - возобновление) - процесс синтеза дочерней молекулы дезоксирибонуклеиновой кислоты на матрице родительской молекулы ДНК. В ходе последующего деления материнской клетки каждая дочерняя клетка получает по одной копии молекулы ДНК, которая является идентичной ДНК исходной материнской клетки. Этот процесс обеспечивает точную передачу генетической информации из поколения в поколение. Репликацию ДНК осуществляет сложный ферментный комплекс, состоящий из 15 - 20 различных белков, называемый реплисомой.
Каждая молекула ДНК состоит из одной цепи исходной родительской молекулы и одной вновь синтезированной цепи. Такой механизм репликации называется полуконсервативным. В настоящее время этот механизм считается доказанным благодаря опытам Мэтью Мезельсона и Франклина Сталя (1958 г.). Ранее существовали и две другие модели: «консервативная» - в результате репликации образуется одна молекула ДНК, состоящая только из родительских цепей, и одна, состоящая только из дочерних цепей; «дисперсионная» - все получившиеся в результате репликации молекулы ДНК состоят из цепей, одни участки которых вновь синтезированы, а другие взяты из родительской молекулы ДНК. Молекула ДНК разрезается пополам и образуется два шаблона.
Репликация ДНК - ключевое событие в ходе деления клетки. Принципиально, чтобы к моменту деления ДНК была реплицирована полностью и при этом только один раз. Это обеспечивается определёнными механизмами регуляции репликации ДНК. Репликация проходит в три этапа:
· инициация репликации;
· элонгация;
· терминация репликации.
Регуляция репликации осуществляется в основном на этапе инициации. Это достаточно легко осуществимо, потому что репликация может начинаться не с любого участка ДНК, а со строго определённого, называемого сайтом инициации репликации. В геноме таких сайтов может быть, как всего один, так и много. С понятием сайта инициации репликации тесно связано понятие репликон. Репликон - это участок ДНК, который содержит сайт инициации репликации и реплицируется после начала синтеза ДНК с этого сайта. Геномы бактерий, как правило, представляют собой один репликон, это значит, что репликация всего генома является следствием всего одного акта инициации репликации. Геномы эукариот (а также их отдельные хромосомы) состоят из большого числа самостоятельных репликонов, это значительно сокращает суммарное время репликации отдельной хромосомы. Молекулярные механизмы, которые контролируют количество актов инициации репликации в каждом сайте за один цикл деления клетки, называются контролем копийности. В бактериальных клетках помимо хромосомной ДНК часто содержатся плазмиды, которые представляют собой отдельные репликоны. У плазмид существуют свои механизмы контроля копийности: они могут обеспечивать синтез как всего одной копии плазмиды за клеточный цикл, так и тысяч копий.
Репликация начинается в сайте инициации репликации с расплетания двойной спирали ДНК, при этом формируется репликационная вилка - место непосредственной репликации ДНК. В каждом сайте может формироваться одна или две репликационные вилки в зависимости от того, является ли репликация одно- или двунаправленной. Более распространена двунаправленная репликация. Через некоторое время после начала репликации в электронный микроскоп можно наблюдать репликационный глазок - участок хромосомы, где ДНК уже реплицирована, окружённый более протяжёнными участками нереплицированной ДНК.
Белки, связывающие одноцепочечную ДНК (англ. Single-strand binding protein, SSB, SSBP) - связывают одноцепочечные фрагменты ДНК, и предотвращают комплементарное спаривание. Одноцепочечные участки ДНК имеют термодинамически более выгодную форму - дуплекс. Белки SSB предотвращают образование дуплекса и позволяют компонентам репликационной вилки осуществлять репликацию ДНК.
В репликационной вилке ДНК копирует крупный белковый комплекс (реплисома), ключевым ферментом которого является ДНК-полимераза. Репликационная вилка движется со скоростью порядка 100 000 пар нуклеотидов в минуту у прокариот и 500 - 5000 - у эукариот.
Лекция 6. Репарация ДНК.
Репарация (от лат. reparatio - восстановление) - особая функция клеток, заключающаяся в способности исправлять химические повреждения и разрывы в молекулах ДНК, повреждённых при нормальном биосинтезе ДНК в клетке или в результате воздействия физических или химических реагентов. Осуществляется специальными ферментными системами клетки. Ряд наследственных болезней (напр., пигментная ксеродерма) связан с нарушениями систем репарации.
Начало изучению репарации было положено работами Альберта Кельнера (США), который в 1948 году обнаружил явление фотореактивации - уменьшение повреждения биологических объектов, вызываемого ультрафиолетовыми (УФ) лучами, при последующем воздействии ярким видимым светом (световая репарация).
Р. Сетлоу, К. Руперт (США) и другие вскоре установили, что фотореактивация - фотохимический процесс, протекающий с участием специального фермента и приводящий к расщеплению димеров тимина, образовавшихся в ДНК при поглощении УФ-кванта.
Позднее при изучении генетического контроля чувствительности бактерий к УФ-свету и ионизирующим излучениям была обнаружена темновая репарация - свойство клеток ликвидировать повреждения в ДНК без участия видимого света. Механизм темновой репарации облучённых УФ-светом бактериальных клеток был предсказан А. П. Говард-Фландерсом и экспериментально подтверждён в 1964 году Ф. Ханавальтом и Д. Петиджоном (США). Было показано, что у бактерий после облучения происходит вырезание повреждённых участков ДНК с изменёнными нуклеотидами и ресинтез ДНК в образовавшихся пробелах.
Системы репарации существуют не только у микроорганизмов, но также в клетках животных и человека, у которых они изучаются на культурах тканей. Известен наследственный недуг человека - пигментная ксеродерма, при котором нарушена репарация.
Источники повреждения ДНК :
Ультрафиолетовое излучение.
Радиация.
Химические вещества.
Ошибки репликации ДНК.
Апуринизация - отщепление азотистых оснований от сахарофосфатного остова
Дезаминирование - отщепление аминогруппы от азотистого основания
Типы репарации.
У бактерий имеются по крайней мере 3 ферментные системы, ведущие репарацию - прямая, эксцизионная и пострепликативная. У эукариот к ним добавляется ещё Mismatch и SOS-репарация.
Прямая репарация - наиболее простой путь устранения повреждений в ДНК, в котором обычно задействованы специфические ферменты, способные быстро (как правило, в одну стадию) устранять соответствующее повреждение, восстанавливая исходную структуру нуклеотидов. Так действует, например, O6-метилгуанин-ДНК-метилтрансфераза, которая снимает метильную группу с азотистого основания на один из собственных остатков цистеина.
Эксцизионная репарация (англ. excision - вырезание) включает удаление повреждённых азотистых оснований из ДНК и последующее восстановление нормальной структуры молекулы по комплементарной цепи. Ферментативная система удаляет короткую однонитевую последовательность двунитевой ДНК, содержащей ошибочно спаренные или поврежденные основания, и замещает их путём синтеза последовательности, комплементарной оставшейся нити.
Эксцизионная репарация является наиболее распространённым способом репарации модифицированных оснований ДНК. Она базируется на распознавании модифицированного основания различными гликозилазами, расщепляющими N-гликозидную связь этого основания с сахарофосфатным остовом молекулы ДНК. При этом существуют гликозилазы, специфически распознающие присутствие в ДНК определенных модифицированных оснований (оксиметилурацила, гипоксантина, 5-метилурацила, 3-метиладенина, 7-метилгуанина и т. д.). Для многих гликозилаз к настоящему времени описан полиморфизм, связанный с заменой одного из нуклеотидов в кодирующей последовательности гена. Для ряда изоформ этих ферментов была установлена ассоциация с повышенным риском возникновения онкологических заболеваний.
Другой тип эксцизионной репарации - эксцизионная репарация нуклеотидов, предназначенная для более крупных повреждений, таких как образование пиримидиновых димеров.
Лекция 7. Транскрипция.
Процесс воплощения генетической информации в живые работоспособные структуры связан с процессом биосинтеза белков. Если редупликация ДНК - это процесс копирования чертежей и инструкций по эксплуатации сложного прибора, то биосинтез белка - это его реальная сборка. Имея белки - ферменты, можно сделать и другие компоненты живого (липиды, углеводы и т.д.).
Транскрипция (от лат. transcriptio - переписывание) - процесс синтеза РНК с использованием ДНК в качестве матрицы, происходящий во всех живых клетках. Другими словами, это перенос генетической информации с ДНК на РНК.
Транскрипция катализируется ферментом ДНК-зависимой РНК-полимеразой. РНК-полимераза- движется по молекуле ДНК в направлении 3' → 5'.
Транскрипция состоит из стадий инициации, элонгации и терминации. Единицей транскрипции является оперон, фрагмент молекулы ДНК, состоящий из промотора, транскрибируемой части и терминатора.
Инициация транскрипции - сложный процесс, зависящий от последовательности ДНК вблизи транскрибируемой последовательности (а у эукариот также и от более далеких участков генома - энхансеров и сайленсеров) и от наличия или отсутствия различных белковых факторов.
Момент перехода РНК-полимеразы от инициации транскрипции к элонгации точно не определен. Три основных биохимических события характеризуют этот переход в случае РНК-полимеразы кишечной палочки: отделение сигма-фактора, первая транслокация молекулы фермента вдоль матрицы и сильная стабилизация транскрипционного комплекса, который кроме РНК-полимеразы включает растущую цепь РНК и транскрибируемую ДНК. Эти же явления характерны и для РНК-полимераз эукариот. Переход от инициации к элонгации сопровождается разрывом связей между ферментом, промотором, факторами инициации транскрипции, а в ряде случаев - переходом РНК-полимеразы в состояние компетентности в отношении элонгации (например, фосфорилирование CTD-домена у РНК-полимеразы II). Фаза элонгации заканчивается после освобождения растущего транскрипта и диссоциации фермента от матрицы (терминация).
На стадии элонгации в ДНК расплетено примерно 18 пар нуклеотидов. Примерно 12 нуклеотидов матричной нити ДНК образует гибридную спираль с растущим концом цепи РНК. По мере движения РНК-полимеразы по матрице впереди неё происходит расплетание, а позади - восстановление двойной спирали ДНК. Одновременно освобождается очередное звено растущей цепи РНК из комплекса с матрицей и РНК-полимеразой. Эти перемещения должны сопровождаться относительным вращением РНК-полимеразы и ДНК. Трудно себе представить, как это может происходить в клетке, особенно при транскрипции хроматина. Поэтому не исключено, что для предотвращения такого вращения двигающуюся по ДНК РНК-полимеразу сопровождают топоизомеразы.
Элонгация осуществляется с помощью основных элонгирующих факторов, необходимых, чтобы процесс не останавливался преждевременно.
В последнее время появились данные, показывающие, что регуляторные факторы также могут регулировать элонгацию. РНК-полимераза в процессе элонгации делает паузы на определенных участках гена. Особенно четко это видно при низких концентрациях субстратов. В некоторых участках матрицы длительные задержки в продвижении РНК-полимеразы, т. н. паузы, наблюдаются даже при оптимальных концентрациях субстратов. Продолжительность этих пауз может контролироваться факторами элонгации.
Терминация.
У бактерий есть два механизма терминации транскрипции:
ро-зависимый механизм, при котором белок Rho (ро) дестабилизирует водородные связи между матрицей ДНК и мРНК, высвобождая молекулу РНК.
ро-независимый, при котором транскрипция останавливается, когда только что синтезированная молекула РНК формирует стебель-петлю, за которой расположено несколько урацилов (…УУУУ), что приводит к отсоединению молекулы РНК от матрицы ДНК.
Терминация транскрипции у эукариот менее изучена. Она завершается разрезанием РНК, после чего к её 3' концу фермент добавляет несколько аденинов (…АААА), от числа которых зависит стабильность данного транскрипта.
Существует ряд экспериментальных данных, свидетельствующих о том, что транскрипция осуществляется в так называемых транскрипционных фабриках: огромных, по некоторым оценкам, до 10 МДа комплексах, которые содержат около 8 РНК-полимераз II и компоненты последующего процессинга и сплайсинга, а также корректирования новосинтезированного транскрипта. В ядре клетки происходит постоянный обмен между пулами растворимой и задействованной РНК-полимеразы. Активная РНК-полимераза задействована в таком комплексе, который в свою очередь является структурной организовывающей компактизацию хроматина единицей. Последние данные свидетельствуют о том, что транскрипционные фабрики существуют и в отсутствие транскрипции, они фиксированы в клетке (пока не ясно, взаимодействуют ли они с ядерным матриксом клетки или нет) и представляют собой независимый ядерный субкомпартмент. Комплекс транскрипционных фабрик, содержащих РНК полимеразу I, II или III, был проанализирован с помощью масс-спектрометрии.
Обратная транскрипция.
Некоторые вирусы (такие как вирус иммунодефицита человека, вызывающий ВИЧ-инфекцию), имеют возможность транскрибировать РНК в ДНК. ВИЧ имеет РНК-геном, который встраивается в ДНК. В результате, ДНК вируса может быть объединена с геномом клетки-хозяина. Главный фермент, ответственный за синтез ДНК из РНК, называется ревертазой. Одной из функций ревертазы является создание комплементарной ДНК (кДНК) из вирусного генома. Ассоциированный фермент рибонуклеаза H расщепляет РНК, а ревертаза синтезирует кДНК из двойной спирали ДНК. кДНК интегрируется в геном клетки-хозяина с помощью интегразы. Результатом является синтез вирусных протеинов клеткой-хозяином, которые образуют новые вирусы. В случае с ВИЧ так же программируется апоптоз (смерть клетки) Т-лимфоцитов. В иных случаях клетка может остаться распространителем вирусов.
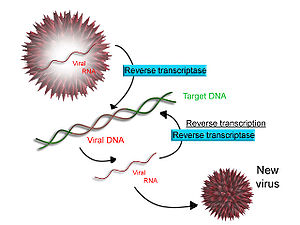 Схема обратной транскрипции
Схема обратной транскрипции
Некоторые клетки эукариот содержат фермент теломеразу, также проявляющую активность обратной транскрипции. С её помощью синтезируются повторяющиеся последовательности в ДНК. Теломераза часто активирутся в раковых клетках для бесконечной дупликации генома без потери кодирующей протеины последовательности ДНК. Некоторые РНК-содержащие вирусы животных при помощи РНК-зависимой ДНК-полимеразы способны синтезировать ДНК, комплементарную по отношению к вирусной РНК. Она встраивается в геном эукариотической клетки, где может многие поколения оставаться в скрытом состоянии. При определённых условиях (например, воздействии канцерогенов) вирусные гены могут активироваться, и здоровые клетки превратятся в раковые.
Лекция 8. Процессинг.
Новосинтезированные РНК еще неактивны
Сразу после синтеза первичные транскрипты РНК по разным причинам еще не имеют активности, являются "незрелыми" и в дальнейшем претерпевают ряд изменений, которые называются процессинг. У эукариот процессингу подвергаются все виды пре-РНК, у прокариот - только предшественники рРНК и тРНК.
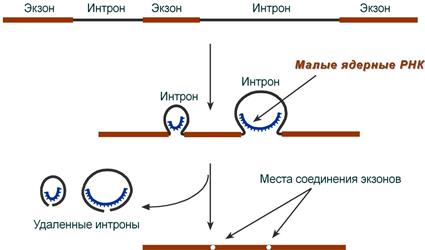
Посттранскрипционные модификации РНК - совокупность процессов в клетках эукариот, которые приводят к превращению первичного транскрипта в зрелую РНК. При транскрипции участков ДНК, несущих информацию о белках, образуются гетерогенные ядерные РНК, по размеру намного превосходящие мРНК. Дело в том, что из-за мозаичной структуры генов эти гетерогенные РНК включают в себя информативные (экзоны) и неинформативные (интроны) участки.
В зависимости от типа РНК (матричные, рибосомные, транспортные, малые ядерные) их предшественники подвергаются разным последовательным модификациям. Например, предшественники матричных РНК подвергаются кэпированию, сплайсингу, полиаденилированию, метилированию и иногда редактированию.
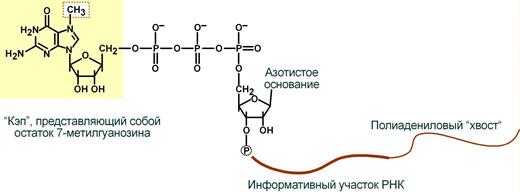
1. Кэпирование (англ. cap – шапка) – происходит еще во время транскрипции. Процесс состоит в присоединении к 5'-трифосфату концевого нуклеотида пре-мРНК 5'-углерода N7-метил-гуанозина.
"Кэп" необходим для защиты молекулы РНК от экзонуклеаз, работающих с 5'-конца, а также для связывания мРНК с рибосомой и для начала трансляции.
2. Сплайсинг (англ. splice – склеивать встык) – особый процесс, в котором при участии малых ядерных РНК происходит удаление интронов и сохранение экзонов.
3. Полиаденилирование – при помощи полиаденилат-полимеразы с использованием молекул АТФ происходит присоединение к 3'-концу РНК от 100 до 200 адениловых нуклеотидов, формирующих полиадениловый фрагмент – поли(А)-хвост. Поли(А)-хвост необходим для защиты молекулы РНК от экзонуклеаз, работающих с 3'-конца.
4. Метилирование.
Эукариотическая мРНК подвергаются посттранскрипционному метилированию. Наиболее распространённой модификацией является метилирование остатков аденина с образованием метиладенозина (m6A). Этот процесс метилируют ферменты аденозинметилтрансферазы, которые распознают остатки аденина в консенсусных* последовательностях GAC (70 % случаев) и AAC (30 % случаев). Соответствующие деметилазы ингибируют обратный процесс деметилирования. Учитывая обратимость и динамичность процесса метилирования мРНК, а также повышенную концентрацию m6A в длинных экзонах и вокруг стоп-кодонов, предполагают, что метилирование мРНК выполняет регуляторную функцию.
*Консе́нсусная после́довательность Ко́зак (последовательность Козак, англ. Kozak consensus sequence) - последовательность нуклеотидов в составе молекулы мРНК эукариот, окружающая старт-кодон и важная для инициации трансляции. Консенсусная последовательность была впервые описана Мэрилин Козак в 1986 году.
5. Редактирование РНК (англ. RNA editing) - молекулярно-биологический процесс, в ходе которого информация, содержащаяся в молекуле РНК изменяется путём химической модификации оснований. В настоящее время показано редактирование транспортных РНК, рибосомных РНК и матричных РНК эукариот. Редактирование РНК обычно происходит в ядре клетки, цитозоле, а также в митохондриях и пластидах, органоидах, которые произошли из прокариотических эндосимбионтов.
Лекция 9. Трансляция.
Процесс синтеза белка на основе молекулы мРНК называется трансляцией. У прокариот мРНК может считываться рибосомами в аминокислотную последовательность белков сразу после транскрипции, а у эукариот она транспортируется из ядра в цитоплазму, где находятся рибосомы. Скорость синтеза белков выше у прокариот и может достигать 20 аминокислот в секунду.
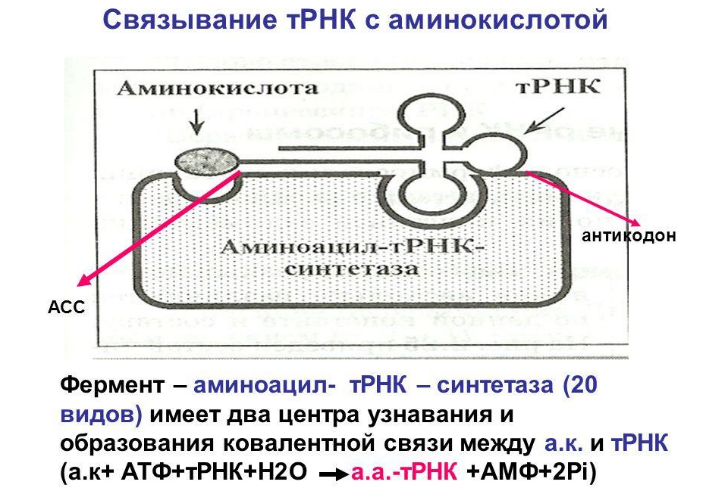 Рибосома содержит 2 функциональных участка для взаимодействия с тРНК: аминоацильный (акцепторный) и пептидильный (донорный). Аминоацил-тРНК попадает в акцепторный участок рибосомы и взаимодействует с образованием водородных связей между триплетами кодона и антикодона. После образования водородных связей система продвигается на 1 кодон и оказывается в донорном участке. Одновременно в освободившемся акцепторном участке оказывается новый кодон, и к нему присоединяется соответствующий аминоацил-т-РНК.
Рибосома содержит 2 функциональных участка для взаимодействия с тРНК: аминоацильный (акцепторный) и пептидильный (донорный). Аминоацил-тРНК попадает в акцепторный участок рибосомы и взаимодействует с образованием водородных связей между триплетами кодона и антикодона. После образования водородных связей система продвигается на 1 кодон и оказывается в донорном участке. Одновременно в освободившемся акцепторном участке оказывается новый кодон, и к нему присоединяется соответствующий аминоацил-т-РНК.
Три основные стадии трансляции.
Инициация - узнавание рибосомой стартового кодона и начало синтеза.
Элонгация - собственно синтез белка.
Терминация - узнавание терминирующего кодона (стоп-кодона) и отделение продукта.
Во время начальной стадии биосинтеза белков, инициации, обычно метиониновый кодон узнаётся малой субъединицей рибосомы, к которой при помощи белков присоединена метиониновая транспортная РНК.
После узнавания стартового кодона к малой субъединице присоединяется большая субъединица и начинается вторая стадия трансляции - элонгация. При каждом движении рибосомы от 5'- к 3'-концу мРНК считывается один кодон путём образования водородных связей между тремя нуклеотидами мРНК и комплементарным ему антикодоном транспортной РНК, к которой присоединена соответствующая аминокислота. Синтез пептидной связи катализируется рибосомой. Можно сказать, что рибосома главный фермент трансляции. Рибосомальная РНК катализирует образование пептидной связи между последней аминокислотой растущего пептида и аминокислотой, присоединённой к тРНК, позиционируя атомы азота и углерода в положении, благоприятном для прохождения реакции.
Третья и последняя стадия трансляции, терминация, происходит при достижении рибосомой стоп-кодона, после чего белковые факторы терминации гидролизуют последнюю тРНК от белка, прекращая его синтез. Таким образом, в рибосомах белки всегда синтезируются от N- к C-концу.
Механизмы трансляции прокариот и эукариот существенно отличаются, поэтому многие вещества, подавляющие прокариотическую трансляцию, в значительно меньшей степени действуют на трансляцию высших организмов, что позволяет использовать их в медицинской практике как антибактериальные средства, безопасные для организма млекопитающих.
Поскольку каждый кодон содержит три нуклеотида, один и тот же генетический текст можно прочитать тремя разными способами (начиная с первого, второго и третьего нуклеотидов), то есть в трех разных рамках считывания. За некоторыми интересными исключениями, значимой является информация, закодированная только в одной рамке считывания. По этой причине крайне важным для синтеза белка рибосомой является её правильное позиционирование на стартовом AUG-кодоне - инициация трансляции.
Синтез белка в большинстве случаев начинается с AUG-кодона, кодирующего метионин. Этот кодон обычно называют стартовым или инициаторным. Инициация трансляции предусматривает узнавание рибосомой этого кодона и привлечение инициаторной аминоацил-тРНК. Для инициации трансляции необходимо также наличие определённых нуклеотидных последовательностей в районе стартового кодона (последовательность Шайна - Дальгарно у прокариот и последовательность Козак у эукариот). Немаловажная роль в защите 5'-конца мРНК принадлежит 5'-кэпу. Существование последовательности, отличающей стартовый AUG от внутренних совершенно необходимо, так как в противном случае инициация синтеза белка происходила бы хаотично на всех AUG-кодонах.
Процесс инициации обеспечивается специальными белками - факторами инициации (англ. initiation factors, IF; инициаторные факторы эукариот обозначают eIF, от англ. eukaryotes).
Механизмы инициации трансляции у про- и эукариот существенно отличаются: прокариотические рибосомы потенциально способны находить стартовый AUG и инициировать синтез на любых участках мРНК, в то время как эукариотические рибосомы обычно присоединяются к мРНК в области кэпа и сканируют её в поисках стартового кодона.
Инициация у прокариот.
Начальная стадия предусматривает связывание малой рибосомной субъединицы (30S) с мРНК. Это может происходить двумя способами: либо сначала к мРНК присоединяется комплекс, содержащий рибосомную субчастицу, а затем к нему привлекается тРНК в комплексе с IF2 и ГТФ, либо 30S субъединица изначально связывается с тРНК, а уже потом садится на мРНК. К образовавшемуся комплексу приходит большая (50S) рибосомная субъединица, инициаторные факторы отсоединяются от 30S субчастицы. Собранная рибосома начинает элонгировать цепь.
Инициация у эукариот.
У эукариот существуют два основных механизма нахождения рибосомой стартового AUG: кэпзависимый (сканирующий) и кэпнезависимый (внутренняя инициация).
При сканирующем механизме рибосома (точнее, её малая субъединица) садится на 5'-конец мРНК в области кэпа и двигается вдоль молекулы мРНК, «сканируя» один кодон за другим, пока не наткнётся на инициаторный AUG. Для привлечения рибосомы к 5'-концу мРНК требуется специальная структура, кэп - 7-метилгуанин, прикреплённый к 5'-концевому нуклеотиду мРНК.
При механизме внутренней инициации, называемом у эукариот также IRES-зависимым механизмом, рибосома садится на внутренний участок мРНК, называемый IRES (англ. Internal Ribosomal Entry Site, участок внутренней посадки рибосомы) - участок мРНК, обладающий выраженной вторичной структурой, позволяющей ему направлять рибосомы на стартовый AUG. По IRES-зависимому механизму инициируется синтез лишь на небольшой части клеточных мРНК, а также на РНК некоторых вирусов.
Также у эукариот возможна реинициация трансляции, когда после окончания трансляции рибосома с белковыми факторами не диссоциирует от мРНК, а перескакивает с 3' на 5'-конец мРНК и начинает инициацию ещё раз. Это возможно благодаря т.н. циклизации мРНК в цитоплазме, то есть физическому сближению старт- и стоп-кодонов с помощью специальных белков.
Элонгация.
В процессе наращивания полипептидной цепи принимают участие два белковых фактора элонгации. Первый (EF1a у эукариот, EF-Tu - у прокариот) переносит аминоацилированную («заряженную» аминокислотой) тРНК в А (аминоацил)-сайт рибосомы. Рибосома катализирует перенос пептида, связанного с тРНК в Р-сайте, в А-сайт и образование пептидной связи с находящимся там аминокислотным остатком. Таким образом растущий пептид удлиняется на один аминокислотный остаток. Затем второй белок (EF2 у эукариот, EF-G - у прокариот) катализирует так называемую транслокацию. Транслокация - перемещение рибосомы по мРНК на один триплет (примерно 20 ангстрем), в результате которого пептидил-тРНК оказывается вновь в Р-сайте, а «пустая» тРНК из P-сайта переходит в Е-сайт (от слова exit). тРНК из E-сайта диссоциирует спонтанно, после чего рибосома готова к новому циклу элонгации.
Терминация.
Терминация - окончание синтеза белка, осуществляется, когда в А-сайте рибосомы оказывается один из стоп- кодонов - UAG, UAA, UGA. Из-за отсутствия тРНК, соответствующих этим кодонам, пептидил-тРНК остаётся связанной с Р-сайтом рибосомы. Здесь в действие вступают специфические белки RF1 или RF2, которые катализируют отсоединение полипептидной цепи от мРНК, а также RF3, который вызывает диссоциацию мРНК из рибосомы. RF1 узнаёт в А-участке UAA или UAG; RF-2 - UAA или UGA. С UAA терминация эффективнее, чем с другими стоп-кодонами.

Компартментализация у эукариот. В отличие от прокариот, у которых биосинтез белка происходит непосредственно во время транскрипции соответствующих мРНК, для эукариот характерна строгая компартментализация всех процессов, происходящих во время биосинтеза белка, в том числе и компартментализация трансляции.
Трансляция мРНК секреторных и мембранных белков (обычно они составляют 3-15 % от всех синтезируемых клеткой белков) происходит на рибосомах, связанных с гранулярной эндоплазматической сеткой. По классическим представлениям, ещё 35-45 % рибосом связаны с цитоскелетом, а оставшиеся 20-40 % рибосом находятся в несвязанном состоянии в цитозоле. Однако высказываются предположения, что свободные рибосомы являются артефактом, и в клетке они связаны с так называемой микротрабекулярной решеткой, образованной особым типом филаментов. Впрочем, по другим данным, само существование микротрабекулярной решетки ставится под сомнение, так что вопрос о существовании активных несвязанных рибосом остаётся открытым.
В настоящее время высказывается гипотеза, что трансляция у эукариот происходит не во всей цитоплазме клетки, а в отдельных областях цитоплазмы, условно называемых «трансляционными компартментами».
Компартментализация трансляции обеспечивает высокую скорость биосинтеза белка и широкие возможности регуляции этого процесса.
Лекция 10. Фолдинг.
В биохимии и молекулярной биологии фо́лдингом белка (укладкой белка, от англ. folding) называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру (так называемая третичная структура).
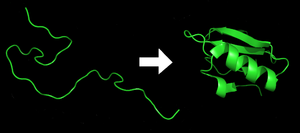
Переход первичной структуры полипептида (слева) в третичную структуру (справа).
Каждая молекула белка начинает формироваться как полипептид, транслируемый из последовательности мРНК в виде линейной цепочки аминокислот. У полипептида нет устойчивой трёхмерной структуры (пример в левой части изображения). Однако все аминокислоты в цепочке имеют определённые химические свойства: гидрофобность, гидрофильность, электрический заряд. При взаимодействии аминокислот друг с другом и клеточным окружением получается хорошо определённая трёхмерная структура - конформация. В результате на внешней поверхности белковой глобулы формируются полости активных центров, а также места контактов субъединиц мультимерных белков друг с другом и с биологическими мембранами.
В редких случаях нативными могут быть сразу две конформации белка (т. н. конформеры). Они могут сильно различаться, и даже выполнять различные функции. Для этого необходимо, чтобы в разных областях фазового пространства белковой молекулы существовали два примерно равных по энергии состояния, каждое из которых будет встречаться в нативной форме с соответствующей вероятностью.
Для стабилизации третичной структуры многие белки в клетке подвергаются посттрансляционной модификации. Весьма часто встречаются дисульфидные мостики между пространственно близкими участками полипептидной цепи.
Для корректной работы белков весьма важна правильная трёхмерная структура. Ошибки сворачивания обычно приводят к образованию неактивного белка с отличающимися свойствами. Считается, что некоторые болезни происходят от накопления в клетках неправильно свёрнутых белков (прионы).
В фолдинге участвуют белки-шапероны. И хотя большинство только что синтезированных белков могут сворачиваться и при отсутствии шаперонов, некоторому меньшинству обязательно требуется их присутствие.
Механизм сворачивания белков до конца не изучен. Экспериментальное определение трёхмерной структуры белка часто очень сложно и дорого. Однако аминокислотная последовательность белка обычно известна. Поэтому учёные пытаются использовать различные биофизические методы, чтобы предсказать пространственную структуру белка из его аминокислотной последовательности.
Нарушения в процессе фолдинга и последующие нарушения третичной структуры белка связывают с конформационными (нарушение в 3D) болезнями и прионами.
Прио́ны (англ. prion от protein «белок» + infection «инфекция»; слово предложено в 1982 году Стенли Прузинером) - особый класс инфекционных агентов, представленных белками с аномальной третичной структурой и не содержащих нуклеиновых кислот. Это положение лежит в основе прионной гипотезы, однако насчёт состава прионов есть и другие точки зрения.
Прионы способны увеличивать свою численность, используя функции живых клеток (в этом отношении прионы схожи с вирусами). Прион - это белок с аномальной третичной структурой, способный катализировать конформационное превращение гомологичного ему нормального клеточного белка в себе подобный (прион). Как правило, при переходе белка в прионное состояние его α-спирали превращаются в β-слои. Появившиеся в результате такого перехода прионы могут в свою очередь перестраивать новые молекулы белка; таким образом, запускается цепная реакция, в ходе которой образуется огромное количество неправильно свёрнутых молекул. Прионы - единственные известные инфекционные агенты, размножение которых происходит без участия нуклеиновых кислот.
Все известные прионы вызывают формирование амилоидов - белковых агрегатов, включающих плотно упакованные β-слои. Амилоиды представляют собой фибриллы, растущие на концах, а разлом фибриллы приводит к появлению четырёх растущих концов. Инкубационный период прионного заболевания определяется скоростью экспоненциального роста количества прионов, а она, в свою очередь, зависит от скорости линейного роста и фрагментации агрегатов (фибрилл). Для размножения приона необходимо исходное наличие нормально уложенного клеточного прионного белка; организмы, у которых отсутствует нормальная форма прионного белка, не страдают прионными заболеваниями.
Прионная форма белка чрезвычайно стабильна и накапливается в поражённой ткани, вызывая её повреждение и, в конечном счёте, отмирание. Стабильность прионной формы означает, что прионы устойчивы к денатурации под действием химических и физических агентов, поэтому уничтожить эти частицы или сдержать их рост тяжело. Прионы существуют в нескольких формах - штаммах, каждый со слегка отличной структурой.
Прионы вызывают заболевания - трансмиссивные губчатые энцефалопатии (ТГЭ) у различных млекопитающих, в том числе губчатую энцефалопатию крупного рогатого скота («коровье бешенство»). У человека прионы вызывают болезнь Крейтцфельдта - Якоба, вариант болезни Крейтцфельдта - Якоба (vCJD), синдром Герстмана - Штраусслера - Шейнкера, фатальную семейную бессонницу и куру. Все известные прионные заболевания поражают головной мозг и другие нервные ткани, в настоящее время неизлечимы и в конечном итоге смертельны.
Все известные прионные заболевания млекопитающих вызываются белком PrP. Его форма с нормальной третичной структурой называется PrPC (от англ. common «обычный» или cellular «клеточный»), а инфекционная, аномальная форма называется PrPSc (от англ. scrapie (скрейпи) «почесуха овец», одно из первых заболеваний с установленной прионной природой).
Первая открытая трансмиссивная губчатая энцефалопатия - почесуха овец (скрейпи). Первые её случаи были отмечены в Великобритании в 1700-х годах. При этом заболевании овцы страдали от сильнейшего зуда, из-за чего животным приходилось непрерывно тереться (англ. scrape) о деревья, откуда и пошло название болезни. Кроме этого, овцы испытывали боль при движении ногами и страдали от сильнейших припадков. Все эти симптомы являются классическими признаками повреждения мозга, и эта странная болезнь вводила учёных в заблуждение. Гораздо позже, в 1967 году, Чандлер (англ. Chandler) установил, что скрейпи могут болеть и мыши, что, несомненно, было прогрессом в изучении этого заболевания.
В двадцатом веке были описаны и прионные заболевания человека. В 1920-х годах Крейцфельдт и Якоб исследовали новое неизлечимое заболевание нервной системы человека, главным признаком которого было образование полостей в ткани мозга. Впоследствии эта болезнь была названа их именем.
В 1957 году Гайдузек и Зигас описали неврологический синдром, распространённый у народа форе, живущего в высокогорьях Папуа - Новой Гвинеи. Эта болезнь характеризовалась тремором, атаксией, на ранних стадиях - атетоидными движениями. К этим симптомам впоследствии прибавлялась слабость, деменция, болезнь неизбежно заканчивалась летальным исходом. На языке форе эта болезнь называется «куру», что в переводе означает «дрожь» или «порча»; под этим названием эта болезнь известна и сегодня. Оказалось, что причиной распространения куру был нередкий среди форе ритуальный каннибализм. В ходе религиозных ритуалов они поедали органы убитых родичей. Мозг при этом ели дети, поскольку считалось, что от него у детей «прибавлялось ума». Инкубационный период заболевания может составлять до 50 лет, однако у девушек, особенно подверженных куру, он может составлять всего лишь четыре года или менее
Развитие представлений о прионах.
В 1960-х годах, радиобиолог Альпер и математик Гриффит, выдвинули гипотезу, что некоторые трансмиссивные губчатые энцефалопатии вызываются патогенами, состоящими исключительно из белков. Они пытались объяснить тот факт, что таинственный инфекционный агент, вызывающий почесуху овец и болезнь Крейтцфельдта - Якоба, очень устойчив к ионизирующему излучению. Доза радиации, необходимая для уничтожения половины частиц инфекционного агента, зависит от их размера: чем меньше такая частица, тем меньше вероятность попадания в неё заряженной частицы. Так и было установлено, что прион слишком мал для вируса.
Объяснения распространения почесухи овец содержала противоречие с «Центральной догмой молекулярной биологии». Поток информации от белка к белку или от белка к ДНК или РНК невозможен.
В 1982 году Прузинер сообщил, что его группа выделила гипотетический инфекционный агент (прион) и что он состоит в основном из одного белка и в 1997 году был удостоен Нобелевской премии по физиологии или медицине.
Белок, из которого состоят прионы (PrP), можно найти во всех частях тела у здоровых людей и животных. Однако в поражённых тканях присутствует PrP, имеющий аномальную структуру и устойчивый к протеазам (ферментам, гидролизующим белки). Нормальная форма называется PrPC, а инфекционная - PrPSc.
PrPC - нормальный мембранный белок млекопитающих, который у человека кодируется геном PRNP. мРНК PRNP человека кодирует полипептид длиной 253 аминокислотных остатка (а. о.), который в процессе созревания укорачивается клеточными ферментами. Зрелая форма PrP состоит из 208 аминокислотных остатков и имеет молекулярную массу 35 - 36 кДа. Помимо ограниченного протеолиза, PrP подвергается и другим посттрансляционным модификациям: N-гликозилированию по положениям Asn-181 и Asn-197, присоединению гликозилфосфатидилинозитола к Ser-230 и образованию дисульфидной связи между Cys-179 и Cys-214. Аминокислотные остатки, вовлечённые во все перечисленные посттрансляционные модификации, высоко консервативны у млекопитающих. Образование PrPC происходит в ЭПР, дальнейшее созревание - в комплексе Гольджи, откуда он при помощи мембранных везикул доставляется к плазматической мембране. После этого он либо закрепляется на мембране после разрушения эндосомы, либо же подвергается эндоцитозу и разрушается в лизосомах.
В отличие от нормальной, растворимой формы белка, прионы осаждаются высокоскоростным центрифугированием, что является стандартным тестом на наличие прионов. PrPC обладает высоким сродством к катионам двухвалентной меди. Значение этого факта неясно, но, возможно, это имеет какое-то отношение к его структуре или функциям. Есть данные, что PrP играет важную роль в прикреплении клеток, передаче внутриклеточных сигналов, а потому может быть вовлечён в коммуникацию клеток мозга. Тем не менее, функции PrP исследованы недостаточно.
PrPSc - дефектный.
Инфекционная изоформа PrP - PrPSc - способна превращать нормальный белок PrPC в инфекционную изоформу, изменяя его конформацию (то есть третичную структуру); это, в свою очередь, изменяет взаимодействия PrP с другими белками. Хотя точная пространственная структура PrPSc неизвестна, установлено, что в ней вместо α-спиралей преобладают β-слои. Такие ненормальные изоформы объединяются в высокоструктурированные амилоидные волокна, которые, скапливаясь, формируют бляшки. Неясно, являются ли эти образования причиной повреждения клеток или всего лишь побочным продуктом патологического процесса. Конец каждого волокна служит своего рода затравкой, к которой могут прикрепляться свободные белковые молекулы, в результате чего фибрилла растёт. В большинстве случаев присоединяться могут только молекулы PrP, идентичные по первичной структуре PrPSc (поэтому обычно передача прионов видоспецифична). Однако, возможны и случаи межвидовой передачи прионов.
 Механизм размножения прионов.
Механизм размножения прионов.
Гетеродимерная модель размножения прионов
Согласно этой гипотезе, одна молекула PrPSc присоединяется к одной молекуле PrPC и катализирует её переход в прионную форму. После этого они расходятся и продолжают превращать другие. Однако, модель размножения (репликации) прионов должна объяснять не только механизм размножения прионов, но и то, почему спонтанное появление прионов столь редко. Гетеродимерная модель требует, чтобы PrPSc был фантастически эффективным катализатором: он должен повышать частоту обращения нормального белка в прионную форму в 1015 раз. Такой проблемы не возникает, если допустить, что PrPSc существует только в агрегированной (например, амилоидной) форме, где кооперативность выступает как барьер для спонтанного перехода в прионную форму. Вдобавок к этому, несмотря на приложенные усилия, выделить мономерный PrPSc так и не удалось.
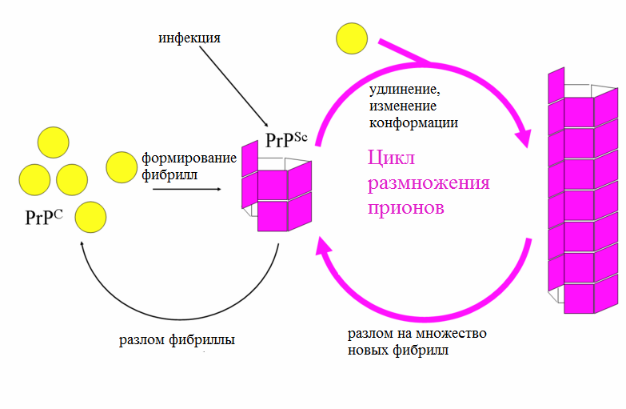 Фибриллярная модель размножения прионов
Фибриллярная модель размножения прионов
Альтернативная фибриллярная модель предполагает, что PrPSc существует только в виде фибрилл, при этом концы фибрилл связывают PrPС, где он превращается в PrPSc. Если бы это было только так, то численность прионов возрастала бы линейно. Однако по мере развития прионного заболевания наблюдается экспоненциальный рост количества PrPSc и общей концентрации инфекционных частиц. Это можно объяснить, если принять во внимание разлом фибрилл. В организме разламывание фибрилл осуществляется белками-шаперонами, которые обычно помогают очистить клетку от аггрегированных белков.
Механизм репликации прионов имеет значение для разработки лекарств. Поскольку инкубационный период прионных заболеваний чрезвычайно долог, эффективному лекарству вовсе необязательно уничтожить все прионы, достаточно лишь снизить скорость экспоненциального роста их количества. Моделирование предсказывает, что самым эффективным препаратом был бы такой, который связывается с концами фибрилл и блокирует их рост.
Одним из объяснений нейродегенерации, вызываемой прионами, может быть нарушение функционирования PrP. Однако нормальная функция этого белка изучена плохо. Данные in vitro указывают на множество разнообразных ролей, а эксперименты на мышах, «нокаутных» по этому гену, дали относительно немного информации, поскольку у этих животных наблюдались лишь малые отклонения от нормы. Недавние исследования, проведённые на мышах, показали, что расщепление PrP в периферических нервах активирует восстановление их миелинового слоя шванновскими клетками и что отсутствие PrP приводит к демиелинизации нервов, наблюдается изменённая гиппокампальная долговременная потенциация и проблемы с памятью, экспрессия гена Prnp в гемопоэтических стволовых клетках необходима для самоподдержания костного мозга.
Гипотезы о составе прионов.
«Чисто белковая» гипотеза.
До открытия прионов считалось, что все инфекционные агенты используют для размножения нуклеиновые кислоты. «Чисто белковая» гипотеза постулирует, что белковая структура может размножаться без участия нуклеиновых кислот. Первоначально считалось, что эта гипотеза противоречит центральной догме молекулярной биологии, согласно которой нуклеиновые кислоты служат единственным способом передачи наследственной информации, однако в настоящее время считается, что хотя прионы способны к переносу информации без участия нуклеиновых кислот, они неспособны передавать информацию на нуклеиновые кислоты.
Доказательства, говорящие в пользу «чисто белковой» гипотезы:
прионные заболевания не удалось достоверно связать ни с вирусными, ни с бактериальными, ни с грибковыми возбудителями;
инфективность прионов, насколько известно, не связана с нуклеиновыми кислотами; прионы устойчивы к нуклеазам и ультрафиолетовому излучению, губительно сказывающихся на нуклеиновых кислотах;
прионы не вызывают иммунного ответа;
у организма, заражённого прионом от другого вида, не обнаруживается PrPSc с аминокислотной последовательностью приона вида-донора, следовательно, репликации приона донора не происходит;
в семьях мышей с мутацией гена PrP имеют место наследственные прионные заболевания, несмотря на жёсткий контроль условий содержания, исключающий заражение извне;
животные, не имеющие белка PrPC, не подвержены прионным заболеваниям.
Вирусная гипотеза.
«Чисто белковая» гипотеза встретила критику со стороны тех, кто считает, что простейшим объяснением прионных заболеваний является их вирусная природа. Вирусная гипотеза утверждает, что прионовые болезни вызываются способными к репликации информационными молекулами (скорее всего, нуклеиновыми кислотами), связывающимися с PrP. Известны штаммы прионов, в том числе губчатой энцефалопатии крупного рогатого скота и скрейпи, которые характеризуются специфическими биологическими свойствами, что, по мнению сторонников вирусной гипотезы, не объясняется «чисто белковой» гипотезой.
Аргументы, говорящие в пользу вирусной гипотезы:
вариации между штаммами: прионы различаются по инфективности, инкубационному периоду, симптоматике и скорости развития заболевания, что напоминает различия между вирусами, особенно РНК-содержащими вирусами (вирусы, содержщие РНК в качестве единственного наследственного материала);
долгий инкубационный период и быстрое развитие симптомов прионных болезней напоминает лентивирусную инфекцию, например, схожим образом протекает ВИЧ-индуцированный СПИД;
в некоторых клетках линий, заражённых скрейпи или болезнью Крейтцфельдта - Якоба, были найдены вирусоподобные частицы, не состоящие из PrP.
Недавние исследования распространения губчатой энцефалопатии крупного рогатого скота в бесклеточных системах и в химических реакциях с очищенными компонентами чётко свидетельствуют против вирусной природы этого заболевания.
Прионы вызывают нейродегенеративные заболевания, так как образуют внеклеточные скопления в центральной нервной системе и формируют амилоидные бляшки, которые разрушают нормальную структуру ткани. Разрушение характеризуется образованием «дыр» (полостей) в ткани, и ткань принимает губчатую структуру из-за формирования вакуолей в нейронах. Другие наблюдаемые при этом гистологические изменения - астроглиоз (увеличение численности астроцитов из-за разрушения близлежащих нейронов) и отсутствие воспалительных реакций. Хотя инкубационный период прионных заболеваний, как правило, очень долог, после появления симптомов болезнь прогрессирует быстро, приводя к разрушению мозга и смерти. Проявляющимися при этом нейродегенеративными симптомами могут быть конвульсии, деменция, атаксия(расстройство координации движений), поведенческие и личностные изменения.
Все известные прионные заболевания, объединяемые под названием «трансмиссивные губчатые энцефалопатии» (ТГЭ), неизлечимы и фатальны. Для мышей была разработана специальная вакцина, возможно, это поможет разработать вакцину против прионных заболеваний и для человека. Кроме того, в 2006 году учёные заявили, что методами генной инженерии ими была получена корова, лишённая необходимого для образования прионов гена, то есть теоретически она обладает иммунитетом к ТГЭ. Этот вывод основан на результатах исследования, что мыши, лишённые прионного белка в нормальной форме, проявляли устойчивость к приону скрейпи.
Прионы поражают множество различных видов млекопитающих, и белок PrP очень схож у всех млекопитающих. Из-за небольших различий между PrP у различных видов для прионной болезни передача от одного вида к другому необычна. Однако вариант человеческого прионного заболевания (болезни Крейтцфельдта - Якоба) вызывается прионом, обычно поражающим коров и вызывающим губчатую энцефалопатию крупного рогатого скота, который передаётся через заражённое мясо.
Пути возникновения.
Считается, что прионное заболевание может быть приобретено 3 путями: в случае прямого заражения, наследственно или спорадически (спонтанно). В некоторых случаях для развития болезни требуется комбинация этих факторов. Например, для развития скрейпи необходимо как заражение, так и определённая генотипом чувствительность. В большинстве случаев прионные заболевания возникают спонтанно по невыясненным причинам. На долю наследственных заболеваний приходится около 15 % всех случаев. Наконец, меньшинство являются результатом действия окружающей среды, то есть имеют ятрогенную природу или появляются в результате прионного заражения.
Спорадическая (то есть спонтанная) прионная болезнь возникает в популяции у случайной особи. Таков, например, классический вариант болезни Крейтцфельдта - Якоба. Существуют две основные гипотезы относительно спонтанного появления прионных болезней. Согласно первой из них спонтанное изменение происходит в самом доселе нормальном белке в мозге, то есть имеет место посттрансляционная модификация. Альтернативная гипотеза гласит, что одна или несколько клеток организма в какой-то момент претерпевают соматическую мутацию (то есть не передающуюся наследственно) и начинают производить дефектный белок PrPSc. Как бы то ни было, конкретный механизм спонтанного возникновения прионных болезней неизвестен.
Наследственность.
Локализация гена PRNP. Был идентифицирован ген, кодирующий нормальный белок PrP - PRNP, локализованный на 20-й хромосоме. При всех наследственных прионных заболеваниях имеет место мутация этого гена. Было выделено много различных мутаций (около 30) этого гена, и получающиеся при этом мутантные белки более склонны к укладке в ненормальную (прионную) форму. Все такие мутации наследуются аутосомно-доминантно. Это открытие показало дыру в общей теории прионов, гласящей, что прионы могут переводить в прионную форму только белки идентичного аминокислотного состава.
Заражение.
По данным современных исследований, основной путь приобретения прионных заболеваний - поедание заражённой пищи. Считается, что прионы могут оставаться в окружающей среде в останках мёртвых животных, а также присутствуют в моче, слюне и других жидкостях и тканях тела. Из-за этого заражение прионами может произойти и в ходе пользования нестерильными хирургическими инструментами. Они также могут долго сохраняться в почве за счёт связывания с глиной и другими почвенными минералами.
В 2011 году было сообщено об открытии прионов, передающихся по воздуху в частицах аэрозоля (то есть воздушно-капельным путём). Это открытие было сделано в ходе эксперимента на заражённых скрейпи мышах. Также в 2011 году было опубликовано предварительное доказательство того, что прионы могут передаваться с получаемым из мочи человеческим менопаузальным гонадотропином, применяемым для лечения бесплодия.
Стерилизация.
Размножение инфекционных агентов, содержащих нуклеиновые кислоты, зависит от нуклеиновых кислот. Однако прионы увеличивают свою численность, изменяя структуру нормальной формы белка на прионную. Поэтому стерилизация против прионов должна включать их денатурацию до состояния, в котором бы они были неспособны изменять конфигурацию других белков. Прионы в большинстве своём устойчивы к протеазам, высокой температуре, радиации и хранению в формалине, хотя эти меры и снижают их инфективность. Эффективная дезинфекция против прионов должна включать гидролиз прионов или повреждение/разрушение их третичной структуры. Это можно достичь обработкой хлорной известью, гидроксидом натрия и сильнокислыми моющими веществами. Пребывание в течение 18 минут при температуре 134 °C в герметичном паровом автоклаве не может деактивировать прионы. Как потенциальный метод для деактивации и денатурации прионов в настоящее время изучается озоновая стерилизация.
Хлоропласты.

Хлоропласты в клетках листа
В хлоропластах имеются свои ДНК, РНК, рибосомы (типа 70s), идёт синтез белка (хотя этот процесс и контролируется из ядра). Они не синтезируются вновь, а образуются путём деления предшествующих. Всё это позволило считать их потомками свободных цианобактерий, вошедших в состав эукариотической клетки в процессе симбиогенеза.
А. Структура митохондрий
Митохондрии - это органеллы размером с бактерию (около 1 х 2 мкм). Они найдены в большом количестве почти во всех эукариотических клетках. Обычно в клетке содержится около 2000 митохондрий, общий объем которых составляет до 25% от общего объема клетки. Митохондрия ограничена двумя мембранами - гладкой внешней и складчатой внутренней, имеющей очень большую поверхность. Складки внутренней мембраны глубоко входят в матрикс митохондрий, образуя поперечный перегородки - кристы. Пространство между внешней и внутренней мембранами обычно  называют межмембранным пространством.
называют межмембранным пространством.
Различный типы клеток отличаются друг от друга как по количеству и форме митохондрий, так и по количеству крист. Особенно много крист имеют митохондрии в тканях с активными окислительными процессами, например в сердечной мышце. Вариации митохондрий по форме, что зависит от их функционального состояния, могут наблюдаться и в тканях одного типа. Митохондрии - изменчивые и пластичные органеллы.
Мембраны митохондрий содержат интегральные мембранные белки. Во внешнюю мембрану входят порины, которые образуют поры и делают мембраны проницаемыми для веществ с молекулярной массой до 10 кДа (см. рис. 223). Внутренняя же мембрана митохондрий непроницаема для большинства молекул; исключение составляют О2, СО2, Н20. Внутренняя мембрана митохондрий характеризуется необычно высоким содержанием белков (75%). В их число входят транспортные белки-переносчики (см. рис. 215), ферменты, компоненты дыхательной цепи и АТФ-синтаза. Кроме того, в ней содержится необычный фосфолипид кардиолипин (см. с. 56). Матрикс также обогащен белками, особенно ферментами цитратного цикла.
Б. Метаболические функции
Митохондрии являются «силовой станцией» клетки, поскольку за счет окислительной деградации питательных веществ в них синтезируется большая часть необходимого клетке АТФ (АТР). В митохондриях локализованы следующие метаболические процессы: превращение пирувата в ацетил-КоА, катализируемое пируватдегидрогеназным комплексом: цитратный цикл; дыхательная цепь, сопряженная с синтезом АТФ (сочетание этих процессов носит название «окислительное фосфорилирование»); расщепление жирных кислот путем β-окисления и частично цикл мочевины. Митохондрии также поставляют клетке продукты промежуточного метаболизма и действуют наряду с ЭР как депо ионов кальция, которое с помощью ионных насосов поддерживает концентрацию Са2+ в цитоплазме на постоянном низком уровне (ниже 1 мкмоль/л).
Главной функцией митохондрий является захват богатых энергией субстратов (жирные кислоты, пируват, углеродный скелет аминокислот) из цитоплазмы и их окислительное расщепление с образованием СО2 и Н2О, сопряженное с синтезом АТФ.
Реакции цитратного цикла приводят к полному окислению углеродсодержащих соединений (СО2) и образованию восстановительных эквивалентов, главным образом в виде восстановленных коферментов. Большинство этих процессов протекают в матриксе. Ферменты дыхательной цепи, которые реокисляют восстановленные коферменты, локализованы во внутренней мембране митохондрий. В качестве доноров электронов для восстановления кислорода и образования воды используются НАДН и связанный с ферментом ФАДН2. Эта высоко экзергоническая реакция является многоступенчатой и сопряжена с переносом протонов (Н+) через внутреннюю мембрану из матрикса в межмембранное пространство (см. рис. 143). В результате на внутренней мембране создается электрохимический градиент (см. рис. 129). В митохондриях электрохимический градиент используется для синтеза АТФ из АДФ (ADP) и неорганического фосфата (Рi) при катализе АТФ-синтазой. Электрохимический градиент является также движущей силой ряда транспортных систем (см. рис. 215).
АТФазы.
АТФазы разных видов ионов через мембрану. Они переносят их как внутрь клетки, так и, наоборот, наружу.
Название АТФаза означает, что это фермент, нацеленный на расщепление АТФ, его полное название - аденозинтрифосфатаза.
Обнаружено множество различных видов транспортных АТФаз. Они схожи между собой по строению и механизму действия, но имеют разную специализацию, т.е. каждый их вид перетаскивает через мембрану что-то своё. В настоящее время достаточно хорошо изучены Na+/K+-АТФаза, Ca2+-АТФаза, H+-АТФаза, H+,K+-АТФаза, Mg2+-АТФаза, которые обеспечивают перемещение соответственно ионов Na+, K+, Ca2+, H+, Mg2+ изолированно или сопряжённо: например, Na+ сопряжённо с К+; Н+сопряжённо с К+.
Эти ферменты расщепляют АТФ и высвобождают химическую энергию, заключённую в молекулах АТФ. Эта освобождённая энергия тратится тут же на какую-то полезную работу. Транспортные мембранные АТФазы тратят её на доставку определённого вещества на противоположную сторону мембраны «силой». Различные АТФазы, встроенные в мембрану, выполняет функцию переносчиков для различных веществ, и являются, таким образом, молекулярными транспортёрами, «насильно» переносящими вещества сквозь мембрану. Такой перенос называется активным транспортом.
Самой главной мембранной АТФазой по праву можно считать Na,K-АТФазу (натрий-калиевую аденозинтрифосфатазу).
Na,K-АТФаза образует в мембране «ионный натрий-калиевый насос», который разносит по разные стороны мембраны ионы Na+ и K+. Этот насос работает как обменник. На внутренней стороне мембраны активный центр фермента (АТФазы) захватывает 3 иона натрия и выбрасывает их уже на внешней стороне. А выбросив ионы натрия наружу, АТФаза на их место захватывает снаружи 2 иона калия. Затем фермент выворачивается внутрь клетки и перемещает ионы калия на внутреннюю сторону мембраны. Там он отпускает их, а вместо них опять захватывает 3 иона натрия.
При этом следует помнить, что, как истинный фермент, Na,K-АТФаза параллельно расщепляет АТФ, получая от этого энергию на свою транспортную деятельность.
Далее цикл повторяется.
Н+,К+-АТФазы обеспечивают секрецию соляной кислоты париетальными клетками желудка. Они перемещают на наружную сторону мембраны ионы водорода, которые создают кислую среду в желудке. Этот транспорт тоже работает по принципу обменника, т.к. меняет внутриклеточные ионы водорода на внеклеточные ионы калия. Кстати, в мембрану боковой и базальной поверхности этих клеток встроен хлорно-бикарбонатный анионообменник, через который анионы: Cl- вводятся в клетку в обмен на HCO3-
Н+-АТФаза растений обеспечивает поглощение из почвы солей корнями растений. Принцип действия тот же: обмен одних ионов на другие за счёт энергии, полученной из АТФ. Из клеток корня в почву выделяются ионы водорода Н+, а на их место в клетку переносятся ионы солей.
Са2+-АТФаза саркоплазматического ретикулюма в мышечных клетках обеспечивает транспорт кальция из цитоплазмы мышечных клеток во внутриклеточные цистерны для депонирования (запасания) кальция.
Транспортёры глюкозы.
Глюкозные транспортёры - это белки, переносящие глюкозу через мембрану. Их называют белками-переносчиками, а также рецепторами глюкозы. Эти белки образуют гидрофильные трансмембранные каналы.
Глюкозные транспортеры делятся на две группы.
1. Na+-глюкозные ко-транспортёры (симпортёры). Эти транспортёры занимаются активным транспортом глюкозы с помощью ионов Na+ и их работа зависит от градиента концентрации натрия. Они работают только в почечных канальцах и кишечнике, обеспечивая всасывание глюкозы против градиента её концентрации.
2. Транспортные белки семейства ГЛЮТ. Они отличаются от сходных по функции белков, транспортирующих глюкозу через мембрану в кишечнике и почках, и обеспечивают облегчённую диффузию, а не активный транспорт. Белки ГЛЮТ обнаружены во всех тканях и их существует несколько разновидностей.
Все 5 типов ГЛЮТ имеют сходную первичную структуру и доменную организацию.
· ГЛЮТ-1 (эритроцитарный тип) обеспечивает стабильный поток глюкозы в глиальные клетки мозга.
· ГЛЮТ-2 (печёночный тип) обнаружен в клетках органов, выделяющих глюкозу в кровь. Именно при участии ГЛЮТ-2 глюкоза переходит в кровь из энтероцитов и печени. ГЛЮТ-2 участвует в транспорте глюкозы в β-клетки поджелудочной железы. В то же время ГЛЮТ-2 обеспечивает проникновение глюкозы из крови в клетки печени (гепатоциты) по механизму облегчённой диффузии. Там глюкоза превращается в активное вещество глюкозо-6-фосфат, участвующее в обмене углеводов, жиров и в энергообмене.
· ГЛЮТ-3 (мозговой тип) обладает большим, чем ГЛЮТ-1, сродством к глюкозе. Он также обеспечивает постоянный приток глюкозы к клеткам нервной и других тканей.
· ГЛЮТ-4 (мышечно-жировой тип) - главный переносчик глюкозы в клетки мышц и жировой ткани. Это единственный переносчик, регулируемый инсулином, поэтому мышцы и жировую ткань называют инсулинзависимыми тканями.
· ГЛЮТ-5 (кишечный тип) встречается, главным образом, в клетках тонкого кишечника.
Везикулярный транспорт.
Эндоцито́з - процесс захвата внешнего материала клеткой, осуществляемый путём образования мембранных везикул. В результате эндоцитоза клетка получает для своей жизнедеятельности гидрофильный материал, который иначе не проникает через липидный бислой клеточной мембраны.
Различают фагоцитоз, пиноцитоз и рецептор-опосредованный эндоцитоз.
· Фагоцитоз (поедание клеткой) - процесс поглощения клеткой твёрдых объектов, таких как клетки эукариот, бактерии, вирусы, остатки мёртвых клеток и т. п. Вокруг поглощаемого объекта образуется большая внутриклеточная вакуоль (фагосома). Размер фагосом - от 250 нм и больше. Путём слияния фагосомы с первичной лизосомой образуется вторичная лизосома. В кислой среде гидролитические ферменты расщепляют макромолекулы, оказавшиеся во вторичной лизосоме. Продукты расщепления (аминокислоты, моносахариды и прочие полезные вещества) транспортируются затем через лизосомную мембрану в цитоплазму клетки. Фагоцитоз распространен очень широко. У высокоорганизованных животных и человека процесс фагоцитоза играет защитную роль. Фагоцитарная деятельность лейкоцитов и макрофагов имеет огромное значение в защите организма от попадающих в него патогенных микробов и других нежелательных частиц. Фагоцитоз впервые описал русский ученый И. И. Мечников.
· Пиноцитоз (питьё клеткой) - процесс поглощения клеткой жидкой фазы из окружающей среды, содержащей растворимые вещества, включая крупные молекулы (белки, полисахариды и др.). При пиноцитозе от мембраны отшнуровываются внутрь клетки небольшие пузырьки - эндосомы. Они меньше фагосом (их размер до 150 нм) и обычно не содержат крупных частиц. После образования эндосомы к ней подходит первичная лизосома, и эти два мембранных пузырька сливаются. Образовавшаяся органелла носит название вторичной лизосомы. Процесс пиноцитоза постоянно осуществляют все эукариотические клетки.
· Рецептор-опосредованный эндоцитоз - активный специфический процесс, при котором клеточная мембрана выпучивается внутрь клетки, формируя окаймлённые ямки. Внутриклеточная сторона окаймлённой ямки содержит набор адаптивных белков (адаптин, клатрин, обуславливающий необходимую кривизну выпучивания, и др. белки). Макромолекулы, связывающиеся со специфическими рецепторами на поверхности клетки, проходят внутрь со значительно большей скоростью, чем вещества, поступающие в клетки за счет пиноцитоза. Внешняя сторона мембраны при этом включает специфические рецепторы (например, ЛПНП-рецептор). При связывании лиганда из окружающей клетку среды окаймлённые ямки формируют внутриклеточные везикулы (окаймлённые пузырьки). Рецептор-опосредованный эндоцитоз включается для быстрого и контролируемого поглощения клеткой соответствующего лиганда (например, ЛПНП). Эти пузырьки быстро теряют свою кайму и сливаются между собой, образуя более крупные пузырьки - эндосомы. После чего эндосомы сливаются с первичными лизосомами, в результате чего формируются вторичные лизосомы. Например, когда животной клетке необходим холестерин для синтеза мембраны, она экспрессирует ЛПНП-рецепторы на плазматической мембране. Богатые холестерином и эфирами холестерина ЛПНП, связавшиеся с ЛПНП-рецепторами, быстро доставляют холестерин в клетку.
Типичный эндоцитоз встречается у эукариот, лишенных клеточной стенки - животных и многих протистов. Долгое время считалось, что прокариоты полностью лишены способности к эндоцитозу. Однако в 2010 году эндоцитоз был описан у бактерий рода Gemmata .
Экзоцитоз (от др.-греч. «вне, снаружи» и «клетка») - у эукариот клеточный процесс, при котором внутриклеточные везикулы (мембранные пузырьки) сливаются с внешней клеточной мембраной. При экзоцитозе содержимое секреторных везикул (экзоцитозных пузырьков) выделяется наружу, а их мембрана сливается с клеточной мембраной. Практически все макромолекулярные соединения (белки, пептидные гормоны и др.) выделяются из клетки этим способом.
У прокариот везикулярный механизм экзоцитоза не встречается, у них экзоцитозом называют встраивание белков в клеточную мембрану (или в наружную мембрану у грамотрицательных бактерий), выделение белков из клетки во внешнюю среду или в периплазматическое пространство.
Экзоцитоз может выполнять три основные задачи:
· доставка на клеточную мембрану липидов, необходимых для роста клетки;
· высвобождение различных соединений из клетки, например, токсичных продуктов метаболизма или сигнальных молекул (гормонов или нейромедиаторов);
· доставка на клеточную мембрану функциональных мембранных белков, таких как рецепторы или белки-транспортёры. При этом часть белка, которая была направлена внутрь секреторной везикулы, оказывается выступающей на наружной поверхности клетки.
У эукариот различают два типа экзоцитоза:
1. Кальций -независимый конститутивный экзоцитоз встречается практически во всех эукариотических клетках. Это необходимый процесс для построения внеклеточного матрикса и доставки белков на внешнюю клеточную мембрану. При этом секреторные везикулы доставляются к поверхности клетки и сливаются с наружной мембраной по мере их образования.
2. Кальций-зависимый неконститутивный экзоцитоз встречается, например, в химических синапсах или клетках, вырабатывающих макромолекулярные гормоны. Этот экзоцитоз служит, например, для выделения нейромедиаторов. При этом типе экзоцитоза секреторные пузырьки накапливаются в клетке, а процесс их высвобождения запускается по определённому сигналу, опосредованному быстрым повышением концентрации ионов кальция в цитозоле клетки. В пресинаптических мембранах процесс осуществляется специальным кальций-зависимым белковым комплексом SNARE.
Различают следующие этапы экзоцитоза:
· Транспортировка везикулы от места синтеза и формирования (аппарат Гольджи) до места доставки осуществляется моторными белками вдоль актиновых филаментов либо микротрубочек цитоскелета. Этот этап может потребовать перемещения секретируемого материала на значительное расстояние, как, например, в нейроне. Когда везикула достигает места секреции, она входит в контакт со специфическими удерживающими факторами клеточной мембраны.
· Удержание доставленной везикулы обеспечивается относительно слабыми связями на расстоянии более 25 нм и может служить, например, для концентрирования синаптических везикул около пресинаптической мембраны.
· Стыковка везикулы с мембраной является непосредственным продолжением первой фазы доставки, когда мембрана везикулы входит в близкий контакт с мембраной клетки (5-10 нм). Это включает прочное соединение белковых компонентов обеих мембран, вызванным внутримолекулярными перестановками, и предваряет формирования SNARE комплекса.
· Стимуляция (прайминг) везикулы фактически соответствует образованию особого SNARE комплекса между двумя мембранами и осуществляется только в случае нейронального экзоцитоза. Этот этап включает процессы молекулярных перестановок и АТФ-зависимые модификации белков и липидов, происходящие непосредственно до слияния мембран в ответ на подъём уровня свободного кальция. Этот кальций-зависимый процесс необходим для контролируемого быстрого выброса нейромедиатора и отсутствует в случае конститутивного экзоцитоза.
· Слияние мембраны везикулы с мембраной клетки приводит к высвобождению, или выбросу, содержания секретируемой везикулы во внеклеточное пространство и объединению липидного бислоя везикулы с внешней мембраной. В случае синаптического выброса процесс слияния, так же как и стимуляция, осуществляется SNARE комплексом.
Раздел 6. Цитоскелет.
Состав цитоскелета.
Цитоскелет образован белками, выделяют несколько основных систем, называемых либо по основным структурным элементам, заметным при электронно-микроскопических исследованиях (микрофиламенты, промежуточные филаменты, микротрубочки), либо по основным белкам, входящим в их состав (актин-миозиновая система, кератины, тубулин-динеиновая система).
Цитоскелет эукариот.
Клетки эукариот содержат три типа так называемых филаментов. Это супрамолекулярные, протяжённые структуры, состоящие из белков одного типа, сходные с полимерами. Разница заключается в том, что в полимерах связь между мономерами ковалентная, а в филаментах связь составных единиц обеспечивается за счёт слабого нековалентного взаимодействия.
Актиновые филаменты (микрофиламенты) порядка 7 нм в диаметре, микрофиламенты представляют собой две цепочки из мономеров актина, закрученные спиралью. В основном они сконцентрированы у внешней мембраны клетки, так как отвечают за форму клетки и способны образовывать выступы на поверхности клетки (псевдоподии и микроворсинки). Также они участвуют в межклеточном взаимодействии (образовании адгезивных контактов), передаче сигналов и, вместе с миозином - в мышечном сокращении. С помощью цитоплазматических миозинов по микрофиламентам может осуществляться везикулярный транспорт.
Промежуточные филаменты.
Диаметр промежуточных филаментов составляет от 8 до 11 нанометров. Они состоят из разного рода субъединиц и являются наименее динамичной частью цитоскелета.
Микротрубочки.
Микротрубочки представляют собой полые цилиндры порядка 25 нм диаметром, стенки которых составлены из 13 протофиламентов, каждый из которых представляет линейный полимер из димера белка тубулина. Димер состоит из двух субъединиц - альфа- и бета- формы тубулина. Микротрубочки - крайне динамичные структуры, потребляющие ГТФ в процессе полимеризации. Они играют ключевую роль во внутриклеточном транспорте (служат «рельсами», по которым перемещаются молекулярные моторы - кинезин и динеин), образуют основу аксонемы ундулиподий и веретено деления при митозе и мейозе.
Цитоскелет прокариот.
Долгое время считалось, что цитоскелетом обладают только эукариоты. Однако с выходом в 2001 году статьи Jones и соавт. (PMID 11290328), описывающей роль бактериальных гомологов актина в клетках Bacillus subtilis, начался период активного изучения элементов бактериального цитоскелета. К настоящему времени найдены бактериальные гомологи всех трех типов элементов цитоскелета эукариот - тубулина, актина и промежуточных филаментов[1]. Также было установлено, что как минимум одна группа белков бактериального цитоскелета, MinD/ParA, не имеет эукариотических аналогов.
MreB и его гомологи.
Белки MreB и его гомологи являются актиноподобными компонентами цитоскелета бактерий, играющими важную роль в поддержании формы клетки, сегрегации хромосом и организации мембранных структур. Некоторые виды бактерий, такие как Escherichia coli, имеют только один белок MreB, тогда как другие могут иметь 2 и более MreB-подобных белков. Примером последних служит бактерия Bacillus subtilis .
В геномах E. coli и B. subtilis ген, отвечающий за синтез MreB, находится в одном опероне с генами белков MreC и MreD. Мутации, подавляющие экспрессию данного оперона, приводят к образованию клеток сферической формы с пониженной жизнеспособностью.
Субъединицы белка MreB образуют филаменты, обвивающие палочковидную бактериальную клетку. Они располагаются на внутренней поверхности цитоплазматической мембраны. Филаменты, образуемые MreB, динамичны, постоянно претерпевают полимеризацию и деполимеризацию. Непосредственно перед делением клетки MreB концентрируется в области, в которой будет формироваться перетяжка. Считается, что функцией MreB также является координация синтеза муреина - полимера клеточной стенки.
Гены, отвечающие за синтез гомологов MreB, были обнаружены только у палочковидных бактерий и не были найдены у кокков.
ParM.
Белок ParM присутствует в клетках, содержащих малокопийные плазмиды. Его функция заключается в разведении плазмид по полюсам клетки. При этом субъединицы белка формируют филаменты, вытянутые вдоль большой оси палочковидной клетки. Филамент по своей структуре представляет собой двойную спираль. Рост филаментов, образуемых ParM, возможен с обоих концов, в отличие от актиновых филаментов, растущих только на 1 полюсе.
MamK
MamK - это актиноподобный белок Magnetospirillum magneticum, отвечающий за правильное расположение магнитосом. Магнитосомы представляют собой впячивания цитоплазматической мембраны, окружающие частички железа. Филамент MamK выполняет роль направляющей, вдоль которой, одна за другой, располагаются магнитосомы. В отсутствие белка MamK магнитосомы располагаются беспорядочно по поверхности клетки.
Гомологи тубулина.
В настоящее время у прокариот найдены 2 гомолога тубулина: FtsZ и BtubA/B. Как и эукариотический тубулин, эти белки обладают ГТФазной активностью.
FtsZ
Белок FtsZ чрезвычайно важен для клеточного деления бактерий, он найден практически у всех эубактерий и архей. Также гомологи этого белка были обнаружены в пластидах эукариот, что является ещё одним подтверждением их симбиотического происхождения.
FtsZ формирует так называемое Z-кольцо, выполняющее роль каркаса для дополнительных белков клеточного деления. Вместе они представляют собой структуру, ответственную за образование перетяжки (септы).
BtubA/В.
В отличие от широко распространенного FtsZ, эти белки обнаружены только у бактерий рода Prosthecobacter. Они более близки к тубулину по своему строению, чем FtsZ.
MinD и ParA
Лекция 15. Митоз.
Мито́з (др.-греч. нить) - непрямое деление клетки, наиболее распространённый способ репродукции эукариотическихклеток. Биологическое значение митоза состоит в строго одинаковом распределении хромосом между дочерними ядрами, что обеспечивает образование генетически идентичных дочерних клеток и сохраняет преемственность в ряду клеточных поколений.
Митоз - один из фундаментальных процессов онтогенеза (жизни индивидуального организма). Митотическое деление обеспечивает рост многоклеточных эукариот за счёт увеличения популяций клеток тканей. У растений в результате митотического деления клеток образовательных тканей (меристем) увеличивается количество клеток тканей. Дробление оплодотворённого яйца и рост большинства тканей у животных также происходит путём митотических делений.
На основании морфологических особенностей митоз условно подразделяется на стадии: профазу, прометафазу, метафазу, анафазу, телофазу.
Продолжительность митоза в среднем составляет 1-2 часа. Митоз клеток животных, как правило, длится 30-60 минут, а растений - 2-3 часа. За 70 лет в теле человека суммарно осуществляется порядка 1014 клеточных делений.
Митоз происходит только в клетках эукариот (ядерных). Клетки прокариот (безъядерных) делятся другим, бинарным, способом. Митоз отличается для разных организмов. Так, например, процесс для клеток животных является «открытым», а для клеток грибов - «закрытым» (при котором хромосомы делятся в целом клеточном ядре). У человека все клетки, кроме гамет, производятся митозом. Гаметы производятся мейозом.
В 1970-х годах началась расшифровка и детальное изучение регуляторов митотического деления, благодаря серии экспериментов по слиянию клеток, находящихся на разных этапах клеточного цикла. В тех опытах, когда клетку в М-фазе объединяли с клеткой, находящейся в любой из стадий интерфазы (G1, S или G2), интерфазные клетки переходили в митотическое состояние (начиналась конденсация хромосом и распадалась ядерная мембрана). В итоге был сделан вывод, что в цитоплазме митотической клетки присутствует фактор (или факторы), стимулирующий митоз, или, иначе, М-стимулирующий фактор (англ.)русск. (МСФ, от англ. M-phase-promoting factor, MPF).
Впервые «фактор стимуляции митоза» был открыт в зрелых неоплодотворенных яйцах шпорцевой лягушки, находящихся в М-фазе клеточного цикла. Цитоплазма такого яйца, инъецированная в ооцит, приводила к преждевременному переходу в М-фазу и к началу созревания ооцита (первоначально сокращение MPF означало Maturation promoting factor , что переводится как «фактор, способствующий созреванию». В ходе дальнейших экспериментов были установлены универсальное значение и вместе с тем высокая степень консервативности «фактора стимуляции митоза»: экстракты, приготовленные из митотических клеток весьма разнообразных организмов (млекопитающих, морских ежей, моллюсков, дрожжей), при введении в ооциты шпорцевой лягушки переводили их в М-фазу.
В ходе последующих исследований выяснилось, что фактор, стимулирующий митоз, представляет собой гетеродимерный комплекс, состоящий из белка циклина и зависимой от циклина протеинкиназы. Циклин является регуляторным белком и обнаруживается у всех эукариот. Его концентрация периодически возрастает в течение клеточного цикла, достигая максимума в метафазе митоза. С началом анафазы наблюдается резкое сокращение концентрации циклина, вследствие его расщепления с помощью сложных белковых протеолитических комплексов - протеасом. Зависимая от циклина протеинкиназа представляет собой фермент (фосфорилазу), модифицирующий белки за счёт переноса фосфатной группы от АТФ на аминокислоты серин и треонин. Таким образом с установления роли и структуры основного регулятора митотического деления начались исследования тонких регуляторных механизмов митоза, которые продолжаются до настоящего времени.
Аппарат клеточного деления.
Деление всех эукариотических клеток сопряжено с формированием специального аппарата клеточного деления. Активная роль в митотическом делении клеток зачастую отведена цитоскелетным структурам. Универсальным как для животных, так и для растительных клеток является двухполюсное митотическое веретено, состоящее из микротрубочек и связанных с ними белков. Веретено деления обеспечивает строго одинаковое распределение хромосом между полюсами деления, в области которых в телофазе образуются ядра дочерних клеток.
Ещё одна не менее важная структура цитоскелета отвечает за разделение цитоплазмы (цитокинез) и, как следствие, за распределение клеточных органелл. В животных клетках за цитокинез отвечает сократимое кольцо из актиновых и миозиновых филаментов. В большинстве клеток высших растений из-за наличия жёсткой клеточной стенки цитокинез протекает с образованием клеточной пластинки в плоскости между двумя дочерними клетками. При этом область образования новой клеточной перегородки определяется заранее предпрофазным пояском из актиновых микрофиламентов, а поскольку актин участвует также в формировании клеточных септ у грибов, возможно, что он направляет цитокинез у всех эукариот.
Веретено деления
Поздняя метафаза митоза в клетке лёгкого тритона(использованы иммунофлуоресцентные красители). Четко просматривается веретено деления, образованное микротрубочками (зелёные), и хромосомы (синие)
Ф  ормирование веретена деления начинается в профазе. В его образовании принимают участие полярные тельца (полюса) веретена и кинетохоры хромосом, и те и другие взаимодействуют с микротрубочками - биополимерами, состоящими из субъединиц тубулина. Главным центром организации микротрубочек (ЦОМТ) во многих эукариотических клетках является центросома - скопление аморфного фибриллярного материала, причём в большинстве животных клеток в состав центросом также входят пары центриолей. Во время интерфазы ЦОМТ, как правило, располагающийся вблизи клеточного ядра, инициирует рост микротрубочек, расходящихся к периметру клетки и образующих цитоскелет. В S-фазе материал центросомы удваивается, а в профазе митоза начинается расхождение дочерних центросом. От них в свою очередь «отрастают» микротрубочки, которые удлиняются вплоть до соприкосновения друг с другом, после чего центросомы расходятся. Затем, в прометафазе, после разрушения ядерной мембраны, микротрубочки проникают в область клеточного ядра и взаимодействуют с хромосомами. Две дочерние центросомы теперь называют полюсами веретена.
ормирование веретена деления начинается в профазе. В его образовании принимают участие полярные тельца (полюса) веретена и кинетохоры хромосом, и те и другие взаимодействуют с микротрубочками - биополимерами, состоящими из субъединиц тубулина. Главным центром организации микротрубочек (ЦОМТ) во многих эукариотических клетках является центросома - скопление аморфного фибриллярного материала, причём в большинстве животных клеток в состав центросом также входят пары центриолей. Во время интерфазы ЦОМТ, как правило, располагающийся вблизи клеточного ядра, инициирует рост микротрубочек, расходящихся к периметру клетки и образующих цитоскелет. В S-фазе материал центросомы удваивается, а в профазе митоза начинается расхождение дочерних центросом. От них в свою очередь «отрастают» микротрубочки, которые удлиняются вплоть до соприкосновения друг с другом, после чего центросомы расходятся. Затем, в прометафазе, после разрушения ядерной мембраны, микротрубочки проникают в область клеточного ядра и взаимодействуют с хромосомами. Две дочерние центросомы теперь называют полюсами веретена.
По морфологии различают два типа митотического веретена: астральный (или конвергентный) и анастральный (дивергентный).
Астральный тип митотической фигуры, характерный для животных клеток, отличают благодаря небольшим зонам, на полюсах веретена, в которых сходятся (конвергируют) микротрубочки. Зачастую центросомы, располагающиеся в области полюсов астрального веретена, содержат центриоли. От полюсов деления также расходятся во всех направлениях радиальные микротрубочки, не входящие в состав веретена, а образующие звездчатые зоны - цитастеры.
Анастральный тип митотической фигуры отличается широкими полярными областями веретена, так называемыми полярными шапочками, в их состав не входят центриоли. Микротрубочки при этом расходятся широким фронтом (дивергируют) от всей зоны полярных шапочек. Этот тип митотической фигуры также отличает отсутствие цитастеров. Анастральный тип митотического веретена наиболее характерен для делящихся клеток высших растений, хотя иногда наблюдается и в некоторых клетках животных.
Микротрубочки - динамичные структуры, принимающие активное участие в построении веретена деления во время митоза. Химически они представляют собой биополимеры, состоящие из субъединиц белка тубулина. Количество микротрубочек в клетках различных организмов может значительно отличаться. В метафазе веретено деления в клетках высших животных и растений может содержать до нескольких тысяч микротрубочек, тогда как у некоторых грибов их всего около 40.
Митотические микротрубочки веретена деления «динамически нестабильны». Их «положительные» или «плюс-концы», расходящиеся во всех направлениях от центросом резко переходят от равномерного роста к стремительному укорочению, при котором часто деполимеризуется вся микротрубочка. Согласно этим данным, образование митотического веретена объясняется селективной (выборочной) стабилизацией микротрубочек, взаимодействующих в экваториальной области клетки с кинетохорами хромосом и с микротрубочками, идущими от противоположного полюса деления. Данная модель объясняет характерную двухполюсную фигуру митотического веретена.
Центромера, Кинетохор .
Центромеры - специализированные последовательности ДНК, необходимые для связывания с микротрубочками веретена деления и для последующего расхождения хромосом. В зависимости от локализации различают несколько типов центромер. Для голоцентрических центромер характерно образование связей с микротрубочками веретена по всей длине хромосомы (некоторые насекомые, нематоды, некоторые растения). В противоположность голоцентрическим моноцентрические центромеры служат для связи с микротрубочками в единственной области хромосомы.
В центромерной области обычно располагаются кинетохоры хромосом - сложные белковые комплексы, морфологически очень сходные по своей структуре для различных групп эукариот, как, например, для диатомовых водорослей, так и для человека. Обычно на каждую хроматиду (хромосому) приходится по одному кинетохору. На электронных микрофотографиях кинетохор обычно выглядит как пластинчатая трёхслойная структура. Порядок слоев следующий: внутренний плотный слой, примыкающий к телу хромосомы; средний рыхлый слой; внешний плотный слой, от которого отходит множество фибрилл, образуя т. н. фиброзную корону кинетохора.
К основным функциям кинетохора относят: закрепление микротрубочек веретена деления, обеспечение движения хромосом во время митоза при участии микротрубочек, связывание между собой сестринских хроматид и регуляцию их последующего разделения в анафазе митоза. Минимально достаточно одной микротрубочки (например, для дрожжей) ассоциированной с кинетохором, чтобы обеспечить движение хромосомы. Однако с одним кинетохором могут быть связаны целые пучки, состоящие из 20-40 микротрубочек (например, у высших растений или человека), чтобы обеспечить расхождение хромосом к полюсам клетки.
Временной ход митоза и цитокинеза, типичный для клетки млекопитающего. Точные цифры для разных клеток различны. Цитокинез берёт своё начало в анафазе и завершается, как правило, к окончанию телофазы
Собственно митоз зачастую протекает сравнительно быстро. Средняя продолжительность составляет 1-2 часа, что занимает всего около 10% времени клеточного цикла. К примеру, у делящихся клеток меристемы корней интерфаза составляет 16-30 часов, а митоз длится всего 1-3 часа. Для эпителиальных клеток кишечника мыши интерфазный период составляет порядка 20-22 часов, а митоз продолжается в течение 1 часа. В клетках животных митоз обычно протекает быстрее и длится в среднем 30-60 минут, в то время как в растительных клетках средняя продолжительность митоза составляет 2-3 часа. Известны исключения с противоположными показателями. К примеру, в животных клетках продолжительность митоза может достигать 3,8 часов (эпидермис мыши). Или же встречаются растительные объекты с длительностью митоза в 5 минут (Chilomonas).Наиболее интенсивно митоз протекает в эмбриональных клетках (10-40 минут в дробящихся яйцеклетках).
Длительность митоза находится в зависимости от целого ряда факторов: размеров делящейся клетки, её плоидности, числа ядер. Частота клеточных делений также зависит от степени дифференцировки клеток и специфики выполняемых функций. Так, нейроны или клетки скелетной мышцы человека не делятся совсем; клетки печени обычно делятся раз в один или два года, а некоторые эпителиальные клетки кишечника делятся чаще, чем 2 раза в сутки.
Темп клеточного деления зависит также от условий окружающей среды, в частности, от температуры. Повышение температуры окружающей среды в физиологических пределах повышает скорость митоза, что может быть объяснено обычной закономерностью кинетики химических реакций.
Фазы митоза
Фаза клеточного цикла, соответствующая делению клетки, называется М-фазой (от слова «митоз»). М-фазу условно подразделяют на шесть стадий, постепенно и непрерывно переходящих одна в другую. Первые пять - профаза, прометафаза (метакинез), метафаза, анафаза и телофаза (или цитотомия) - составляют митоз а берущий своё начало в анафазе процесс разделения цитоплазмы клетки, или цитокинез, протекает вплоть до завершения митотического цикла и, как правило, рассматривается в составе телофазы.
Длительность отдельных стадий различна и варьируется в зависимости от типа ткани, физиологического состояния организма, внешних факторов. Наиболее продолжительны стадии, сопряженные с процессами внутриклеточного синтеза: профаза (2-270 минут) и телофаза (1,5-140 минут). Наиболее быстротечны фазы митоза, в ходе которых происходит движение хромосом: метафаза (0,3-175 минут) и анафаза (0,3-122 минуты). Непосредственно процесс расхождения хромосом к полюсам обычно не превышает 10 минут.
Профаза.
К основным событиям профазы относят конденсацию хромосом внутри ядра и образование веретена деления в цитоплазме клетки. Распад ядрышка в профазе является характерной, но необязательной для всех клеток особенностью.
Условно за начало профазы принимается момент возникновения микроскопически видимых хромосом вследствие конденсации внутриядерного хроматина. Уплотнение хромосом происходит за счёт многоуровневой спирализации ДНК. Данные изменения сопровождаются повышением активности фосфорилаз, модифицирующих гистоны, непосредственно участвующие в компоновке ДНК. Как следствие, резко снижается транскрипционная активность хроматина, инактивируются ядрышковые гены, большая часть ядрышковых белков диссоциирует. Конденсирующиеся сестринские хроматиды в ранней профазе остаются спаренными по всей своей длине с помощью белков-когезинов, однако к началу прометафазы связь между хроматидами сохраняется лишь в области центромер. К поздней профазе на каждой центромере сестринских хроматид формируются зрелые кинетохоры, необходимые хромосомам для присоединения к микротрубочкам веретена деления в прометафазе.
Наряду с процессами внутриядерной конденсации хромосом в цитоплазме начинает формироваться митотическое веретено - одна из главных структур аппарата клеточного деления, ответственная за распределение хромосом между дочерними клетками. В образовании веретена деления у всех эукариотических клеток принимают участие полярные тельца (центросомы), микротрубочки и кинетохоры хромосом.
С началом формирования митотического веретена в профазе сопряжены разительные изменения динамических свойств микротрубочек. Время полужизни средней микротрубочки уменьшается примерно в 20 раз от 5 минут (в интерфазе) до 15 секунд. Однако скорость их роста увеличивается примерно в 2 раза по сравнению с теми же интерфазными микротрубочками. Полимеризующиеся плюс-концы («+»-концы) являются «динамически нестабильными» и резко переходят от равномерного роста к быстрому укорочению, при котором часто деполимеризуется вся микротрубочка. Примечательно, что для правильного функционирования митотического веретена необходим определенный баланс между процессами сборки и деполимеризации микротрубочек, так как ни стабилизированные, ни деполимеризованные микротрубочки веретена не в состоянии перемещать хромосомы.[~ 3]
Наряду с наблюдаемыми изменениями динамических свойств микротрубочек, слагающих нити веретена, в профазе закладываются полюса деления. Реплицированные в S-фазе центросомы расходятся в противоположных направлениях за счёт взаимодействия полюсных микротрубочек, растущих навстречу друг другу. Своими минус-концами («-»-концами) микротрубочки погружены в аморфное вещество центросом, а процессы полимеризации протекают со стороны плюс-концов, обращенных к экваториальной плоскости клетки. При этом вероятный механизм расхождения полюсов объясняется следующим образом: динеино-подобные белки ориентируют в параллельном направлении полимеризующиеся плюс-концы полюсных микротрубочек, а кинезино-подобные белки в свою очередь расталкивают их в направлении к полюсам деления.
Параллельно конденсации хромосом и формированию митотического веретена, во время профазы происходит фрагментация эндоплазматического ретикулума, который распадается на мелкие вакуоли, расходящиеся затем к периферии клетки. Одновременно рибосомы теряют связи с мембранами ЭПР. Цистерны аппарата Гольджи также меняют свою околоядерную локализацию, распадаясь на отдельные диктиосомы, без особого порядка распределенные в цитоплазме.
Окончание профазы и наступление прометафазы, как правило, знаменуется распадом ядерной мембраны. Целый ряд белков ламины фосфорилируется, вследствие чего ядерная оболочка фрагментируется на мелкие вакуоли, а поровые комплексы исчезают. После разрушения ядерной мембраны хромосомы без особого порядка располагаются в области ядра. Однако вскоре все они приходят в движение.
В прометафазе наблюдается интенсивное, но беспорядочное перемещение хромосом. Поначалу отдельные хромосомы стремительно дрейфуют к ближайшему полюсу митотического веретена со скоростью, достигающей 25 мкм/мин. Вблизи полюсов деления повышается вероятность взаимодействия новосинтезированных плюс-концов микротрубочек веретена с кинетохорами хромосом. В результате такого взаимодействия кинетохорные микротрубочки (связанные с кинетохором) стабилизируются от спонтанной деполимеризации, а их рост отчасти обеспечивает отдаление соединенной с ними хромосомы в направлении от полюса к экваториальной плоскости веретена. С другой стороны хромосому настигают тяжи микротрубочек, идущие от противоположного полюса митотического веретена. Взаимодействуя с кинетохором, они также участвуют в движении хромосомы. В результате сестринские хроматиды оказываются связанными с противоположными полюсами веретена. Усилие, развиваемое микротрубочками от разных полюсов, не только стабилизирует взаимодействие этих микротрубочек с кинетохорами, но также, в конечном счёте, приводит каждую хромосому в плоскость метафазной пластинки.
В клетках млекопитающих прометафаза протекает, как правило, в течение 10-20 минут. В нейробластах кузнечика данная стадия занимает всего 4 минуты, а в эндосперме Haemanthus и в фибробластах тритона - около 30 минут. В дрожжевых клетках невозможно чётко разграничить стадии профазы и прометафазы по причине сохранения ядерной оболочки в процессе деления. Аналогичным образом, частичное или более позднее разрушение ядерной мембраны затрудняет разграничение стадий профазы и прометафазы в клетках Drosophila и C. elegans. В подобных случаях для описания всех ранних событий митотического деления используется обобщающий термин «профаза».
Метафаза
В завершении прометафазы хромосомы располагаются в экваториальной плоскости веретена (а не всей клетки) примерно на равном расстоянии от обоих полюсов деления, образуя метафазную (экваториальную) пластинку. Морфология метафазной пластинки в клетках животных, как правило, отличается упорядоченным расположением хромосом: центромерные участки обращены к центру веретена, а плечи - к периферии клетки (фигура «материнской звезды»). В растительных клетках хромосомы зачастую лежат в экваториальной плоскости веретена без строгого порядка. В дрожжевых клетках хромосомы тоже не выстраиваются в экваториальной плоскости, а располагаются произвольно вдоль волокон веретена деления.
Метафаза занимает значительную часть периода митоза, и отличается относительно стабильным состоянием. Все это время хромосомы удерживаются в экваториальной плоскости веретена за счёт сбалансированных сил натяжения кинетохорных микротрубочек, совершая колебательные движения с незначительной амплитудой в плоскости метафазной пластинки.
В метафазе, также как и в течение других фаз митоза, продолжается активное обновление микротрубочек веретена путём интенсивной сборки и деполимеризации молекул тубулина. Несмотря на некоторую стабилизацию пучков кинетохорных микротрубочек, происходит постоянная переборка межполюсных микротрубочек, численность которых в метафазе достигает максимума.
К окончанию метафазы наблюдается чёткое обособление сестринских хроматид, соединение между которыми сохраняется лишь в центромерных участках. Плечи хроматид располагаются параллельно друг другу, и становится отчетливо заметной разделяющая их щель.
Анафаза - самая короткая стадия митоза, которая начинается внезапным разделением и последующим расхождением сестринских хроматид в направлении противоположных полюсов клетки. Хроматиды расходятся с равномерной скоростью достигающей 0,5-2 мкм/мин. (0,2-5 мкм/мин.), при этом они часто принимают V-образную форму. Их движение обусловлено воздействием значительных сил, оценочно 10−5 дин на хромосому, что в 10 000 раз превышает усилие, необходимое для простого продвижения хромосомы через цитоплазму с наблюдаемой скоростью.
Как правило, расхождение хромосом в анафазе состоит из двух относительно независимых процессов, называемых анафазой А и анафазой В.
Анафаза А характеризуется расхождением сестринских хроматид к противоположным полюсам деления клетки. За их движение при этом отвечают те же силы, что ранее удерживали хромосомы в плоскости метафазной пластинки. Процесс расхождения хроматид сопровождается сокращением длины деполимеризующихся кинетохорных микротрубочек. Причем их распад наблюдается преимущественно (на 80 %) в области кинетохоров, со стороны плюс-концов (ранее, с начала профазы и вплоть до начала анафазы, на плюс-концах преобладали процессы сборки субъединиц тубулина). Вероятно, деполимеризация микротрубочек у кинетохоров либо в области полюсов деления является необходимым условием для перемещения сестринских хроматид, так как их движение прекращается при добавлении таксола или тяжёлой воды (D2O), оказывающих стабилизирующее воздействие на микротрубочки. Механизм, лежащий в основе расхождения хромосом в анафазе А, пока остается неизвестным.
Во время анафазы В расходятся сами полюса деления клетки, и, в отличие от анафазы А, данный процесс происходит за счёт сборки полюсных микротрубочек со стороны плюс-концов. Полимеризующиеся антипараллельные нити веретена при взаимодействии отчасти и создают расталкивающее полюса усилие. Величина относительного перемещения полюсов при этом, также как и степень перекрывания полюсных микротрубочек в экваториальной зоне клетки, сильно варьирует у особей разных видов. Помимо расталкивающих сил, на полюса деления воздействуют тянущие силы со стороны астральных микротрубочек, которые создаются в результате взаимодействия с динеино-подобными белками на плазматической мембране клетки.
Последовательность, продолжительность и относительный вклад каждого из двух процессов, слагающих анафазу, могут быть крайне различны. Так, в клетках млекопитающих анафаза В начинается сразу вслед за началом расхождения хроматид к противоположным полюсам и продолжается вплоть до удлинения митотического веретена в 1,5-2 раза по сравнению с метафазным. В некоторых других клетках (например, дрожжевых) анафаза В начинается только после того как хроматиды достигают полюсов деления. У некоторых простейших в процессе анафазы В веретено удлиняется в 15 раз по сравнению с метафазным. В растительных клетках анафаза В отсутствует.
Телофаза.
Телофаза (от греч. telos - конец) рассматривается как заключительная стадия митоза; за её начало принимается момент остановки разделённых сестринских хроматид у противоположных полюсов деления клетки. В ранней телофазе наблюдается деконденсация хромосом и, следовательно, увеличение их в объёме. Вблизи сгруппированных индивидуальных хромосом начинается слияние мембранных пузырьков, что дает начало реконструкции ядерной оболочки. Материалом для построения мембран новообразованных дочерних ядер служат фрагменты изначально распавшейся ядерной мембраны материнской клетки, а также элементы эндоплазматического ретикулума. При этом отдельные пузырьки связываются с поверхностью хромосом и сливаются воедино. Постепенно восстанавливается наружная и внутренняя ядерные мембраны, восстанавливаются ядерная ламина и ядерные поры. В процессе восстановления ядерной оболочки дискретные мембранные пузырьки, вероятно, соединяются с поверхностью хромосом без распознавания специфических последовательностей нуклеотидов, так как в результате проведенных экспериментов было выявлено, что восстановление ядерной мембраны происходит вокруг молекул ДНК, заимствованных у любого организма, даже у бактериального вируса. Внутри заново сформировавшихся клеточных ядер хроматин переходит в дисперсное состояние, возобновляется синтез РНК, и становятся различимыми ядрышки.
Параллельно с процессами образования ядер дочерних клеток в телофазе начинается и заканчивается разборка микротрубочек веретена деления. Деполимеризация протекает в направлении от полюсов деления к экваториальной плоскости клетки, от минус-концов к плюс-концам. При этом дольше всего сохраняются микротрубочки в средней части веретена деления, которые образуют остаточное тельце Флемминга.
Цитокинез.
Окончание телофазы преимущественно совпадает с разделением тела материнской клетки - цитокинезом (цитотомией).При этом образуются две или более дочерние клетки. Процессы, ведущие к разделению цитоплазмы, берут своё начало ещё в середине анафазы и могут продолжаться после завершения телофазы. Митоз не всегда сопровождается разделением цитоплазмы, поэтому цитокинез не классифицируется в качестве отдельной фазы митотического деления и обычно рассматривается в составе телофазы.[~ 5]
Различают два основных типа цитокинеза: деление поперечной перетяжкой клетки (наиболее характерно для клеток животных) и деление путём образования клеточной пластинки (свойственно растениям в связи с наличием жёсткой клеточной стенки). Плоскость деления клетки детерминируется положением митотического веретена и проходит под прямым углом к длинной оси веретена.
При делении поперечной перетяжкой клетки место разделения цитоплазмы закладывается предварительно ещё в период анафазы, когда в плоскости метафазной пластинки под мембраной клетки возникает сократительное кольцо из актиновых и миозиновых филаментов. В дальнейшем, вследствие активности сократительного кольца, образуется борозда деления, которая постепенно углубляется вплоть до полного разделения клетки. По окончании цитокинеза сократимое кольцо полностью распадается, а плазматическая мембрана стягивается вокруг остаточного тельца Флемминга, состоящего из скопления остатков двух групп полюсных микротрубочек, тесно упакованных вместе с материалом плотного матрикса.
Деление путём образования клеточной пластинки начинается с перемещения мелких ограниченных мембраной пузырьков по направлению к экваториальной плоскости клетки. Здесь они сливаются, образуя дисковидную, окружённую мембраной структуру - раннюю клеточную пластинку. Мелкие пузырьки происходят в основном из аппарата Гольджи и перемещаются к экваториальной плоскости вдоль остаточных полюсных микротрубочек веретена деления, образующих цилиндрическую структуру, называемую фрагмопластом. По мере расширения клеточной пластинки микротрубочки раннего фрагмопласта попутно перемещаются к периферии клетки, где за счёт новых мембранных пузырьков продолжается рост клеточной пластинки вплоть до её окончательного слияния с мембраной материнской клетки. После окончательного разделения дочерних клеток в клеточной пластинке откладываются микрофибриллы целлюлозы, завершая образование жёсткой клеточной стенки.
Основными регулято́рными механизмами митоза являются процессы фосфорилирования и протеолиза. Обратимые реакции фосфорилирования и дефосфорилирования обеспечивают протекание обратимых событий митоза, таких как сборка/распад веретена деления или распад/восстановление ядерной оболочки. Протеолиз лежит в основе необратимых событий митоза, таких как разделение сестринских хроматид в анафазе или разрушение митотических циклинов на поздних стадиях митоза.
Рассматривая вопрос регуляции митоза, можно условно выделить два периода митотического деления: от начала профазы до анафазы, и далее, от анафазы до конца телофазы. Каждый из двух обозначенных периодов начинается с прохождения контрольной точки клеточного цикла.
Первой контрольной точкой является переход из фазы G2 к M-фазе. Главным условием для преодоления контрольной точки G2/M является завершённая репликация ДНК: старт митотического деления блокируется у большинства эукариот при повреждениях или неоконченной репликации ДНК. События от начала профазы и до окончания метафазы инициируются и протекают при участии белковых комплексов, состоящих из митотических циклинов и циклин-зависимых киназ (англ. M-Cdk).
Вторая контрольная точка служит разделительным барьером на границе метафазы и анафазы. На данном этапе критичным показателем является состояние веретена деления: вступление в анафазу у всех эукариот блокируется в случае наличия дефектов веретена. Ключевым активатором событий анафазы является убиквитинлигаза APCCdc20.
Основные регуляторы митоза.
Циклин-киназы.
Ключевыми активаторами митоза, обеспечивающими инициацию событий профазы-метафазы, являются циклин-киназные комплексы (англ. M-Cdk). Данные комплексы представляют собой гетеродимеры, состоящие из двух субъединиц: регуляторной - митотического циклина (англ. M cyclin) и каталитической - циклин-зависимой киназы (англ. Cdk - cyclin-dependent kinase).
В регуляцию митоза у всех эукариот вовлечена циклин-зависимая киназа Cdk1, которая представляет собой фермент (фосфорилазу), модифицирующий белки за счёт переноса фосфатной группы от АТФ на аминокислоты серин и треонин. Концентрация Cdk1 постоянна на протяжении всего клеточного цикла, поэтому активность циклин-зависимой киназы в процессе митоза зависит главным образом от её соединения с митотическим циклином. Концентрация митотических циклинов увеличивается по мере приближения к митозу и достигает максимума в метафазе. Различным таксонам свойственны различные митотические циклины. Так, у почкующихся дрожжей в регуляцию митоза вовлечены четыре циклина Clb1, 2, 3 и 4; у дрозофилы - циклины A, B, B3; у позвоночных - циклин B.
Патология митоза.
Патология митоза развивается при нарушении нормального течения митотического деления и зачастую приводит к возникновению клеток с несбалансированными кариотипами, следовательно, ведёт к развитию мутаций и анеуплоидии. Также в результате развития отдельных форм патологии наблюдаются хромосомные аберрации. Незавершённые митозы, прекращающиеся по причине дезорганизации или разрушения митотического аппарата, приводят к образованию полиплоидныхклеток. Полиплоидия и формирование дву- и многоядерных клеток возникают в случае нарушений механизмов цитокинеза. При значительных последствиях патологии митоза возможна гибель клетки.
В нормальных тканях патология встречается в незначительных количествах. Например, в эпидермисе мышей встречается около 0,3% патологических митозов; в эпителии гортани и матки человека - около 2%. Патологические митозы часто наблюдаются при канцерогенезе, при различных экстремальных воздействиях, при лучевой болезни или вирусной инфекции, при раке и предраковых гиперплазиях. Частота патологических митозов также увеличивается с возрастом.
Условно различают патологию митоза функционального и органического типа. К функциональным нарушениям относят, например, гипореактивность вступающих в митоз клеток - снижение реакции на физиологические регуляторы, определяющие интенсивность пролиферации нормальных клеток. Органические нарушения возникают при повреждении структур, участвующих в митотическом делении (хромосомы, митотический аппарат, клеточная поверхность), а также при нарушении процессов, связанных с данными структурами (репликация ДНК, образование веретена деления, движение хромосом, цитокинез).
Предполагается, что сложный митотический процесс высших организмов развивался постепенно из механизмов деления прокариот. Это предположение подтверждается тем, что прокариоты появились приблизительно на миллиард лет раньше первых эукариот. Кроме того, в митозе эукариот и бинарном делении прокариот принимают участие схожие белки.
Возможные промежуточные стадии между бинарным делением и митозом можно проследить у одноклеточных эукариот, у которых в ходе деления не разрушается ядерная мембрана. У большинства же других эукариот, в том числе растений и животных, веретено деления формируется вне ядра, а ядерная оболочка разрушается в течение митоза. Хотя митоз у одноклеточных эукариот ещё недостаточно изучен, можно предположить, что он произошёл от бинарного деления и в конечном счёте достиг того уровня сложности, который имеется у многоклеточных организмов.
У многих простейших эукариот митоз также остался процессом, связанным с мембраной, однако теперь уже не плазматической, а ядерной. Возможно, в связи с увеличением размера и числа хромосом, структура типа мезосомы разделилась на два элемента: ЦОМТ на ядерной оболочке и кинетохор на хромосоме. Для соединения данных структур между собой в процессе эволюции развилась промежуточная система микротрубочек. В рамках данного представления, наиболее древним и примитивным считается закрытый внутриядерный плевромитоз. Сегрегация хромосом при этом происходит путём расхождения ЦОМТ, к которым хромосомы крепятся посредством микротрубочек. В свою очередь, ЦОМТ закреплены на ядерной оболочке и расходятся за счёт роста ядерной мембраны между ними.
От разных вариантов закрытого внутриядерного плевромитоза, вероятно, берут своё начало несколько параллельных эволюционных линий. В качестве эволюционно прогрессивных признаков при этом рассматриваются: распад ядерной оболочки во время митоза; переход ЦОМТ из ядра в цитоплазму; образование биполярного веретена; усиление спирализации хромосом; формирование экваториальной пластинки в метафазе. Таким образом, эволюция митотического деления идёт в направлении от закрытого внутриядерного плевромитоза к открытому ортомитозу.
Эндомитоз представляет собой разновидность митоза без деления ядра или клетки, в результате чего в клетке накапливается множество копий одних и тех же хромосом, собранных в одном ядре. Этот процесс может также включать эндоредупликацию, а клетки в этом случае называются эндоплоидными. Примером клеток, подвергающихся эндомитозу, могут служить мегакариоциты, дающие начало тромбоцитам.
Крайним случаем эндомитоза является образование гигантских политенных хромосом, появляющихся как результат многократного воспроизведения хромосом без последующего расхождения. Такие хромосомы встречаются в слюнных железах некоторых насекомых, у личинок двукрылых в ядрах клеток кишечника и у некоторых растений в ядрах синергид (например, гороха) .
Митоз происходит в следующих случаях:
· Рост и развитие. Количество клеток в организме в процессе роста увеличивается благодаря митозу. Это лежит в развитии многоклеточного организма из единственной клетки - зиготы, а также роста многоклеточного организма.
· Перемещение клеток. В некоторых органах организма, например, коже и пищеварительном тракте, клетки постоянно отшелушиваются и заменяются новыми. Новые клетки образуются путём митоза, а потому являются точными копиями своих предшественников. Схожим путём происходит замена красных кровяных клеток - эритроцитов, имеющих короткую продолжительность жизни - 4 месяца, а новые эритроциты формируются путём митоза.
· Регенерация. Некоторые организмы способны восстанавливать утраченные части тела. В этих случаях образование новых клеток часто идёт путём митоза. Например, благодаря митозу морские звёзды восстанавливают утраченные лучи.
· Бесполое размножение. Некоторые организмы образуют генетически идентичное потомство путём бесполого размножения. Например, гидры размножаются бесполым способом при помощи почкования. Поверхностные клетки гидры подвергаются митозу и образуют скопления клеток, называемые почками. Митоз продолжается и в клетках почки, и она вырастает во взрослую особь. Сходное клеточное деление происходит при вегетативном размножении растений.
Лекция 16. Мейоз.
Мейо́з (от др.-греч. - уменьшение), или редукционное деление, клетки - деление ядра эукариотической клетки с уменьшением числа хромосом в два раза. Происходит в два этапа (редукционный и эквационный этапы мейоза). Мейоз происходит в половых клетках и связан с образованием гамет.
С уменьшением числа хромосом в результате мейоза в жизненном цикле происходит переход от диплоидной фазы к гаплоидной. Восстановление плоидности (переход от гаплоидной фазы к диплоидной) происходит в результате полового процесса.
В связи с тем, что в профазе первого, редукционного, этапа происходит попарное слияние (конъюгация) гомологичных хромосом, правильное протекание мейоза возможно только в диплоидных клетках или в чётных полиплоидах (тетра-, гексаплоидных и т. п. клетках). Мейоз может происходить и в нечётных полиплоидах (три-, пентаплоидных и т. п. клетках), но в них, из-за невозможности обеспечить попарное слияние хромосом в профазе I, расхождение хромосом происходит с нарушениями, которые ставят под угрозу жизнеспособность клетки или развивающегося из неё многоклеточного гаплоидного организма.
Этот же механизм лежит в основе стерильности межвидовых гибридов. Поскольку у межвидовых гибридов в ядре клеток сочетаются хромосомы родителей, относящихся к различным видам, хромосомы обычно не могут вступить в конъюгацию. Это приводит к нарушениям в расхождении хромосом при мейозе и, в конечном счете, к нежизнеспособности половых клеток, или гамет (основным средством борьбы с этой проблемой является применение полиплоидных хромосомных наборов, поскольку в данном случае каждая хромосома конъюгирует с соответствующей хромосомой своего набора). Определённые ограничения на конъюгацию хромосом накладывают и хромосомные перестройки (масштабные делеции, дупликации, инверсии или транслокации).
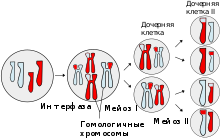
Фазы мейоза.
Мейоз состоит из 2 последовательных делений с короткой интерфазой между ними.
· Профаза I - профаза первого деления очень сложная и состоит из 5 стадий:
· Лептотена, или лептонема - упаковка хромосом, конденсация ДНК с образованием хромосом в виде тонких нитей (хромосомы укорачиваются).
· Зиготена, или зигонема - происходит конъюгация - соединение гомологичных хромосом с образованием структур, состоящих из двух соединённых хромосом, называемых тетрадами или бивалентами и их дальнейшая компактизация.
· Пахитена, или пахинема - (самая длительная стадия) - в некоторых местах гомологичные хромосомы плотно соединяются, образуя хиазмы. В них происходит кроссинговер - обмен участками между гомологичными хромосомами.
· Диплотена, или диплонема - происходит частичная деконденсация хромосом, при этом часть генома может работать, происходят процессы транскрипции (образование РНК), трансляции (синтез белка); гомологичные хромосомы остаются соединёнными между собой. У некоторых животных в ооцитах хромосомы на этой стадии профазы мейоза приобретают характерную форму хромосом типа ламповых щёток.
· Диакинез - ДНК снова максимально конденсируется, синтетические процессы прекращаются, растворяется ядерная оболочка; центриоли расходятся к полюсам; гомологичные хромосомы остаются соединёнными между собой.
К концу профазы I центриоли мигрируют к полюсам клетки, формируются нити веретена деления, разрушаются ядерная мембрана и ядрышки.
· Метафаза I - бивалентные хромосомы выстраиваются вдоль экватора клетки.
· Анафаза I - микротрубочки сокращаются, биваленты делятся, и хромосомы расходятся к полюсам. Важно отметить, что, из-за конъюгации хромосом в зиготене, к полюсам расходятся целые хромосомы, состоящие из двух хроматид каждая, а не отдельные хроматиды, как в митозе.
· Телофаза I - хромосомы деспирализуются и появляется ядерная оболочка.
Второе деление мейоза следует непосредственно за первым, без выраженной интерфазы: S-период отсутствует, поскольку перед вторым делением не происходит репликации ДНК.
· Профаза II - происходит конденсация хромосом, клеточный центр делится и продукты его деления расходятся к полюсам ядра, разрушается ядерная оболочка, образуется веретено деления, перпендикулярное первому веретену.
· Метафаза II - унивалентные хромосомы (состоящие из двух хроматид каждая) располагаются на «экваторе» (на равном расстоянии от «полюсов» ядра) в одной плоскости, образуя так называемую метафазную пластинку.
· Анафаза II - униваленты делятся и хроматиды расходятся к полюсам.
· Телофаза II - хромосомы деспирализуются и появляется ядерная оболочка.
В результате из одной диплоидной клетки образуется четыре гаплоидных клетки. В тех случаях, когда мейоз сопряжён с гаметогенезом (например, у многоклеточных животных), при развитии яйцеклеток первое и второе деления мейоза резко неравномерны. В результате формируется одна гаплоидная яйцеклетка и три так называемых редукционных тельца (абортивные дериваты первого и второго делений).
У некоторых простейших мейоз протекает иначе, чем описанный выше типичный мейоз многоклеточных. Например, может протекать только одно, а не два последовательных, мейотических деления, а кроссинговер - проходить во время другой фазы мейоза. Предполагается, что такой одноступенчатый мейоз примитивен и предшествовал возникновению двухступенчатого мейоза, обеспечивающего эффективную рекомбинацию генома.
Значение мейоза.
· У организмов, размножающихся половым путём, предотвращается удвоение числа хромосом в каждом поколении, так как при образовании половых клеток мейозом происходит редукция числа хромосом.
· Мейоз создает возможность для возникновения новых комбинаций генов (комбинативная изменчивость), так как происходит образование генетически различных гамет.
· Редукция числа хромосом приводит к образованию «чистых гамет», несущих только один аллель соответствующего локуса.
· Расположение бивалентов экваториальной пластинки веретена деления в метафазе 1 и хромосом в метафазе 2 определяется случайным образом. Последующее расхождение хромосом в анафазе приводит к образованию новых комбинаций аллелей в гаметах. Независимое расхождение хромосом лежит в основе третьего закона Менделя.
Десенситизация рецепторов.
При многократной аппликации действующего вещества наблюдается уменьшение клеточного ответа. Впервые явление десенситизации было исследовано при изучении действия ацетилхолина в нервно-мышечном препарате лягушки. Оказалось, что оно определяется свойствами самого рецептора, поскольку модулируется при его фосфорилировании. Десенситизация обратима: так, повторная аппликация агониста через 15 минут после его удаления вызывает ответ, сравнимый по величине с первоначально наблюдаемым.
В физиологических условиях десенситизация холинергической передачи в нервно-мышечном синапсе не играет существенной роли. В то же время десенситизация в некоторых ГАМК- и глутаматергических синапсах является важным фактором, определяющим активность в постсинаптической клетке. Десенситизация характерна и для метаботропных рецепторов, функционирование которых опосредуется G-белками. В этом случае модуляция активности рецепторов осуществляется за счет их фосфорилирования А-киназой или специфическими киназами, связанными с G-белком.
Этапы исследования
Независимо от выбранного метода молекулярно-генетического исследования, оно будет включать в себя следующие этапы:
· взятие биоматериала. Как уже было сказано, чаще для исследования используют кровь пациента. Полученный материал маркируют и транспортируют в лабораторию;
· выделение ДНК/РНК;
· проведение исследований в соответствии с выбранным методом;
· изучение и интерпретацию результатов;
· выдачу заключения.
Микрочипирование.
Этот метод похож на предыдущий - здесь так же используются меченные флуоресцентом последовательности ДНК. Однако эти зонды сначала выделяют из проб, полученных от пациента, и затем сравнивают с образцами, нанесенными на микрочипы. ДНК-микрочип представляет собой основание (стеклянное, пластиковое, гелевое), на которое может быть нанесено до нескольких тысяч микротестов длиной от 25 до 1000 нуклеотидов. Полученные после очистки биоматериала пробы (зонды) совмещают с микротестами на чипе и наблюдают за реакцией маркёров. Результаты исследования готовы через 4–6 дней после забора материала.
Для анализа используется любой биоматериал, из которого можно получить образец ДНК/РНК. Используют такой метод в онкологии и кардиологии, в том числе, для изучения генетической предрасположенности, он точен и чувствителен, однако в России его применяют редко - в этом его главный минус.
Раздел 11. Биотехнология.
Конспекты лекций по молекулярной биологии.
Дата: 2019-03-05, просмотров: 246.