Специфика электролиза расплавов определяется в основном строением и свойствами электролитов. В настоящее время жидкость при незначительном перегреве выше температуры плавления принято считать близкой по строению к твердому веществу. При плавлении не происходит резкого изменения многих свойств вещества.
Относительное возрастание объема чаще всего не превышает 10% (что соответствует увеличению расстояния между частицами всего на 3,3%). Теплота плавления для солей в 8-10 раз меньше теплоты испарения, следовательно, меньше и изменение энтропии при плавлении. Энтропия, как известно, является мерой упорядоченности системы. Теплоемкость расплава мало отличается (при малых перегревах) от теплоемкости твердой соли (вблизи температуры плавления). Поэтому можно предположить, что в расплавах сохраняются те же типы связей между частицами, что и в кристаллах,
Структура кристалла характеризуется наличием дальнего порядка, т. е. правильным расположением частиц во всем объеме кристалла. При переходе в жидкое состояние дальний порядок исчезает. Однако ближайшее окружение каждого атома остается в основном таким же, как в твердом теле. Движение частиц жидкости сводится к колебанию около среднего положения равновесия. Это равновесие носит временный характер, так как увеличение объема при плавлении и увеличение вследствие этого свободного объема облегчает переход частиц в соседнее положение равновесия. Период колебания частиц жидкости около положения равновесия оценивается в 10-13 сек, а время «оседлой» жизни частиц 10-11 сек.
Для чистых ионных расплавов солей (галоидные соли щелочных металлов) с малой поляризацией ионов единственной структурной составляющей является ион (анион и катион).
Непосредственным подтверждением сохранения ближнего порядка в растворах является рентгеноструктурный анализ жидкостей. Расширение жидкости происходит вследствие образования вакантных мест (дырок). Дырки уменьшают координационное число и создают свободу перемещения частиц жидкости друг относительно друга. Расстояние максимального сближения центров катиона и аниона при плавлении не только не увеличивается (по сравнению с этим расстоянием в кристалле), а чаше уменьшается.
Между чисто ионными солями (в узлах решетки - ионы, например, типа NaCl) и чисто молекулярными солями (в узлах решетки - молекулы, например SiCl4) находится большая группа солей, в которой ковалентность связи нарастает постепенно. При плавлении таких солей полного распада на ионы не происходит, и структурными единицами в расплаве являются ионы типа ZnCl+, ZnСl3- и т. п. Предполагают, что структура автокомплексных ионов зависит от отношения величин обобщенных моментов ионов ne/r. Если обобщенный момент катиона в соли велик по сравнению с моментом аниона, часть катионов выступает в роли комплексообразователей, и распад соли на ионы можно представить схемой
2МеХ « Ме+ + МеХ2-.
При большом обобщенном моменте аниона образуется автокомплексный катион:
2МеХ « Ме2X+ + Х-.
При очень большой разнице в обобщенных моментах катионов и анионов возникают полностью «закрытые» незаряженные комплексы - молекулы, расплав становится молекулярным, не проводящим тока. По мере роста ковалентности увеличивается доля молекул в расплаве.
В чисто ионных расплавах движение совершается путем перескока отдельного иона из одного равновесного положения в соседнюю дырку. В солях, состоящих из группировок ионов (автокомплексных ионов), можно представить три возможных вида перемещения ионов: перескок отдельного иона от одной группировки к другой, перемещение всей группировки ионов в соседнее свободное пространство путем перескока и перемещение путем вращения.
Плавкость солевых систем
Для успешного проведения электролиза расплавленных солей в большинстве случаев важно иметь электролиты с минимальной температурой плавления. Температура плавления связана с энергией решетки соли.
Энергию решетки соединений, имеющих ионы типа инертного газа, приблизительно рассчитывают по уравнению А. Ф. Капустинского:
U = 256(n+ + n-)/rк + ra ккал/г-экв,
где n - валентность; r - радиус, А.
Чем выше энергия кристаллической решетки, тем выше должна быть температура для расплавления соли. Следовательно, для соединений, описываемых формулой Капустинского, температура плавления падает по мере роста суммы радиусов катиона и аниона (табл. 39).
Таблица 39
Зависимость температуры плавления галогенидов металлов I и II групп от радиуса ионов
| Катион | rк, Å | Температура плавления, °С | |||
| F-, 1,33 Å | Cl-, 1,813 Å | Br-, 1,96 Å | I-, 2,20 Å | ||
| Li+ | 0,78 | 870 | 614 | 549 | 443 |
| Na+ | 0,98 | 997 | 800 | 755 | 651 |
| K+ | 1,33 | 846 | 790 | 734 | 680 |
| Rb+ | 1,49 | 780 | 715 | 681 | 642 |
| Cs+ | 1,65 | 683 | 646 | 610 | 600 |
| Be+2 | 0,34 | 800 | 404 | ||
| Mg+2 | 0,78 | 1270 | 718 | ||
| Ca+2 | 1,06 | 1478 | 772 | ||
| Sr+2 | 1,27 | 1190 | 868 | ||
| Ba+2 | 1,43 | 1280 | 958 | ||
Для фторидов, бромидов и хлоридов Cs-Na указанная закономерность выполняется. Падение температуры плавления для солей лития связано с большой поляризующей способностью лития, и частичной ковалентностью связи. Для иодидов падение температуры плавления начинается с натрия, так как даже ион Na+ способен поляризовать большой анион I-.
Увеличение доли ковалентной связи приводит к увеличению сил притяжения внутри каждой пары ионов и уменьшению этих сил между парами (направленность ковалентной связи), что и приводит к снижению прочности кристалла.
Для металлов второй группы увеличение суммы радиусов ионов приводит к повышению температуры плавления, так как двухзарядные ионы оказывают сильное поляризующее действие на анионы, а чем меньше радиус иона, тем большее поляризующее действие он оказывает (хлорид бериллия, например, в расплавленном состоянии не проводит ток, что подтверждает ковалентный характер связи). Увеличение радиуса двухвалентного иона уменьшает его поляризующую способность (особенно по отношению к F-), поэтому повышение температуры плавления в ряду двухвалентных ионов прекращается у CaF2. Для хлоридов (С1- поляризуется сильнее F-) зависимость температуры плавления от суммы радиусов имеет монотонный характер'.
По периодам периодической системы температура плавления солей меняется следующим образом:
| NaF | 997° С | AlF3 | Возгоняется без плавления |
| MgF2 | 1360° С | SiF4 | -77° С |
Вначале уменьшение радиуса катиона и увеличение его заряда приводят к упрочнению решетки соли и повышению температуры плавления, которая затем уменьшается вследствие роста доли ковалентности связи.
Для металлов, имеющих несколько степеней окисления, уменьшение валентности приводит чаще всего к понижению ковалентности связи и повышению прочности решетки (и температуры плавления):
| UF6 | 64,05° С | SnCl4 | 30,2° С | PbCl4 | 15° С | TiCl4 | 30° С |
| UF5 | 348° С | SnCl2 | 247° С | PbCl2 | 501° С | TiCl2 | 400° С |
| UF4 | 1036° С |
Окислы большинства металлов имеют ионные решетки, что обусловливает высокую температуру плавления. При плавлении смеси двух солей температура плавления зависит от состава смеси. Рассмотрим наиболее простые типы диаграмм плавкости двойных систем. На рис. 75 представлены три простейших типа таких диаграмм. Диаграммы плавкости описывают равновесия в гетерогенных системах.
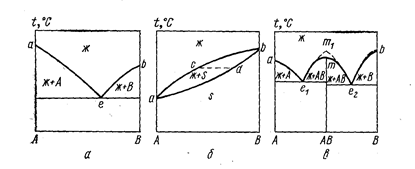
Рис. 75. Простейшие типы диаграмм плавкости двойных систем (Баймаков Ю. В., Ветюков М. М., 1966, с. 43, рис. б):
a- эвтектический тип; б- непрерывный ряд твердых растворов; в- с конгруэнтно плавящимся химическим соединением.
Выражение правила фаз [уравнение (40)] для солевых систем имеет вид
F = k - ф + l.
На диаграмме эвтектического типа (см. рис. 75, а) над линией ликвидиуса аеb имеется раствор веществ А и В друг в друге (одна фаза, два компонента, F = 2). Эта область дивариантна, в ней можно произвольно менять оба параметра - температуру и состав. На линиях ае и be жидкость находится в равновесии с кристаллами А и В - система моновариантна (изменив состав для сохранения числа фаз, необходимо двигаться по линии ае или be). В эвтектической точке е, когда в равновесии находятся три фазы – жидкость + А + В, система становится нонвариантной - нельзя произвольно менять ни состав, ни температуру без нарушения равновесия.
В случае неограниченной взаимной растворимости компонентов в жидком и твердом состояниях (см. рис. 75,6) система моновариантна. Раствор, состав которого выражается, например, точкой с, находится в равновесии с гомогенным твердым раствором, состав которого выражается точкой d. При кристаллизации смеси состава с фигуративная точка жидкой фазы движется от с к а, а твердой фазы - от d к a.
Если компоненты А и В обладают неограниченной растворимостью в жидком состоянии и образуют химическое соединение АВ в твердом состоянии, на линии ликвидуса должны быть три ветви, пересекающиеся между собой: две ветви кристаллизации чистых компонентов и ветвь кристаллизации химического соединения. При этом возможны два случая: состав жидкой фазы, образующейся при плавлении химического соединения, совпадает с составом его в твердом виде - конгруэнтное плавление (соединение АВ называется конгруэнтным) или состав соединения не совпадает с составом жидкой фазы, образующейся при его плавлении, - инконгруэнтное плавление. В случае конгруэнтного плавления на диаграмме плавкости соединению АВ отвечает максимум (дистектака), а диаграмму можно разбить на две части А-АВ и АВ-В, которые идентичны простым эвтектическим диаграммам (см. рис. 75, в). Обычно при плавлении химического соединения происходит частичный термический распад: АВ«А+В. Чем больше степень распада, тем больше радиус кривизны линии ликвидуса в дистектике. При отсутствии распада над химическим соединением линия ликвидуса претерпевает излом (точка m1).
В случае инконгруэнтного плавления (плавление малопрочных соединений) на диаграмме плавкости имеется «скрытый» максимум.
Полная взаимная растворимость в жидком и твердом состояниях (см. рис. 75,б) свидетельствует о близости структуры солей. Обычно такой тип диаграммы наблюдается для смесей солей чисто ионного строения с общим анионом или в том случае, если катионы близки по своим поляризационным свойствам (поляризующая сила и поляризуемость). Примеры системы: NaCl-KCl; Na2SO4-Li2SO4 и т. д.
Если кристаллические решетки индивидуальных солей смеси различаются значительно, возможны случаи полного смешения в жидком состоянии и раздельная эвтектическая кристаллизация в твердом.
Когда в смеси АХ-ВХ один из катионов (например, В"+) обладает большим зарядом и меньшим радиусом, силы связи Вn+—Х- будут больше, чем А+—Х-. Ион Вn+ выступает в качестве комплексообразователя, и образуется достаточно прочная группировка ВХm(m-n)-, в то время как катион А+ остается относительно свободным. Комплексообразование проявляется тем отчетливее, чем больше различие в поляризационных свойствах катионов. Диаграмма плавкости такой системы часто имеет вид, представленный на рис. 75, в.
Дата: 2019-03-05, просмотров: 835.