Изучение антигенов эритроцитов составляет период длительностью более ста лет. Группоспецифические антигены были обнаружены в связи с аллогенными гемотрансфузиями и нарушением гомеостаза организма при попадании в него чужеродных антигенов. Поэтому наиболее очевидной была иммунологическая функция этих структур. Успехи биохимии, в частности мембранологии, молекулярной биологии, позволили получить представление об общебиологических функциях антигенов групп крови. Установлено, что они участвуют в переносе веществ в клетку, служат рецепторами экзогенных лигандов, вирусов, бактерий, паразитов, выполняют ферментативную роль, участвуют в адгезии различных молекул, выполняют структурную роль в биомембране. В настоящее время изучена иммуногенная активность более 250, а, по мнению других авторов – 450 антигенных детерминант-групп крови.
Группы крови, образованные антиген-антительным представительством, выполняют исключительно важную роль в жизнедеятельности человека как биологического вида. Групоспецифические полисахариды, подобные групповым антигенам человека, широко распространены в природе. Их находят
у животных, растений, бактерий. Контакт с этими веществами в процессе естественного отбора привел к дифференцировке человека как вида на 4 типа по содержанию или отсутствию антигенов А и В. Люди, не содержащие антигены А и В, имеют α- и β-антитела.
Групповые антигены крови человека называют агглютиногенами, так как они обычно выявляются реакцией агглютинации. Агглютиногены являются составной частью клеточных структур форменных элементов крови (гликопротеины клеточной мембраны), но некоторые из них могут находиться в водорастворимой форме в плазме крови, слюне, желудочном соке, моче, тканевой и других жидкостях организма. Антигены, аналогичные агглютиногенам крови, имеются в клетках других тканей. Наиболее богаты
12
групповыми антигенами и антителами ткани и жидкости генеративных органов, где они обезвреживают антитела, препятствующие оплодотворению и развитию плода. Четвертое место по содержанию групповых антигенов и антител занимает кровь – эритроциты и плазма.
Агглютиногены обладают следующими свойствами:
1) иммуногенностью, т. е. способностью вызывать образование иммунных антител при поступлении антигена в организм, не имеющего его;
2) специфичностью (серологической активностью), т. е. способностью вступать с соответствующим антителом в иммунологическую реакцию, такую, как агглютинация, преципитация и флокуляция.
Разные антигены обладают этими свойствами в разной мере, и у кого-то более выражено одно из них, у кого-то - другое. Антигены могут быть полноценными, если они обладают обоими указанными свойствами, и неполноценными (гаптены), если они обладают одним из этих свойств.
Все групповые антигены являются наследственными, врожденными и не меняются в течение жизни. В большинстве групповых систем антигены полностью развиваются к моменту рождения, и активность их сохраняется на таком же уровне, как и перед рождением. Исключением являются антигены системы Левис, Р, которые слабо выражены при рождении, и антиген системы Ай, который почти совсем не развит у новорожденных. Напротив, антиген Rh 0 (D) к концу эмбрионального периода имеет активность выше, чем у взрослого человека.
Практическое значение имеют те агглютиногены крови, которые расположены на поверхности форменных элементов, ибо они являются причиной изоиммунизации (изосенсибилизации) и с этими антигенами соединяются антитела при гемотрансфузиях, вызывая агглютинацию и гемолиз. Такое расположение имеют агглютиногены систем АВО, Rh-Hr и Kell, что и явилось основной причиной подбора крови для переливания именно по этим агглютиногенным системам.
13
Международное общество переливания крови в 1980 году систематизировало антигены эритроцитов и разделило их на три категории: систему, коллекцию и серию.
Выделены:
1) системы группы крови;
2) коллекции группы крови;
3) редко встречающиеся антигены (700-е серии);
4) часто встречающиеся антигены (901-е серии).
К системам группы крови относятся: система АВО, Келл, Левис,
Даффи, резус-система и другие. Коллекция содержит антигены, которые не отвечают критериям для формирования системы группы крови. Известно 5 коллекций, содержащих 11 антигенов. Эритроцитарные антигены, которые не принадлежат к системам или коллекциям группы крови, сортируются на две серии: если они редки (частота менее 1%), они находятся в 700-й серии, если они являются общими (частота выше 90%), они помещаются в 901 серии.
Закономерности наследования позволяют объединить известные группы крови в 25 генетически дискретных систем. Буквы алфавита используют для обозначения антигенов системы АВО и резус (С, Д, Е). Новые антигены назывались по имени первого обладателя антител к неизвестному ранее
антигену: Левис (Le a , Le b , Le c , Le d ), Сцианна (Sc1, Sc2, Sc3), Даффи (Fy a ,
Fy b ), Домброк (D 0 ), Колтон (Co a , Co b , Co c ), Гербих (Ge), Кромер (Crom), Кнопс (Kn), Диего (Di a , Di b ), Келл (K, k, Kp a , Kp b , Js a Js b ) и другие. Короткий символ – первые буквы полного названия: Rh, Le (Lewis), Lu (Lutheran) и другие. Для обозначения системы Kidd взяты инициалы ребенка Ik (Iohn Kidd), родившегося с гемолитической анемией к неизвестному антигену Kidd на его эритроцитах. Ряд систем и антигенов именованы географическими названиями тех мест, где впервые были обнаружены: Индиан (In), Бомбей. Антиген S системы MNS – от Sidney. Современная номенклатура антигенов включает исторические названия и цифровые обозначения для автоматизированного
считывания. Почти все известные антигены из диаллельных превратились в 14
полиаллельные, насчитывающие десятки антигенов. Были обнаружены слабые и редко встречающиеся антигены, относящиеся особенно к системе АВО и Rh: А 2 , А 3 , А х , А u , А m , Аcl, Аend, B 3 , В х , В m , Д u , С u , С х , E u и другие.
Антигены многих эритроцитарных систем (АВО, Rh, P, Levis) экспрессированы не только на мембране эритроцитов, но и на мембранах клеток практически всех тканей организма человека, а также определяются в биологических жидкостях, что используется в судебно-медицинской практике для идентификации личности.
Тромбоцитарные антигены
Тромбоциты – функционально специализированные клетки, структура и метаболизм которых направлены на выполнение их главной функции - первичного гемостаза. Они также относятся к безъядерным клеткам крови, изучаются уже около ста двадцати лет. Известно, что они проходят путь формирования от коммитированных, морфологически неидентифицированных КОЕ-мегакариоцитов, клеток предшественников, образуя мегакариобласт, далее - промегакариоцит, мегакариоцит до получения популяции неоднородных безъядерных клеток – тромбоцитов: зрелых (87%), юных (3,2%), старых (4,5%), форм раздражения (2,5%).
В кровяном русле тромбоциты могут находиться пристеночно, а также в токе крови.
Тромбоциты содержат:
• антигены AB0, резус, P, Le и I одинаковые с эритроцитарными;
• HLA антигены, принадлежащие к 1 классу (на каждом тромбоците содержится приблизительно 80 000 ± 20 000 молекул HLA);
• свои собственные уникальные антигены HPA (Human Platelet Antigens), в основном участвующие в клоттинговых реакциях.
15
Система антигенов HPA содержит 26 антигенов. Наиболее полно изучены органоспецифические аллоантигены, принадлежащие к 5 локусам (HPA-1-HPA-5), каждый из которых объединяет аллельные гены – Zw или PIA, Ko или Sib, Bak, Yuk или Pen и Br.
Часто встречающийся аллельный антиген обозначен символом «а», редко встречающийся – символом «b».
Антигены HPA-1а встречаются у 97,9% лиц белой расы, HPA-1b - у 28,8%. HPA-2а встречаются более 99,9%, HPA-2b - 13,2% и т. д.
Чужеродный (аллогенный) антиген может попасть в организм реципиента при переливании компонентов донорской крови, в том числе тромбоцитов; трансплацентарно при беременности; при аллотрансплантации костного мозга.
Посттрансфузионная сенсибилизация реципиентов происходит не только после транфузии тромбоцитов, но и при переливаниях эритроцитной массы недостаточно очищенной от примесей тромбоцитов и лейкоцитов.
Повторные же трансфузии тромбоцитов, если они проводятся без соответствующего подбора совместимого донора, способствуют активному антитромбоцитарному антителогенезу, из-за которого вновь перелитые тромбоциты лизируются, и трансфузионная терапия оказывается неэффективной. Кроме того, не восприятие перелитых тромбоцитов, их лизис влечёт за собой развитие определенных патологических состояний у реципиента, получивших название посттрансфузионных реакций и осложнений негемолитического типа (температура, озноб, состояние рефрактерности к перелитым тромбоцитам).
Типичными клиническими симптомами являются кожные геморрагии, гематурия. Иногда наблюдаются сильные кровотечения из внутренних органов, кровоизлияние в мозг.
Выявление тромбоцитспецифических антител имеет не только теоретическое значение как доказательство иммуногенности тромбоцитарных антигенов системы HPA, но и практическую значимость, которая заключается в возможности профилактики сенсибилизации и посттрансфузионных
16
осложнений за счёт подбора совместимых доноров по HPA-антигенам тромбоцитов, что повышает эффективность проводимой трансфузионной терапии.
Сложная структурная организация тромбоцитов - обилие биологически активных соединений с различным характером действия - обеспечивает выполнение ими следующих функций:
1. Ангиотрофическая функция тромбоцитов способствует нормальной проницаемости и резистентности стенок микрососудов. Тромбоциты поддерживают или восстанавливают сосудистую стенку посредством процесса реэндотелизации у места повреждения. На ангиотрофическую функцию расходуется ежедневно около 15% циркулирующих в сосудах тромбоцитов. Дефицит тромбоцитов приводит к дистрофии эндотелия сосудов, он становится проницаем для плазмы и эритроцитов. В клинике повышенная проницаемость (ломкость) капилляров сопровождается мелкими кровоизлияниями (петехиями). При выраженной тромбоцитопении развивается геморрагический синдром.
2. Адгезивно-агрегационная функция обусловлена способностью тромбоцитов прилипать (адгезия) к субэндотелиальным структурам поврежденной сосудистой стенки и образовывать сначала скопления (агрегация), а затем тромбоцитарную пробку. Формирование первичной тромбоцитарной пробки в зоне повреждения сосудов возникает вследствие процесса, который можно условно разделить на 3 стадии:
• адгезия тромбоцитов к субэндотелиальным структурам через рецепторы ГПIα и ГПVI к коллагену эндотелия, а при высокой скорости кровотока и через фактор Виллебранда, фибронектин, витронектин, ламинин, тромбоспондин и другие адгезивные белки;
• активация этих тромбоцитов с выбросом медиаторов из гранул хранения;
• агрегация – последующая активация, рекрутирование и фиксация в зоне повреждения дополнительных тромбоцитов.
17
3. Сорбционно-транспортная функция тромбоцитов состоит в адсорбции ими на своей поверхности и доставке к месту кровотечения плазменных факторов свертывания, таких как фибриноген, фактор VIII и другие, а также биологически активных веществ, например, серотонина и антикоагулянтов, циркулирующих иммунных комплексов.
4. Активация плазменного гемостаза происходит за счет тромбоцитарных факторов, освобождающихся при дегрануляции тромбоцитов. Под влиянием стимуляторов тромбоциты подвергаются адгезии на субэндотелии сосудов, активируются, изменяют форму, образуют псевдоподии и объединяются в рыхлый агрегат. Он уплотняется, происходит дегрануляция и освобождение содержимого гранул. В процессе реакции под действием тромбина – индуктора агрегации – освобождаются аденозиндифосфорная кислота (АДФ), серотонин тромбоцитов, происходит синтез тромбоксана. Последний индуцирует вторичную необратимую агрегацию тромбоцитов. Высвобождающиеся внутриклеточно ионы Са++ играют роль пускового механизма реакции сокращения контрактильных белков и участвуют в изменении формы тромбоцитов, активации реакции освобождения факторов и АТФ-азной активности тромбостенина. При разрушении тромбоцитов формируется фактор 3, который осуществляет связь между образованием тромбоцитарного тромба и включением в процесс свертывания плазменных факторов.
5. Ретракция кровяного сгустка – функция тромбоцитов, обеспечивающая уплотнение сгустка и выделение из него избытка сыворотки, что способствует улучшению механических характеристик сгустка и снижению активности фибринолиза внутри него. Ретракция сгустка связана с контрактильными свойствами тромбоцитов. В активированных тромбоцитах за счет миозина происходит процесс постепенного «сжимания» цитоплазмы, что приводит к уплотнению всего сгустка
крови. В процессе ретракции тромбоциты прилипают к нитям фибрина, 18
одновременно в тромбоцитах освобождается тромбостенин, который вызывает сокращение нитей фибрина. В результате их взаимодействия образуется первичный тромб.
Тромбоциты способы вызвать локальную вазоконстрикцию, стимулировать репарацию тканей, участвуют в регулировании местной воспалительной реакции за счет высвобождения соответствующих медиаторов из пулов хранения. Главная функция тромбоцитов – первичная остановка кровотечения. При малых травмах они могут обеспечивать окончательный гемостаз.
Антигены лейкоцитов
МНС – (major histocompability complex) главный комплекс гистосовместимости - обеспечивает соматическую индивидуальность и иммунореактивность организма. Молекулы МНС играют решающую роль в событиях меж- и внутриклеточного уровня, лежащих в основе иммунного ответа на этапе распознавания чужеродного агента (афферентный этап) и ответа на антиген (эфферентный этап).
Эта система особо значима при трансфузии крови, трансплантации тканей
и органов, т. к. отвечает за распознавание своих и чужих клеток. Установлено, что HLA-система более широко экспрессирована в организме, чем АВ0 антигены. Она обеспечивает иммунные ответы на антигенные стимулы, координацию клеточного и гуморального иммунитета. Следует отметить роль HLA-системы в качестве поверхностных клеточных маркеров, распознаваемых цитотоксическими Т-лимфоцитами и Т-хелперами в комплексе с антигеном. Молекулы, кодируемые частью области генов МНС (комплексом Тla), вовлечены в процессы дифференцировки, особенно у эмбриона, а возможно, и в плаценте. МНС принимает участие в самых разных неиммунологических процессах, многие из которых опосредованы гормонами. Молекулы МНС
19
класса I могут входить в состав гормональных рецепторов, связывая инсулин, глюкагон, эпидермальный фактор роста и гамма-эндорфин.
МНС представлен семейством генов, расположенных в сегменте р 21.3 короткого плеча шестой хромосомы.
HLA-антигены находятся в лимфоцитах, нейтрофилах, тромбоцитах, в клетках различных органов и тканей и в меньшей степени в эритроцитах и плазме крови.
При определенных условиях выявляется взаимосвязь между HLA-фенотипом и различными заболеваниями. Несколько механизмов, возможно, связывают HLA-систему и болезни, особенно те из них, в которых установлена или предполагается роль иммунного ответа на микроорганизм:
1) гены, детерминирующие HLA-антигены одновременно являются генами, контролирующими иммунный ответ, поскольку при связывании чужеродных антигенов HLA-молекулы осуществляют взаимодействие между антигенами и Т-клетками;
2) антигенная структура некоторых HLA-молекул может иметь сходство с определенными вирусами и способна привести к изменению иммунного ответа на эти вирусы;
3) некоторые HLA-антигены представляют собой рецепторы для определенных вирусов.
Определение связи между различными заболеваниями и антигенами HLA
позволит выделить группы повышенного риска развития болезни, установить категории больных с особенностями течения болезни с сочетанием различных форм патологии, провести дифференциальную диагностику заболеваний, в ряде случаев определить их прогноз и оптимальную тактику лечения, выявить гиперчувствительность к абакавир-содержащим препаратам у ВИЧ-инфицированных больных.
Особую роль играет фенотипическое сходство HLA при трансплантации органов и тканей: почек, печени, желудка, легкого, сердца. Уровень совместимости коррелирует с выживаемостью трансплантата.
20
Антитела крови человека
Групповые изоантитела (агглютинины) крови представляют собой молекулы гамма-глобулина, образующие 5 классов. Наиболее значимы групповые антитела (иммуноглобулины) классов: IgM; IgG; IgA.
Первыми при иммунизации появляются IgM (5-10%). Они наиболее активны в реакции с антигенами – это первая линия защиты, но быстро разрушаются, период их полураспада составляет 5-8 дней.
Вторая линия защиты – IgG (70-85% всех Ig плазмы). Появляются вслед за IgM. Имеют самую маленькую белковую молекулу и длительно циркулируют (период полураспада составляет 25 дней). Типичными представителями антител класса IgG являются антирезусные антитела.
Одни из них агглютинины обладают способностью агглютинировать одноименные антигены крови (свойство агглютинабельности) – склеивание и разрушение эритроцитов, наступающее через несколько минут или часов. Другие цитолизины (гемолизины, лейколизины, тромбоцитолизины), фиксируясь на эритроцитах, лейкоцитах или тромбоцитах вызывают их гемолиз без предварительного склеивания, но с обязательным участием комплемента. Наибольшее практическое значение имеют антиэритроцитарные агглютинины. Кроме того, бывают антитела преципитины (взаимодействуют с белковыми антигенами, выпадая в осадок).
По механизму образования антитела подразделяются на естественные, или врожденные (генетически обусловленные и существующие в течение всей жизни, например α- и β-агглютинины) и иммунные, или приобретенные (появляются у некоторых людей в какой-либо период жизни в результате иммунизации чужеродными для них антигенами крови, например, анти-А, анти-Rh агглютинины). Возможны следующие пути иммунизации: переливание иногруппной крови – трансфузионный путь; гетероспецифическая беременность – трансплацентарный путь (мать Rh-
21
отрицательная, а плод Rh-положительный). В норме плацента не пропускает эритроциты, и иммунизация невозможна. В результате травмы или заболевания, а также во время родов кровь плода может попадать к матери и происходит иммунизация, у нее вырабатываются антирезусные антитела, которые при следующей беременности могут проходить через плаценту к плоду
и приводить к гемолизу его эритроцитов); пересадка органов и тканей без учета их групповой совместимости – трансплантационный путь; введение вакцин и сывороток – инъекционный путь; иммунизация пищевыми продуктами – энтеральный путь. Появление иммунных анти-А, реже анти-В антител
возможно у практически здоровых людей, например, после введения противостолбнячной сыворотки, которая содержит антиген А. У женщин Оαβ(I) группы после беременности плодом Аβ(II) второй, Вα(III) третьей групп крови в 10-12% случаев регистрируются иммунные антитела.
Иммунные антитела, как правило, находятся в высоком титре и при переливании крови иммунизированного донора, они в кровотоке реципиента не подвергаются достаточному разведению, не блокируются водорастворимыми антигенами его плазмы и вступают в непосредственный контакт с антигенами эритроцитов реципиента, приводя к их агглютинации
Агглютинины не столь постоянны, как агглютиногены. Так, в системе АВО они не выражены при рождении и развиваются лишь в течение первого года жизни. К концу первого года их титр становится устойчивым, а полного развития они достигают к 18 годам. В старости же их титр снижается. В связи с этим у детей до 4-месячного возраста нельзя использовать перекрестный способ определения групп крови, т. е. группу крови можно определять только по цоликлонам и нельзя по стандартным эритроцитам.
По специфичности выделяют: аутоантитела – направлены против собственных антигенов. При патологии иммунной системы они разрушают клетки крови, вызывая аутоиммунную лейкопению, тромбоцитопению, аутоиммунную гипопластическую анемию. Встречаются очень редко;
22
аллоантитела (изоантитела) – антитела против антигенов крови человека, чужеродных данному индивидууму (типичный представитель – антирезусные антитела).
По температурному оптимуму активности агглютинины могут быть холодовыми или тепловыми. Холодовые антитела (например, α и β) наиболее активны при температуре +4° - +6° С (реакция возможна и при температуре, не превышающей +25° - +30° С) и не активны при температуре +37° С и выше. Вот почему определение групп крови по системе АВО проводят при комнатной (низкой) температуре. Тепловые антитела, в свою очередь (например, антирезусные антитела), более активны при температуре +37° С и выше. В связи с этим определение резус-принадлежности осуществляется в условиях термостата при температуре +46° - +48° С. Однако пробы на совместимость можно проводить при комнатной температуре с применением коллоидной среды.
В зависимости от среды, в которой агглютинины вызывают реакцию агглютинации соответствующих агглютиногенов, их подразделяют на полные
и неполные антитела. Полные антитела (IgM, например, α и β) способны вызывать реакцию агглютинации одноименных агглютиногенов и в солевой (физиологический раствор поваренной соли), и в коллоидной средах. В связи с этим при определении групп крови по системе АВО к реагентам добавляется физиологический раствор хлористого натрия. Схематично реакция агглютинации с полными агглютининами представлена на рис. 1.1.
23
Эритроциты с
Полные
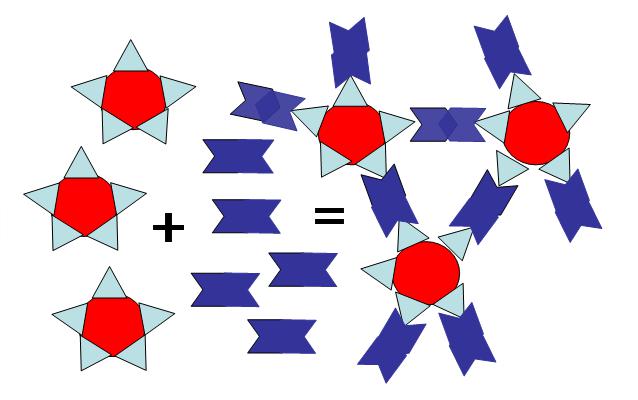
Агглютинация
рецепторами
агглютинины
Рисунок 1.1 - Схема агглютинации эритроцитов полными агглютининами
Неполные агглютинины (IgG, таковыми чаще бывают анти-А, анти-В, антирезусные антитела) не могут вызывать реакцию агглютинации соответствующих агглютиногенов в солевой среде, эта реакция возможна лишь
в присутствии коллоида (сыворотка, полиглюкин, желатина) либо при других определенных условиях (предварительное разведение, обработка эритроцитов ферментами). Среди них выделяют: неполные агглютинирующие, неполные скрытые и неполные блокирующие агглютинины. В живом организме они оказываются в благоприятных условиях и дают отчетливо проявляющуюся реакцию антиген-антитело. При попытке обнаружить их вне организма
24
подходящие для реакции условия, близкие по температуре и коллоидным свойствам циркулирующей крови, приходится создавать искусственно. Так, неполные агглютинирующие антитела могут быть обнаружены только в высокомолекулярной (коллоидной) среде. Вот почему при определении резус-принадлежности крови с помощью стандартной антирезусной сыворотки, содержащей неполные антитела, исследуемые эритроциты следует брать в виде взвеси в их собственной сыворотке, добавлять 33% раствор полиглюкина или 10% желатина (рис. 1.2). Неполные скрытые антитела – это агглютинины, находящиеся в сыворотке в чрезвычайно высоком титре (1:512 - 1:2048), препятствующем агглютинации «соседних» эритроцитов, несмотря на их встречу с одноименными агглютининами. Это явление получило название «феномена зоны». Вызвать агглютинацию и обнаружить неполные скрытые антитела при пробе на индивидуальную совместимость или определение группы крови стандартными эритроцитами возможно лишь после предварительного разведения в 8-16 раз и более сыворотки человека, анамнестически заподозренного в сенсибилизации. Разведение производится коллоидным раствором (чаще сывороткой АВ(IV) группы) (рис. 1.3). Неполные блокирующие антитела отличаются способностью адсорбироваться на эритроцитах без агглютинации. Эти антитела обнаруживаются с помощью антиглобулиновой сыворотки (непрямая проба Кумбса), а в случае скрытых антител – непрямой пробой Кумбса с разведением в 8-16 раз. Антиглобулиновую сыворотку получают путем иммунизации животных сывороткой человека. В результате этого у них образуются иммунные антитела против белков человека (антиглобулиновые антитела), и сыворотка, их содержащая, вызывает преципитацию неполных блокирующих антител, адсорбированных на эритроцитах. При этом эритроциты механически вовлекаются в реакцию склеивания, что выражается их агглютинацией (рис. 1.4).
25
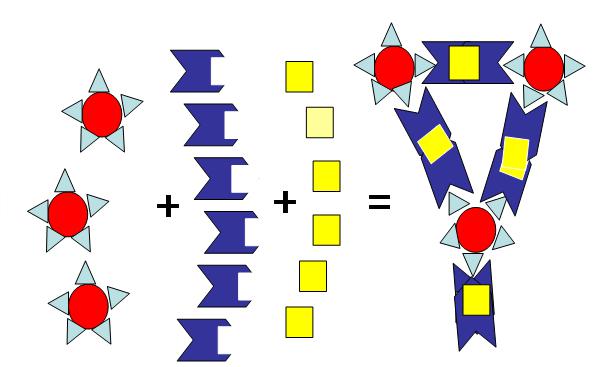
Эритроциты Неполные Коллоидный Агглютинация
с агглютини-раствор
рецепторамирующие агглютинины
Рисунок 1.2 - Схема агглютинации эритроцитов неполными
Дата: 2019-03-05, просмотров: 343.