с = µс/µ; соб = 22,4/ µс
Значение теплоёмкостей
| Атомность газов | µср | µсv |
| Двухатомный | 29,3 | 20,9 |
| Трёхатомный и более | 37,7 | 29,3 |
Газовые смеси
Под смесью идеальных газов понимают смесь не вступающих в химическое взаимодействие газов (воздух, природный газ, продукты сгорания).
Все газовые законы применимы к газовой смеси.
Давление, которое оказывает газовая смесь, определяется по закону Дальтона:
р = ∑рi
Важнейшей характеристикой газовой смеси является её состав, который может быть выражен массовыми и объёмными долями.
1. Массовая доля mi = 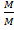
2. Объёмная доля ri = 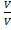
Vсм = ∑Vi ∑ri = 1 ∑mi = 1
Молекулярная масса газовой смеси
1. Через объёмные доли
µсм = ∑µiri
2. Через массовые доли
µсм = 1/∑ 
Газовая постоянная смеси
Rсм = 
Удельный объём смеси
υ = 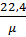
η = 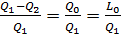
Задача 9. Определить массу кислорода в баллоне 75 дм3 при давлении 9,8 МПа и температуре 200 С.
Дано: Решение:
V = 75 дм3 = 0,075 м3 PV = МRT
P = 9,8 Мпа = 9,8 * 106 Па RO 8310 Дж
t = 200 С; Т = 20 + 273 = 293 К R = μ = 32 = 259,7 кг К
М - ? PV 9,8 * 106 * 0,075
μ = RT = 259,7 * 293 = 9,6 кг
Задача 10. Дымовые газы, образовавшиеся в топке парового котла, охлаждаются с температуры 12000 С до температуры 2500 С. Во сколько раз уменьшится их объем, если давление газов в начале и конце газохода одинаково ?
Дано: Решение:
t1 = 12000C, T1 = 1200 + 273 = 1473 K V 1 T 1 1473
t2 = 2500 C, T2 = 250 + 273 = 523 K V2 = T2 = 523 = 2,85 раз
V 1
V2
Задача 11. Определить массовую изобарную теплоемкость газа СО2
μ Ср 37,7 кДж
Ср = μ = 44 = 0,85 кг К
к ДЖ
μ Ср = 37,7 моль К; μ (СО2) = 12 + 16 * 2 = 44
Задача 12. Баллон емкостью 0,6 м3 заполнен газом С2Н4 при температуре 170 С. Присоединенный к баллону, вакуумметр показывает давление 65 кПа. Определить массу газа в баллоне. Атмосферное давление принят равным 99 кПа.
Дано: Решение:
V = 0,6 м3 PV = MRT
T = 170 С, Т = 17 + 273 = 290 К PV
Pвак = 65 кПа = 65 * 103 Па M = RT
Pа = 99 кПа = 99 * 103 Па Pабс = Ра – Рв аб = (99 – 65) 103 = 34 * 103 Па
M - ? R 0 8310 Дж
R = μ = 28 = кг К
μ (С2Н4) = 12 * 2 + 1 * 4 = 28
34 * 103 * 0,6
М = 296,8 * 290 = 0,23 кг
Тема 2.2. Термодинамические процессы. Законы термодинамики.
Студент должен
знать: основные термодинамические процессы и законы термодинамики;
уметь: рассчитывать термодинамические процессы.
Термодинамические процессы. Работа расширения газа и внутрянняя энергия. Теплота. Первый закон термодинамики, его сущность и формулировка. Энтропия газов. p-v, T-s и h-s диаграммы и графическое изображение в них термодинамических процессов.
Энтальпия газа. Изотермический, изобарный, изохорный, адиабатный и политропный процессы, их анализ.
Второй закон термодинамики, его сущность и формулировка. Круговые процессы и циклы. Прямой и обратный циклы. Термический КПД цикла и холодильный коэффициент. Прямой и обратный циклы Карно.
Вопросы для самоконтроля
Что такое энтальпия и энтропия газов?
Какие бывают термодинамические процессы.
Формулировка и математическое выражение первого закона термодинамики.
Дата: 2019-02-19, просмотров: 460.