Зависимость скорости химической реакции от температурыопределяется правилом Вант-Гоффа и уравнением Аррениуса.
Правило Вант-Гоффа:
при увеличении температуры на каждые 100 скорость химической реакции возрастает в 2-4 раза.
Математически это запишется следующим образом:
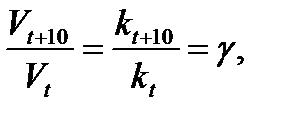 (7)
(7)
где: Vtи kt – скорость и константа скорости химической реакции при температуре t; Vt+10и kt+10 – скорость и константа скорости химической реакции при температуре t+10; g – температурный коэффициент скорости химической реакции, показывающий, во сколько раз увеличивается скорость реакции при увеличении температуры на 10 градусов; для большинства реакций значения g = 2 ÷ 4.
В общем случае, когда температура процесса изменилась на Dt, уравнение (7) можно преобразовать к виду
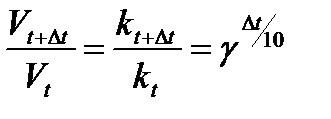 . (8)
. (8)
Уравнения (7) и (8) лишь приближенно оценивают зависимости V = f ( t ) и k = f ( t ). Функциональная зависимость константы скорости химической реакции (скорости химической реакции) от температуры была установлена шведским ученым Св. Аррениусом (1889 г.). Она выражается уравнением, названным в его честь уравнением Аррениуса:
k= Ae-Ea/RT, (9)
где: А – предэкспоненциальный множитель; ЕА – энергия активации химической реакции.
А и ЕА являются важными характеристиками каждой химической реакции. Выясним физический смысл этих величин.
Предэкспоненциальный множитель
А = р·z, (10)
где z – число соударений молекул реагирующих веществ в единице объема за единицу времени; р – стерический (вероятностный) фактор, учитывает влияние пространственной ориентации молекул на скорость реакции (или константу скорости). Значения р меняются в широких пределах: 10-9 ÷1. Малые значения р отвечают реакциям между сложными по своей структуре органическими соединениями.
Энергия активации химической реакции
Не все сталкивающиеся молекулы взаимодействуют с образованием продуктов реакции, а только те активные молекулы, которые обладают достаточной энергией, чтобы разорвать или ослабить связи в исходных молекулах, создав возможность образования новых молекул.
Например, при химическом взаимодействии: H2 + I2 = 2HI должны разорваться связи Н-Н и I-I и образоваться связи Н-I. В некоторый момент времени возникает переходное состояние, когда одни связи не полностью разорвались, а другие уже начали формироваться.
Такой нестабильный ассоциат называетсяактивным (активированным) комплексом. Его образование можно представить следующей схемой:
Н I Н · · · I Н-I
| + | → ∶ ∶ →
Н I H · · · I Н-I
Исходные вещества Активный Продукты реакции
комплекс
Для образования активного комплекса нужно преодолеть некоторый энергетический барьер, затратив энергиюЕА. Эта энергия и есть энергия активации – некоторая избыточная энергия, по сравнению со средней при данной температуре энергией, которой должны обладать молекулы для того, чтобы их столкновения были эффективными.
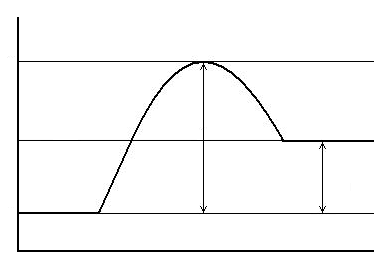
| Активный комплекс А…В |
| А+В |
| C+D |
| Еа |
| Е’ |
| Е2 |
| Е1 |
| ΔH>0 |
| б) |
| Рис. 6.2. Энергетическая диаграмма для реакции: а) экзотермической; б) эндотермической |
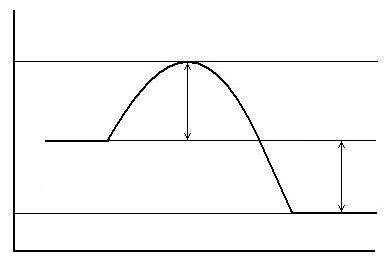
| Координата реакции |
| Е’ |
| Е1 |
| Е2 |
| Активный комплекс А…В |
| А+В |
| ΔH<0 |
| C+D |
| Еа |
  |
В общем случае для химической реакции А + В = С +Д переход от исходных веществ А и В к продуктам реакции С и Д через состояние активного комплекса А + В = А¼В = С + D схематически можно представить в виде энергетических диаграмм (рис. 6.2).
Энергия активации ЕА – один из основных параметров, который характеризует скорость химического взаимодействия. Она зависит от природы реагирующих веществ. Чем больше ЕА, тем меньше (при прочих равных условиях) скорость реакции. При повышении температуры число активных частиц сильно возрастает, благодаря чему резко увеличивается скорость реакции.
Обычно реакции между веществами с прочными ковалентными связями характеризуются большими значениями ЕА и идут медленно, например:
| а) взаимодействия между органическими веществами | Скорость этих процессов при стандартных условиях близка к нулю |
| б) H2 + 1/2О2 = H2О | |
| в) N2 + 3H2 = 2NH3 |
Низкими значениями ЕА и очень большими скоростями характеризуются ионные взаимодействия в растворах электролитов. Например:
Ca+2 + SO 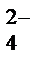 = CaSO4.
= CaSO4.
Объясняется это тем, что разноименно заряженные ионы притягиваются друг к другу и не требуется затрат энергии на преодоление сил отталкивания взаимодействующих частиц.
Влияние катализатора
Изменение скорости реакции под воздействием малых добавок особых веществ, количество которых в ходе процесса не меняется, называется катализом.
Вещества, изменяющие скорость химической реакции, называютсякатализаторами (вещества, изменяющие скорость химических процессов в живых организмах – ферменты).
Катализатор в реакциях не расходуется и в состав конечных продуктов не входит.
Химические реакции, протекающие в присутствии катализатора, называются каталитическими. Различают положительный катализ – в присутствии катализатора скорость химической реакции возрастает– иотрицательный катализ (ингибирование) – в присутствии катализатора (ингибитора) скорость химической реакции замедляется.
Примеры:
1. Окисление сернистого ангидрида в присутствии платинового катализатора:
Pt
2SO2 + O2 = 2SO3 – положительный катализ.
2. Замедление процесса образования хлороводорода в присутствии кислорода:
О2
H2 + Cl2= 2HCl – отрицательный катализ.
Различают: а) гомогенный катализ – реагирующие вещества и катализатор образуют однофазную систему; б) гетерогенный катализ – реагирующие вещества и катализатор образуют систему из разных фаз.
Дата: 2019-02-19, просмотров: 373.