Известно, что все химические процессы сопровождаются тепловыми эффектами.
Тепловым эффектом химической реакции называется теплота, выделяемая или поглощаемая в результате превращения исходных веществ в количествах, соответствующих уравнению химической реакции.
При этом единственной работой является работа расширения, а исходные вещества и продукты реакции должны иметь одинаковую температуру.
Независимость теплоты химической реакции от пути процесса при р = const и Т = const (A = pDV) впервые была установлена в 1836 г. русским ученым Г.И. Гессом. Эта закономерность известна как закон Гесса:
тепловой эффект химической реакции не зависит от пути ее протекания, а зависит лишь от природы и физического состояния исходных веществ и продуктов реакции.
Закон составляет теоретическую основу термохимии – раздела химической термодинамики, в котором вычисляются тепловые эффекты различных физико-химических процессов: химических реакций, фазовых переходов, процессов растворения и кристаллизации и т. д.
Следует помнить, что все термохимические расчеты проводятся при стандартных условиях: Т = 298 К (25 0С), р = 101,3 кПа (1 атм.), например: DН0298 – стандартная энтальпия.
В термохимии уравнение химической реакции записывается с указанием теплового эффекта реакции (энтальпии) и агрегатного состояния веществ. Эти уравнения называют термохимическими уравнениями:
Н2(г) + Cl2(г) = 2HCl(г) DН0298 = - 184,6 кДж.
В термодинамике принято:
- в экзотермических процессах теплота выделяется, для них DН < 0 и DU < 0 (теплосодержание и внутренняя энергия системы уменьшаются);
- в эндотермических процессах теплота поглощается, для них DН > 0 и DU > 0 (теплосодержание и внутренняя энергия системы возрастают).
При выяснении природы самопроизвольного протекания процессов(без воздействия извне) было установлено, что самопроизвольные реакции сопровождаются экзотермическим эффектом ( 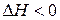 ). Однако связь между снижением энтальпии системы (энтальпийный фактор) и ее самопроизвольностью является недостаточным фактором.
). Однако связь между снижением энтальпии системы (энтальпийный фактор) и ее самопроизвольностью является недостаточным фактором.
В термохимических расчетах широко используются три следствия из закона Гесса.
Первое следствие:
тепловой эффект прямой реакции равен тепловому эффекту обратной реакции с противоположным знаком:DНпр.= - DНобр.
Второе следствие:
тепловой эффект реакции равен разности между суммой теплот (энтальпий) сгорания исходных веществ и суммой теплот (энтальпий) сгорания продуктов реакции с учетом стехиометрических коэффициентов веществ, участвующих в процессе:
DНр.= S(ni . DНсг i)исх.-S(ni. DНсг i)прод., (10)
где ni – стехиометрический коэффициент дляi-того вещества в уравнении реакции, ∆Нсг i– теплота (энтальпия) сгорания i-того вещества.
Теплота (энтальпия) сгорания – количество теплоты, которое выделяется при полном сгорании одного моля вещества до высших окислов при данных условиях (р, Т).
Численные значения теплот сгорания определяются по справочным изданиям.
Третье следствие:
тепловой эффект реакции равен разности между суммой теплот (энтальпий) образования продуктов реакции и суммой теплот (энтальпий) образования исходных веществ с учетом стехиометрических коэффициентов веществ, участвующих в процессе:
DНр.= S(ni . DНобр. i)прод.-S(ni. DНобр. i)исх., (11)
где ni –стехиометрический коэффициент для i-того вещества в уравнении реакции, ∆Нобр. i – теплота (энтальпия) образования i-того вещества.
Под теплотой (энтальпией) образования понимается тепловой эффект реакции образования 1 моль вещества из простых веществ (измеряется в кДж/моль).
Обычно используют стандартные энтальпии образования; их обозначают DН0обр,298 или DН0f,298 (часто один из индексов опускают и обозначают, например, DН0298). Стандартные энтальпии простых веществ, устойчивых в стандартных условиях (газообразный кислород, жидкий бром, кристаллический йод, ромбическая сера, графит и т.д.) принимаются равными нулю.
Численные значения теплот (энтальпий) образования определяются по справочникам.
Энтропия
Если на систему оказать внешнее воздействие, в системе происходят определенные изменения. Если после снятия этого воздействия система может вернуться в первоначальное состояние, то процесс является обратимым. Если после снятия внешнего воздействия систему и окружающую среду нельзя вернуть в первоначальное состояние, то процесс – необратимый.
Процессы, протекающие без подвода энергии от внешнего источника, называются самопроизвольными. Например: падение камня с высоты, переход тепла от более нагретого тела к менее нагретому, стекание воды по желобу. При этом система из более упорядоченного состояния переходит в состояние менее упорядоченное и более вероятное.
Самопроизвольные процессы в обратном направлении не могут протекать самопроизвольно, т.е. самопроизвольно камень не полетит вверх, теплота не перейдет от холодного тела к нагретому, а вода не потечет вверх по желобу.
Многие химические процессы также протекают самопроизвольно, например, образование ржавчины на железе, растворение соли в воде и др. Каковы движущие силы и критерии самопроизвольных процессов?
Частицам (молекулам, атомам, ионам) присуще стремление к беспорядочному движению, поэтому система стремится перейти из более упорядоченного состояния в менее упорядоченное.
Например:если баллон с газом (состояние I) соединить с сосудом, то газ из баллона будет распределяться по всему объему сосуда (состояние II). При этом система из более упорядоченного состояния (с меньшим беспорядком) переходит в состояние менее упорядоченное (с большим беспорядком).
Количественной мерой беспорядка системы является термодинамическая функция состояния - энтропия (S).
Ее численное значение можно определить следующим образом:
S = R·T·lnW, (12)
т.е. энтропия пропорциональнаlnW,
где W – термодинамическая вероятность состояния системы или число вероятных микросостояний, которыми может быть реализовано данное макросостояние;W> 1.
При переходе системы из более упорядоченного состояния в менее упорядоченное (из состояния I в состояние II) энтропия системы возрастает, т.е. DS = S2 – S1 > 0.
Переход системы из менее упорядоченного состояния в более упорядоченное (из состояния II в состояние I) без воздействия извне невозможен. Такой процесс называется несамопроизвольным. В рассматриваемом примере представляется невероятным, чтобы газ сам собой собрался в баллоне. Очевидно, что в этом случае энтропия системы уменьшается:
DS=S2–S1< 0,т.е.:
- все процессы, протекающие с уменьшением порядка в расположении частиц, сопровождаются увеличением энтропии, являются самопроизвольными процессами (процессы растворения, плавления, испарения, нагревания);
- все процессы, протекающие с увеличением порядка в расположении частиц, сопровождаются уменьшением энтропии, являются несамопроизвольными процессами (процессы конденсации, кристаллизации, охлаждения).
Таким образом, II закон термодинамики можно сформулировать:
в изолированной системе самопроизвольные процессы протекают в сторону увеличения энтропии, DS> 0.
Системы, в которых протекают химические реакции, не являются изолированными, т.к. они сопровождаются тепловым эффектом, т.е. системы обмениваются энергией с окружающей средой. В неизолированных системах возможны процессы, в которых энтропия понижается. Например, при отводе тепла в окружающую среду расплав или стекло могут закристаллизоваться, а пар сконденсироваться (т.е. DS< 0).
В отличие от энтальпии, для любого вещества абсолютное значение энтропии можно вычислить либо определить экспериментальным путем. Энтропии веществ принято относить к стандартным условиям: Т = 298 К;Р = 101,3 КПа. Обозначают S0298 и называют стандартной энтропией. Энтропия вещества измеряется в Дж/моль.К.
Значениями энтропии веществ пользуются для определения изменения энтропии системы в результате соответствующих реакций. Например, для реакции, записанной в общем виде: аА +вВ + … = dD + eE + …
изменение энтропии выразится:
DS = (dSD+eSE + …) – (aSA + bSB+ …) = S(ni·Si)прод.-S(ni· Si)исх. (13)
Энтропия системы измеряется в Дж/К.
Свободная энергия Гиббса
Все химические реакции обычно сопровождаются изменением и энтропии, и энтальпии. Связь между энтальпией и энтропией системы устанавливает термодинамическая функция состояния, которая называется свободной энергией Гиббса или изобарно-изотермическим потенциалом(G).Она характеризует направление и предел самопроизвольного протекания процессов в изобарно-изотермических условиях (р = const и Т = const). С энтальпией и энтропией системы свободная энергия Гиббса связана соотношением
G = H – TS. (14)
Абсолютное значение измерить невозможно, поэтому используется изменение функции в процессе протекания того или иного процесса:
DG = DH – TDS. (15)
Свободная энергия Гиббса измеряется в кДж/моль и кДж. Физический смысл свободной энергии Гиббса: свободная энергия системы, которая может быть превращена в работу. Для простых веществ свободная энергия Гиббса принимается равной нулю.
Стремление системы к понижению потенциальной энергии называется энергетическим или энтальпийным фактором. Количественно эта тенденция системы выражается через тепловой эффект процесса, т. е. значением 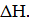
Стремление системы к возрастанию энтропии называется энтропийным фактором. Этот фактор проявляется тем сильнее, чем выше температура. Количественно энтропийный фактор можно оценить произведением 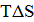 .
.
Из рассмотренного выше следует, что в химических процессах одновременно действуют две тенденции: стремление частиц объединяться за счет прочных связей в более сложные, что уменьшает энтальпию системы, и стремление частиц разъединиться, что увеличивает энтропию. Иными словами, проявляется действие двух прямо противоположных факторов –энтальпийного ( 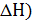 и энтропийного
и энтропийного 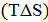 .
.
Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных температуре и давлении, отражает функциясостояния системы DG.
Знак изменения свободной энергии Гиббса DG и ее величина при Р = const определяют термодинамическую устойчивость системы:
- если в химическом процессе происходит снижение свободной энергии Гиббса, т.е. DG < 0, процесс может протекать самопроизвольно, или говорят: процесс термодинамически возможен;
- если продукты реакции имеют больший термодинамический потенциал, чем исходные вещества, т.е. DG > 0, процесс протекать самопроизвольно не может, или говорят: процесс термодинамически невозможен;
- если DG = 0, то реакция может протекать как в прямом, так и в обратном направлении, т.е. реакция обратима.
Следовательно, самопроизвольные процессы при Р=constидут с уменьшением свободной энергии Гиббса. Этот вывод справедлив как для изолированных, так и для открытых систем.
Изменение энергии Гиббса системы при образовании 1 моль вещества из простых веществ, устойчивых в данных условиях, называется энергией Гиббса образования вещества DGобр., измеряется в кДж/моль.
Если вещество находится в стандартных условиях, то энергия Гиббса образования называется стандартной энергией Гиббса образования вещества (DG0обр.298). Стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю.
Значения DG0обр.298 веществ приводятся в справочниках.
Изменение энергии Гиббса, как и изменение энтальпии и энтропии, не зависит от пути процесса, поэтому DGлюбой химической реакции можно определить как разность между суммой энергий Гиббса образования продуктов реакции и суммой энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов:
DG0298 = S(niDG 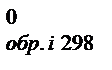 )пр.-S(niDG
)пр.-S(niDG 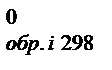 )исх. (16)
)исх. (16)
Дата: 2019-02-19, просмотров: 412.