Например, взаимодействие кальция и меди с кислородом протекает в соответствии с уравнениями реакций:
1. 2Ca + O2 = 2СaO;
2. 2Cu +O2 = 2CuO.
Первый процесс протекает со скоростью V1, второй – V2, причем, V1 >> V2.
Закон действующих масс
Зависимость скорости химической реакции от концентрации реагирующих веществ определяется законом действующих масс. Этот закон установлен норвежскими учеными Гульдбергом и Вааге в 1867 г. Он формулируется следующим образом:
при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для химической реакции, протекающей по уравнению, записанному в общем виде
аА + bВ = сС + dD, (3)
математическое выражение закона действующих масс, называемое кинетическим уравнением химической реакции,для этой реакции имеет вид;
V = k · CAa · CBb, (4)
где V – скорость химической реакции; CA, CB – молярные концентрации реагентов А и В; а и b – стехиометрические коэффициенты для реагентов А и В в уравнении реакции; k – коэффициент пропорциональности, называемый константой скорости химической реакции.
Ее физический смысл становится понятным, если принять CA= CB = 1 моль/л, тогда k = V (константа скорости численно равна скорости химической реакции при концентрациях компонентов 1 моль/л), или удельная (единичная) скорость.
Константа скорости химической реакции зависит: от природы реагирующих веществ, температуры, присутствия катализатора и не зависит от концентрации реагирующих веществ.
Для гомогенных газовых систем существует прямо пропорциональная зависимость между концентрацией газов и их парциальным давлением, определяемая уравнением Менделеева-Клапейрона:
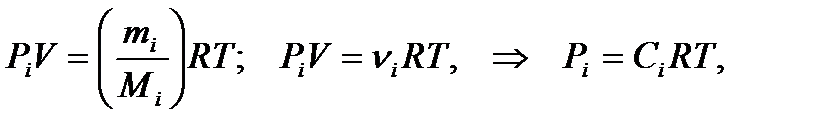 (5)
(5)
где Сi– молярная концентрация i-того компонента в системе, моль/л; Pi – парциальное давление i-того компонента в системе.
Учитывая вышесказанное, математическое выражение закона действующих масс для уравнения химической реакции (3), протекающей в газовой фазе, можно записать в виде
V = k·PAa·PBb. (6)
В случае гетерогенных реакций в математическое выражение закона действующих масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе.
Вещества, находящиеся в конденсированном состоянии (твердом или жидком), реагируют лишь на поверхности раздела фаз, которая остается неизменной, поэтому концентрация веществ (поверхностная) постоянна и входит в константу скорости. Например, для реакции горения угля:
С(тв.) + О2(г) = СО2(г)
закон действующих масс запишется:
V = k'·Cc·CО2 = k·CО2,
где k = k'·Cc.
Примеры.
1. Запишите математическое выражение закона действующих масс для гомогенной реакции:
2NO(г) + O2(г) = 2NO2(г).
Решение:V = k·СNO2·СO  или V = k·РNO2·РO
или V = k·РNO2·РO  .
.
2. Как изменится скорость химической реакции:
2NO(г) + Сl2(г) = 2NOCl(г),
если концентрацию первого реагирующего вещества увеличить в 3 раза?
Решение: до изменения условий скорость данной гомогенной химической реакции выражалась уравнением
V = k · СNO2·СCl  .
.
Концентрации веществ и скорость химической реакции при изменении условий выделим штрихом ( ' ). При изменении условий: С'NO = 3· СNO, тогда
V' = k·(С'NO)2· СCl 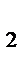 = k ·(3· СNO)2· СCl
= k ·(3· СNO)2· СCl 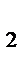 = 9· k · СNO2· СCl
= 9· k · СNO2· СCl 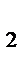 .
.
Найдем, во сколько раз изменилась скорость химической реакции при увеличении концентрации первого реагирующего вещества в 3 раза:
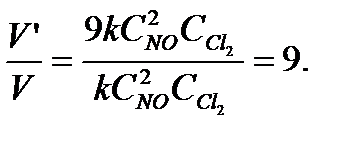
Ответ: скорость химической реакции увеличится в 9 раз.
3. Как изменится скорость химической реакции:
2S(тв.) + 3О2(г.) = 2SO3(г.),
если давление в системе уменьшить в 2 раза?
Решение: до изменения условий (уменьшение давления) скорость данной гетерогенной химической реакции выражалась уравнением
V = k · (СO 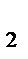 )3 = k · (РO
)3 = k · (РO 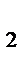 )3.
)3.
После уменьшения давления в системе в 2 раза парциальное давление кислорода, как и его молярная концентрация, также уменьшается в 2 раза: Р'O 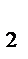 = 1/2 РO
= 1/2 РO 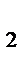 , тогда
, тогда
V' = k · (Р'O 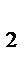 )3 = k ·(1/2РO
)3 = k ·(1/2РO 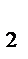 )3 = 1/8 k ·(РO
)3 = 1/8 k ·(РO 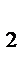 )3;
)3;
отсюда
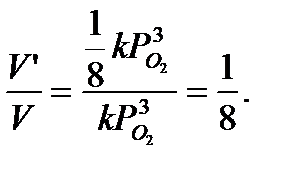
Ответ: скорость химической реакции уменьшится в 8 раз.
Дата: 2019-02-19, просмотров: 373.