Характер гибридизации валентных орбиталей центрального атома и их пространственное расположение определяют пространственную конфигурацию (геометрическую форму) молекул:
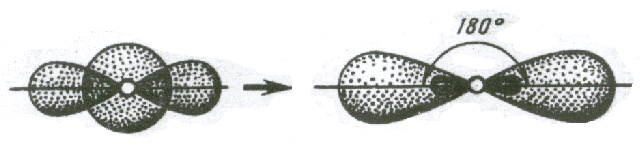
1. Если в химическую связь вступает атом, у которого на внешней оболочке имеются по одному неспаренные s- и р – электрону, то у данного атома в процессе образования связи происходит sp – гибридизация АО (рис. 3.10).
(s+p) орбитали Две sp–орбитали
Рис. 3.10. Схема sp – гибридизации
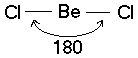
Две sp – гибридные орбитали расположены симметрично под углом 180˚, отсюда и связи, образуемые с участием электронов этих орбиталей, также располагаются под углом 180˚. Например, у атома бериллия sp – гибридизация орбиталей проявляется в молекуле BeCl2, которая вследствие этого имеет линейную форму (рис. 3.13,а)
sp – гибридизация характерна для атомов элементов II группы периодической системы (Be, Mg, Cd, Hg и т. д.), для углерода в СО2, в органических соединениях с тройной углерод – углеродной связью.
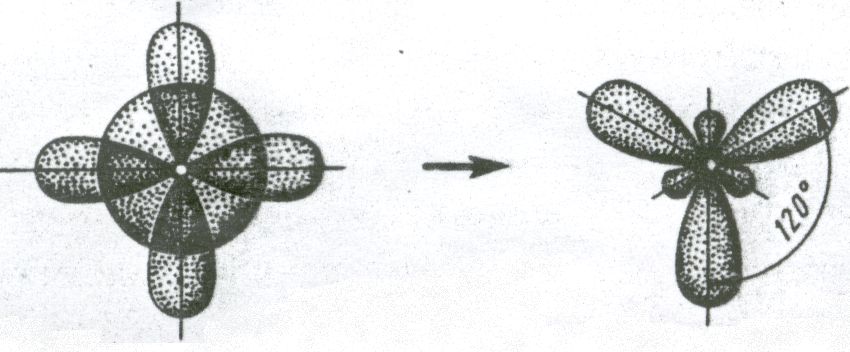
2. Если у атома, вступающего в химическую связь, на внешней оболочке имеется один s- и два p- электрона, то происходит sp2 – гибридизация АО орбиталей этого атома (рис. 3.11).
(s+p+p) – орбитали Три sp2 – орбитали
Рис. 3.11 . Схема sp2 – гибридизации
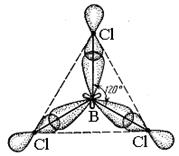
Три sp2 – гибридные орбитали расположены под углом 120˚. Под таким же углом располагаются и связи, образованные с участием электронов этих орбиталей. Например, вследствие sp2 – гибридизации орбиталей атома бора молекула BCl3 имеет треугольную форму (рис. 3.13, б). Распределение химических связей можно представить следующей схемой:
sp2 – гибридизация встречается в молекулах элементов III группы периодической системы, а также в органических соединениях с двойной углерод – углеродной связью.
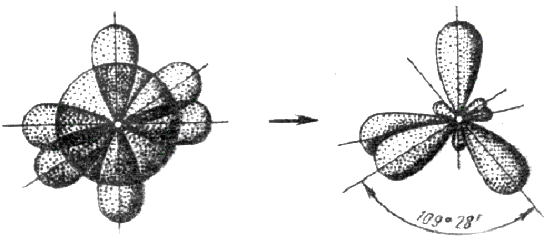
3. У атома, имеющего на внешней оболочке один s- и три р- электрона, при химическом взаимодействии происходит sp3 – гибридизация этих АО (рис. 3.12).
(s+p+p+p) – орбитали Четыре sp3 – орбитали
Рис. 3.12. Схема sp3 – гибридизации
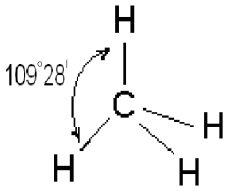
Четыре sp3 – гибридные орбитали симметрично ориентированы в пространстве под углом 109˚28′ к четырем вершинам тетраэдра (рис. 3.13, в). Тетраэдрическое расположение связей и форма тетраэдра характерны для элементов IV группы, в том числе для многих соединений углерода, например, CH4:
4. Возможны также более сложные виды гибридизации с участием d- и f-орбиталей атомов, при которых образуются молекулы ещё более сложной конфигурации.
Комбинация орбиталей типа одной s-, трех р- и одной d- приводит к sp3d-гибридизации. Это соответствует пространственной ориентации пяти sp3d-гибридных орбиталей к вершинам тригональной бипирамиды (рис. 3.13, г). В случае sp3d2-гибридизации шесть sp3d2-гибридных орбиталей ориентируются к вершинам октаэдра (рис. 3.13, д). Ориентация семи орбиталей к вершинам пентагональной бипирамиды (рис. 3.13, е) соответствует sp3d3 (или sp3d2f) – гибридизации валентных орбиталей центрального атома молекулы (комплекса).
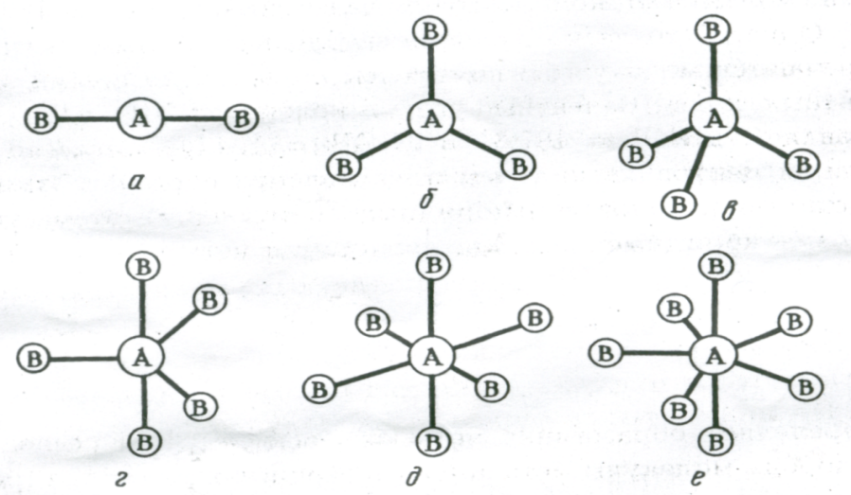
Рис. 3.13. Пространственное расположение связей и конфигурация молекул:
а – линейная; б – треугольная; в – тетраэдрическая; г – тригонально-бипирамидальная; д – октаэдрическая; е – пентагонально-бипирамидальная
Дата: 2019-02-19, просмотров: 425.