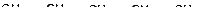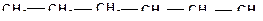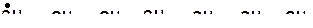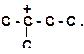На величину энергий разрыва связей «углерод-углерод» и «углерод-водород» влияют структуры и массы молекул углеводородов (табл. 2.1 и табл. 2.2).
1. В молекулах алканов энергия разрыва связи между крайним атомом углерода и водородом наибольшая в метане (431 кДж/моль), и она снижается по мере увеличения числа углеводородных атомов до 4 и затем становится постоянной (на уровне 394 кДж/моль).
2. Энергия разрыва связи «углерод-водород» зависит от характера углеродного атома – первичный, вторичный, третичный. Наиболее прочная связь «углерод-водород» у первичного атома углерода, наименее прочная у третичного атома углерода.
3. Энергия разрыва связей «углерод-водород» наибольшая у концевых групп в молекулах, по мере приближения к центру молекулы энергия связи снижается.
4. В молекуле алкенов энергия отрыва атома водорода от углеродного атома с двойной связью значительно больше, а от атома углерода, находящегося в сопряжении с двойной связью, - значительно ниже, чем энергия связи «углерод-водород» в алканах.
5. В нафтеновых кольцах прочность связи «углерод-водород» такая же, как в связях вторичного атома углерода с водородом в молекулах алканов.
6. В молекулах бензола и алкилароматических углеводородов энергия связи между атомом углерода в кольце и водородом сопоставима с прочностью связи «углерод-водород» в метане, а энергия отрыва водорода от углерода, сопряженного с ароматическим кольцом, значительно ниже, чем энергия связи «углерод-водород» в алканах.
7. Энергия разрыва связи «углерод-углерод» в молекулах всех классов углеводородов всегда ниже энергии связи «углерод-водород» (примерно на 50 кДж/моль).
8. В алкилароматических углеводородах связь «углерод-углерод», сопряженная с ароматическим кольцом (С-САР.), менее прочна, чем связь «углерод-углерод» в алканах.
9. В алкенах «углерод-углеродные» двойные связи значительно прочнее (но менее чем в 2 раза), чем связи «углерод-углерод» в алканах. Однако «углерод-углеродные» связи, сопряженные с двойной (находящиеся в b-положении), значительно слабее «углерод-углерод» связи в алканах.
Задачи и упражнения 1
1. В каждой из молекул укажите наименее прочную связь «углерод-водород»:
| а)
| |
б)
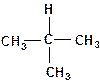
| в)
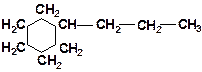
|
2. В каждой из молекул укажите наиболее прочную связь «углерод-водород»:
а)

| г)
|
б)
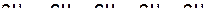
| |
в)
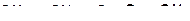
|
3. В каждой из молекул укажите наиболее прочную связь «углерод-углерод»:
а)

| б)
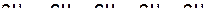
|
в)

| г)
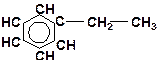
|
4. В каждой из молекул укажите наименее прочную связь «углерод-углерод»:
а)
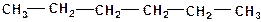
| б)

|
в)
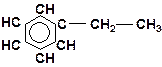
| г)
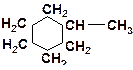
|
5. Укажите наименее прочную связь в молекулах:
а)

| б)

|
в)
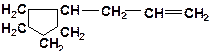
| г)
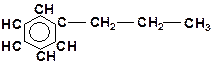
|
6. Укажите наиболее прочную (прочные) связь в молекулах:
а)
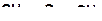
| б)
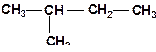
|
в)
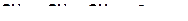
| г)
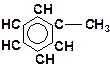
|
7. Расположите углеводороды в порядке возрастания их термической устойчивости:
| а)
| |
б)
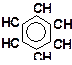
| в)
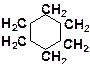
|
8. Расположите углеводороды в порядке возрастания их термической устойчивости:
а)
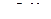
| б)

|
| в)
| |
9. Расположите углеводороды в порядке снижения их термической устойчивости:
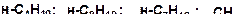
10. Расположите углеводороды в порядке снижения их термической устойчивости:
а)
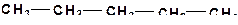
| в)
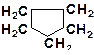
|
б)
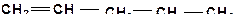
| г)
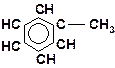
|
6.2 Радикально-цепной механизм термических реакций
нефтяного сырья
В основе процессов термолиза нефтяного сырья лежат реакции крекинга (распада) и поликонденсации (синтеза), протекающие через ряд промежуточных стадий по радикально-цепному механизму. В реакции крекинга ведущими являются короткоживущие радикалы алкильного типа, а поликонденсации – долгоживущие бензильные или фенильные радикалы.
Радикалы, имеющие неспаренные (свободные) электроны, образуются при гомолитическом распаде углеводородов путем разрыва менее прочной «углерод-углеродной» связи, а также «углерод-водородной» связи. Радикалы, являясь химически ненасыщенными частицами, обладают высокой реакционной способностью и мгновенно вступают в различные реакции.
Радикалы высокой молекулярной массы термически малостабильны и распадаются с образованием низкомолекулярного более устойчивого радикала, в том числе водородного.
Основные стадии радикально-цепного механизма рассмотрены в разделе 2.5.1.
При термолизе протекают следующие типы реакций радикалов.
1. Распад радикалов:
- Мономолекулярные реакции распада с образованием монорадикала и олефинового углеводорода.
- Распад радикалов с образованием водородного радикала энергетически менее выгоден, чем образование алкильного радикала.
- Энергетически более выгоден распад с образованием большего алкильного радикала.
- С перемещением свободной валентности ближе к центру радикала возрастает энергия, необходимая для его распада.
- Легче всего происходит распад «углерод-углеродной» связи в
b-положении к углероду, имеющему неспаренный электрон. - При распаде алкильных радикалов энергетически выгоднее образование алкадиенов и водородного радикала.
- Распад нафтенового радикала с наибольшей скоростью проходит с раскрытием кольца, а не с отрывом водорода с кольца.
- Бензильные радикалы малоактивны в реакциях распада, они склонны к реакциям рекомбинации и поликонденсации.
2. Реакции изомеризации. В процессах термолиза углеводородов происходят реакции структурной и скелетной изомеризации радикалов. Первичные радикалы изомеризуются в более стабильные вторичные.
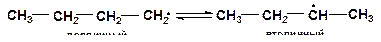
3. Реакции замещения. Обмен атомом водорода между радикалом (Н ·, СН3 ·, С2Н5 ·) (присоединяет) и молекулой углеводорода (отдает):
R · + R ¢ H ® RH + · R ¢
4. Реакции присоединения. При взаимодействии радикала с молекулой, имеющей двойную (то есть p) связь:
R · + CH 2 = CH ― R ¢ ® R ― CH 2 ― CH ― · R ¢
(например, С2Н5 · + С2Н4 ® С4Н9 ·).
5. Реакция рекомбинации, обратная реакции мономолекулярного распада молекулы на радикалы:
R · + · R ¢ ® RR ¢
(например, СН3 · + С2Н5 · ® С3Н8).
6. Реакция диспропорционирования радикалов, обратная (обратимая) по отношению к реакции бимолекулярного их образования:
СН3 · + С2Н5 · ® СН4 + С2Н4
или 2 С2Н5 · ® С2Н4 + С2Н6
Задачи и упражнения 2
1. Напишите все мономолекулярные реакции, в которые могут вступить радикалы:
а)
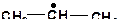
| б)
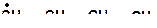
|
| в)
| |
2. Напишите все возможные реакции замещения атома водорода с углеводородами. Какая из этих реакций пойдет наиболее легко? Наиболее трудно?
а)
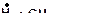
| в)

|
б)
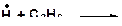
| г)
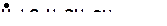
|
3. Напишите возможные реакции замещения и укажите наиболее вероятную из них:
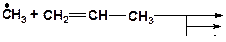
4. Напишите возможные реакции замещения и укажите наименее вероятную из них:
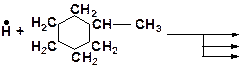
5. Напишите возможные реакции замещения и укажите наиболее вероятную из них:
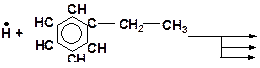
6. Напишите возможные реакции замещения и укажите наиболее вероятную из них:
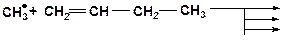
7. Напишите возможные реакции замещения и укажите наиболее вероятную из них:
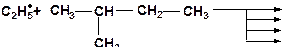
8. Напишите возможные реакции замещения и расположите в порядке возрастания трудности их осуществления:
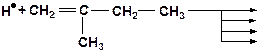
9. Напишите возможные варианты распада радикала. Какое направление распада наиболее вероятно?
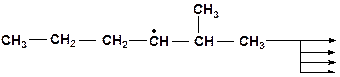
10. Напищите возможные варианты распада радикала. Какое направление распада наиболее вероятно?
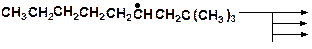
11. Какие радикалы могут образовываться при взаимодействии. Укажите возможные направления распада образующихся радикалов.
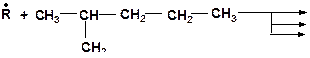
12. Какие радикалы могут образоваться при взаимодействии:
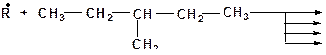
13. Какие радикалы могут образовываться при взаимодействии:
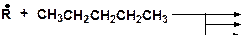
14. Напишите возможные реакции в системе:
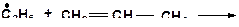
15. Напишите моно- и бимолекулярные реакции, которые могут протекать в системах:

|

|

|
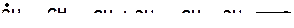
|

|
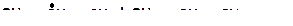
|

|
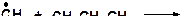
|
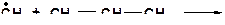
|
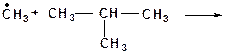
|
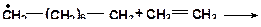
|
6.3 Карбоний ионный механизм термокаталитических
процессов переработки нефтяного сырья
Химизм превращения углеводородов в процессе каталитического крекинга углеводородов и основные реакции процесса каталитического крекинга подробно рассмотрены в разделе 3.1.4.
Основные стадии цепного карбкатионного механизма каталитического крекинга и реакции, в которые вступают карбкатионы, приведены в разделе 3.1.5.
Химические превращения углеводородов крекируемого сырья, протекающие по карбкатионному механизму на поверхности цеолитсодержащего катализатора, могут быть представлены в следующей последовательности [2]:
1. Первичные мономолекулярные реакции крекинга и деалкилирования (распад по С–С-связи) высокомолекулярных соединений исходного сырья с образованием низкомолекулярных углеводородов:
- крекинг парафинов с образованием низкомолекулярного парафина и олефина;
- крекинг олефинов с образованием низкомолекулярных олефинов;
- деалкилирование алкилароматических углеводородов;
- крекинг нафтенов с образованием олефинов.
2. Вторичные бимолекулярные реакции углеводородов на поверхности цеолита с участием карбоний ионов, образующихся присоединением протона к олефину (инициирование цепи). Стабильность карбкатионов возрастает в ряду:
СН3+ < С2Н5+ < С+перв. < С+втор. < С+трет.
Третичный карбкатион является самым стабильным, этим объясняется высокий выход изопарафиновых углеводородов, особенно изобутана.
Наиболее характерные реакции карбониевых ионов (развитие цепи): распад С–С-связи, перенос гидрид-иона (Н-перенос), изомеризация, циклизация, дециклизация, деалкилирование, алкилирование, полимеризация, поликонденсация и др.
Обрыв цепи превращений карбониевых ионов происходит возвратом протона к поверхности катализатора или отнятием электрона от центров Льюиса.
Распад С–С-связи карбкатиона – наиболее важная целевая реакция, приводящая к образованию низкомолекулярных топливных фракций и С3-С4 углеводородовв газах каталитического крекинга.
Правила распада С–С-связи карбкатиона:
- легче разрывается С–С-связь, находящаяся в b-положении по отношению к атому углерода, несущему заряд (правило
b-распада); - образующиеся олефины содержат двойную связь у первого углеродного атома;
- наиболее вероятен b-распад карбкатиона с образованием олефина с меньшей длиной цепи. Продукт первичного b-распада – карбоний-ион RCH2+ – может снова крекироваться до образования более стабильных карбкатионов или углеводородов (после отдачи протона или присоединения электрона);
- более выгодным для алкилароматических или алкилнафтеновых углеводородов является отрыв всей алкильной группы;
- поскольку образование СН3+ и С2Н5+ требует высоких энергетических затрат, цепной распад карбкатионов прерывается до образования карбониевых ионов с числом углеродных атомов 3-5.
Перенос гидрид-иона (Н-перенос) протекает следующим образом:
R ¢ H + + R ² ® + R ¢ + R ² H
Лучшими гидрид-донорами являются нафтены, полициклические нафтены или нафтено-ароматические углеводороды, изоалканы и олефины. Энергетически более выгоден отрыв гидрид-иона от третичного, затем вторичного и менее выгоден от первичного углеродного атома. Нафтеновые, алкилароматические и изопарафиновые углеводороды часто содержат третичные атомы углерода и поэтому интенсивно участвуют в реакциях Н-переноса. Акцепторами гидрид-ионов являются наименее стабильные карбоний ионы или углеводороды, содержащие несколько p-связей (диолефины). Именно Н-перенос обусловливает повышенные выход топливных фракций и химическую стабильность бензинов каталитического крекинга.
По Н-переносу осуществляются следующие реакции каталитического крекинга:
олефин + нафтен ® парафин + арен;
олефин + парафин ® парафин + олефин;
олефин + олефин ® арен + парафин;
олефин + олефин ® арен + водород;
арен + арен ® кокс + парафин + водород.
Изомеризация карбониевых ионов является также важной целевой реакцией. Изомеризация протекает быстрее чем крекинг, часто предшествует b-распаду. Сочетание реакций изомеризации и b-распада обусловливает повышенное содержание в продуктах каталитического крекинга углеводородов изостроения. Изомеризация карбониевых ионов может происходить либо путем передачи протона (гидридный сдвиг) или метильной группы (скелетная изомеризация) вдоль углеводородной цепи.
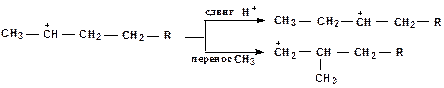
Реакции циклизации и дециклизации с участием карбоний ионов протекают через мультиплетную хемосорбцию:
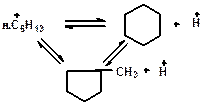
или через диеновый синтез:
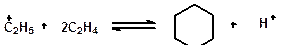
Циклопентаны в условиях каталитического крекинга более устойчивы, чем циклогексаны. Циклогексаны подвергаются дегидрированию в арены посредством Н-переноса. При наличии длинных боковых цепей в циклоалкановом карбониевом ионе возможны изомеризация боковой цепи и деалкилирование. Бициклические циклоалкановые карбониевые ионы ароматизируются в большей степени, чем моноциклические.
Реакции конденсации ароматических углеводородов, дающие соединения с более высокой молекулярной массой, вплоть до кокса, характерны для каталитического крекинга. Ареновый карбкатион вступает в последовательные реакции присоединения (конденсации) к ароматическим углеводородам и Н-переноса. Процесс конденсации вследствие высокой стабильности полициклического аренового карбоний иона продолжается до обрыва цепи:
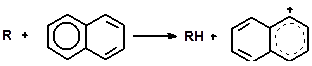
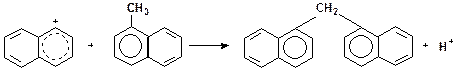
Задачи и упражнения 3
1. Расположите карбкатионы в порядке возрастания склонности их к распаду:
а)
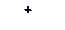
| б)

|
в)
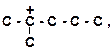
| г)
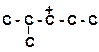
|
2. Расположите карбкатионы в порядке возрастания склонности их к распаду:
а)

| в)
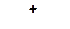
|
б)

| г)
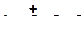
|
3. Расположите карбкатионы в порядке возрастания склонности их к распаду:
| а)
| в)
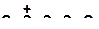
|
г)
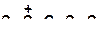
| |
б)
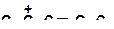
| д)
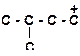
|
4. Расположите карбкатионы в порядке возрастания склонности их к распаду:
а)

| в)
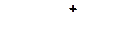
|
б)
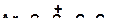
| г)

|
5. Расположите карбкатионы в порядке возрастания их стабильности:
а)
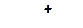
| в)
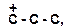
|
б)
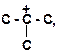
| г)
|
6. Укажите все возможные направления распада карбкатионов и подчеркните наиболее вероятные из них:
1)
| 2)
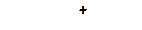
|
3)
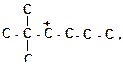
| 4)
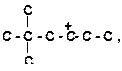
|
5)
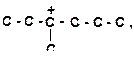
| 6)
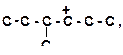
|
7)

| 8)
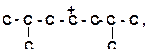
|
9)
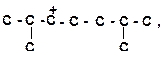
| 10)

|
11)
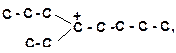
| 12)
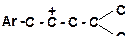
|
7. Напишите, в какие реакции могут вступать карбкатионы:
1)
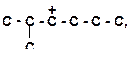
| 2)
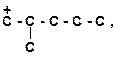
|
3)
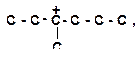
| 4)
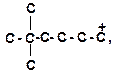
|
5)
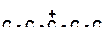
| 6)
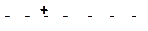
|
7)
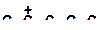
| 8)
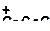
|
8. Напишите реакции передачи гидрид-иона и укажите, которая из них пойдет наиболее легко:
а)
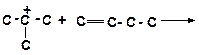
|
б)

|
в)

|
9. Напишите реакции передачи гидрид-иона и укажите, которая из них наиболее затруднена:
а)
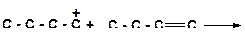
|
б)
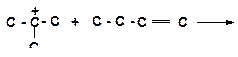
|
в)
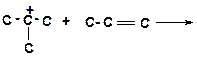
|
10. Напишите реакции передачи гидрид-иона и укажите, которая из них пойдет наиболее легко:
а)

|
б)
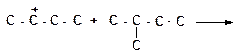
|
в)
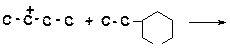
|
11. Напишите реакции передачи гидрид-иона и укажите, которая из них пойдет наиболее легко:
а)
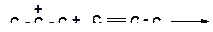
|
б)
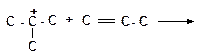
|
в)
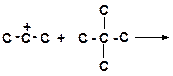
|
12. Напишите реакции передачи гидрид-иона и укажите, которая из них пойдет наиболее легко:
а)
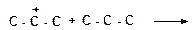
|
б)
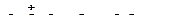
|
в)

|
13. Напишите реакции передачи гидрид-иона и укажите, которая из них пойдет наиболее легко:
а)
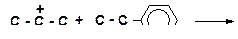
|
б)

|
в)
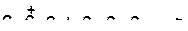
|
14. Напишите реакции передачи гидрид-иона и укажите, которая из них пойдет наиболее легко:
а)
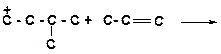
|
б)
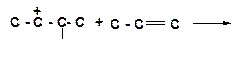
|
в)
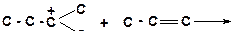
|
15. Напишите реакции передачи гидрид-иона и укажите наиболее затрудненную из них:
а)
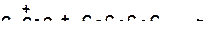
|
б)
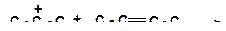
|
в)
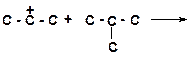
|
16. Напишите реакции передачи гидрид-иона и укажите наиболее затрудненную из них:
а)
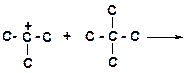
|
б)
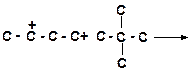
|
в)
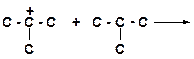
|
17. Напишите реакции передачи гидрид-иона и расположите их в порядке возрастания трудности осуществления:
а)
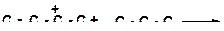
|
б)
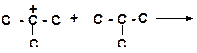
|
в)

|
18. Напишите реакции передачи протона и укажите, какая из них пойдет наиболее легко:
а)

|
б)
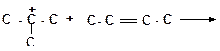
|
в)
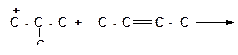
|
19. Напишите реакции передачи протона и укажите, которая из них пойдет наиболее легко:
а)

|
б)
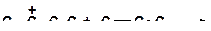
|
в)
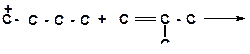
|
20. Напишите реакции передачи протона и укажите, которая из них пойдет наиболее легко:
а)
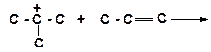
|
б)
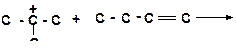
|
в)

|
21. Напишите реакции передачи протона и укажите наиболее затрудненную из них:
а)
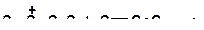
|
б)
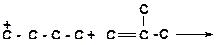
|
в)
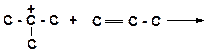
|
22. Напишите реакции передачи протона и расположите в порядке возрастания трудности их осуществления:
а)
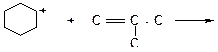
|
б)

|
в)
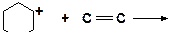
|
23. Напишите моно- и бимолекулярные реакции, которые могут протекать в системах:
1)

|
2)
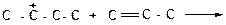
|
3)
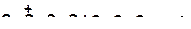
|
4)
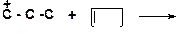
|
5)

|
6)
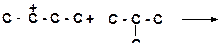
|
7)
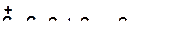
|
8)
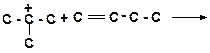
|
9)
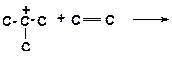
|
24. Напишите реакции присоединения и укажите, протекание какой из них пойдет легко и наиболее трудно:
а)
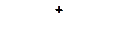
|
б)
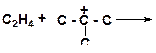
|
в)
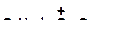
|
25. Напишите реакции присоединения и укажите наиболее легкую и наиболее трудную из них:
а)
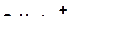
|
б)
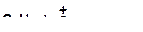
|
в)
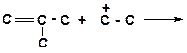
|
26. Напишите реакции присоединения и укажите наиболее легкую и наиболее трудную из них:
а)
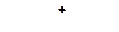
|
б)
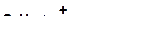
|
в)
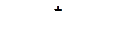
|
27. Напишите реакции присоединения и укажите наиболее легкую и наиболее трудную из них:
а)
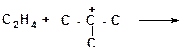
|
б)
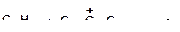
|
в)

|
г)
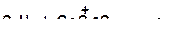
|
28. Напишите реакции присоединения и укажите наиболее легкую и наиболее трудную из них:
а)
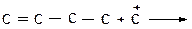
|
б)
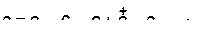
|
в)
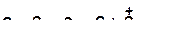
|
г)
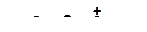
|
д)
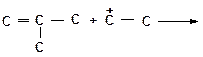
|
Задачи и упражнения 4
1. Напишите механизм каталитического крекинга алкана н -С30Н62.
2. Напишите механизм каталитического крекинга алкана:
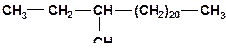
3. Напишите механизм каталитического крекинга алкана:
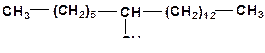
4. Напишите механизм каталитического крекинга этилциклогексана:
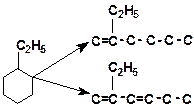
5. Напишите механизм каталитического крекинга этилциклогексана:
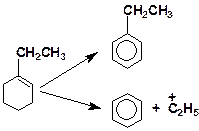
6. Напишите механизм реакции деалкилирования бутилциклогексана:
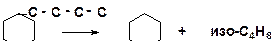
7. Напишите механизм образования толуола из пропена и изобутена:
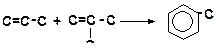
8. Напишите механизм реакции перераспределения (диспропорционирования) водорода:
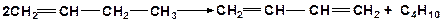
9. Напишите механизм реакции перераспределения водорода:
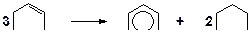
10. Вспомните, какие реакции протекают с аренами в условиях каталитического крекинга и напишите их.
11. Напишите механизм деалкилирования бутилбензила.
12. Напишите реакции деалкилирования аренов и укажите реакцию, которая будет протекать наиболее легко:
а)
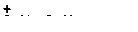
|
б)

|
в)
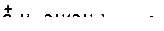
|
13. Напишите реакции деалкилирования и расположите в порядке возрастания трудности их протекания:
а)
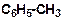
|
б)
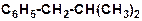
|
в)
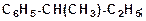
|
г)
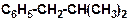
|
14. Напишите реакции деалкилирования и разложите их в порядке возрастания трудности их осуществления:
а)
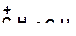
|
б)
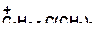
|
в)
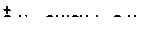
|
г)
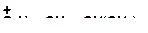
|
15. Напишите механизм реакции перераспределения метильных групп:
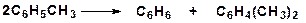
16. Напишите механизм распада дифенилэтана:
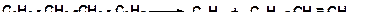
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Глаголева, О.Ф. Технология переработки нефти: в 2 т. Т. 1. Первичная переработка нефти / О.Ф. Глаголева, В.М. Капустин. –
М.: Химия, КолосС, 2006. – 400 с.
2. Ахметов, С.А. Технология глубокой переработки нефти и газа: учебное пособие / С.А. Ахметов. – Уфа: Гилем, 2002. – 672 с.
3. Мановян, А.К. Технология переработки природных энергоносителей / А.К. Мановян. – М.: Химия, КолосС, 2004. – 456 с.
4. Курочкин, А.К. Высокие технологии на малых НПЗ /
А.К. Курочкин, А.В. Курочкин // Нефть и капитал. – 2007. – № 12. –
С. 80-84.
5. Кузнецов, А.В. Топливо и смазочные материалы / А.В. Кузнецов. – М.: КолосС, 2005. – 199 с.
6. Баннов, П.Г. Процессы переработки нефти: учебно-методическое пособие для повышения квалификации работников нефтеперерабатывающей промышленности: в 3 т / П.Г. Баннов; под ред. О.Ф. Глаголевой. – М.: ЦНИИТЭнефтехим, 2003.
7. Ахметов, С.А. Технология, экономика и автоматизация процессов переработки нефти и газа: учебное пособие / С.А. Ахметов, М.Х. Ишмияров, А.П. Веревкин, Е.С. Докучаев, Ю.М. Малышев; Под ред. С.А. Ахметова. – М.: Химия, 2005. – 736 с.
8. Капустин, В.М. Технология переработки нефти: в 2 т. Т. 2. Деструктивные процессы / В.М. Капустин, А.А. Гуреев. – М.: КолосС, 2008. – 334 с.
9. Рудин, М.Г. Карманный справочник нефтепереработчика / М.Г. Рудин, В.Е. Сомов, А.С. Фомин; Под ред. М.Г. Рудина. –
М.: ЦНИИТЭнефтехим, 2004. – 336 с.
10. Корзун, Н.В. Термические процессы переработки нефти: учебное пособие / Н.В. Корзун, Р.З. Магарил. – М.: КДУ, 2008. – 96 с.
11. Рябов, В.Д. Химия нефти и газа: учебное пособие / В.Д. Рябов. – М.: ИД «ФОРУМ», 2009. – 336 с.
12. Батуева, И.Ю. Теоретические основы химической технологии: сборник задач и упражнений / И.Ю. Батуева, Н.Л. Солодова,
И.Н. Дияров. – Казань: КГТУ, 1993. – 40 с.
13. Проскуряков, В.А. Химия нефти и газа: учебное пособие / В.А. Проскуряков, А.Е. Драбкина. – Л.: Химия, 1981. – 359 с.
14. Магарил, Р.З. Теоретические основы химических процессов переработки нефти: учебное пособие / Р.З. Магарил. – М.: КДУ, 2008. – 280 с.
15. Магарил, Е.Р. Моторные топлива: учебное пособие /
Е.Р. Магарил, Р.З. Магарил. – М.: КДУ, 2008. – 160 с.
16. Вержичинская, С.В. Химия и технология нефти и газа: учебное пособие / С.В. Вержичинская, Н.Г. Дигуров, С.А. Синицин. –
М.: ФОРУМ, 2009. – 400 с.
17. Черенков, А.С. Исследование параметров топлив и смазочных материалов двигателей и энергетических установок: учебное пособие / А.С. Черенков, М.З. Зарифянова, А.П. Абраковнов; Под ред.
А.Ф. Дрегалина. – Казань: Казан. гос. техн. ун-т, 2014. – 160 c.
18. Юкельсон, И.И. Технология основного органического синтеза / И.И. Юкельсон. – М.: Химия, 1968. – 848 с.
19. http://kazanfirst.ru/feed/29395; http://e-nkama.ru/news/252/26331/; http://www.business-gazeta.ru/company/74/.
20. Крылов, О.В. Гетерогенный катализ / О.В. Крылов. – М.: Академкнига, 2004. – 679 с.
Оглавление
ВВЕДЕНИЕ. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3
I Основные задачи современной
нефтепереработки. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5
1.1 Основные направления и схемы организации
нефтеперерабатывающих заводов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6
1.2 Первичная перегонка нефти. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9
Вопросы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 13
II Термические процессы переработки нефти. . . . . . . . .14
2.1 Термический крекинг. Висбрекинг. . . . . . . . . . . . . . . . . . . . . . . . . . 15
2.2 Пиролиз нефтяного сырья. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .19
2.3 Коксование. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 21
2.4 Теоретические основы термических процессов переработки
нефтяного сырья. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .22
2.4.1 Алканы, циклоалканы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .30
2.4.2 Алкены, алкины. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .32
2.4.3 Арены. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .33
2.5 Химизм превращения углеводородов в процессах термической
переработки нефтяного сырья. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33
2.5.1 Радикально-цепной механизм крекинга алканов. . . . . . . . . . . . . . . . . . . .34
2.5.2 Превращения циклоалканов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .36
2.5.3 Превращения аренов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .38
Вопросы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39
III Термокаталитические процессы переработки
нефти. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
3.1 Каталитический крекинг. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .41
3.1.1 Продукты каталитического крекинга. . . . . . . . . . . . . . . . . . . . . . . 46
3.1.2 Катализаторы каталитического крекинга. . . . . . . . . . . . . . . . . . . .47
3.1.3 Дезактивация катализаторов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54
3.1.4 Химизм превращения углеводородов в процессе
каталитического крекинга. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .55
3.1.5 Карбкатионный механизм крекинга алканов. . . . . . . . . . . . . . . . .57
3.1.6 Превращения циклоалканов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .59
3.1.7 Превращения аренов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .61
3.1.8 Сопоставление качества продуктов каталитического
крекинга перед термическим крекингом. . . . . . . . . . . . . . . . . . . . . . . . .62
Вопросы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 63
3.2 Каталитический риформинг. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 64
3.2.1 Антидетонационная стойкость бензинов. . . . . . . . . . . . . . . . . . . .65
3.2.2 Катализаторы каталитического риформинга. . . . . . . . . . . . . . . . .68
3.2.3 Установки каталитического риформинга. . . . . . . . . . . . . . . . . . . .71
3.2.4 Химизм и термодинамика процесса
каталитического риформинга. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .77
3.3 Каталитическая изомеризация пентан-гексановой
фракции бензинов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 82
Вопросы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 85
IV ТЕРМОГИДРОКАТАЛИТИЧЕСКИЕ ПРОЦЕССЫ. . . . . . . . . . . . .87
4.1 Гидроочистка дистиллятного сырья. . . . . . . . . . . . . . . . . . . . . . . . . 88
4.1.1 Катализаторы процесса гидроочистки. . . . . . . . . . . . . . . . . . . . . . 90
4.1.2 Химизм процесса гидроочистки. . . . . . . . . . . . . . . . . . . . . . . . . . . 92
4.1.3 Гидроочистка дистиллятов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 94
4.2 Гидрокрекинг. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 102
4.2.1 Катализаторы и химизм процесса гидрокрекинга. . . . . . . . . . . .107
4.2.2 Гидрокрекинг вакуумных дистиллятов. . . . . . . . . . . . . . . . . . . . 116
Вопросы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 119
V ВЫБОР СХЕМЫ НЕФТЕПЕРЕРАБОТКИ. . . . . . . . . . . . . . . . . . . .120
VI ЗАДАЧИ И УПРАЖНЕНИЯ. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .124
6.1 Типы разрыва связей в молекулах углеводородов. . . . . . . . . . . . .124
Задачи и упражнения 1. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 125
6.2 Радикально-цепной механизм термических реакций
нефтяного сырья. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .128
Задачи и упражнения 2. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 130
6.3 Карбоний ионный механизм термокаталитических
процессов переработки нефтяного сырья. . . . . . . . . . . . . . . . . . . . . . . 133
Задачи и упражнения 3. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 137
Задачи и упражнения 4. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 148
БИБЛИОГРАФИЧЕСКИЙ СПИСОК. . . . . . . . . . . . . . . . . . . . . . . . . . 152
ОГЛАВЛЕНИЕ. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .154
Учебное издание
Зарифянова Муслима Зиннетзяновна – доктор технических наук, доцент кафедры общей химической технологии ФГБОУ ВПО «Казанский национальный исследовательский технологический университет»;
Пучкова Татьяна Львовна – кандидат технических наук, старший преподаватель кафедры общей химической технологии ФГБОУ ВПО «Казанский национальный исследовательский технологический университет»;
Шарифуллин Андрей Виленович – доктор технических наук, профессор кафедры химической технологии переработки нефти и газа ФГБОУ ВПО «Казанский национальный исследовательский технологический университет».
Дата: 2019-02-25, просмотров: 452.