Недостаточность кровообращения
Недостаточность кровообращения — состояние, при котором система кровообращения не обеспечивает потребности тканей и органов в оптимальном кровоснабжении.
Причины
Основные причины недостаточности кровообращения:
• расстройства сердечной деятельности,
• нарушения тонуса стенок кровеносных сосудов,
• изменения ОЦК и/или реологических свойств крови.
Виды
Виды недостаточности кровообращения классифицируют по критериям:
•компенсированности расстройств,
•остроте их развития и течения,
• выраженности признаков.
Компенсированность расстройств
По компенсированности расстройства системы кровообращения подразделяют на компенсированные (признаки расстройств кровообращения выявляются при нагрузке) и некомпенсированные (признаки нарушения кровообращения обнаруживаются в покое).
Острота развития и течения
По остроте развития и течения выделяют острую (развивается в течение часов и суток) и хроническую (развивается на протяжении нескольких месяцев или лет) недостаточность кровообращения.
• Острая недостаточность кровообращения. Наиболее частые причины: инфаркт миокарда, острая сердечная недостаточность, некоторые аритмии (пароксизмальная тахикардия, выраженная брадикардия, мерцательная аритмия и др.), шок, острая кровопотеря.
• Хроническая недостаточность кровообращения. Причины: перикардиты, длительно текущие миокардиты, миокардиодистрофии, кардиосклероз, пороки сердца, гипер‑ и гипотензивные состояния, анемии, гиперволемии различного генеза.
Выраженность признаков
По выраженности признаков выделено три стадии недостаточности кровообращения.
• Стадия I — начальная — недостаточность кровообращения первой степени. Признаки: уменьшение скорости сокращения миокарда и cнижение фракции выброса, одышка, сердцебиение, утомляемость. Указанные признаки выявляются при физической нагрузке и отсутствуют в покое.
• Стадия II — недостаточность кровообращения второй степени (умеренно или значительно выраженная недостаточность кровообращения). Указанные для начальной стадии признаки недостаточности кровообращения обнаруживаются не только при физической нагрузке, но и в покое.
• Стадия III — конечная — недостаточность кровообращения третьей степени. Характеризуется значительными нарушениями сердечной деятельности и гемодинамики в покое, а также развитием существенных дистрофических и структурных изменений в органах и тканях.
Факторы риска
Сердечно‑сосудистые заболевания занимают первое место среди причин инвалидизации и гибели человека (убийца № 1).
Высокий уровень заболеваемости, инвалидизации и летальности от болезней ССС в значительной мере определяется широкой распространённостью различных форм патологии сердца и прежде всего — ИБС. В промышленно развитых странах 15–20% взрослого населения страдает ИБС. Последняя, в свою очередь, является причиной внезапной смерти у 2/3 пациентов, умерших от сердечно‑сосудистых заболеваний. Около половины страдающих этими болезнями становятся инвалидами в трудоспособном возрасте. Постоянно увеличивается заболеваемость и смертность от них среди молодого населения (до 35 лет), а также в сельских местностях.
Основные факторы, определяющие высокую заболеваемость сердечно‑сосудистой патологией: повторные и затяжные стрессорные эпизоды, хроническая гиподинамия, интоксикация алкоголем, курение, избыток чая, кофе и других «бытовых допингов», некачественное, несбалансированное питание и переедание, ожирение. Всего известно не менее 50 факторов риска, существенно влияющих на возникновение кардиоваскулярной патологии.
Типовые формы патологии ССС
Патологические процессы ССС объединяют в две группы типовых форм патологии.
• Нарушения центрального кровообращения. Они обусловлены патологией сердечной деятельности и магистральны кровообращения х сосудов.
• Расстройства периферического, включая нарушения микроциркуляции.
Большинство расстройств сердечной деятельности относятся к трем группам типовых форм патологии: коронарной недостаточности, аритмиям и сердечной недостаточности.
Коронарная недостаточность
Коронарная недостаточность — типовая форма патологии сердца, характеризующаяся превышением потребности миокарда в кислороде и субстратах метаболизма над их притоком по коронарным артериям, а также нарушением оттока от миокарда продуктов обмена веществ, БАВ, ионов и других агентов. Ведущий патогенетический фактор коронарной недостаточности — ишемия миокарда. Клинически коронарная недостаточность проявляется как ишемическая болезнь сердца (ИБС). При поражении венечных артерий может развиться стенокардия, инфаркт миокарда или внезапная сердечная смерть.
Рис. 22–1. Виды, клинические формы и исходы коронарной недостаточности.
Рис. 22–2. Группы причин коронарной недостаточности.
Рис. 22–3. Факторы, уменьшающие или прекращающие приток крови к миокарду по коронарным артериям.
• Атеросклеротическое поражение коронарных артерий. У 92% пациентов со стенокардией на коронароангиограммах выявляются значительные локальные сужения просвета как минимум одной из венечных артерий сердца.
• Агрегация форменных элементов крови (главным образом — эритроцитов и тромбоцитов) и образование тромбов в венечных артериях сердца. Этим процессам в значительной мере способствуют:
† атеросклеротические изменения в стенках сосудов;
† турбулентный характер кровотока в венечных сосудах;
† повышение содержания и активности факторов свёртывающей системы крови, высвобождающихся из повреждённых клеток крови и сосудистой стенки. Указанные факторы дополнительно стимулируют агрегацию и адгезию тромбоцитов, эритроцитов и лейкоцитов, высвобождение из них БАВ, потенцирующих, в свою очередь, клеточную агрегацию и тромбообразование как в просвете, так и на внутренней поверхности коронарных артерий.
• Спазм коронарных артерий. Развитие коронарной недостаточности в результате сосудистого спазма доказано ангиографическими исследованиями.
† Решающее значение в развитии коронароспазма имеют катехоламины. Значительное увеличение их содержания в крови или повышение адренореактивных свойств сосудов миокарда, как правило, сопровождается всеми клиническими, электрокардиографическими и биохимическими изменениями, свойственными стенокардии.
Аргументы в пользу симпатергического (катехоламинового) механизма спазма артериол при коронарной недостаточности: развитие эпизодов коронарной недостаточности при стрессовых ситуациях, частые приступы стенокардии при феохромоцитоме, развитие коронарной недостаточности при внутриартериальном введении адреналина, повышение содержания катехоламинов в крови до и на высоте эпизода коронарной недостаточности. Доказано также существенное значение в развитии коронароспазма тромбоксана А2, ПгF2b, а также лейкотриенов C4, D4, E4.
† В реальной жизни коронарная недостаточность является результатом действия комплекса взаимосвязанных факторов:
‡ сокращения ГМК коронарных артерий и уменьшения их просвета под влиянием катехоламинов, тромбоксана А2, ПгF2b и других вазоконстрикторов;
‡ уменьшения внутреннего диаметра просвета коронарных артерий в результате утолщения её стенки (за счёт атеросклеротических изменений, гипертрофии мышечной оболочки, фиброзных изменений, отёка и др.);
‡ сужения и закрытия просвета сосуда агрегатами форменных элементов крови.
Эти представления суммированы в концепции о динамическом стенозе коронарных артерий (рис. 22–4).
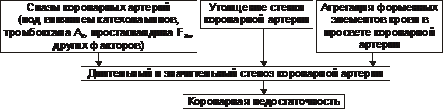
Рис. 22–4. Основные звенья механизма динамического стеноза венечных артерий сердца.
• Уменьшение притока крови к сердцу и снижение в связи с этим перфузионного давления в коронарных артериях. К этому приводят значительная бради- или тахикардия, трепетание и мерцание предсердий и/или желудочков сердца, недостаточность аортальных клапанов, острая артериальная гипотензия, сдавление коронарных артерий сердца (опухолью, рубцом, инородным телом).
Рис. 22–5. Факторы, увеличивающие потребление миокардом кислорода и субстратов обмена веществ.
• Существенное повышение в сердце уровня катехоламинов (например, при стрессе или феохромоцитоме). Избыток катехоламинов в миокарде обусловливает развитие их кардиотоксического эффекта. Механизмы кардиотоксического эффекта катехоламинов представлены на рис. 22–6.
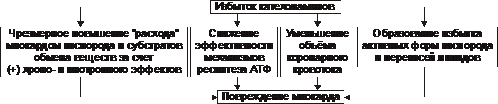
Рис. 22–6. Механизмы кардиотоксического действия избытка катехоламинов в миокарде.
† Чрезмерное повышение расхода O2 и субстратов метаболизма миокардом. Последнее связано с положительным хроно‑ и инотропным эффектами катехоламинов и значительным возрастанием в связи с этим функции сердца.
† Снижение эффективности ресинтеза АТФ и, в связи с этим, расхода кислорода и субстратов окисления. Последнее вызвано повреждением мембранного аппарата кардиомиоцитов (прежде всего — плазматической мембраны, митохондрий), инактивацией ферментов тканевого дыхания, гликолиза, пентозофосфатного шунта (при этом мембраны и ферменты альтерируются свободными радикалами, продуктами нарушенного метаболизма и перекисного окисления липидов. Образование их стимулируют катехоламины, а также — активированные гидролазы лизосом) и разобщением окислительного фосфорилирования избытком ВЖК и ионов под влиянием катехоламинов.
† Уменьшение (в сравнении с потребным) величины коронарного кровообращения. Это является результатом укорочения (в условиях катехоламиновой тахикардии) диастолы, в течение которой приток крови к миокарду максимален, повышения напряжения миокарда и сдавления в связи с этим коронарных сосудов, усиления агрегации клеток крови в просвете микрососудов.
В целом развитие коронарной недостаточности при чрезмерной активации симпатикоадреналовой системы характеризуется как увеличением расхода гиперфункционирующим миокардом O2 и метаболитов, так и ограничением их притока к миокарду по коронарным артериям.
• Значительное возрастание работы сердца. Наиболее часто является следствием чрезмерной физической нагрузки, длительной тахикардии, острой артериальной гипертензии, выраженной гемоконцентрации, значительной гиперволемии.
Важно, что чрезмерное увеличение работы сердца, а также причины, вызвавшие её, как правило, одновременно приводят и к активации симпатикоадреналовой системы. Последнее сопровождается высвобождением избытка катехоламинов и реализацией их кардиотоксического действия.
Рис. 22–7. Состояния, приводящие к снижению содержания в крови и/или кардиомиоцитах кислорода и субстратов метаболизма.
Рис. 22–8. Механизмы повреждения сердца при коронарной недостаточности.
Механизмы альтерации клеток подробно рассмотрены в разделе «Общие механизмы повреждения» главы 4 «Патология клетки». Указанные механизмы (расстройство энергетического обеспечения кардиомиоцитов, повреждение их мембран и ферментов, дисбаланс ионов и жидкости, изменение механизмов регуляции сердечной деятельности) реализуются как в зоне ишемии, так и за её пределами, хотя в последней — в существенно меньшей мере.
Рис. 22–10. Изменения в клетках миокарда в зависимости от продолжительности ишемии.
† Нарушение аэробного синтеза АТФ приводит к активации гликолиза и накоплению в миокарде лактата. Одновременно быстро уменьшаются запасы гликогена.
† Активация гликолитического метаболизма углеводов обусловливают развитие ацидоза.
† Развитие внутри- и внеклеточного ацидоза существенно изменяет проницаемость мембран для метаболитов и ионов, подавляет активность ферментов энергообеспечения, синтеза клеточных структур, транспорта субстратов метаболизма и катионов.
В отдалённых от зоны ишемии участках сердца процессы энергетического обеспечения миокарда страдают в значительно меньшей мере.
• Последствия расстройств процессов энергообеспечения кардиомиоцитов: снижение сократительной функции миокарда, нарушения кровообращения в органах и тканях, развитие сердечных аритмий. Нарушения ритма сердца, в свою очередь, нередко становятся причиной внезапной смерти пациентов с коронарной недостаточностью.

Последствия ишемии миокарда. Чем позже происходит реперфузия, чем более выражено повреждение сердечной мышцы. [по 4].
Рис. 22–11. Механизмы повреждения мембран и ферментов клеток миокарда при коронарной недостаточности (период ишемии и начальный этап реперфузии).
Дисбаланс ионов и жидкости
Ионный дисбаланс (рис. 22–12, см. также раздел «Дисбаланс ионов и воды в клетке» в главе 4 «Повреждение клетки») развивается вслед за расстройствами энергообеспечения кардиомиоцитов и повреждением их мембран и ферментов или одновременно с ними.
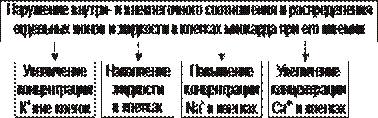
Рис. 22–12. Дисбаланс ионов и жидкости в миокарде при коронарной недостаточности (период ишемии и начальный этап реперфузии).
Дисбаланс ионов и воды, развивающийся при ишемии миокарда, относится как к общему содержанию ионов и жидкости в клетках и ткани миокарда в целом, так и к внутри- и внеклеточному соотношению отдельных ионов (прежде всего Na+, K+, Cl–, Ca2+), а также к внутриклеточному соотношению и распределению (компартментализации) отдельных ионов.
• Общее содержание ионов в клетках ишемизированного миокарда существенно возрастает.
• Внутри‑ и внеклеточное соотношение и распределение отдельных ионов, а также жидкости в кардиомиоцитах значительно изменяется (рис. 4–9, рис. 22–13).

Рис. 22–13. Нарушение внутри‑ и внеклеточного соотношения и распределения отдельных ионов и жидкости в клетках миокарда при его ишемии.
Особенно важны нижеперечисленные изменения.
† Увеличение [K+] вне кардиомиоцитов вследствие снижения активности Na+,K+‑АТФазы, дефицита АТФ, повышения проницаемости плазматической мембраны.
Потеря K+ кардиомиоцитами сопровождается повышением его содержания в интерстициальной жидкости и крови. В связи с этим гиперкалиемия является одним из характерных признаков коронарной недостаточности, особенно при инфаркте миокарда.
† Повышение содержания ионов Na+ в кардиомиоцитах, увеличение [Ca2+] в клетках миокарда, расстройство регуляции объёма клеток миокарда.
Указанные факторы приводят к накопление избытка жидкости в клетках миокарда и существенному увеличению их объёма.
• Последствия дисбаланса ионов и жидкости в миокарде при коронарной недостаточности представлены на рис. 22–14.
Рис. 22–14. Последствия дисбаланса ионов и жидкости в миокарде при коронарной недостаточности (период ишемии и начальный этап реперфузии).
Дисбаланс ионов и жидкости вызывает нарушение ряда фундаментальных процессов (прежде всего электрогенеза и сократительных характеристик), протекающих в клетках миокарда (см. рис. 4–11). При ишемии миокарда страдают все процессы мембранного электрогенеза: возбудимость клеток миокарда, автоматизм ритмогенеза и проведение импульсов возбуждения.
В связи с существенными отклонениями трансмембранного электрогенеза развиваются аритмии сердца.
Рис. 22–15. Механизмы прооксидантного эффекта избытка адреналина в миокарде.
• Коронарная недостаточность сопровождается и другими изменениями нейрогуморальной регуляции функции сердца, но они весьма индивидуализированы (в зависимости от длительности эпизода коронарной недостаточности, числа их в анамнезе, возраста пациента, выраженности сердечной недостаточности и т.д.) и рассматриваются в клинических руководствах.
Реперфузия
Возобновление тока крови (реперфузия) является самым эффективным способом прекращения действия патогенных факторов ишемии миокарда и устранения последствий их влияния на сердце.
| Реперфузия: |
| • препятствует развитию инфаркта миокарда, |
| • предотвращает формирование аневризмы в ранее ишемизированной зоне сердца, |
| • способствует образованию соединительной ткани в стенке аневризмы, если она развилась; |
| • потенцирует восстановление сократительной функции сердца. |
• Вместе с тем начальный этап постокклюзионной реперфузии коронарных сосудов и миокарда нередко сопровождается существенными расстройствами функции сердца: развитием аритмий, включая фибрилляцию желудочков, что чревато смерть пациента; преходящей дестабилизацией показателей центрального и органно‑тканевого кровообращения, дисбалансом биохимических и электрофизиологических параметров сердца.
Таким образом, на раннем этапе реперфузии возможно пролонгирование и даже потенцирование повреждения реперфузируемого участка сердца. В связи с этим сформулировано положение о том, что коронарная недостаточность является совокупностью двух синдромов: ишемического и реперфузионного, а не только одного — ишемического, как считалось ранее.
АРИТМИИ сердца
Аритмия — типовая форма патологии сердца — характеризуется нарушением частоты и периодичности генерации возбуждения и/или последовательности возбуждения предсердий и желудочков.
• Дополнительный материал по патофизиологии аритмий изложен в приложении «Справочник терминов» (статьи «Аритмия сердца», «Блокада сердца», «Брадикардия», «Гиперкалиемия», «Кардиоверсия», «Тахикардия», «Трепетание», «Фибрилляция», «Экстрасистола», «Экстрасистолии», «Электрокардиография», «Электрокардиостимуляция», а также статьи и подстатьи по упомянутым в этом разделе нозологическим единицам).
Виды аритмий, их этиология и патогенез
Аритмии являются следствием нарушения свойств автоматизма, проводимости и возбудимости или их комбинированных нарушений. Расстройства сократимости лежат в основе развития сердечной (миокардиальной) недостаточности, и не являются непосредственной причиной нарушений ритма сердца.
Рис. 22–16. Виды аритмий в результате нарушения автоматизма сердца.
• Номотопные аритмии. Возникают в синусно-предсердном узле. К ним относятся синусовые тахикардия, брадикардия, аритмия и синдром слабости синусно‑предсердного узла.
• Гетеротопные аритмии. Это эктопические ритмы. Они возникают вне синусно‑предсердного узла и обусловлены преобладанием автоматизма нижележащих центров ритмогенеза. Проявления этих аритмий: миграция наджелудочкового водителя ритма, предсердный медленный ритм, атриовентрикулярный (АВ) ритм (узловой ритм), идиовентрикулярный редкий (желудочковый) ритм (гетеротопный ритм сердца, при котором водитель ритма — пейсмейкер — расположен в миокарде желудочков), идиовентрикулярный ускоренный ритм сердца — ЧСС 60–120 в 1 мин (возникает при патологической циркуляции возбуждения по миокарду желудочков), АВ диссоциация — полное прекращение проведения возбуждения от предсердий к желудочкам; при этом предсердия и желудочки сокращаются независимо друг от друга (полный поперечный блок), «выскакивающие» импульсы.
Повторный вход импульса
Петля макро-reentry возникает в дополнительных проводящих путях (при синдроме преждевременного возбуждения желудочков) или в АВ-соединении. Для возникновения reentry необходима однонаправленная блокада проведения импульса и анатомический или функциональный барьер для формирования петли reentry. Кроме того, развитие reentry характеризуется замедлением проведения импульса и коротким рефрактерным периодом.
Виды нарушений проводимости
Виды нарушений проводимости представлены на рис. 22–17.
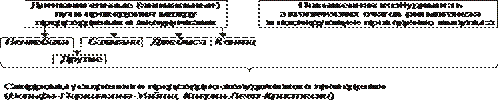
Рис. 22–17. Виды нарушений проводимости в сердце.
Нарушения проводимости по изменению скорости проведения импульсов возбуждения подразделяют на сопровождающиеся замедлением и/или блокадой проведения импульсов и на сопровождающиеся ускорением проведения возбуждения.
• Замедление и/или блокада проведения импульсов. Является следствием функциональных или органических изменений в проводящей системе сердца.
† Причины.
‡ Повышение эффектов парасимпатических влияний на сердце и/или его холинореактивных свойств. Активация тонических воздействий блуждающего нерва на миокард обусловливает существенное замедление скорости волны возбуждения по проводящей системе, особенно на уровне АВ–узла (отрицательный дромотропный эффект ацетилхолина).
‡ Непосредственное повреждение клеток проводящей системы сердца различными факторами физического, химического и биологического происхождения. Наиболее часто это наблюдается при инфаркте миокарда, миокардитах, кровоизлияниях, операционных (кардиохирургических) травмах миокарда, опухолях, рубцах, интоксикациях алкоголем, никотином, медикаментами (препаратами наперстянки, хинидина, антагонистов кальция, блокаторами b‑адренорецепторов и др.), действии бактериальных ядов (при дифтерии, скарлатине, брюшном тифе), вирусной инфекции, нарушении трансмембранного распределения ионов (чаще всего — гиперкалиемии).
† Характеристика отдельных видов аритмий.
‡ Нарушение синоатриального (синусно‑предсердного) проведения. Торможение или блокада передачи импульса возбуждения от синусно-предсердного узла к предсердиям обусловливает выпадение отдельных сердечных сокращений. В результате наблюдается замедление частоты и нарушение регулярности сердечных сокращений.
‡ Расстройства внутрипредсердного проведения. В связи с несимметричным расположением синусно-предсердного узла по отношению к предсердиям возбуждение их в норме происходит неодномоментно (вначале — правого и с некоторым запозданием — левого). Возрастание гетерохронии возбуждения предсердий в условиях патологии может привести к различной степени внутрипредсердного торможения или блокады проведения синусовых импульсов.
‡ Нарушения АВ–проведения. Характеризуются замедлением или блокадой проведения возбуждения из предсердий в желудочки. Развивается в результате удлинения рефракторного периода после ПД клеток предсердия и АВ–системы. Различают несколько разновидностей атриовентрикулярных блокад.
‡ Внутрижелудочковые (интравентрикулярные) нарушения проведения. Заключаются в торможении или блокаде распространения возбуждения по ножкам пучка Хиса, его разветвлениям и по волокнам Пуркинье. Чаще наблюдается нарушение проведения в одной из ножек пучка Хиса. Затем оно распространяется по неповреждённой системе ножек пучка и только после этого к другому желудочку (главным образом через межжелудочковую перегородку). Такой маршрут возбуждения обусловливает неодновременное, дискордантное сокращение желудочков.
† Расстройства гемодинамики. Зависят от длительности эпизода нарушения, характера основного заболевания и уровня повреждения проводящей системы сердца.
‡ Замедление или кратковременная блокада синусно‑предсердного проведения обусловливают уменьшение минутного выброса сердца, снижение АД, развитие ишемии органов и тканей. Если блокада длится несколько минут и не сопровождается развитием замещающего гетеротопного (узлового или желудочкового ритма), то это ведёт к асистолии и гибели пациента.
‡ Нарушение внутрипредсердного и внутрижелудочкового проведения возбуждения само по себе существенно не изменяет частоты и ритма сердечных сокращений. В связи с этим системные гемодинамические расстройства определяются основным заболеванием сердца (миокардитами, пороками клапанов, инфарктом миокарда и т.п.).
‡ При полной АВ-блокаде нарушения гемодинамики обусловлены главным образом степенью желудочковой брадикардии и основной сердечной патологией. В результате значительной брадикардии часто отмечается застой венозной крови и снижение сердечного выброса.
‡ Блокада проведения на любом уровне проводящей системы сердца (чаще при полной АВ–блокаде) может осложниться развитием синдрома Морганьи‑Адамса‑Стокса. Патогенетическая основа синдрома: значительное снижение, вплоть до прекращения, эффективной работы сердца. Клинически синдром проявляется внезапной потерей сознания, отсутствием пульса и сердечных тонов. Возможны эпилептиформные судороги. Длится приступ обычно 5–20 с, редко 1–2 мин.
† Коронарный кровоток. Снижается в тех случаях, когда имеется существенное падение системного АД. Последнее обусловливает уменьшение перфузионного давления в венечных артериях сердца и может привести к коронарной недостаточности в результате снижения доставки кислорода и субстратов метаболизма к миокарду.
• Ускорение проведения возбуждения между предсердиями и желудочками или отдельными участками сердца.
† Причины ускорения проведения возбуждения представлены на рис. 22–18.
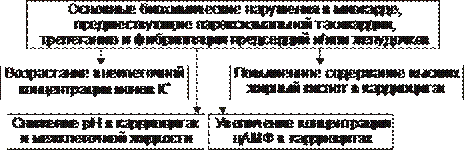
Рис. 22–18. Основные причины ускорения проведения возбуждения в сердце.
† Дополнительные (минуя АВ–узел) пути проведения возбуждения рассмотрены в статье «Пучок» и на рис. п-02 приложения «Справочник терминов». В этом случае синусовые импульсы поступают в желудочки по дополнительным пучкам проводящей ткани и по основному — атриовентрикулярному. По дополнительным пучкам возбуждение распространяется быстрее и достигает желудочков раньше того же импульса, проходящего через АВ–узел. Таким образом, импульс, распространяющийся по дополнительному пучку преждевременно активирует часть желудочков. Остальная часть их возбуждается позднее импульсом, проходящим через АВ–узел. Это и обусловливает развитие тахикардии.
† Повышенная возбудимость гетеротопных очагов. Согласно теории повышенной возбудимости, в миокарде желудочков имеются участки, способные к преждевременному (опережающему) возбуждению. Эти участки могут стать очагами гетеротопной ритмической активности под воздействием ряда факторов: импульса возбуждения, распространяющегося по проводящей системе сердца, электрического или механического (например, при растяжении миокарда избытком притекающей крови) раздражения, активации симпатикоадреналовых влияний на сердце.
† Клинические проявления.
‡ Синдром Вольффа‑Паркинсона‑Уайта характеризуется развитием пароксизмальной тахикардии (примерно, в 50–80%), мерцания или трепетания (в 20–30%) предсердий и/или желудочков.
‡ Синдром Клерка‑Леви‑Кристеско характеризуется преждевременным возбуждением желудочков, ускорением интервала P‑R/Q и увеличением ЧСС.
† Расстройства гемодинамики.
‡ Снижение ударного и сердечного выбросов. Обусловлено пониженным наполнением камер сердца кровью в условиях тахикардии, мерцательной аритмии, трепетания предсердий.
‡ Падение АД. Вызвано снижением сердечного выброса и ОПСС.
† Коронарный кровоток, как правило, снижен в большей или меньшей степени. Это чревато развитием коронарной недостаточности.
Возбудимость
Возбудимость — свойство клеток воспринимать сигнал и реагировать на него реакцией возбуждения. Возбудимость сердечной мышцы выражается в способности генерировать ПД. Свойство возбудимости сердца следует отличать от автоматизма, заключающегося в спонтанной генерации импульсов.
• Свойством возбудимости обладают как рабочие (сократительные) кардиомиоциты, так и кардиомиоциты проводящей системы. Возбудимость лежит в основе распространения электрического импульса по сердцу.
• Возбудимость сердца описывается законом «всё или ничего». Это означает, что подпороговые раздражители не инициируют ПД, тогда как раздражители пороговой величины вызывают максимальный по величине и скорости распространения ПД. Увеличение силы раздражения (надпороговые величины) не меняет характеристик ПД.
• Возбудимость кардиомиоцитов изменяется в отдельные периоды сердечного цикла. Во время систолы они не возбуждаются, т.е. рефрактерны к раздражению. Во время диастолы возбудимость сердечных клеток восстанавливается.
• Существуют два коротких интервала сердечного цикла, когда возбудимость миокарда повышена: уязвимый период и период сверхнормальной возбудимости.
† Уязвимый период — терминальная часть фазы реполяризации, компонент относительного рефрактерного периода. В уязвимый период величина порогового МП снижена, а возбудимость повышена. В связи с этим даже сравнительно слабые электрические импульсы и другие раздражители могут вызвать возбуждение и аритмию. Этот период совпадает с пиком волны T на ЭКГ и соответствует третьей фазе реполяризации клетки.
† Период сверхнормальной возбудимости следует непосредственно после окончания относительного рефрактерного периода, находится в начале диастолы и совпадает с волной U на ЭКГ. В этот период ПД могут вызвать даже подпороговые импульсы.
Причины
• Функциональные расстройства нервной системы (неврозы, стресс, ваготония).
• Органические поражения нервной системы (опухоли мозга, травмы черепа, нарушения мозгового кровообращения).
• Поражения миокарда (дистрофии, миокардиты, кардиосклероз, кардиомиопатии, инфаркт миокарда).
• Нарушения электролитного баланса (изменения содержания в крови ионов калия, кальция, магния).
• Влияние токсических веществ (окись углерода, бактериальные токсины, никотин, алкоголь, промышленные токсические вещества).
• Интоксикация ЛС (антиаритмические препараты, b-адреномиметики, сердечные гликозиды).
• Гипоксемия (при сердечной недостаточности, «лёгочном сердце»).
Механизмы возникновения
• Аномальный автоматизм. Комбинированные механизмы нарушений сердечного ритма характеризуются наличием эктопического центра, генерирующего собственный ритм, который защищён так называемой блокадой входа.
• Блокада входа — зона нарушенной проводимости, препятствующая подавлению эктопического очага синусовыми импульсами. Таким образом, создаются условия для одновременного сосуществования двух источников активации сердца — нормального (синусового) и работающего в автономном режиме альтернативного (парасистолического). Этот механизм проявляется парасистолией, которую необходимо отличать от экстрасистолии.
• Постдеполяризационная и триггерная активность.
• Повторный вход (reentry) и круговое движение импульса.
• Нарушения проводимости.
Экстрасистолия
Экстрасистола — наиболее часто регистрируемый вид аритмии — преждевременная деполяризация и, как правило, сокращение сердца или отдельных его камер. Нередко экстрасистолы регистрируются повторно. Если три и более экстрасистол следуют одна за другой, говорят об экстрасистолии.
• Разновидности экстрасистолии.
† Аллоритмия — сочетание (связь) в определённой последовательности нормальных (своевременных) сокращений с экстрасистолами. Наиболее частые формы: бигеминия — экстрасистола после каждого (одного) очередного сокращения, тригеминия — экстрасистола после двух очередных сокращений, квадригеминия — экстрасистола после трёх очередных сокращений.
† Парасистолия — сосуществование двух или более независимых, одновременно функционирующих очагов генерации импульсов, вызывающих сокращение всего сердца или отдельных его частей. Один из очагов определяет основной ритм сердца. Как правило, им является синусно‑предсердный узел. Другой очаг — эктопический (парасистолический). Он обычно расположен в желудочках.
Пароксизмальная тахикардия
Пароксизмальная тахикардия — приступообразное и внезапное увеличение частоты импульсации правильного ритма из эктопического очага сердца. О пароксизме тахикардии говорят, когда число эктопических импульсов превышает 3–5, а частота их колеблется обычно от 160 до 220 в минуту (при расположении гетеротопного очага в предсердии) или от 140 до 200 (при расположении в желудочках).
Характеристика отдельных разновидностей пароксизмальных тахикардий изложена в статье «Тахикардия» (см. приложение «Справочник терминов»).
Рис. 22–19. Основные биохимические нарушения в миокарде, предшествующие пароксизмальной тахикардии, трепетанию и фибрилляции предсердий и/или желудочков.
• Увеличение внеклеточного K+.
† Причины увеличение концентрации ионов K+ во внеклеточной жидкости приведены на рис. 22–20.
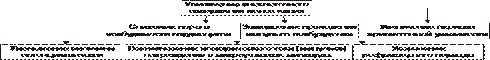
Рис. 22–20. Основные причины увеличения внеклеточного содержания K+.
Указанные (и многое другие) факторы вызывают аритмогенные изменения в миокарде и различные нарушения ритма сердца.
† Аритмогенные эффекты увеличения содержания K+ в интерстициальной жидкости представлены на рис. 22–21.
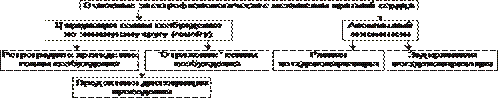
Рис. 22–21. Аритмогенные эффекты увеличения внеклеточного содержания K+.
† Перечисленные аритмогенные эффекты сопровождаются развитием различных видов аритмий, включая пароксизмы тахикардии и фибрилляцию желудочков. Так, при коронарогенной ишемии миокарда внеклеточное содержание K+ увеличивается почти в 2 раза уже в течение первых 10 с.
• Снижение pH в клетках миокарда.
† Основные причины.
‡ Активация анаэробного гликолиза. Это приводит к накоплению избытка МК в кардиомиоцитах, а также в интерстициальной жидкости и к развитию ацидоза. Лактатацидоз при ишемии миокарда в результате коронарной недостаточности развивается уже в течение нескольких секунд после снижения коронарного кровотока.
‡ Торможение процессов аэробного тканевого дыхания. Закономерно наблюдается при коронарной недостаточности в связи с дефицитом кислорода и субстратов обмена веществ.
† Аритмогенные эффекты избытка ионов H+ в миокарде весьма сходны с таковыми при увеличении концентрации ионов K+ в интерстиции (см. выше). Однако, выраженность этих эффектов меньше.
• Накопление в кардиомиоцитах избытка цАМФ.
† Основные причины.
‡ Активация аденилатциклазы. Наблюдается при воздействии многих факторов. Ведущими среди них являются катехоламины. Значительное увеличение содержания адреналина и норадреналина в миокарде (например, при острой коронарной недостаточности или стрессе) сопровождается активацией аденилатциклазы и увеличением уровня цАМФ.
‡ Подавление активности фосфодиэстераз, разрушающих цАМФ. Наблюдается при ишемии миокарда, миокардитах, кардиомиопатиях.
† Аритмогенные эффекты избытка цАМФ реализуются благодаря стимуляции под влиянием цАМФ так называемого медленного входящего кальциевого тока. ПД при этом развивается за счёт медленного транспорта Ca2+ через мембрану клеток миокарда и характеризуется малой скоростью нарастания деполяризации. Последнее в свою очередь обусловливает замедление проведения возбуждения по сердцу. Высокая концентрация внутриклеточного цАМФ стимулирует медленный кальциевый ток и создаёт тем самым условия для формирования гетеротопных очагов ритмической активности. О важной аритмогенной роли медленного кальциевого ответа, стимулируемого цАМФ, свидетельствует факт уменьшения частоты аритмий при блокаде входа Ca2+ в клетку антагонистами кальция верапамилом, нифедипином и др.
• Повышение содержания ВЖК в клетках миокарда.
† Основные причины: увеличение содержания катехоламинов в миокарде (они обладают выраженной липолитической активностью), ишемия миокарда (характеризуется возрастанием содержания катехоламинов в миокарде и активацией липолиза), повышение захвата ВЖК повреждёнными кардиомиоцитами (обусловлено альтерацией мембран кардиомиоцитов и увеличением их проницаемости, в том числе для ВЖК), активация гидролиза мембранных фосфолипидов (например, под действием катехоламинов и Ca2+).
† Аритмогенные эффекты.
‡ Разобщение процессов окисления и фосфорилирования. Это приводит к потенцированию дефицита АТФ и выходу ионов K+ в межклеточную жидкость (механизмы развития аритмий под влиянием гиперкалиемии рассмотрены выше).
‡ Подавление ресинтеза АТФ в процессе гликолиза. Вызвано тем, что АТФ гликолитического происхождения используется катионными насосами при формировании МП, а также при развитии ПД. Дефицит АТФ нарушает мембранный электрогенез, что неизбежно приводит к появлению аритмий.
Рис. 22–22. Основные электрофизиологические механизмы аритмии сердца.
• Циркуляция возбуждения по замкнутому контуру.
Циркуляция возбуждения развивается на базе феноменов ретроградного проведения и продольной диссоциации.
† Ретроградное проведение. Замедление или блокада проведения импульса возбуждения в одном направлении (антероградном) сочетается с возможностью проведения его в другом (ретроградном). Такая ситуация складывается обычно в микроучастке на периферии проводящей системы, а также в зонах контактов волокон Пуркинье с рабочими кардиомиоцитами.
† Продольная диссоциация проведения импульса. Этот феномен развивается в участках с параллельным ходом волокон проводящей системы и наличием между ними анастомозов. Условиями его возникновения являются блокада проведения импульса в одном каком‑либо волокне и замедленная проводимость в другом. Типичная ситуация развития циркуляции возбуждения на базе феномена продольной диссоциации заключается в следующем: синусовый импульс не может распространяться антероградно по волокну A в связи с наличием в нём блокады проведения. Возбуждение движется по волокну Б. Из него по анастомозам импульс может пройти в дистальный участок волокна А и, распространяясь в ретроградном направлении через блокированный участок, активировать проксимальную часть волокна А. Затем по межклеточным анастомозам возбуждение вновь попадает в волокно Б, находящееся в состоянии покоя. Этот процесс может быть однократным или повторяться многократно, обеспечивая длительную циркуляцию возбуждения.
‡ Описанный феномен характерен для механизма reentry в АВ–узле, пучке Хиса, его ножках и их разветвлениях.
‡ Если импульс возбуждения циркулирует вокруг крупных анатомических препятствий (например, вокруг зоны ишемии или инфаркта миокарда, рубцовой ткани, по ткани вокруг отверстий полых вен), то говорят о контуре и феномене макроциркуляции (макро reentry); если по волокнам проводящей системы или миоцитам без анатомического препятствия и микромасштаба, то этот контур и феномен обозначают как микроциркуляция (микро reentry).
• Аномальный автоматизм.
† Особенности аномального автоматизма.
‡ Способность аномального автоматизма сохраняться (не угнетаться) при работе водителя ритма с более высокой частотой генерации импульсов возбуждения. Именно поэтому аномальный ритм может «подчинять» ритм нормального пейсмейкера сердца, в том числе в условиях кратковременного замедления ритма нормального пейсмейкера (замещающая активность).
‡ Формирование автоматизма у рабочих кардиомиоцитов, в том числе при частичной их деполяризации.
‡ Сохранение или нарастание аномального автоматизма при высокочастотном электрическом раздражении миокарда (нормальный автоматизм в этих условиях подавляется).
† Виды аномального автоматизма.
‡ Триггерная активность (от англ. trigger спусковой крючок, приводящий в движение) — доминирующая ритмическая активность пейсмейкера, возникающая в результате постдеполяризации. При этом пейсмейкер может располагаться как в синусно‑предсердном узле, так и (чаще) вне его.
§ Триггерная активность формируется на основе предшествующего ПД в случае, если МП постдеполяризации достигает порогового диапазона.
§ Триггерная активность развивается во время периода реполяризации (2–я и 3–я фазы ПД) и в завершающей фазе ПД (в фазе 4). В соответствии с этим выделяют раннюю и задержанную постдеполяризацию.
‡ Феномен постдеполяризации мембраны.
Описанные выше механизмы (reentry и аномального автоматизма) могут лежать в основе формирования одиночного импульса и обусловить возникновение экстрасистолы. При наличии условий для повторного возникновения экстрасистол возможна генерация серии импульсов, приводящих к развитию пароксизмальной тахикардии, трепетания или фибрилляции предсердий и желудочков.
Сердечная недостаточность
Сердечная недостаточность — одна из частных причин утраты трудоспособности, инвалидизации и смерти пациентов, страдающих заболеваниями ССС. Сердечная недостаточность — не нозологическая форма, не болезнь. Это синдром, развивающийся при многих болезнях, в том числе — поражающих органы и ткани, не относящиеся к ССС.
Сердечная недостаточность — типовая форма патологии, при которой сердце не обеспечивает потребности органов и тканей в адекватном (их функции и уровню пластических процессов в них) кровоснабжении. Проявляется меньшей (в сравнении с потребной) величиной сердечного выброса, а также циркуляторной гипоксией.
Сущность сердечной недостаточности заключается в том, что сердце (при данном ОПСС) не может переместить в артериальное русло всю кровь, притекающую к нему по венам.
Повреждение сердца
Факторы, непосредственно повреждающие сердце, могут иметь физическую, химическую и биологическую природу.
• Физические факторы: сдавление сердца (экссудатом, кровью, эмфизематозными лёгкими, опухолью), воздействие электрического тока (при электротравме, проведении дефибрилляции сердца), механическая травма (при ушибах грудной клетки, проникающих ранениях, хирургических манипуляциях).
• Химические факторы: нелекарственные химические соединения (например, разобщители окислительного фосфорилирования, соли кальция и тяжёлых металлов, ингибиторы ферментов, гидроперекиси липидов), ЛС в неадекватной дозировке (например, антагонисты кальция, сердечные гликозиды, адреноблокаторы), дефицит кислорода, недостаток химических соединений, необходимых для обмена веществ (например, соли различных металлов).
• Биологические факторы.
† Высокие уровни БАВ (например, катехоламинов, T4).
† Дефицит или отсутствие БАВ, необходимых для метаболизма (например, ферментов, витаминов и др.).
† Длительная ишемия или инфаркт миокарда. Вызывает прекращение сокращений миокарда в зоне повреждения. Это сопровождается функциональной перегрузкой миокарда вне зоны ишемии или инфаркта.
† Кардиомиопатии — поражения миокарда, преимущественно невоспалительной природы. Характеризуются существенными структурно‑функциональными изменениями в сердце.
Перегрузка сердца
Причины перегрузки сердца подразделяют на две подгруппы: увеличивающие преднагрузку или увеличивающие посленагрузку (рис. 22–23).
Рис. 22–23. Основные факторы перегрузки сердца.
• Преднагрузка. Увеличение преднагрузки (объём крови, притекающей к сердцу и увеличивающей давление наполнения желудочков) наблюдается при гиперволемии, полицитемии, гемоконцентрации, клапанных пороках (сопровождаются увеличением остаточного объёма крови в желудочках).
• Посленагрузка. Увеличение постнагрузки (сопротивление изгнанию крови из желудочков в аорту и лёгочную артерию, основным фактором постнагрузки является ОПСС) происходит при артериальных гипертензиях любого генеза, стенозах клапанных отверстий сердца, сужении крупных артериальных стволов (аорты, лёгочной артерии).
Рис. 22–24. Виды сердечной недостаточности.
По происхождению
По этому критерию выделены миокардиальная, перегрузочная и смешанные формы сердечной недостаточности.
• Миокардиальная форма развивается преимущественно в результате непосредственного повреждения миокарда.
• Перегрузочная форма сердечной недостаточности возникает преимущественно в результате перегрузки сердца (увеличения пред- или постнагрузки).
• Смешанная форма сердечной недостаточности — результат сочетания прямого повреждения миокарда и его перегрузки.
По скорости развития
По быстроте развития симптомов сердечной недостаточности выделены острая и хроническая формы.
• Острая (развивается за минуты и часы). Является результатом инфаркта миокарда, острой недостаточности митрального и аортального клапанов, разрыва стенок левого желудочка.
• Хроническая (формируется постепенно, в течение недель, месяцев, годами). Является следствием артериальной гипертензии, хронической дыхательной недостаточности, длительной анемии, пороков сердца. Течение хронической сердечной недостаточности может осложнять острая сердечная недостаточность.
Рис. 22–25. Экстренные механизмы компенсации сниженной сократительной функции сердца.
• Повышение сократимости миокарда при его растяжении притекающей кровью (механизм Франка‑Старлинга). Обеспечивает увеличение развиваемого миокардом напряжения и скорости сокращения и расслабления.
† Увеличение напряжения, развиваемого сердцем, осуществляется в ответ на нарастающее растяжение миокарда. В связи с этим механизм Франка‑Старлинга называют гетерометрическим, т.е. связанным с возрастанием длины мышечного волокна.
† Увеличение скорости сокращения и расслабления кардиомиоцитов развивается в связи с более быстрым выбросом Ca2+ из кальциевых депо (саркоплазматическая сеть) и последующим ускоренным закачиванием Ca2+ (Са2+-АТФазы) в цистерны саркоплазматической сети.
• Увеличение силы сокращений миокарда в ответ на повышенную нагрузку. Происходит при неизменной длине миоцитов. Такой механизм называют гомеометрическим, поскольку он реализуется без значительного изменения длины мышечных волокон.
• Возрастание сократимости сердца при увеличении ЧСС.
• Повышение сократимости сердца в результате возрастания симпатикоадреналовых влияний. Характеризуется увеличением частоты и силы сокращений.
† Симпатическая иннервация миокарда осуществляется окончаниями аксонов адренергических нейронов шейного верхнего, шейного среднего и звёздчатого (шейно-грудного) ганглиев.
† Активация симпатических нервов вызывает положительный инотропный эффект. Увеличивается частота спонтанной деполяризации мембран водителей ритма, облегчается проведение импульса в волокнах Пуркинье, увеличивается частота и сила сокращения типичных кардиомиоцитов.
† Действие катехоламинов на кардиомиоциты через b1‑адренорецепторы обусловлено рядом последующих событий: стимуляция b‑адренорецептора адреномиметиком (например, норадреналином) ® через G‑белок активируется аденилатциклаза с образованием цАМФ ® активация цАМФ‑зависимой протеинкиназы ® фосфорилирование белка р27 сарколеммы ® в саркоплазму увеличивается вход кальция через открытые потенциалозависимые Ca2+‑каналы ® усиливается кальций-индуцированная мобилизация Ca2+ в цитозоль через активированные рецепторы рианодина ® в саркоплазме значительно повышается концентрация Ca2+ ® связывание Ca2+ с тропонином C снимает ингибирующее действие тропомиозина на взаимодействие актина с миозином ® образуется большее количество актомиозиновых связей ® увеличивается сила сокращения.
Рис. 22–26. Основные механизмы декомпенсации гипертрофированного сердца.
В основе декомпенсации длительно гипертрофированного миокарда лежит нарушение сбалансированности роста различных его структур. Эти сдвиги — наряду с другими (см. рис 22–26) — в конечном счёте обусловливает уменьшение силы сердечных сокращений и скорости контрактильного процесса, т.е. — развитие сердечной недостаточности.
Рис. 22–27. Основные механизмы снижения сократительной функции миокарда при сердечной недостаточности.
• Недостаточность энергетического обеспечения клеток миокарда
Расстройство энергоснабжения основных процессов, происходящих в клетках миокарда (прежде всего его сокращения и расслабления), развивается вследствие нарушения: ресинтеза макроэргов, транспорта их энергии к эффекторным структурам кардиомиоцитов, утилизации ими энергии макроэргических фосфатных соединений. Эти звенья патогенеза в общем виде рассмотрены в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Расстройства энергетического обеспечения клетки»).
Нарушение обеспечения кардиомиоцитов энергией на этапах её продукции, транспорта и утилизации может быть как стартовым механизмом снижения сократительной функции сердца, так и существенным фактором нарастания её депрессии.
• Повреждение мембран и ферментов кардиомиоцитов
Повреждение клеточных мембран и ферментов рассмотрено в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Повреждение мембран и ферментов»).
Альтерация мембран и ферментов клеток миокарда — главное, а нередко и инициальное звено патогенеза сердечной недостаточности. Изменение физико‑химических свойств и конформации молекул белка (структурных и ферментов), липидов, фосфолипидов и ЛП сопровождается значительным обратимым, а часто — необратимым повреждением структуры и функции мембран и ферментов, в том числе — митохондрий, саркоплазматического ретикулума, миофибрилл, плазматической мембраны, обеспечивающих реализацию сократительной и ритмической функций сердца.
• Ионный дисбаланс
Нарушение содержания и соотношения между отдельными ионами внутри и вне клеток рассмотрены в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Дисбаланс ионов и воды в клетке»). Ниже приведены специфичные для развития сердечной недостаточности особенности ионного дисбаланса.
Ионный дисбаланс при сердечной недостаточности проявляется нарушением соотношения между отдельными ионами в разных секторах кардиомиоцитов: в органеллах (митохондриях, саркоплазматическом ретикулуме, миофибриллах), в цитозоле, по разные стороны плазматической мембраны кардиомиоцитов. В наибольшей степени это относится к ионам: K+, Na+, Ca2+. Именно эти катионы в основном определяют реализацию таких процессов, как возбуждение, электромеханическое сопряжение, сокращение и расслабление миокарда.
• Нарушения в генетической программ кардиомиоцитов
Нарушения в генетической программе клеток и/или механизмов её реализации рассмотрены в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Генетические нарушения»).
При сердечной недостаточности происходит активация генов, контролирующих процессы обновления субклеточных структур кардиомиоцитов, а также роста сосудов микроциркуляторного русла и нервных волокон. В частности, при ишемическом и стрессорном повреждении сердца подавлена экспрессия мРНК, для Ca2+‑зависимой АТФазы саркоплазматической сети. Это и потенцирует ингибирование процессов захвата и выброса Ca2+ ретикулумом миоцитов. В условиях ишемии и инфаркта миокарда, хронического эмоционально‑болевого стресса подавлен также процесс трансляции генетической информации. Это сопровождается нарушением синтеза различных белков клеток миокарда.
• Расстройства нейрогуморальной регуляции сердца
Общая характеристика нарушений регуляции клеточных функций приведена в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Расстройства регуляции внутриклеточных процессов»). Ниже рассмотрены важные для развития сердечной недостаточности изменения симпатической и парасимпатической регуляции сердца.
† Изменение механизмов симпатической регуляции.
‡ Уменьшение содержания нейромедиатора симпатической нервной системы — норадреналина в ткани сердца.
Причины. Снижение синтеза норадреналина в нейронах симпатической нервной системы (в норме в них образуется около 80% медиатора, содержащегося в миокарде). Является результатом подавления активности фермент тирозин гидроксилазы и торможение захвата норадреналина нервными окончаниями.
‡ Снижение адренореактивных свойств сердца, т.е. выраженности ино-, хроно-, дромо- и батмотропных эффектов норадреналина и адреналина.
† Изменение механизмов парасимпатической регуляции.
‡ Ацетилхолин через м‑холинорецепторы вызывает уменьшение частоты сердечных сокращений, ингибируя образование цАМФ и активируя образование цГМФ. цГМФ активирует цГМФ‑зависимую киназу, подавляющую активность потенциалозависимых Ca2+‑каналов.
‡ Изменение механизмов парасимпатической регуляции при сердечной недостаточности выражены значительно меньше, чем симпатической. Это является результатом более высокой резистентности парасимпатических механизмов к различным повреждающим факторам.
Последствия нарушенных симпатических и парасимпатических влияний на миокард состоят в снижении степени управляемости и надёжности регуляции сердца. Это приводит к падению темпа и величины мобилизации сократительной функции сердца, особенно в чрезвычайных условиях.
Рис. 22–28. Основные нарушения функции сердца и центральной гемодинамики при сердечной недостаточности.
Депрессия силы и скорости сокращения, а также расслабления миокарда при сердечной недостаточности проявляется отклонениями от нормы показателей функции сердца, центральной и органно‑тканевой гемодинамики.
• Уменьшение ударного и минутного выброса сердца. Развивается в результате депрессии сократительной функции миокарда.
† В подавляющем большинстве случаев сердечный выброс ниже нормального (как правило, менее 3 л/мин).
† При некоторых состояниях сердечный выброс, предшествующий развитию сердечной недостаточности, бывает выше нормального. Это наблюдается, например, у пациентов с тиреотоксикозом, хроническими анемиями, артериовенозными шунтами, после вливания избытка жидкости в сосудистое русло. При развитии у этих пациентов сердечной недостаточности величина сердечного выброса остаётся выше нормального диапазона (например, более 7–8 л/мин). Однако, и в этих условиях отмечается недостаточность кровоснабжения органов и тканей, поскольку сердечный выброс остается ниже потребной величины. Подобные состояния известны как сердечная недостаточность с высоким выбросом крови.
• Увеличение остаточного систолического объёма крови в полостях желудочков сердца. Является следствием так называемой неполной систолы.
Неполное опорожнение желудочков сердца представляет собой результат избыточного притока крови к нему (например, при клапанной недостаточности), чрезмерно повышенного ОПСС (например, при артериальных гипертензиях, стенозе аорты), прямого повреждения миокарда.
• Повышение конечного диастолического давления в желудочках сердца. Обусловлено увеличением количества крови, скапливающейся в их полости; нарушением расслабления миокарда, дилатацией полостей сердца вследствие увеличения в них объёма крови и растяжения миокарда.
• Повышение давления крови в тех венозных сосудах и сердечных полостях, откуда кровь поступает в преимущественно поражённые отделы сердца. Так, при левожелудочковой сердечной недостаточности повышается давление в левом предсердии, малом круге кровообращения и правом желудочке. При правожелудочковой сердечной недостаточности давление увеличивается в правом предсердии и в венах большого круга кровообращения.
• Снижение скорости систолического сокращения и диастолического расслабления миокарда. Проявляется, главным образом, увеличением длительности периода изометрического напряжения и систолы сердца в целом.
Этиология
Острая сердечная недостаточность чаще развивается вследствие заболеваний, приводящих к быстрому и значительному снижению сердечного выброса (наиболее часто при инфаркте миокарда). Однако, возможна острая сердечная недостаточность и при высоком сердечном выбросе. Основные причины острой сердечной недостаточности перечислены в табл. 22‑1.
Таблица 22–1. Основные причины острой сердечной недостаточности.
| С низким сердечным выбросом |
| Инфаркт миокарда — большой объём повреждённого миокарда, разрыв стенок сердца, острая недостаточность митрального клапана |
| Декомпенсация хронической сердечной недостаточности — неадекватное лечение, аритмии, тяжёлое сопутствующее заболевание |
| Аритмии (наджелудочковые и желудочковые тахикардии, брадикардии, экстрасистолии, блокады проведения возбуждения) |
| Препятствие на пути тока крови — стенозы устья аорты и митрального отверстия, гипертрофическая кардиомиопатия, опухоли, тромбы |
| Клапанная недостаточность — митрального или аортального клапана |
| Миокардиты |
| Массивная тромбоэмболия лёгочной артерии |
| «Лёгочное сердце» |
| Артериальная гипертензия |
| Тампонада сердца |
| Травма сердца |
| С относительно высоким сердечным выбросом |
| Анемия |
| Тиреотоксикоз |
| Острый гломерулонефрит с артериальной гипертензией |
| Артериовенозное шунтирование |
Острая сердечная недостаточность имеет три клинических проявления: сердечная астма, отёк лёгких и кардиогенный шок. В каждом конкретном случае рекомендуется указывать форму острой сердечной недостаточности (сердечная астма, кардиогенный шок или отёк лёгких), а не общий термин «острая сердечная недостаточность».
Сердечная астма
Удушье (сердечная астма, пароксизмальная ночная одышка) возникает в результате застоя крови в малом круге кровообращения при положении больного лёжа как проявление интерстициального отёка лёгких и резкого увеличения давления крови в сосудах малого круга кровообращения.
Отёк лёгких
Отёк лёгких подразделяют на интерстициальный (наблюдается при сердечной астме) и альвеолярный, которые нужно рассматривать как две стадии одного процесса.
• Интерстициальный отёк лёгких — отёк паренхимы лёгких без выхода транссудата в просвет альвеол. Клинически проявляется одышкой и кашлем без мокроты. При прогрессировании процесса возникает альвеолярный отёк.
• Альвеолярный отёк лёгких характеризуется пропотеванием плазмы в просвет альвеол. У больных появляется кашель с отделением пенистой мокроты, удушье, в лёгких выслушиваются вначале сухие, а затем влажные хрипы.
Отёк лёгких развивается при увеличении давления заклинивания лёгочных капилляров более 25 мм рт.ст.
Патогенез
• Основные звенья патогенеза интерстициального отёка лёгких: увеличение давления в просвете лёгочных капилляров, усиление лимфотока, увеличение объёма внесосудистой жидкости, увеличение сопротивления мелких бронхов, уменьшение растяжимости лёгочной ткани.
• Длительное увеличение внутрисосудистого давления приводит к нарушению целостности альвеолярно-капиллярной мембраны и выходу в полость альвеол жидкости, макромолекул и эритроцитов. В последующем возникает гипоксия, гиперкапния и ацидоз, приводящие к остановке дыхания.
Лечение и прогноз
При отёке лёгких необходимы экстренные мероприятия. Смертность при отёке лёгких составляет 15–20%.
Кардиогенный шок
Кардиогенный шок развивается в результате внезапного снижения сердечного выброса. Как правило, он возникает при обширном инфаркте миокарда на фоне множественного поражения венечных артерий. Подробно кардиогенный шок описан в статье «Шок кардиогенный» приложения «Справочник терминов».
Этиология и патогенез
Основные причины, приводящие к развитию хронической систолической сердечной недостаточности, приведены в табл. 22‑2.
Таблица 22–2. Основные причины хронической систолической сердечной недостаточности.
| С НИЗКИМ СЕРДЕЧНЫМ ВЫБРОСОМ |
| Поражение миокарда |
| ИБС (постинфарктный кардиосклероз, хроническая миокардиальная ишемия), кардиомиопатии, миокардиты, токсические воздействия (например, алкоголь, доксорубицин), инфильтративные заболевания (саркоидоз, амилоидоз), эндокринные заболевания, нарушения питания (дефицит витамина В1) |
| Перегрузка миокарда |
| Артериальная гипертензия, пороки сердца |
| Аритмии |
| Наджелудочковые и желудочковые тахикардии, фибрилляция предсердий |
| С ОТНОСИТЕЛЬНО ВЫСОКИМ СЕРДЕЧНЫМ ВЫБРОСОМ |
| Анемия, тиреотоксикоз, артериовенозное шунтирование |
Под влиянием перечисленных причин нарушается насосная функция сердца. Это приводит к уменьшению сердечного выброса. В результате развивается гипоперфузия органов и тканей. Наибольшее значение имеет снижение перфузии сердца, почек, периферических мышц. Уменьшение кровоснабжения сердца и развитие его недостаточности ведет к активации симпатикоадреналовой системы и учащению ритма сердца. Уменьшение перфузии почек обусловливает стимуляцию ренин-ангиотензиновой системы. Увеличивается выработка ренина, что инициирует избыточную продукцию ангиотензина II. Последний вызывает вазоконстрикцию, задержку воды (отёки, увеличение ОЦК) и последующее увеличение преднагрузки на сердце. Снижение перфузии периферических мышц (и как следствие — развитие гипоксии) обусловливает накопление в них недоокисленных продуктов метаболизма и как результат — выраженную утомляемость. Схема патогенеза хронической систолической сердечной недостаточности приведена на рисунке 22‑29.
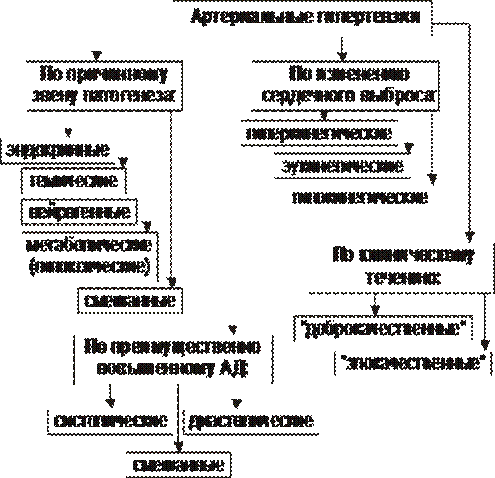
Рис. 22–29. Патогенез хронической систолической сердечной недостаточности.
Классификация
По классификации XII Всесоюзного съезда терапевтов выделяют три стадии хронической сердечной недостаточности (табл. 22‑3).
Таблица 22–3. Классификация хронической сердечной недостаточности.
| Стадия I (начальная) — скрытая сердечная недостаточность, проявляющаяся только при физической нагрузке (одышкой, тахикардией, быстрой утомляемостью) |
| Стадия II (выраженная) — длительная недостаточность кровообращения, нарушения гемодинамики (застой в большом и малом круге кровообращения), нарушения функций органов и обмена веществ выражены и в покое |
| Период А — начало длительной стадии, характеризуется слабо выраженными нарушениями гемодинамики, нарушениями функций сердца или только их части |
| Период Б — конец длительной стадии, характеризуется глубокими нарушениями гемодинамики, в процесс вовлекается вся сердечно-сосудистая система |
| Стадия III (конечная, дистрофическая) — тяжёлые нарушения гемодинамики, стойкие изменения обмена веществ и функций всех органов, необратимые изменения структуры тканей и органов |
Проявления
Клинические проявления сердечной недостаточности существенно зависят от её стадии.
Стадия I. Признаки (быстрая утомляемость, одышка и сердцебиение) появляются при обычной физической нагрузке, в покое проявлений сердечной недостаточности нет.
Стадия IIА. Слабо выраженные нарушения гемодинамики. Клинические проявления зависят от преимущественно поражённых отделов сердца (правых или левых).
• Левожелудочковая недостаточность характеризуется застоем в малом круге кровообращения. Проявляется одышкой при умеренной физической нагрузке, приступами пароксизмальной ночной одышки, быстрой утомляемостью.
• Правожелудочковая недостаточность характеризуется формированием застойных явлений в большом круге кровообращения. Пациентов беспокоит боль и тяжесть в правом подреберье, уменьшение диуреза. Характерно увеличение печени. Отличительной особенностью сердечной недостаточности стадии IIА считают полное компенсирование состояния на фоне лечения, т.е. обратимость сердечной недостаточности в результате адекватной терапии.
Стадия IIБ. Развиваются глубокие нарушения гемодинамики. В процесс вовлечена вся система кровообращения. Одышка возникает при малейшей физической нагрузке. Больных беспокоят чувство тяжести в правой подрёберной области, общая слабость, нарушение сна. Характерны ортопноэ, отёки, асцит (вследствие увеличения давления в печёночных венах усиливается транссудация, и жидкость в избытке накапливается в брюшной полости), гидроторакс, гидроперикард.
Стадия III. Конечная (дистрофическая) стадия с глубокими необратимыми нарушениями обмена веществ. Как правило, состояние больных в этой стадии тяжёлое. Одышка выражена даже в покое. Характерны массивные отёки, скопление жидкости в полостях тела (асцит, гидроторакс, гидроперикард, отёк половых органов). На этой стадии возникает кахексия, обусловленная следующими причинами.
• Увеличение секреции фактора некроза опухоли.
• Усиление метаболизма вследствие увеличения работы дыхательных мышц, повышения потребности гипертрофированного сердца в кислороде.
• Снижение аппетита, тошнота, рвота центрального генеза, а также вследствие интоксикации гликозидами, застоя в брюшной полости.
• Ухудшение всасывания в кишечнике из-за застоя в системе воротной вены.
Лечение
При лечении хронической сердечной недостаточности необходимо в первую очередь оценить возможность воздействия на её причину (см. табл. 22‑3). В ряде случаев эффективное этиотропное воздействие (например, хирургическая коррекция порока сердца, реваскуляризация миокарда при ИБС) может значительно уменьшить выраженность проявлений хронической сердечной недостаточности.
В лечении хронической сердечной недостаточности выделяют немедикаментозные и лекарственные методы терапии. Следует отметить, что оба вида лечения должны дополнять друг друга.
• Немедикаментозное лечение. Включает ограничение употребления поваренной соли до 5–6 г/сут, жидкости (до 1–1,5 л/сут) и оптимизацию физической активности. Умеренная физическая активность возможна (ходьба как минимум по 20–30 мин 3–5 раз в неделю). Полный физический покой следует соблюдать при ухудшении состояния (в покое урежается ЧСС и уменьшается работа сердца).
• Лекарственное лечение
Конечная цель лечения хронической сердечной недостаточности — повышение качества жизни и увеличение её продолжительности. Для достижения этой цели стимулируют сократительную функцию миокарда, уменьшают ОЦК (снижение преднагрузки), снижают ОПСС (уменьшение постнагрузки), устраняют чрезмерное влияние на сердце симпатической нервной системы, предотвращают или устраняют расстройства системы гемостаза (профилактика тромботического синдрома и ДВС), устраняют нарушения ритма сердца.
Из ЛС в лечении хронической сердечной недостаточности (в зависимости от клинических проявлений заболевания) применяют диуретики, ингибиторы АПФ, сердечные гликозиды, другие кардиотонические средства, вазодилататоры, b-адреноблокаторы, антикоагулянты, антиаритмические средства.
• Хирургические методы лечения. При развитии хронической сердечной недостаточности на фоне ИБС решают вопрос о своевременной реваскуляризации миокарда. При наличии сердечной недостаточности на фоне брадиаритмии показана электрокардиостимуляция. Частые пароксизмы желудочковой тахикардии считают показанием для имплантации кардиовертера-дефибриллятора. Крайняя мера в лечении рефрактерной сердечной недостаточности — пересадка сердца. Пятилетняя выживаемость при своевременно проведённой пересадке сердца составляет 70%.
Этиология и патогенез
К возникновению диастолической сердечной недостаточности приводят ИБС (с инфарктом миокарда или без него), гипертрофическая кардиомиопатия, амилоидоз сердца, артериальная гипертензия, клапанные пороки сердца, сахарный диабет, констриктивный перикардит.
В результате снижения податливости и нарушения наполнения левого желудочка в нём повышается конечное диастолическое давление, что вызывает снижение сердечного выброса. Увеличивается давление в левом предсердии, малом круге кровообращения. В последующем может возникать правожелудочковая сердечная недостаточность.
Лечение
Проводят немедикаментозные мероприятия, аналогичные таковым при хронической систолической сердечной недостаточности, включающие ограничение потребления поваренной соли, жидкости, оптимизацию физической активности. Из ЛС используют следующие группы.
• b-Адреноблокаторы. Урежают ЧСС и удлиняют диастолу.
• Блокаторы медленных кальциевых каналов (верапамил, дилтиазем). Оказывают действие, подобное действию b-адреноблокаторов.
• Нитраты. Применяют при наличии ИБС (использовать их необходимо осторожно из-за возможного избыточного уменьшения преднагрузки, что может вызвать артериальную гипотензию).
• Диуретики. Необходимо применять осторожно в связи с угрозой избыточного уменьшения преднагрузки и уменьшения сердечного выброса.
• Ингибиторы АПФ. Уменьшают гипертрофию левого желудочка и улучшают расслабление левого желудочка.
• Сердечные гликозиды. При диастолической сердечной недостаточности противопоказаны, поскольку они могут способствовать дальнейшему ухудшению диастолического расслабления левого желудочка. ЛС с положительным инотропным действием (в том числе сердечные гликозиды) назначают только при сопутствующей систолической сердечной недостаточности.
Прогноз
Смертность от диастолической сердечной недостаточности составляет 8% в год.
Таблица 22–4. Принципы и цели нормализации функции сердца при его недостаточности.
| Цели | Примеры ЛС |
| Этиотропный принцип | |
| Уменьшить постнагрузку (снизить тонус резистивных сосудов) | Вазодилататоры, |
| Уменьшить преднагрузку (снизить возврат венозной крови к сердцу) | Венозные вазодилататоры, диуретики |
| Патогенетический принцип | |
| Повысить сократительную функцию сердца | Адреномиметики, сердечные гликозиды,·ингибиторы фосфодиэстеразы |
| Уменьшить нарушения энергообеспечения кардиомиоцитов | Антигипоксанты,·антиоксиданты,·коронародилататоры |
| Защитить мембраны и ферменты кардиомиоцитов от факторов повреждения | ЛС с мембранопротекторным эффектом |
| Уменьшить дисбаланс ионов и воды в миокарде | Регуляторы транспорта ионов через мембраны (калийсберегающие вещества, блокаторы кальциевых каналов и др.),·препараты магния |
| Скорректировать адрено‑ и холинергические влияния на сердце, его адрено‑ и холинореактивные свойства | Симпатолитики,·ЛС с положительным инотропным действием (при достаточном миокардиальном резерве),·холиномиметики |
При своевременном начале терапии и её рациональном проведении возможна длительная нормализация сердечной деятельности и системной гемодинамики.
Терминология
Для адекватного обозначения различных состояний и реакций, характеризующихся изменением АД, применяют специальные термины и понятия. Важно различать значения терминологических элементов «тония» и «тензия».
• Терминологический элемент «тония» применяется для характеристики тонуса мышц, в том числе — ГМК сосудистой стенки.
† Гипертония означает избыточное напряжение мышц, проявляющееся увеличением их сопротивления растяжению.
† Гипотония подразумевает снижение напряжения мышц, проявляющееся уменьшением их сопротивления растяжению.
• Терминологический элемент «тензия» используют для обозначения давления жидкостей в полостях и сосудах, в том числе — кровеносных.
† Гипертензия означает повышение, а гипотензия — снижение давления в полостях организма, его полых органах и сосудах. Адекватным для обозначения гипер‑ или гипотензивных состояний является использование именно элемента «тензия», поскольку уровень АД зависит не только от тонуса ГМК сосудов (при некоторых видах гипертензии он не повышен, а может быть даже ниже нормы), но также от величины минутного выброса сердца и ОЦК.
† Тем не менее, термины «Гипертоническая болезнь» и «Гипертонический криз» применяют для обозначения эссенциальной артериальной гипертензии и грозного осложнения артериальной гипертензии соответственно.
• Лекарственные средства (независимо от механизма их действия: на тонус сосудов, сердечный выброс, ОЦК) называют гипотензивными (ЛС, снижающие АД) и гипертензивными (ЛС, вызывающие повышение АД).
• Необходимо различать понятия «гипер- и гипотензивная реакция» и «артериальная гипер- или гипотензия».
† Гипер‑ или гипотензивная реакция — адаптивная и преходящая (временная) реакция ССС (после неё АД нормализуется в связи с прекращением действия агента, вызвавшего реакцию), регулируемая физиологическими механизмами;
† Артериальная гипер‑ или гипотензия носит стойкий характер, обычно не устраняется после прекращения действия причинного фактора и сопровождаются повреждением органов и тканей, а также снижением адаптивных возможностей организма.
Артериальные гипертензии
Артериальная гипертензия — состояние, при котором систолическое АД составляет 140 мм рт.ст. и более и/или диастолическое АД 90 мм рт.ст. и более (при условии, что эти значения получены в результате как минимум трёх измерений, произведённых в различное время на фоне спокойной обстановки, а больной за сутки до измерений не принимал ЛС, изменяющих АД).
Таблица 22–5. Классификация артериальной гипертензии.
| Категория | Систолическое АД мм рт.ст. | Диастолическое АД мм рт.ст. |
| Оптимальное | <120 | <80 |
| Нормальное | <130 | <85 |
| Высокое нормальное | 130–139 | 85–89 |
| I степень (мягкая) | 140–159 | 90–99 |
| подгруппа: пограничная | 140–149 | 90–94 |
| II степень (умеренная) | 160–179 | 100–109 |
| III степень (выраженная) | >180 | >110 |
| Изолированная систолическая | >140 | <90 |
| подгруппа: пограничная | 140–149 | <90 |
Примечание. При определении категории следует использовать наибольшее значение АД, например 140/100 мм рт.ст. — степень II артериальной гипертензии.
• Если удаётся выявить причины артериальной гипертензии, то её считают вторичной (симптоматической).
• При отсутствии явной причины гипертензии она называется первичной, эссенциальной, идиопатической, а в России — гипертонической болезнью.
• Изолированная систолическая артериальная гипертензия диагностируется при повышении систолического АД более 140 мм рт.ст. и диастолического АД менее 90 мм рт.ст.
• Артериальную гипертензию считают злокачественной при уровне диастолического АД более 120 мм рт.ст.
• Исключительно стремительно и катастрофически по последствиям развиваются артериальные гипертензии при гестозах.
Группы риска
• Группа низкого риска. Эта группа включает мужчин и женщин моложе 55 лет с артериальной гипертензией 1-й степени при отсутствии факторов риска, поражения органов-мишеней и сопутствующих сердечно-сосудистых заболеваний. Риск развития сердечно-сосудистых осложнений в ближайшие 10 лет составляет менее 15%.
• Группа среднего риска. Эта группа включает в себя пациентов с широким диапазоном АД. Принципиальным признаком принадлежности к этой группе является наличие факторов риска (мужчины старше 55 лет, женщины старше 65 лет, курение, холестерин более 6,5 ммоль/л, семейный анамнез ранних сердечно-сосудистых заболеваний) при отсутствии поражения органов-мишеней и/или сопутствующих заболеваний. Иными словами, эта группа объединяет пациентов с небольшим повышением АД и многочисленными факторами риска и пациентов с выраженным повышением АД. Риск развития сердечно-сосудистых осложнений в ближайшие 10 лет составляет 15-20%.
• Группа высокого риска. К этой категории относятся пациенты, имеющие поражение органов-мишеней (гипертрофия левого желудочка по ЭКГ, эхокардиографии; протеинурия или креатининемия 1,2–2 мг/дл, генерализованное или очаговое сужение артерий сетчатки) независимо от степени артериальной гипертензии и сопутствующих факторов риска. Угроза развития сердечно-сосудистых осложнений в ближайшие 10 лет превышает 20%.
• Группа очень высокого риска. К этой группе относят пациентов, у которых имеются ассоциированные заболевания (стенокардия и/или перенесённый инфаркт миокарда, операция реваскуляризации, сердечная недостаточность, перенесённые мозговой инсульт или транзиторная ишемическая атака, нефропатия, хроническая почечная недостаточность, поражение периферических сосудов, ретинопатия степени III-IV) независимо от степени артериальной гипертензии. В эту группу включают также больных с АД на верхней границе нормы при наличии сахарного диабета. Риск развития сердечно-сосудистых осложнений в ближайшие 10 лет превышает 30%.
Рис. 22–30. Виды артериальных гипертензий.
• Инициальное звено механизма развития. По этому критерию выделяют общие и местные артериальные гипертензии.
† Общие (системные) артериальные гипертензии подразделяют на нейрогенные, эндокринные, метаболические, гемические и смешанные.
‡ Нейрогенные артериальные гипертензии. Среди них различают центрогенные и рефлекторные (рефлексогенные).
‡ Эндокринные (эндокриногенные, гормональные). Развиваются вследствие эндокринопатий надпочечников, щитовидной железы и гипофиза.
‡ Гипоксические (метаболитогенные, метаболические, ишемические). Выделяют ишемические (почечноишемическая, цереброишемическая), венозно‑застойные и гипоксические (без первичного нарушения гемодинамики в органах и тканях).
‡ Гемические («кровяные»). Развиваются вследствие увеличения объёма и/или вязкости крови.
† Местные (регионарные) артериальные гипертензии.
• Изменение сердечного выброса. Выделяют гиперкинетические и гипокинетические артериальные гипертензии.
† Гиперкинетические. Повышен сердечный выброс (при нормальном или пониженном ОПСС).
† Гипокинетические. Понижен сердечный выброс (при значительно увеличенном ОПСС).
† Эукинетические. Нормальный сердечный выброс и повышенное ОПСС.
• Тип повышения АД. Различают систолические, диастолические и смешанные (систоло‑диастолические) артериальные гипертензии.
• Характер клинического течения. Выделяют артериальные гипертензии злокачественного и доброкачественного течения.
† «Доброкачественные». С медленным развитием, повышением как систолического, так и диастолического АД; как правило, эукинетические.
† «Злокачественные». Быстро прогрессирующие, с преимущественным повышением диастолического АД; как правило, гипокинетические, реже — гиперкинетические (особенно на начальном этапе).
Факторы риска
К факторам риска артериальных гипертензий относятся семейный анамнез (нарушения липидного обмена у самого больного и у его родителей, СД у пациента и его родителей, заболевания почек у родителей), ожирение, злоупотребление алкоголем, избыточное употребление поваренной соли, стресс, гиподинамия, курение, тип личности пациента и его окружение.
Многочисленные виды артериальных гипертензий (включая гипертоническую болезнь — эссенциальную гипертензию) значительно различаются по механизмам патогенеза. Ниже приводится характеристика наиболее часто встречающихся в клинике видов артериальных гипертензий.
Рис. 22–31. Виды нейрогенных артериальных гипертензий.
• Центрогенные артериальные гипертензии.
† Корковые и подкорковые нейроны — нервные центры, участвующие в регуляции АД — сложная функциональная система, состоящая из прессорно‑гипертензивной и депрессорно‑гипотензивной подсистем при доминировании прессорно‑гипертензивных механизмов. Главной структурой, регулирующей системное АД, является кардиовазомоторный (сосудодвигательный) центр. Его эфферентные влияния изменяют как тонус сосудов, так и функцию сердца.
† Причины: нарушения ВНД, органические поражения структур мозга, регулирующих системную гемодинамику.
† Патогенез центрогенных нейрогенных артериальных гипертензий приведён на рис. 22–32.

Рис. 22–32. Основные звенья патогенеза центрогенных нейрогенных артериальных гипертензий.
‡ Артериальные гипертензии, обусловленные нарушениями ВНД (неврозом). Повторные и затяжные стресс‑реакции с негативной эмоциональной окраской вызывают цепь взаимозависимых прогрессирующих изменений. Наиболее важными являются:
§ Перенапряжение и срыв основных корковых нервных процессов (возбуждения и активного коркового торможения), нарушение их сбалансированности и подвижности.
§ Развитие невротического состояния.
Невроз — инициальное патогенетическое звено артериальных гипертензий центрогенного характера. Развивается в результате повторных стрессорных воздействий.
§ Формирование корково‑подкоркового комплекса возбуждения (доминанты возбуждения) — закономерного следствия невроза. Этот комплекс включает симпатические ядра заднего гипоталамуса и адренергические структуры ретикулярной формации и кардиовазомоторного центра.
§ Усиление влияний симпатической нервной системы на органы и ткани. Проявляется высвобождением избытка катехоламинов.
§ Повышение под влиянием катехоламинов тонуса стенок артериальных и венозных сосудов.
§ Стимуляция катехоламинами работы сердца: увеличение ударного и минутного выбросов крови.
§ Повышение систолического и диастолического АД.
§ Активация (в связи с возбуждением подкорковых центров) и других «гипертензивных» систем. Основной среди них является система «гипоталамус — гипофиз — надпочечники». Это сопровождается увеличением продукции и концентрации в крови гормонов с гипертензивным действием (АДГ, АКТГ и кортикостероидов [включая минерало‑ и глюкокорикоиды], катехоламинов, тиреоидных гормонов).
§ Потенцирование указанными веществами степени и длительности сужения артериол и венул, увеличения ОЦК, повышения сердечного выброса.
Это ведёт к стойкому значительному повышению АД — развивается артериальная гипертензия.
Описанные выше звенья патогенеза центрогенной артериальной гипертензии характерны и для инициальных этапов гипертонической болезни (эссенциальной гипертензии).
‡ Артериальные гипертензии, обусловленные органическими повреждениями структур мозга, участвующих в регуляции АД.
§ Наиболее частые причины: травма мозга (например, при его сотрясении или ушибах), энцефалиты, опухоли мозга или его оболочек, приводящие к его сдавлению, кровоизлияние в желудочки мозга, очаговые ишемические поражения мозга.
§ Общий патогенез. Указанные причины непосредственно повреждают структуры, участвующие в регуляции уровня АД (симпатические ядра гипоталамуса, ретикулярную формацию, кардиовазомоторный центр). Это активирует симпатическую нервную систему и систему «гипоталамус — гипофиз — надпочечники». Повышение же в крови уровней катехоламинов, АДГ, кортикостероидов, тиреоидных гормонов обусловливает увеличение тонуса стенок резистивных сосудов и как следствие — ОПСС, повышение ОЦК, возрастание величины сердечного выброса.
В результате развивается стойкое повышение АД — артериальная гипертензия.
‡ Цереброишемическая гипертензия.
§ Причина: нарушение кровоснабжения головного мозга, особенно — продолговатого, где расположен сосудодвигательный центр. Наиболее часто это наблюдается при атеросклерозе (преимущественно ветвей внутренних сонных артерий), тромбозе кровоснабжающих мозг сосудов, сдавливающих мозг и его сосуды опухолях.
§ Механизм развития.
- Мозг весьма чувствителен к снижению содержания кислорода в крови. В организме существует система защиты мозга от нарушений кровоснабжения в виде механизмов, обеспечивающих повышение системного АД (это ведёт к увеличению перфузионного давления во всех органах, включая мозг), понижающих сопротивление сосудов мозга кровотоку (вазодилатация), а также включающих коллатеральное кровообращение.
В физиологическом плане второй способ предпочтительнее, поскольку он не ведёт к изменениям кровообращения в других органах. По преимуществу именно этот механизм обеспечивает адекватную церебральную гемодинамику в норме. Однако, при длительном и выраженном нарушении мозгового кровообращения происходит стойкое повышение системного АД в результате цепи последовательных патогенных процессов.
- При значительном снижении перфузионного давления в сосудах мозга активируется симпатикоадреналовая система. Это приводит к существенному и стойкому увеличению концентрации катехоламинов в крови.
Повышенные уровни адреналина и норадреналина вызывают значительное увеличение сердечного выброса (за счёт положительного хроно‑ и инотропного эффектов их) и сужение артериол, ведущее к повышению ОПСС.
Эти эффекты катехоламинов приводят к значительному повышению АД. При хронической ишемии мозга это завершается развитием артериальной гипертензии.
- Гипертензию усугубляет увеличение в крови pCO2. Повышение рCO2 приводит к непосредственной активации нейронов вазомоторного центра и возрастанию возбудимости нервных клеток других структур мозга. Это потенцирует активацию нейронов симпатической нервной системы, что сопровождается ещё большей гиперкатехоламинемией и гипертензией.
• Рефлекторные артериальные гипертензии.
Рефлекторные (рефлексогенные) артериальные гипертензии могут развиваться на основе условных и безусловных рефлексов. Известны случаи рефлекторной артериальной гипертензии в виде т.н. артериальной гипертензии «белого халата». Для неё характерно повышение АД в лечебном учреждении, в то время как вне него АД нормальное. При проведении суточного мониторирования АД находят нормальные величины среднесуточного АД — менее 125/80 мм рт.ст.
† Условнорефлекторные артериальные гипертензии.
Причина: повторное сочетание индифферентных (условных) сигналов (например, информации о предстоящем публичном выступлении, важном соревновании или событии) с действием агентов, вызывающих повышение АД (например, кофеина, адреномиметиков, психостимуляторов, алкоголя или наркотиков).
После определённого числа сочетаний увеличение АД регистрируется уже только на индифферентный сигнал. Через некоторое время может развиться стойкое повышение АД. Так, описан случай артериальной гипертензии у человека, принимавшего перед чтением лекций и докладов кофеин (для психологического допинга). Вскоре у него регистрировалось повышение АД до 180 и 115 мм рт.ст. уже при одной мысли о предстоящей лекции. Спустя несколько лет у этого человека развилась артериальная гипертензия.
† Безусловнорефлекторные артериальные гипертензии.
Безусловнорефлекторные артериальные гипертензии развиваются в результате хронического раздражения экстеро‑ и интерорецепторов, нервных стволов и нервных центров или вследствие прекращения «депрессорной» афферентной импульсации.
‡ Гипертензии, развивающиеся в результате хронического раздражения экстеро‑ и интерорецепторов, нервных стволов или нервных центров. Причины: длительно протекающие болевые (каузалгические) синдромы (например, при повреждении или воспалении тройничного, лицевого, седалищного и других нервов), энцефалиты, опухоли мозга (например, в области зрительных бугров, промежуточного или продолговатого мозга).
‡ Формирующиеся вследствие прекращения афферентной импульсации, оказывающей тормозящее (сдерживающее, депрессорное) влияние на тоническую активность кардиовазомоторного (прессорного) центра.
В норме даже незначительные колебания АД вызывают увеличение (при его повышении) или уменьшение (при снижении АД) депрессорной импульсации. Рецепторы, реагирующие на их растяжение, расположены в различных регионах сосудистой системы, но в наибольшей мере — в области дуги аорты (от этой зоны отходит депрессорный нерв Людвига‑Циона) и разветвления сонной артерии — каротидного синуса (отсюда отходит депрессорный нерв Херинга).
‡ Длительное снижение или прекращение импульсации от указанных и других зон «высвобождает» кардиовазомоторный центр от сдерживающих влияний и может обусловить развитие артериальной гипертензии.
Эндокринные артериальные гипертензии
Эти гипертензии составляют до 1% всех артериальных гипертензий (по данным специализированных клиник — до 12%) и развиваются в результате гипертензивного эффекта ряда гормонов (рис. 22–33).

Рис. 22–33. Общие звенья патогенеза эндокринных артериальных гипертензий.
• Артериальная гипертензия при эндокринопатиях надпочечников. Не менее половины всех пациентов с эндокринными гипертензиями приходится на надпочечниковые артериальные гипертензии.
† Надпочечники являются главным эндокринным органом, обеспечивающим регуляцию системного АД. Все гормоны надпочечников в норме имеют более или менее выраженное отношение к регуляции АД, а в патологии участвуют в формировании и закреплении повышенного АД.
† Надпочечниковые артериальных гипертензий подразделяют на катехоламиновые и кортикостероидные, а последние на минералокортикоидные и глюкокортикоидные.
‡ Минералокортикоидные артериальные гипертензии. В патогенезе артериальной гипертензии основное значение имеет избыточный синтез минералокортикоида альдостерона (гиперальдостеронизм первичный и вторичный). Кортизол, 11-дезоксикортизол, 11-дезоксикортикостерон, кортикостерон, хотя и имеют незначительную минералокортикоидную активность, расцениваются как глюкокортикоиды (их суммарный вклад в развитие артериальной гипертензии мал).
§ Первичный гиперальдостеронизм. Артериальная гипертензия при первичном гиперальдостеронизме составляет до 0,4% всех случаев артериальных гипертензий. Различают несколько этиологических форм первичного гиперальдостеронизма: синдром Конна (аденома, продуцирующая альдостерон), адренокортикальная карцинома, первичная надпочечниковая гиперплазия, идиопатическая двусторонняя надпочечниковая гиперплазия. Основные проявления первичного гиперальдостеронизма: артериальная гипертензия и гипокалиемия (вследствие увеличения почечной реабсорбции Na2+).
§ Вторичный альдостеронизм. Развивается как следствие патологических процессов, протекающих в других органах и их физиологических системах (например, при сердечной, почечной, печёночной недостаточности). При этих формах патологии может наблюдаться гиперпродукция альдостерона в клубочковой зоне коры обоих надпочечников.
§ Гиперальдостеронизм любого генеза сопровождается повышением АД. Патогенез артериальных гипертензий при гиперальдостеронизме приведён на рис. 22–34.

Рис. 22–34. Общие звенья патогенеза артериальных гипертензий при гиперальдостеронизме.
‡ Глюкокортикоидные артериальные гипертензии. Являются результатом гиперпродукции глюкокортикоидов, в основном кортизола (17-гидрокортизон, гидрокортизон, на его долю приходится 80%). Остальные 20% — кортизон, кортикостерон, 11-дезоксикортизол и 11-дезоксикортикостерон). Практически все артериальные гипертензии глюкокортикоидного генеза развиваются при болезни и синдроме Иценко‑Кушинга (см. в приложении «Справочник терминов»).
‡ Катехоламиновые артериальные гипертензии. Развиваются в связи со значительным увеличением в крови катехоламинов — адреналина и норадреналина, вырабатываемых хромафинными клетками. В 99% всех случаев такой гипертензии обнаруживают феохромоцитому. Артериальная гипертензия при феохромоцитоме встречается менее чем в 0,2% случаев всех артериальных гипертензий.
§ Механизм гипертензивного действия избытка катехоламинов. Катехоламины одновременно увеличивают тонус сосудов и стимулируют работу сердца.
- Норадреналин стимулирует в основном a‑адренорецепторы и в меньшей мере — b‑адренорецепторы. Это приводит к повышению АД за счёт сосудосуживающего эффекта.
- Адреналин воздействует как на a‑, так и на b‑адренорецепторы. В связи с этим наблюдается вазоконстрикция (и артериол, и венул) и возрастание работы сердца (за счёт положительного хроно‑ и инотропного эффектов) и выброса крови в сосудистое русло.
В совокупности эти эффекты и обусловливают развитие артериальной гипертензии.
§ Проявления феохромоцитомы разнообразны, но неспецифичны. Артериальную гипертензию отмечают в 90% случаев, головная боль возникает в 80% случаев, ортостатическая артериальная гипотензия — в 60%, потливость — в 65%, сердцебиение и тахикардия — в 60%, страх смерти — в 45%, бледность — в 45%, тремор конечностей — в 35%, боль в животе — в 15%, нарушения зрения — в 15% случаев. В 50% случаев артериальная гипертензия может быть постоянной, а в 50% — сочетаться с кризами. Криз обычно возникает вне связи с внешними факторами. Часто наблюдается гипергликемия (в результате стимуляции гликогенолиза).
• Артериальная гипертензия при эндокринопатиях щитовидной железы. Встречается как при гипертиреозе, так и при гипотиреозе.
Гипертиреоз. Характерные признаки гипертиреоза — увеличенные ЧСС и сердечный выброс, преимущественно изолированная систолическая артериальная гипертензия с низким (нормальным) диастолическим АД. Считают, что увеличение диастолического АД при гипертиреозе — признак другого заболевания, сопровождающегося артериальной гипертензией или признак гипертонической болезни.
Гипотиреоз. Характерный признак гипотиреоза — высокое диастолическое АД. Другие проявления со стороны ССС — уменьшение ЧСС и сердечного выброса.
В обоих случаях для уточнения диагноза необходимо определение функций щитовидной железы.
Патогенез. В основе развития артериальной гипертензии лежит кардиотонический эффект T3 и T4. Он характеризуется значительным увеличением минутного выброса сердца. Это достигается благодаря выраженной тахикардии (в связи с положительным хронотропным эффектом) и увеличению ударного выброса (за счёт положительного инотропного эффекта тиреоидных гормонов).
• Артериальная гипертензия при расстройствах эндокринной функции гипоталамо‑гипофизарной системы. Наибольшее клиническое значение имеет артериальная гипертензия, развивающаяся при значительном и длительном увеличении в крови АДГ и АКТГ.
† Гиперпродукция АДГ.
Патогенез.
§ Активация (под влиянием АДГ) реабсорбции жидкости из первичной мочи. Это реализуется при взаимодействии АДГ с его рецепторами, связанными с водными каналами — аквапоринами.
§ Увеличение (в связи с этим) ОЦК (гиперволемия). Это само по себе может привести к увеличению уровня АД.
§ Повышение величины сердечного выброса. Вызвано увеличением притока крови к сердцу в связи с гиперволемией. Избыток крови, растягивая миокард, увеличивает (согласно закону Франка‑Старлинга) силу его сокращений и как следствие — величину выброса сердца и АД.
§ Стимуляция АДГ его рецепторов в ГМК стенок артериол. Это приводит к сужению их просвета, повышению ОПСС и уровня АД.
† Гиперпродукция АКТГ. При этом развивается болезнь Иценко‑Кушинга (см. в приложении «Справочник терминов»).
• Артериальная гипертензия при паранеопластических эндокринопатиях. Артериальные гипертензии часто развиваются при паранеопластических синдромах (см. «Синдром паранеопластический эндокринный» в приложении «Справочник терминов»).
Артериальные гипертензии, вызванные гипоксией органов
Артериальные гипертензии, развивающиеся в результате гипоксии органов (особенно мозга и почек), нередко встречаются в клинической практике. Они обозначаются как «гипоксические» (метаболические, органо-ишемические). К ним относят артериальные гипертензии, в основе патогенеза которых лежат нарушения метаболизма веществ с гипо- и гипертензивным действием. Возникают эти гипертензии в результате расстройств кровообращения и последующей гипоксии различных внутренних органов.
• Гипо- и гипертензивные метаболиты. Вышеназванные расстройства возникают вследствие увеличения эффектов на клетки- и органы–мишени гипертензивных (прессорных) метаболитов или уменьшения эффектов гипотензивных (депрессорных) метаболитов. Метаболиты с гипертензивными и гипотензивными эффектами перечислены на рис. 22–35.
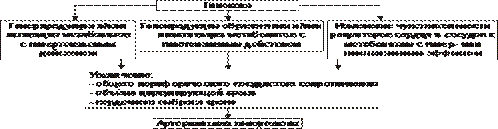
Рис. 22–35. Метаболиты с гипертензивным и гипотензивным действием, участвующие в развитии артериальных гипер‑ и гипотензий.
† Метаболиты с гипертензивным (прессорным) действием: ангиотензины (в наибольшей мере — ангиотензин II), биогенные амины (серотонин, тирамин), ПгF, тромбоксан А2, эндотелин, циклические нуклеотиды (в основном цАМФ).
† Метаболиты с гипотензивным (депрессорным) эффектом: кинины (особенно, брадикинин и каллидин), Пг групп E и I, аденозин, ацетилхолин, натрийуретические факторы (в том числе атриопептин), ГАМК, оксид азота (NО).
• Патогенез гипоксических артериальных гипертензий представлен на рис. 22–36.

Рис. 22–36. Общие звенья патогенеза гипоксических артериальных гипертензий.
• Клинические разновидности. Наиболее частыми клиническими разновидностями гипоксических (метаболических) артериальных гипертензий являются цереброишемическая гипертензия (см. выше) и почечные (вазоренальная и ренопаренхиматозная) гипертензии.
Гипертензия артериальная вазоренальная
Вазоренальная (реноваскулярная, почечно‑ишемическая) артериальная гипертензия — симптоматическая артериальная гипертензия, вызванная ишемией почки (почек) вследствие окклюзии почечных артерий.
† Распространённость составляет 1–2% (до 4–16% по данным специализированных клиник) среди всех видов артериальных гипертензий. Из них 60–70% возникает при атеросклерозе почечных артерий, 30–40% — при фибромускулярной дисплазии, менее 1% — редкие причины (аневризма почечной артерии, тромбоз почечных артерий, почечные артериовенозные фистулы, тромбоз почечных вен).
† Проявления. Клиническая картина определяется симптомами артериальной гипертензии и основного заболевания почек.
† Патогенез.
‡ Последовательные этапы патогенеза вазоренальной артериальной гипертензии приведены на рис. 22–37.
Рис. 22–37. Основные звенья патогенеза вазоренальной артериальной гипертензии.
‡ Наибольшее значение имеет активация ренин-ангиотензиновой системы вследствие гипоперфузии почки (почек). Это ведёт к спазму сосудов, увеличению синтеза альдостерона, задержке ионов натрия и воды, увеличению внутрисосудистого объёма и стимуляции симпатической нервной системы.
‡ Ключевые факторы развития артериальной гипертензии — ангиотензин II и альдостерон.
‡ Отдельные звенья патогенеза рассмотрены в разделе «Почечные отёки» главы 11, на рис. 11–17, а также в статьях «Ангиотензины», «Ренин», «Вазопрессин (АДГ)», «Синдром неадекватной секреции АДГ», «Ингибитор АПФ», «Система ренин‑ангиотензин‑альдостероновая», «Альдостерон».
Гипертензия артериальная ренопаренхиматозная
Ренопаренхиматозная (ренопривная, от лат. ren почка, privo лишать чего‑либо) артериальная гипертензия — симптоматическая (вторичная) артериальная гипертензия, вызванная врождённым или приобретённым заболеванием почек.
† Заболевания почек: двусторонние (гломерулонефрит, диабетическая нефропатия, тубулоинтерстициальный нефрит, поликистоз) и односторонние поражения почек (пиелонефрит, опухоль, травма, одиночная киста почки, гипоплазия, туберкулёз). Наиболее частая причина — гломерулонефрит.
† Распространённость. Ренопаренхиматозная артериальная гипертензия составляет 2–3% (4–5% по данным специализированных клиник) среди всех видов артериальных гипертензий.
† Проявления определяется симптомами артериальной гипертензии и основного заболевания почек. Основными признаками этой формы артериальной гипертензии считают наличие заболеваний почек в анамнезе, изменений в анализах мочи (протеинурия более 2 г/сут, цилиндрурия, гематурия, лейкоцитурия, высокая концентрация креатинина крови), УЗИ-признаков поражения почек. Обычно изменения в анализах мочи предшествуют повышению АД.
† Патогенез. В патогенезе ренопаренхиматозной артериальной гипертензии имеют значение гиперволемия, гипернатриемия (из-за уменьшения количества функционирующих нефронов и активации ренин-ангиотензиновой системы), увеличение ОПСС при нормальном или сниженном сердечном выбросе.
‡ Причина: уменьшение массы паренхимы почек, вырабатывающей БАВ с гипотензивным действием (Пг групп E и I с сосудорасширяющим эффектом, брадикинин и каллидин.
‡ Последовательные этапы патогенеза ренопривной артериальной гипертензии приведены на рис. 22–38.
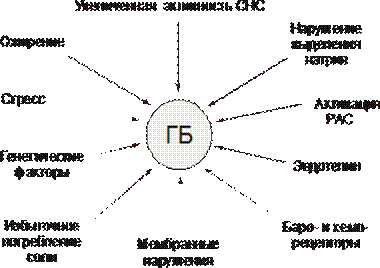
Рис. 22–38. Основные звенья патогенеза ренопаренхиматозной артериальной гипертензии.
Гемические артериальные гипертензии
Изменения состояния крови (увеличение её массы и/или вязкости) нередко приводит к развитию артериальной гипертензии. Так, при полицитемиях (истинной и вторичных), гиперпротеинемии и других подобных состояниях в 25–50% случаев регистрируется стойкое повышение АД.
Смешанные артериальные гипертензии
Помимо указанных выше, артериальные гипертензии могут развиваться в результате одновременного включения нескольких механизмов. Например, артериальные гипертензии при повреждении мозга или развитии аллергических реакций формируются с участием нейрогенного, эндокринного и почечного патологических факторов.
Лекарственные артериальные гипертензии
В патогенезе артериальной гипертензии, вызванной ЛС, могут иметь значение вазоконстрикция из-за стимуляции симпатикоадреналовой системы или прямого воздействия на ГМК кровеносных сосудов, увеличение вязкости крови, стимуляция ренин-ангиотензиновой системы, задержка ионов натрия и воды, взаимодействие с центральными регуляторными механизмами.
Адреномиметики. Капли в нос и лекарства от насморка, содержащие адреномиметические или симпатомиметические средства (например, эфедрин, псевдоэфедрин, фенилэфрин), могут повысить АД.
Пероральные контрацептивы. Возможные механизмы гипертензивного действия пероральных контрацептивов, содержащих эстрогены, — стимуляция ренин-ангиотензиновой системы и задержка жидкости. По некоторым данным, артериальная гипертензия при приёме контрацептивов развивается примерно у 5% женщин.
НПВС. Вызывают артериальную гипертензию в результате подавления синтеза Пг, обладающих вазодилатирующим эффектом, а также благодаря задержке жидкости.
Трициклические антидепрессанты могут вызвать повышение АД из-за стимуляции симпатической нервной системы.
Глюкокортикоиды вызывают повышение АД вследствие увеличения сосудистой реактивности к ангиотензину II и норадреналину, а также в результате задержки жидкости.
Алкогольная артериальная гипертензия
В 5–25% (!) случаев причиной артериальной гипертензии является хроническое употребление алкоголя. Точный механизм гипертензивного действия алкоголя не известен. Обсуждается значение стимуляции симпатической нервной системы, увеличения продукции глюкокортикоидов, гиперинсулинемии, увеличения захвата ионов кальция клетками и повышение ОПСС под влиянием алкоголя.
Артериальная гипертензия у пожилых
К возрастной категории пожилых относят лиц старше 65 лет. Распространённость артериальной гипертензии в данной возрастной группе достигает 50%. Критерием артериальной гипертензии для пожилых считают АД более 160/90 мм рт.ст. Артериальная гипертензия у пожилых может быть изолированной систолической или одновременно систолической и диастолической. Патогенетически, кроме других факторов, влияющих на повышение АД, у пожилых людей важное значение имеет уменьшение эластичности стенок аорты, что выражается в виде увеличения систолического АД и снижения диастолического АД. Эпидемиологические исследования показали, что — по сравнению с повышением диастолического АД — повышение систолического АД имеет большее значение для прогнозирования риска сердечно-сосудистых осложнений и требует лечения.
Артериальная гипертензия при беременности
Частота всех артериальных гипертензий при беременности может достигать 10%, эссенциальной артериальной гипертензии — 3%. Достоверно об эссенциальной артериальной гипертензии у беременной можно говорить при её наличии до беременности, выраженных клинических проявлениях гипертензивного состояния (головные боли, носовые кровотечения), положительном семейном анамнезе по гипертонической болезни. В зависимости от её стадии нарастает риск осложнений для беременной и для плода. Возможные осложнения: преэклампсия и эклампсия, преждевременная отслойка плаценты, перинатальная гибель плода (4% случаев), инфаркт миокарда и кровоизлияния в головной мозг у беременной.
Преэклампсия
Преэклампсия — гестоз с клиникой нарушения мозгового кровообращения (головная боль, головокружение, туман и мелькание мушек перед глазами, тошнота, боли в подложечной области), развивающийся во второй половине беременности. Основная причина преэклампсии — спазм периферических сосудов.
Этиология и патогенез
• Во время нормально протекающей беременности локальные вазоконстрикторы разрушаются ферментами плаценты. У беременных с преэклампсией найдена их недостаточность.
• Локальные вазоконстрикторы вызывают спазм сосудов и уменьшение плацентарного кровотока (в результате снижается кровоснабжение плода и происходит задержка его развития). Вазоконстрикторы, циркулирующие в сосудистой системе беременной, приводят к развитию артериальной гипертензии и снижению почечного кровотока (клубочковая гипоксия, протеинурия, задержка воды, отёки).
Факторы риска
• Возраст беременной. Вероятность преэклампсии увеличивается с возрастом: от 6% в возрасте 25 лет до 9% в возрасте 35 лет и до 15% у беременных в 40 лет и старше.
• Первые роды. Преэклампсия характерна главным образом для первородящих, особенно для женщин экстремального детородного возраста (т.е. подростков и женщин старше 35 лет).
• Генетические аспекты: дефекты гена AGT ангиотензиногена (*106150, 1q42–q43), недостаточность гидроксиацил-КоА дегидрогеназы, гипертензионная токсемия беременности (189800, сочетается с экспрессией HLA-DR4), недостаточность фактора свёртывания V, цистиноз, недостаточность метилентетрагидрофолат редуктазы, недостаточность синтазы 3 (эндотелиальной) оксида азота.
Проявления
• Повышение АД.
• Увеличение массы тела. Слишком быстрое увеличение массы тела (более 900 г/нед) может быть первым признаком преэклампсии; прибавка массы тела обычно начинается внезапно и связана с патологической задержкой жидкости. Возможны отёки.
• Протеинурия. При преэклампсии может быть незначительной и обычно развивается позже артериальной гипертензии.
• Головная боль. При тяжёлой преэклампсии сильная головная боль может предшествовать появлению судорог. Типичная локализация боли — область лба. В большинстве случаев ненаркотические анальгетики не улучшают состояния.
• Усиление сухожильных рефлексов. Предвещает развитие судорог.
• Боли в эпигастральной области Вслед за появлением боли очень быстро могут последовать судороги (развитие эклампсии).
• Нарушения зрения. Варьируют от слабого затуманивания зрения до слепоты и обусловлены спазмом артериол, ишемией и отёком сетчатки, иногда её отслойкой.
Осложнения: гипертонический криз, острый некроз печени, острый отёк лёгких, преждевременная отслойка плаценты, гибель плода, эклампсия.
Эклампсия
Эклампсия — максимальная степень тяжести гестоза. Основное клиническое проявление — судороги с потерей сознания, не связанные с какой-либо другой церебральной патологией (например, эпилепсией или кровоизлиянием в головной мозг). Эклампсия сопровождается нарушением сознания, артериальной гипертензией, отёками, протеинурией. Обычно эклампсия развивается в третьем триместре беременности или в течение 24 ч после родоразрешения.
Проявления: судороги (локальные и генерализованные) и потеря сознания, цианоз (не всегда), протеинурия (80%), отёки (70%), артериальная гипертензия, возможны ДВС, тромбоцитопения, нарушение функций печени, почечная недостаточность.
Течение и прогноз
• У 25% женщин с эклампсией при следующей беременности возникает артериальная гипертензия, у 5% — артериальная гипертензия тяжёлой степени, у 2% — эклампсия.
• Уже рожавших женщин с эклампсией относят к группе высокого риска развития эссенциальной артериальной гипертензии.
Гипертонический криз
Гипертонический (гипертензивный) криз — острое повышение систолического и/или диастолического АД, сопровождающееся ухудшением мозгового, коронарного или почечного кровообращения, а также выраженной вегетативной симптоматикой. Гипертонический криз, как правило, развивается у нелеченых больных, при резком прекращении приёма антигипертензивных средств, а также может быть первым проявлением гипертонической болезни или симптоматической артериальной гипертензии у больных, не получавших адекватного лечения.
Причины: неправильный приём симпатомиметиков, глюкокортикоидов, пероральных контрацептивов, алкоголя, анорексантов; употребление наркотических веществ (например, кокаина, амфетамина), отмена гипотензивных препаратов (особенно клофелина), прекращение приёма ЛС, угнетающих ЦНС; эклампсия и преэклампсия, феохромоцитома, эссенциальная артериальная гипертензия, заболевания почек, тяжёлые ожоги, послеоперационная артериальная гипертензия.
Факторы риска: артериальная гипертензия в анамнезе, алкоголизм, наркомания, злоупотребление ЛС, нежелание принимать антигипертензивные препараты по предписанию врача.
Патоморфология. Экстремальный подъём АД приводит к множественным кровоизлияниям в органы и отёку тканей.
Проявления. Клинически гипертонический криз проявляется повышением АД, которое может сопровождаться развитием энцефалопатии, субарахноидальных кровоизлияний, инсульта, инфаркта миокарда, острой левожелудочковой недостаточности (с отёком лёгких), расслоения аорты, острой почечной недостаточности. При гипертоническом кризе больных могут беспокоить сильная головная боль, выраженное головокружение, нарушения зрения в виде снижения остроты и выпадения полей зрения, загрудинные боли (в связи с ишемией миокарда, аорталгией), сердцебиение, одышка.
Лечение
• Интенсивная терапия с внутривенным введением антигипертензивных препаратов на фоне постоянного контроля АД.
• Постельный режим, благоприятная психологическая обстановка, диеты № 10, 10а.
• АД необходимо нормализовать в течение суток: снижение в течение часа среднего АД примерно на 20–25% от исходного или диастолического АД до 100–110 мм рт.ст.
Течение и прогноз. При адекватной терапии прогноз благоприятный. В тяжёлых случаях гипертензивный криз осложняется комой, отёком лёгких, инсультом, тромбозом и эмболией различных артерий, острой почечной недостаточностью. Резкое снижение АД может привести к нарушению мозгового и коронарного кровообращения, инсульту или инфаркту миокарда.
Гипертоническая болезнь
Гипертоническая болезнь — артериальная гипертензия неизвестной этиологии. Диагноз гипертонической болезни (эссенциальной, первичной артериальной гипертензии) устанавливают лишь методом исключения вторичных (симптоматических) артериальных гипертензий. Определение «эссенциальная» означает, что стойко повышенное АД при гипертонической болезни составляет сущность (главное содержание) этой артериальной гипертензии. Каких‑либо изменений в других органах, которые могли бы привести к артериальной гипертензии, при обычном обследовании не находят.
• Частота эссенциальной артериальной гипертензии составляет 95% всех артериальных гипертензий (при тщательном обследовании пациентов в специализированных стационарах эта величина снижается до 75%).
• Генетические аспекты.
† Семейный анамнез. Позволяет выявить наследственную предрасположенность к гипертонической болезни полигенной природы.
† Существует множество генетически детерминированных нарушений структуры и функции мембран клеток как возбудимого, так и невозбудимого типа в отношении транспорта Na+ и Ca2+.
• Этиология гипертонической болезни.
† Основная причина: повторный, как правило, затяжной психоэмоциональный стресс. Стресс‑реакция носит выраженный отрицательный эмоциональный характер.
† Главные факторы риска (условия, способствующие развитию гипертонической болезни) представлены на рис. 22–39.

Рис. 22–39. Факторы, участвующие в развитии гипертонической болезни. ГБ — гипертоническая болезнь, РАС — ренин-ангиотензиновая система, СНС — симпатическая нервная система.
‡ Избыток Na+ обусловливает (помимо прочего) два важных эффекта:
§ Усиление транспорта жидкости в клетки и их набухание. Набухание клеток стенок сосудов ведёт к их утолщению, сужению их просвета, повышению ригидности сосудов и снижению способности их к вазодилатации.
§ Повышение чувствительности миоцитов стенок сосудов и сердца к вазоконстрикторным факторам.
‡ Расстройства функций мембранных рецепторов, воспринимающих нейромедиаторы и другие БАВ, регулирующие АД. Это создаёт условие для доминирования эффектов гипертензивных факторов.
‡ Нарушения экспрессии генов, контролирующих синтез клетками эндотелия сосудорасширяющих агентов (оксида азота, простациклина, ПгE).
‡ Факторы окружающей среды. Наибольшее значение имеют профессиональные вредности (например, постоянный шум, необходимость напряжения внимания), условия проживания (включая коммунальные), интоксикация (особенно алкоголем, никотином, наркотиками), травмы мозга (ушибы, сотрясения, электротравма и др.).
‡ Индивидуальные характеристики организма.
§ Возраст. С возрастом (особенно после 40 лет) доминируют опосредованные диэнцефально‑гипоталамической областью мозга (они участвуют в регуляции АД) гипертензивные реакции на различные экзо‑ и эндогенные воздействия.
§ Повышенная масса тела, высокий уровень холестерина в сыворотке крови, избыточная продукция ренина.
§ Особенности реакции ССС на раздражители. Заключаются в доминировании гипертензивных реакций на самые различные воздействия. Даже незначительные эмоциональные (особенно негативного характера) влияния, а также факторы внешней среды приводят к существенному повышению АД.
• Классификация гипертонической болезни
† В России принята классификация гипертонической болезни (классификация ВОЗ, 1978), представленная в табл. 22‑6.
Таблица 22–6. Классификация гипертонической болезни.
| I стадия — повышение АД более 160/95 мм рт.ст. без органических изменений в сердечно-сосудистой системе |
| II стадия — повышение АД более 160/95 мм рт.ст. в сочетании с изменениями органов–мишеней (сердце, почки, головной мозг, сосуды глазного дна), обусловленные артериальной гипертензией, но без нарушения их функций |
| III стадия — артериальная гипертензия, сочетающаяся с поражением органов–мишеней (сердце, почки, головной мозг, глазное дно) с нарушением их функций |
† Формы эссенциальной артериальной гипертензии.
‡ Пограничная. Разновидность эссенциальной артериальной гипертензии, наблюдающаяся у лиц молодого и среднего возраста, характеризующаяся колебаниями АД от нормы до 140/90–159/94 мм рт.ст. Нормализация АД происходит спонтанно. Признаки поражения органов-мишеней, типичные для эссенциальной артериальной гипертензии, отсутствуют. Пограничная артериальная гипертензия встречается примерно у 20–25% лиц; у 20–25% из них затем развивается эссенциальная артериальная гипертензия, у 30% пограничная артериальная гипертензия сохраняется многие годы или всю жизнь, у остальных АД со временем нормализуется.
‡ Гиперадренергическая. Характеризуется синусовой тахикардией, неустойчивым АД с преобладанием систолического компонента, потливостью, гиперемией лица, чувством тревоги, пульсирующими головными болями. Проявляется в начальном периоде заболевания (у 15% больных сохраняется и в дальнейшем).
‡ Гипергидратационная (натрий-, объёмзависимая). Проявляется отёчностью лица, параорбитальных областей; колебаниями диуреза с преходящей олигурией; при употреблении симпатолитиков — задержкой натрия и воды; бледными кожными покровами; постоянными распирающими головными болями.
‡ Злокачественная. Быстро прогрессирующее заболевание с повышением АД до очень высоких величин с нарушением зрения, развитием энцефалопатии, отёка лёгких, почечной недостаточности. Злокачественная эссенциальная артериальная гипертензия чаще развивается при симптоматических артериальных гипертензиях.
• Основные звенья патогенеза гипертонической болезни.
† Стадия I гипертонической болезни.
‡ Инициальный фактор патогенеза гипертонической болезни — развитие невротического состояния. Характеризуется включением центрогенного нейрогенного звена патогенеза гипертонической болезни (рис. 22–40).
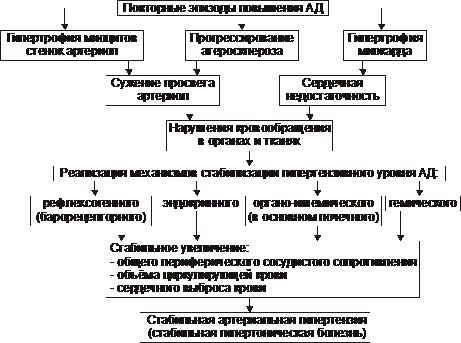
Рис. 22–40. Основные звенья патогенеза гипертонической болезни (стадия 1).
Центрогенный нейрогенный механизм включает:
‡ Формирование корково‑подкоркового комплекса устойчивого возбуждения. Он включает симпатические ядра заднего отдела гипоталамуса, а также адренергические структуры ретикулярной формации и сосудодвигательного центра.
‡ Усиление прессорных (гипертензивных) влияний на ССС. Реализуется по двум взаимозависимым — нервному и гуморальному — каналам.
Нейрогенные гипертензивные эффекты заключаются в активации симпатических нервных влияний на стенку артериол, венул, вен и на сердце.
§ Артериолы. Происходит длительное сужение их просвета и повышение ОПСС. Уровень АД в этих условиях существенно увеличивается.
При хронически повышенной симпатической стимуляции развивается гипертрофия ГМК артериол. Это потенцирует артериальную гипертензию и приводит к дальнейшему сужению просвета.
§ Венулы и вены. Симпатические нервные влияния приводят к сужению просвета ёмкостных сосудов, увеличению притока венозной крови к сердцу и — в связи с этим — повышению ударного и сердечного выбросов.
§ Сердце. Катехоламины реализуют свои положительные хроно‑ и инотропные эффекты. Это потенцирует увеличение сердечного выброса и повышение АД.
Гуморальные гипертензивные эффекты характеризуется активацией образования и высвобождения БАВ с гипертензивным действием: АДГ (вазопрессина), адреналина, АКТГ и кортикостероидов (минерало‑ и глюкокортикоидов), T3 и T4, эндотелина.
‡ Реализацию действия указанных выше гуморальных агентов. Это, параллельно с активацией симпатической нервной системы, обеспечивает повышение ОПСС, веноконстрикцию и увеличение (в связи с этим) возврата венозной крови к сердцу, увеличение ОЦК, увеличение сердечного выброса.
Эти эффекты закрепляют повышенный уровень АД или увеличивают его дополнительно.
‡ Нарастающая гипертрофия ГМК артериол и миокарда и развитие атеросклероза. Эти изменения являются результатом длительно повышенного АД. Они обусловливают нарушения кровообращения в органах и тканях (ишемию, венозную гиперемию), развитие гипоксии (в начале — циркуляторного, а затем — смешанного типа).
Данный этап развития гипертонической болезни обозначают как стадия I (стадия становления гипертонической болезни, или транзиторная). На этой стадии происходит повторное, преходящее, более или менее длительное, повышение АД выше нормы, но признаки поражения внутренних органов отсутствуют.
† Стадия II гипертонической болезни
‡ Стабилизация АД на повышенном уровне. Механизмы реализации этой стадии гипертонической болезни приведены на рис. 22–41.

Рис. 22–41. Основные звенья патогенеза гипертонической болезни (стадия 2).
Стабилизацию АД на повышенном уровне обеспечивают рефлексогенный, эндокринный, гемический механизмы.
§ Рефлексогенный (барорецепторный). Заключается в нарастающем снижении (или даже прекращении) афферентной депрессорной импульсации от барорецепторов дуги аорты, синокаротидной и других зон в адрес сосудодвигательного (прессорного) центра.
§ Эндокринный фактор. Характеризуется стимуляцией продукции и инкреции в кровь гормонов с гипертензивным действием.
§ Метаболический (гипоксический, органо‑ишемический). Включает почечные гипертензивные механизмы (вазоренальный и ренопаренхиматозный) и органо-ишемические. Они проявляются появлением избытка БАВ с гипертензивным действием, уменьшением образования БАВ с гипотензивным эффектом.
§ Гемический. Заключается в развитии в связи с хронической гипоксией полицитемии (в основном, за счёт значительного эритроцитоза) и повышенной вязкости крови (в связи с полицитемией и диспротеинемией).
Этот этап формирования гипертонической болезни обозначают как стадия II (стадия стабильной гипертензии).
На этой стадии регистрируются стабильно повышенное (гипертензивное) АД, а также признаки поражения тканей и внутренних органов (гипертрофия сердца, выраженный атеро‑ и артериосклероз, нефросклероз и другие).
† Стадия III гипертонической болезни
Проявляется органическими изменениями и характеризуется повреждением структурных элементов, грубыми расстройствами функций тканей и органов с развитием полиорганной недостаточности. Наиболее часто наблюдаются:
§ Выраженный атеро‑ и артериосклероз, приводящие к инфарктам в различных органах (наиболее часто — миокарда) и инсультам.
§ Кардиомиопатии. Одной из причин является нарушение сбалансированности роста структур миокарда — комплекс изнашивания гипертрофированного сердца.
§ Склеротическое поражение почек (первично сморщенная почка). Это название указывает на первично гипертензивный генез патологии почек при гипертонической болезни.
§ Дистрофические и склеротические изменения в других органах (мозге, эндокринных железах, сетчатке, сердце).
Описанный этап развития гипертонической болезни обозначают как стадия III гипертонической болезни, или стадия органных изменений.
Немедикаментозное лечение
Немедикаментозное лечение показано всем больным. У 40–60% пациентов с начальной стадией артериальной гипертензии при невысоких значениях АД оно нормализуется без применения ЛС. При выраженной артериальной гипертензии немедикаментозная терапия в комбинации с лекарственной способствует снижению дозы принимаемых ЛС и тем самым уменьшает риск их побочного действия.
Основные меры немедикаментозного воздействия при артериальной гипертензии включают диету, снижение избыточной массы тела, достаточную физическую активность, что достигается радикальным изменением образа жизни.
Диета
• Ограничение потребления поваренной соли менее 6 г/сут (но не менее 1–2 г/сут, поскольку в этом случае может произойти компенсаторная активация ренин-ангиотензиновой системы).
• Снижение в рационе доли углеводов и жиров, что весьма существенно для профилактики ИБС, вероятность которой при артериальной гипертензии увеличена (фактор риска). Считается, что уменьшение избыточной массы тела на 1 кг ведёт к снижению АД в среднем на 2 мм рт.ст.
• Увеличение в диете содержания ионов калия может способствовать снижению АД.
• Отказ или значительное ограничение приёма алкоголя (особенно при злоупотреблении им) также может способствовать снижению АД.
Физическая активность
Достаточная физическая активность циклического типа (ходьба, лёгкий бег, лыжные прогулки) при отсутствии противопоказаний со стороны сердца (ИБС), сосудов ног (облитерирующий атеросклероз), ЦНС (нарушения мозгового кровообращения) снижает АД, а при невысоких уровнях может и нормализовать его. При этом рекомендуют умеренность и постепенность в дозировании физических нагрузок. Нежелательны физические нагрузки с высоким уровнем эмоционального напряжения (соревновательные, гимнастика), а также изометрические усилия (подъём тяжестей). Механизмами, приводящими к снижению АД, считают уменьшение сердечного выброса, снижение ОПСС либо сочетание обоих механизмов.
Прочие методы
Сохраняют своё значение и другие методы лечения артериальной гипертензии: психологические (психотерапия, аутогенная тренировка, релаксация), акупунктура, массаж, физиотерапевтические методы (электросон, диадинамические токи, гипербарическая оксигенация), водные процедуры (плавание, душ, в том числе контрастный), фитотерапия (черноплодная рябина, настойка боярышника, пустырника, сборы с сушеницей болотной, боярышником, бессмертником, донником).
Одно из непременных условий эффективности лечения заключается в разъяснении пациенту с артериальной гипертензией особенностей течения болезни («Болезнь не излечивается, но АД эффективно снижается!»), длительности течения (хроническое у большинства пациентов), вовлечения органов-мишеней, возможных осложнений при отсутствии надлежащего контроля АД. Вместе с тем следует проинформировать пациента об эффективных современных антигипертензивных средствах, позволяющих добиться нормализации или снижения АД у 90–95% больных, к которым прибегают при отсутствии эффекта от немедикаментозной терапии.
Лекарственная терапия
Основные принципы лекарственного лечения формулируются в виде трёх тезисов.
• Начинать лечение мягкой артериальной гипертензии необходимо с малых доз ЛС.
• Следует применять комбинации препаратов для увеличения их эффективности и уменьшения побочного действия.
• Нужно использовать препараты длительного действия (12–24 ч при однократном приёме).
В настоящее время для лечения артериальной гипертензии применяют шесть основных групп препаратов: блокаторы медленных кальциевых каналов, диуретики, b-адреноблокаторы, ингибиторы АПФ, антагонисты (блокаторы рецепторов) ангиотензина II, a-адреноблокаторы. Кроме того, широко используют препараты центрального действия (например, клонидин), средства с комбинированными эффектами (адельфан).
Лекарственную терапию проводят индивидуально по апробированным схемам и официальным рекомендациям.
Артериальные гипотензии
Артериальная гипотензия — снижение АД ниже 100/60 мм рт.ст. у мужчин и 95/60 мм рт.ст. у женщин (границы нормы при хорошем самочувствии и полной работоспособности).
Этиология и патогенез
По инициальному звену механизма развития выделяют нейрогенные, эндокринные и метаболические артериальные гипотензии (рис. 22–42).

Рис. 22–42. Виды артериальных гипотензий по начальному (стартовому) звену патогенеза.
Рис. 22–43. Основные звенья патогенеза центрогенной нейрогенной артериальной гипотензии.
Нейрогенные гипотензии центрогенного генеза являются результатом либо функционального расстройства ВНД, либо органического повреждения мозговых структур, участвующих в регуляции АД.
† Артериальные гипотензии вследствие нарушений ВНД.
‡ Причина: длительный, повторный стресс, обусловленный необходимостью сдерживания двигательных и эмоциональных проявлений. Это приведёт к развитию невротического состояния.
‡ Механизм развития.
§ Перенапряжение (и срыв) ВНД — невроз. Он является инициальным звеном патогенеза гипотензии.
§ Невроз характеризуется формированием корково‑подкоркового комплекса возбуждения. Оно распространяется на парасимпатические ядра переднего гипоталамуса и другие структуры парасимпатической нервной системы (например, на дорсальное двигательное ядро блуждающего нерва).
§ Активация парасимпатических влияний на ССС обусловливает снижение сократительной функции миокарда, сердечного выброса крови и тонуса резистивных сосудов. Развивается артериальная гипотензия.
Аргументом приведенным выше представлениям является большой «удельный вес» людей со слабым типом ВНД (с высокой частотой развития у них невротических состояний) среди больных артериальной гипотензией.
Считают, что именно такой механизм лежит в основе развития гипотонической болезни. При хроническом её течении включаются и другие патогенетические звенья, что способствует стабилизации АД на пониженном уровне или даже усугубляет степень его снижения.
† Артериальные гипотензии вследствие органических изменений в структурах мозга. Возникают при повреждении центральных (диэнцефально‑гипоталамических) и периферических структур, участвующих в регуляции АД.
‡ Наиболее частые причины: травмы головного мозга (при его сотрясении или ушибах), нарушения мозгового кровообращения (ишемия, венозная гиперемия), дегенеративные изменения в веществе головного мозга (дегенерация нейронов экстрапирамидной системы, базальных ядер мозга, заднего ядра блуждающего нерва), нарушение выделения в кровь катехоламинов при физической нагрузке, изменении положения тела из горизонтального в вертикальное (в этом случае нередко развиваются ортостатические коллапсы и обмороки), синдром Шая‑Дрейджера.
‡ Патогенез.
§ Снижение активности симпатикоадреналовой системы и выраженности её эффектов на ССС.
§ Относительное или абсолютное преобладание эффектов парасимпатической нервной системы на сердце и сосуды.
§ Снижение тонуса стенок артериол, ОПСС, сердечного выброса крови.
• Рефлекторные (рефлексогенные, проводниковые) центрогенные артериальные гипотензии.
† Причина: нарушение проведения эфферентных гипертензивных импульсов от сосудодвигательного центра продолговатого мозга к стенкам сосудов и сердцу. Наиболее часто это развивается при нейросифилисе, боковом амиотрофическом склерозе, сирингомиелии, периферических невропатиях различного генеза (например, диабетического, инфекционного, нейротоксического).
† Механизм развития. Заключается в значительном уменьшении или прекращении тонических влияний симпатической нервной системы на стенки сосудов и сердца. Это приводит к снижению ОПСС и, соответственно — диастолического АД, а также к уменьшению сократительной функции сердца, величины сердечного выброса и систолического АД. В результате развивается артериальная гипотензия.
Рис. 22–44. Общие звенья патогенеза «эндокринных» артериальных гипотензий.
Различают артериальные гипотензии надпочечникового, гипофизарного, гипотиреоидного генеза.
• Артериальные гипотензии надпочечникового происхождения.
† Причины: гипотрофия коры надпочечников, опухоль коры надпочечников с разрушением паренхимы, кровоизлияние в надпочечник (один или оба), туберкулёзное поражение надпочечников, деструкция надпочечников в результате реакций иммунной аутоагрессии и травмы, приводящие к повреждению или разрушению надпочечников.
† Патогенез. Дефицит катехоламинов, минерало‑ и глюкокортикоидов и/или недостаточность их эффектов обусловливает снижение тонуса стенок артериол и ОПСС, ОЦК и сердечного выброса.
• Артериальные гипотензии при поражении гипофиза.
† Причина: гипофункция гипофиза.
† Патогенез. Развитие артериальной гипотензии при питуитарной недостаточности является результатом недостаточного эффекта вазопрессина, АКТГ, ТТГ, СТГ. В конечном итоге гипофизарная недостаточность приводит к снижению тонуса артериол и ОПСС, ОЦК, сердечного выброса. В совокупности эти изменения обусловливает стойкое снижение и систолического и диастолического АД.
• Артериальная гипотензия при гипотиреоидных состояниях.
† Причина: Дефицит T3 и T4 и/или их эффектов.
† Механизмы развития.
‡ Брадикардия. Развивается вследствие снижения или отсутствия положительного хронотропного эффекта тиреоидных гормонов в связи с их дефицитом, снижения активности симпатикоадреналовой системы.
‡ Снижение величины сердечного выброса.
‡ Снижение тонуса стенок сосудов вследствие их дистрофических изменений и, как результат — уменьшение ОПСС.
Рис. 22–45. Типовые формы патологии регионарного кровообращения.
Артериальная гиперемия
Артериальная гиперемия — увеличение кровенаполнения и количества протекающей по сосудам органов и тканей крови в результате расширения артериол и артерий.
Причины
Причины артериальных гиперемий могут иметь различное происхождение и природу.
• По происхождению выделяют артериальные гиперемии, причинами которых являются эндогенные или экзогенные факторы.
† Экзогенные. Агенты, вызывающие артериальную гиперемию, действуют на орган или ткань извне. К ним относятся инфекционные (микроорганизмы и/или их эндо‑ и экзотоксины) и неинфекционные факторы различной природы.
† Эндогенные. Факторы, приводящие к артериальной гиперемии, образуются в организме (например, отложение солей и конкрементов в тканях почек, печени, подкожной клетчатке; образование избытка БАВ, вызывающих снижение тонуса ГМК артериол [вазодилатацию] — аденозина, Пг, кининов; накопление органических кислот — молочной, пировиноградной, кетоглутаровой).
• По природе причинного фактора выделяют артериальные гиперемии физического, химического и биологического генеза.
† Физические (например, механическое воздействие, очень высокая температура, электрический ток).
† Химические (например, органические и неорганические кислоты, щёлочи, спирты, альдегиды).
† Биологические (например, физиологически активные вещества, образующиеся в организме: аденозин, ацетилхолин, простациклин, оксид азота).
Механизмы возникновения
Расширение просвета малых артерий и артериол достигается за счёт реализации нейрогенного, гуморального и нейромиопаралитического механизмов или их сочетания.
• Нейрогенный механизм. Различают нейротоническую и нейропаралитическую разновидности нейрогенного механизма развития артериальной гиперемии.
† Нейротонический механизм. Заключается в преобладании эффектов парасимпатических нервных влияний (по сравнению с симпатическими) на стенки артериальных сосудов.
† Нейропаралитический механизм. Характеризуется снижением или отсутствием («параличом») симпатических нервных влияний на стенки артерий и артериол.
• Гуморальный механизм. Заключается в местном увеличении содержания вазодилататоров — БАВ с сосудорасширяющим эффектом (аденозина, оксида азота, ПгE, ПгI2, кининов) и в повышении чувствительности рецепторов стенок артериальных сосудов к вазодилататорам.
• Нейромиопаралитический механизм.
† Характеристика.
‡ Истощение запасов катехоламинов в синаптических везикулах варикозных терминалей симпатических нервных волокон в стенке артериол.
‡ Снижение тонуса ГМК артериальных сосудов.
† Причины.
‡ Продолжительное действие на ткани или органы различных факторов физической или химической природы (например, тепла при применении грелок, согревающих компрессов, горчичников, лечебной грязи; диатермических токов).
‡ Прекращение длительного давления на стенки артерий (например, асцитической жидкости, тугого бинта, давящей одежды).
Действие указанных факторов в течение длительного времени существенно снижает или полностью снимает миогенный и регуляторный (главным образом, адренергический) тонус стенок артериальных сосудов. В связи с этим они расширяются, в них увеличивается количество протекающей артериальной крови.
Виды артериальных гиперемий
Существует физиологическая и патологическая артериальная гиперемия. Их различает два критерия — адекватность и адаптивность.
• Адекватность — соответствие артериальной гиперемии изменению функции и метаболизма в органах и тканях.
• Адаптивность — наличие (или отсутствие) приспособительного биологического значения артериальной гиперемии в каждом конкретном случае.
Физиологическая артериальная гиперемия
Физиологическая артериальная гиперемия адекватна воздействию и имеет адаптивное значение. Может быть функциональной и защитно‑приспособительной.
• Функциональная. Развивается в органах и тканях в связи с увеличением уровня их функционирования (например, гиперемия в сокращающейся мышце или в усиленно работающем органе).
• Защитно‑приспособительная. Развивается при реализации защитных реакций и процессов (например, — в очаге воспаления либо вокруг чужеродного трансплантата, зоны некроза или кровоизлияния). В этих случаях артериальная гиперемия способствует доставке в ткани кислорода, субстратов метаболизма, Ig, фагоцитов, лимфоцитов, других клеток и агентов, необходимых для реализации местных защитных и восстановительных реакций.
Патологическая артериальная гиперемия
Патологическая артериальная гиперемия не адекватна воздействию, не связана с изменением функции органа или ткани и играет дизадаптивную — повреждающую роль. Патологическая гиперемия сопровождается нарушениями кровоснабжения, микрогемоциркуляции, транскапиллярного обмена, иногда — кровоизлияниями и кровотечениями.
Примеры.
• Патологическая артериальная гиперемия головного мозга при гипертензивном кризе.
• Патологическая артериальная гиперемия различных органов и тканей, развивающаяся по нейромиопаралитическому механизму (например, в органах брюшной полости после асцита; в коже и мышцах конечности после снятия длительно наложенного жгута; в зоне хронического воспаления; в месте длительного (часы) воздействия тепла — солнечного, при использовании грелки, горчичников; в регионе с симпатической денервацией).
Рис. 22–46. Основные проявления артериальной гиперемии.
• Увеличение числа и диаметра артериальных сосудов в зоне артериальной гиперемии.
• Покраснение органа, ткани или их участка вследствие повышения притока артериальной крови, расширения просвета артериол и прекапилляров, увеличения числа функционирующих капилляров, «артериализации» венозной крови (т.е. повышения содержания HbO2 в венозной крови).
• Повышение температуры тканей и органов в регионе гиперемии в результате притока более тёплой артериальной крови и повышения интенсивности обмена веществ.
• Увеличение лимфообразования и лимфооттока вследствие повышения перфузионного давления крови в сосудах микроциркуляторного русла.
• Увеличение объёма и тургора органа или ткани в результате возрастания их крове‑ и лимфонаполнения.
• Изменения в сосудах микроциркуляторного русла.
† Увеличение диаметра артериол и прекапилляров.
† Возрастание числа функционирующих капилляров (т.е. капилляров, по которым протекает плазма и форменные элементы крови).
† Ускорение тока крови по микрососудам.
† Уменьшение диаметра осевого «цилиндра» (потока клеток крови по центральной оси артериолы) и увеличение ширины потока плазмы крови с малым содержанием в ней форменных элементов вокруг этого «цилиндра». Причина: увеличение центростремительных сил и отбрасывание клеток крови к центру просвета сосудов в связи с ускорением тока крови в условиях артериальной гипертензии.
Рис. 22–47. Последствия артериальной гиперемии.
• При физиологических разновидностях артериальной гиперемии отмечается активация специфической функции (функций) органа или ткани и потенцирование неспецифических их функций и процессов.
Примеры: активация местного иммунитета (в связи с повышением притока с артериальной кровью Ig, лимфоцитов, фагоцитирующих клеток и других агентов), ускорение пластических процессов, увеличение лимфообразования и лимфооттока от тканей.
† Обеспечение гипертрофии и гиперплазии структурных элементов тканей продуктами обмена веществ и кислородом.
Достижение именно этих эффектов артериальных гипертензий становится целью при проведении лечебных мероприятий (например, при применении компрессов, горчичников, физиотерапевтических процедур; инъекциях сосудорасширяющих ЛС; при хирургических вмешательствах по пересечению симпатических нервных стволов или иссечению симпатических ганглиев при некоторых формах стенокардии и др.), направленных на индуцирование гиперемии. Это применяется при повреждении органов и тканей, их ишемии, нарушении трофики и пластических процессов в них, снижении активности «местного иммунитета».
• При патологических вариантах артериальной гиперемии, как правило, наблюдаются перерастяжение и микроразрывы стенок сосудов микроциркуляторного русла, микро‑ и макрокровоизлияния в ткани, кровотечения (наружные и/или внутренние).
Устранение или предупреждение этих негативных последствий является целью терапии патологических разновидностей артериальной гиперемии.
Венозная гиперемия
Венозная гиперемия — увеличение кровенаполнения, но при уменьшении количества протекающей по сосудам ткани или органа крови. В отличие от артериальной гиперемии развивается в результате замедления или прекращения оттока венозной крови по сосудам.
Причины
Основной причиной венозной гиперемии является механическое препятствие оттоку венозной крови от тканей или органа. Это может быть результатом сужения просвета венулы или вены при её компрессии (опухолью, отёчной тканью, рубцом, жгутом, тугой повязкой) и обтурации (тромбом, эмболом, опухолью), сердечной недостаточности, низкой эластичности венозных стенок, сочетающейся с образованием в них расширений (варикозов) и сужений.
Проявления
Проявления венозной гиперемии приведены на рис. 22–48.

Рис. 22–48. Проявления венозной гиперемии.
• Увеличение числа и диаметра просвета венозных сосудов в регионе гиперемии.
• Цианоз ткани или органа вследствие увеличение в них количества венозной крови и понижения содержания в венозной крови HbO2. Последнее является результатом утилизации кислорода тканью из крови в связи с медленным её током по капиллярам.
• Снижение температуры тканей или органов в зоне венозного застоя в результате увеличения объёма в них более холодной (в сравнении с артериальной) венозной крови и уменьшения интенсивности тканевого метаболизма (является результатом снижения притока артериальной крови к тканям в регионе венозной гиперемии).
• Отёк ткани или органа происходит вследствие увеличения внутрисосудистого давления в капиллярах, посткапиллярах и венулах. При длительной венозной гиперемии отёк потенцируется за счёт включения его осмотического, онкотического и мембраногенного патогенетических факторов (см. «Отёк» в главе 11 «Нарушения баланса воды»).
• Кровоизлияния в ткани и кровотечения (внутренние и наружные) в результате перерастяжения и микроразрывов стенок венозных сосудов (посткапилляров и венул).
• Изменения в сосудах микроциркуляторного русла.
† Увеличение диаметра капилляров, посткапилляров и венул в результате растяжения стенок микрососудов избытком венозной крови.
† Возрастание числа функционирующих капилляров на начальном этапе венозной гиперемии (в результате оттока венозной крови по ранее нефункционирующим капиллярным сетям) и снижение — на более поздних (в связи с прекращением тока крови в результате образования микротромбов и агрегатов клеток крови в посткапиллярах и венулах).
† Замедление (вплоть до прекращения) оттока венозной крови.
† Значительное расширение диаметра осевого «цилиндра» и исчезновение полосы плазматического тока в венулах и венах.
† «Маятникообразное» движение крови в венулах и венах — «туда‑обратно»:
‡ «Туда» — от капилляров в венулы и вены. Причина: проведение систолической волны сердечного выброса крови.
‡ «Обратно» — от вен к венулам и капиллярам. Причина: «отражение» потока венозной крови от механического препятствия (тромба, эмбола, суженного участка венулы).
Ишемия
Ишемия — несоответствие между притоком к тканям и органам артериальной крови и потребностью в ней. При этом потребность в кровоснабжении всегда выше реального притока крови по артериям.
Причины
Причины ишемии могут иметь различное происхождение и природу.
• По природе причины ишемии делят на физические, химические и биологические.
† Физические факторы: сдавление артериальных сосудов (например, опухолью, рубцовой тканью, инородным телом, жгутом), сужение или закрытие просвета изнутри (например, тромбом, эмболом, атеросклеротической бляшкой), действие чрезмерно низкой температуры.
† Химические факторы. Многие химические соединения обладают способностью вызывать сокращение ГМК артериальных сосудов и сужение их просвета. Примеры: никотин, ряд ЛС: мезатон, эфедрин, препараты адреналина, АДГ, ангиотензины.
† Биологические факторы: БАВ с сосудосуживающими эффектами (например, катехоламины, ангиотензин II, АДГ, эндотелин), БАВ микробного происхождения: их экзо‑ и эндотоксины, метаболиты с вазоконстрикторным действием.
• По происхождению выделяют ишемии, причина которых имеет эндогенное или экзогенное происхождение (инфекционное и неинфекционное).
Рис. 22–49. Механизмы возникновения ишемии.
Механизмы, обусловливающие преимущественное снижение притока артериальной крови к тканям и органам: нейрогенный, гуморальный и «механический».
• Нейрогенный механизм (нейротонический и нейропаралитический).
† Нейротонический. Характеризуется преобладанием эффектов симпатической нервной системы на стенки артериол в сравнении с парасимпатической. Это сопровождается повышенным выбросом норадреналина их адренергических терминалей.
Причины: активация симпатических влияний на ткани и органы (например, при различных вариантах стресса, действии на ткани низкой температуры, механической травмы, химических веществ) и повышение адренореактивных свойств стенок артериол (например, при сенсибилизации их к вазоконстрикторным агентам: в условиях повышенного уровня Ca2+ или цАМФ в миоцитах).
† Нейропаралитический. Характеризуется устранением или снижением («параличом») парасимпатических влияний на стенки артериол.
Причины. Торможение или блокада проведения нервных импульсов по парасимпатическим волокнам к артериолам (и в связи с этим — высвобождения ацетилхолина из терминальных нервных волокон в стенках артерий, артериол и прекапилляров). Такая ситуация может наблюдаться при невритах, механических травмах, развитии опухолей, хирургическом удалении ганглиев или пересечении парасимпатических нервов.
• Гуморальный механизм. Заключается в увеличении содержания в тканях веществ с вазоконстрикторным действием (например, ангиотензина II, АДГ, тромбоксана А2, адреналина, ПгF) и чувствительности рецепторов стенок артериол к агентам с сосудосуживающим действием (например, при увеличении в тканях [Ca2+] или [Na+]).
• Этиологический фактор механического характера. Характеризуется наличием механического препятствия движению крови по артериальным сосудам.
• Причины: сдавление (компрессия) артериального сосуда опухолью, рубцом, отёчной тканью, жгутом и уменьшение (вплоть до полного закрытия — обтурации) просвета артериолы (например, тромбом, агрегатом клеток крови, эмболом).
• Эмбол и эмболия.
† Эмбол — образование, циркулирующее в полостях сердца, кровеносных или лимфатических сосудах и в норме в них не встречающееся. По происхождению различают эндогенные и экзогенные эмболы, а по локализации в сосудах — артериальные и венозные.
‡ Экзогенные. Чаще всего — пузырьки воздуха (попадающие в крупные вены при их ранении) и инородные тела (например, осколки пули или ЛС на масляной основе при их введении в холодном состоянии).
‡ Эндогенные.
§ Фрагменты тромбов (тромбоэмболы).
§ Кусочки жировой ткани или кости, образующиеся при размозжении органов или переломах трубчатых костей.
§ Небольшие фрагменты распадающейся опухолевой или разрушенной нормальной ткани.
§ Конгломераты микробных клеток, много‑ и одноклеточные паразиты.
§ Пузырьки газов, в норме растворённых в плазме крови, но образующиеся при быстром переходе от более высокого барометрического давления к более низкому — при разгерметизации самолетов или космических аппаратов, а также при быстром подъёме с больших глубин.
‡ Артериальные эмболы. Закупоривают артериальные сосуды большого круга кровообращения (попадают из лёгочных вен или левых камер сердца), малого круга (заносятся из правых камер сердца или вен большого круга кровообращения).
‡ Венозные. Часто эмболы обнаруживают в мелких венозных сосудах воротной вены.
† Эмболия — циркуляция в кровеносном или лимфатическом русле образования, в норме в нём не встречающегося и закрытие либо сужение им кровеносного или лимфатического сосуда.
Механизмы возникновения ишемии, обусловливающие преимущественно значительное увеличение потребления тканями кислорода и/или субстратов обмена веществ. При этом потребность в кислороде и субстратах метаболизма превышает уровень их реальной доставки к тканям.
• Наиболее частая причина: Значительное повышение функции органа или ткани и возрастание в связи с этим — интенсивности метаболизма в них.
• Примеры.
† Ишемия мышц (включая и миокард) при интенсивной и длительной физической нагрузке.
† Ишемия миокарда при остром значительном повышении уровня АД (например, в условиях гипертензивного криза) и эмоциональном стрессе.
В последнем случае работа сердца значительно возрастает под влиянием избытка катехоламинов, оказывающих положительный хроно- и инотропный эффекты. В этих условиях увеличивается и приток крови к миокарду по коронарным артериям. Однако работа миокарда (и в соответствии с этим потребность в кровоснабжении) возрастает в большей мере. Развивается ишемия миокарда, проявляющаяся приступом стенокардии, а нередко гибелью ишемизированного участка сердца (инфаркт миокарда).
Одновременно, как правило, выявляются и признаки сужения артериальных сосудов сердца в связи с развитием атеросклеротических изменений в них.
Проявления ишемии
Проявления ишемии представлены на рис. 22–50.
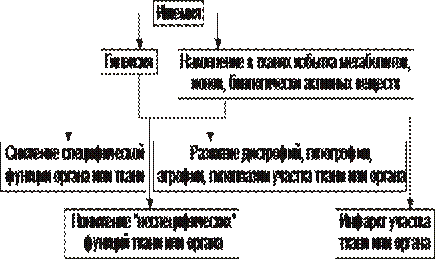
Рис. 22–50. Проявления ишемии.
Последствия ишемии
Основные последствия ишемии, развивающиеся вследствие гипоксии и многочисленных БАВ, представлены на рис. 22–51.

Рис. 22–51. Основные последствия ишемии.
• Характер, выраженность и масштаб последствий ишемии зависит от многих факторов. Наиболее значимыми являются:
† Скорость развития ишемии (чем она выше, тем более значительна степень повреждения тканей).
† Диаметр поражённой артерии или артериолы (чем он больше, тем тяжелее поражение).
† «Чувствительность» ткани или органа к ишемии (она особенно высока у ткани мозга, сердца, почек).
† Значение ишемизированного органа или ткани для организма (ишемия таких органов как мозг, сердце, почки может привести к гибели организма. В отличие от этого, ишемия участка кожи или какой‑либо скелетной мышцы совместима с жизнью).
† Степень развития коллатеральных сосудов и скорость включения или активации коллатерального кровотока в ткани или органе.
• Коллатеральный кровоток — система кровообращения в сосудах вокруг ишемизированного участка ткани и в нём самом.
† Включению (или возрастанию) коллатерального кровообращения способствуют наличие градиента давления крови выше и ниже суженного участка сосуда, накопление в зоне ишемии БАВ с сосудорасширяющим действием (аденозина, ацетилхолина, Пг, кининов и др.), активация местных парасимпатических влияний (способствующих расширению коллатеральных артериол) и высокая степень развития сосудистой сети (коллатералей) в поражённом органе или ткани.
† Группы органов и тканей в зависимости от степени развития артериальных сосудов и анастомозов между ними.
‡ С абсолютно достаточной коллатеральной сетью: скелетная мускулатура, брыжейка кишечника, лёгкие. В указанных образованиях совокупный просвет коллатеральных сосудов равен или превышает диаметр магистральной артерии. В связи с этим прекращение кровотока по ней не вызывает выраженной ишемии тканей в регионе кровоснабжения данной артерии.
‡ С абсолютно недостаточными коллатералями: миокард, почки, головной мозг, селезёнка. В этих органах суммарный просвет коллатеральных артерий значительно меньше диаметра магистральной артериальной ветви. В связи с этим окклюзия её приводит к выраженной ишемии или инфаркту ткани.
‡ С относительно достаточными (недостаточными) коллатералями: стенки кишечника, желудка, мочевого пузыря, кожа, надпочечники. В них совокупный просвет коллатеральных сосудов в более или менее выраженной степени меньше диаметра магистральной артерии. Окклюзия крупного артериального ствола в этих органах сопровождается большей или меньшей степенью их ишемии.
Стаз
Стаз — значительное замедление или прекращение тока крови и/или лимфы в сосудах органа или ткани.
Причины
• Ишемия и венозная гиперемия. Они приводят к стазу вследствие существенного замедления кровотока (при ишемии в связи со снижением притока артериальной крови, при венозной гиперемии в результате замедления или прекращения её оттока) и создания условий для образования и/или активации веществ, обусловливающих склеивание форменных элементов крови, формирования из них агрегатов и тромбов.
• Проагреганты — факторы, вызывающие агрегацию и агглютинацию форменных элементов крови.
Патогенез
Патогенез стаза представлен на рис. 22–52.

Рис. 22–52. Основные звенья патогенеза стаза.
На финальном этапе стаза всегда происходит процесс агрегации и/или агглютинации форменных элементов крови, что приводит к сгущению крови и снижению её текучести. Этот процесс активируют проагреганты, катионы и высокомолекулярные белки.
• Проагреганты (тромбоксан А2, аденозиндифосфат, ПгF, ПгE, катехоламины, АТ к форменным элементам крови) вызывают адгезию, агрегацию, агглютинацию форменных элементов крови с последующим их лизисом и высвобождением из них БАВ (в том числе — проагрегантов, потенцирующих реакции агрегации и агглютинации).
• Катионы. K+, Ca2+, Na+, Mg2+ и высвобождаются из клеток крови, повреждённых стенок сосудов и тканей. Адсорбируясь на цитолемме форменных элементов крови, избыток катионов нейтрализует их отрицательный поверхностный заряд или даже меняет его на обратный. И если неповреждённые клетки (благодаря отрицательному заряду) «отталкиваются» друг от друга, то повреждённые клетки («нейтрализованные») образуют агрегаты. Ещё более активно агрегируют «перезаряженные» клетки крови. Имея положительный поверхностный заряд, они сближаются с «нейтрализованными» клетками и особенно с повреждёнными (имеющими отрицательный заряд), формируя агрегаты, адгезирующие на интиме сосудов.
• Высокомолекулярные белки (например, g‑глобулины, фибриноген) снимают поверхностный заряд неповреждённых клеток (соединяясь с отрицательно заряженной поверхностью клеток с помощью аминогрупп, имеющих положительный заряд) и потенцируют агрегацию форменных элементов крови и адгезию их конгломератов к стенке сосуда (достигается в результате фиксации большого числа белковых мицелл, обладающих адгезивными свойствами, на поверхности форменных элементов крови).
Виды стаза
Все разновидности стаза подразделяют на первичные и вторичные.
• Первичный (истинный) стаз. Формирование стаза первично начинается с активации форменных элементов крови и выделения ими большого количества проагрегантов и/или прокоагулянтов. На следующем этапе форменные элементы агрегируют, агглютинируют и прикрепляются к стенке микрососуда. Это и вызывает замедление или остановку кровотока в сосудах.
• Вторичный стаз (ишемический и застойный).
† Ишемический стаз развивается как исход тяжёлой ишемии в связи со снижением притока артериальной крови, замедлением скорости её тока, турбулентным его характером. Это и приводит к агрегации и адгезии клеток крови.
† Застойный (венознозастойный) вариант стаза является результатом замедления оттока венозной крови, сгущения её, изменения физико‑химических свойств, повреждения форменных элементов крови (в частности, в связи с гипоксией). В последующем клетки крови адгезируют друг с другом и со стенкой микрососудов.
Проявления стаза
При стазе происходят характерные изменения в сосудах микроциркуляторного русла:
• уменьшение внутреннего диаметра микрососудов при ишемическом стазе,
• увеличение просвета сосудов микроциркуляторного русла при застойном варианте стаза,
• большое количество агрегатов форменных элементов крови в просвете сосудов и на их стенках,
• микрокровоизлияния (чаще при застойном стазе).
В то же время проявления ишемии или венозной гиперемии могут перекрывать проявления стаза.
Последствия стаза
При быстром устранении причины стаза ток крови в сосудах микроциркуляторного русла восстанавливается и в тканях не развивается каких‑либо существенных изменений.
Длительный стаз приводит к развитию дистрофических изменений в тканях, нередко — к гибели участка ткани или органа (инфаркт).
Нарушение крово‑ и лимфообращения в сосудах микроциркуляторного русла
Микроциркуляция — упорядоченное движение крови и лимфы по микрососудам, транскапиллярный перенос плазмы и форменных элементов крови, перемещение жидкости во внесосудистом пространстве.
Микроциркуляторное русло. Совокупность артериол, капилляров и венул составляет структурно-функциональную единицу сердечно-сосудистой системы — микроциркуляторное (терминальное) русло. Терминальное русло организовано следующим образом: от терминальной артериолы отходит метартериола, распадающаяся на образующие сеть анастомозирующие истинные капилляры; венозная часть капилляров открывается в посткапиллярные венулы. В месте отделения капилляра от артериол имеется прекапиллярный сфинктер — скопление циркулярно ориентированных ГМК. Сфинктеры контролируют локальный объём крови, проходящий через истинные капилляры; объём же крови, проходящей через терминальное сосудистое русло в целом, определяется тонусом ГМК артериол. В микроциркуляторном русле присутствуют артериоловенулярные анастомозы, связывающие артериолы непосредственно с венулами или мелкие артерии с мелкими венами (юкстакапиллярный кровоток). Стенка сосудов анастомоза содержит много ГМК. Артериовенозные анастомозы в большом количестве присутствуют в некоторых участках кожи, где они играют важную роль в терморегуляции (мочка уха, пальцы). К микроциркуляторному руслу относят также мелкие лимфатические сосуды и межклеточное пространство.
Рис. 22–53. Типовые формы интраваскулярных расстройств микроциркуляции.
• Замедление (вплоть до стаза) тока крови и/или лимфы.
† Наиболее частые причины.
‡ Расстройства гемо‑ и лимфодинамики (например, при сердечной недостаточности, венозной гиперемии, ишемии).
‡ Увеличение вязкости крови и лимфы (в результате гемо[лимфо]концентрации при длительной рвоте, диарее, плазморрагии при ожогах, полицитемии, гиперпротеинемии, агрегации клеток крови, внутрисосудистом её свёртывании, микротромбозе).
‡ Значительное сужение просвета микрососудов (вследствие сдавления их опухолью, отёчной тканью, образования в них тромбов, попадания эмбола, набухания или гиперплазии эндотелиальных клеток, образования атеросклеротической бляшки и т.п.).
† Проявления. Сходны с наблюдающимися в сосудах микроциркуляторного русла при венозной гиперемии, ишемии или стазе.
• Ускорение кровотока.
† Основные причины.
‡ Нарушения гемодинамики (например, при артериальной гипертензии, патологической артериальной гиперемии или сбросе артериальной крови в венозное русло через артериоловенулярные шунты).
‡ Снижение вязкости крови вследствие гемодилюции (при водном отравлении), гипопротеинемии, почечной недостаточности (при олигурической или анурической стадии), панцитопении.
• Нарушение ламинарности (турбулентность) тока крови и/или лимфы.
† Наиболее частые причины.
‡ Изменения вязкости и агрегатного состояния крови (в результате образования агрегатов клеток крови при полицитемии, значительном увеличении числа форменных элементов крови выше нормы или гиперфибриногенемии; при формировании микротромбов).
‡ Повреждение стенок микрососудов или нарушение гладкости их (при васкулитах, гиперплазии клеток эндотелия, артериосклерозе, фиброзных изменениях в различных слоях сосудистых стенок, развитии в них опухолей и т.п.).
• Увеличение юкстакапиллярного тока крови. Происходит вследствие открытия артериоловенулярных шунтов и сброса крови из артериол в венулы, минуя капиллярную сеть микроциркуляторного русла.
† Причина: спазм ГМК артериол и закрытие прекапиллярных сфинктеров при значительном увеличении уровня катехоламинов в крови (например, при гиперкатехоламиновом кризе у пациентов с феохромоцитомой), чрезмерном повышении тонуса симпатической нервной системы (например, в условиях стресса), гипертензивном кризе (например, у пациентов с гипертонической болезнью).
† Проявления: ишемия в регионе сброса крови из артериол в венулы, открытие и/или увеличение диаметра артериоловенулярных шунтов, Турбулентный характер тока крови в местах ответвлений и входов в венулы шунтирующих сосудов (обусловлен тем, что артериоловенулярные шунты отходят от артериол и впадают в венулы, как правило, под значительным углом; это сопровождается соударением форменных элементов крови друг с другом и стенкой сосуда, что приводит к выделению проагрегантов и прокоагулянтов, к образованию агрегатов и тромбов).
Рис. 22–54. Основные причины повышения проницаемости стенок микрососудов.
‡ Последствия. Повышение проницаемости сосудистой стенки потенцирует механизмы перемещения жидкости: фильтрацию (транспорт жидкости по градиенту гидростатического давления), трансцитоз (энергозависимый пиноцитоз), диффузию (перенос жидкости без затрат энергии), осмос (направленную диффузию жидкости по градиенту осмотического давления).
† Уменьшение проницаемости.
‡ Причины: утолщение и/или уплотнение стенок сосудов, либо нарушение энергообеспечения внутриклеточных процессов.
‡ Последствия. Снижение эффективности механизмов перемещения жидкости: фильтрация, диффузия, трансцитоз, осмос.
• Нарушения эмиграции. При различных патологических состояниях перемещение форменных элементов крови через стенку сосуда может возрастать либо уменьшаться.
Эмиграция лейкоцитов через стенку микрососудов осуществляется и в норме. К патологии же относят чрезмерную эмиграцию лейкоцитов, а также выход из крови тромбоцитов и эритроцитов с последующим развитием микрогеморрагий.
Рис. 22–55. Признаки капилляро-трофической недостаточности.
В результате комплекса указанных изменений развиваются различные варианты дистрофий, нарушаются пластические процессы в тканях, расстраивается жизнедеятельность органов и организма в целом.
Сладж
Сладж — феномен, характеризующийся адгезией, агрегацией и агглютинацией форменных элементов крови, что обусловливает сепарацию её на конгломераты из эритроцитов, лейкоцитов, тромбоцитов и плазму, а также — нарушение микрогемоциркуляции.
• Причины сладжа.
† Нарушения центральной гемодинамики (при сердечной недостаточности, венозном застое, ишемии, патологических формах артериальной гиперемии).
† Повышение вязкости крови (например, в условиях гемоконцентрации, гиперпротеинемии, полицитемии).
† Повреждение стенок микрососудов (при местных патологических процессах: воспалении, аллергических реакциях, опухолях и др.).
• Механизмы развития сладжа представлены на рис. 22–56.

Рис. 22–56. Механизмы сладжа. ФЭК — форменные элементы крови.
• Последствия сладжа.
† Нарушение тока крови внутри сосудов (замедление, вплоть до стаза; турбулентный ток крови; включение артериоловенулярных шунтов), расстройство процессов транскапиллярного тока форменных элементов крови.
† Нарушение метаболизма в тканях и органах с развитием дистрофий и расстройством пластических процессов в них.
Причины: нарушения обмена O2 и CO2 в связи с адгезией и агрегацией эритроцитов и развитие васкулопатий в результате прекращения или значительного уменьшения ангиотрофической функции тромбоцитов (они находятся в конгломератах форменных элементов крови).
† Развитие гипоксии и ацидоза в тканях и органах.
В целом совокупность указанных изменений приводит к развитию капилляро-трофической недостаточности. Отсюда следует важный вывод: феномен сладжа является причиной расстройств микроциркуляции (в тех случаях, когда он развивается первично) или следствием внутрисосудистых нарушений микрогемоциркуляции (при их первичном развитии).
Недостаточность кровообращения
Недостаточность кровообращения — состояние, при котором система кровообращения не обеспечивает потребности тканей и органов в оптимальном кровоснабжении.
Причины
Основные причины недостаточности кровообращения:
• расстройства сердечной деятельности,
• нарушения тонуса стенок кровеносных сосудов,
• изменения ОЦК и/или реологических свойств крови.
Виды
Виды недостаточности кровообращения классифицируют по критериям:
•компенсированности расстройств,
•остроте их развития и течения,
• выраженности признаков.
Дата: 2019-02-25, просмотров: 338.