Состояние заданной массы газа определяется значениями трех параметров: давления р, объема V и температуры Т. Эти параметры закономерно связаны друг с другом, так что изменение одного из них влечет за собой изменение других. Указанная связь может быть задана аналитически в виде функции:
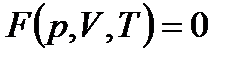
Соотношение, определяющее связь между параметрами какого-либо тела, называется уравнением состояния этого тела. Следовательно, данная формула представляет собой уравнение состояния данной массы газа.
Простейшими свойствами обладает газ, взаимодействие между молекулами которого пренебрежимо мало. Такой газ называется идеальным. Взаимодействие между молекулами всякого газа становится пренебрежимо слабым при большом разрежении, т. е. при малых плотностях газа. Всякий реальный газ при достаточном разрежении близок по своим свойствам к идеальному. Некоторые газы, такие, как воздух, азот, кислород, даже при обычных условиях, т. е. при комнатной температуре и атмосферном давлении, мало отличаются от идеального газа. Особенно близки по своим свойствам к идеальному газу гелий и водород.
При небольших плотностях газы с хорошей точностью подчиняются уравнению:
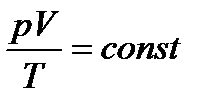
Следовательно, это уравнение есть уравнение состояния идеального газа.
В соответствии с законом, установленным Авогадро, моли всех газов занимают при одинаковых условиях (т. е. при одинаковых температуре и давлении) одинаковый объем. В частности, при так называемых нормальных условиях, т. е. при О °С и при давлении в 1 атм объем моля любого газа равен 22,4 л/моль.
Отношение массы газа к занимаемому объему дает плотность газа: р = т/У [i]. Плотность идеального газа пропорциональна давлению и обратно пропорциональна температуре.
Опыт показывает, что внутренняя энергия идеального газа зависит только от температуры:
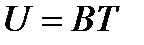
Здесь В — коэффициент пропорциональности, который остается постоянным в весьма широком интервале температур.
Отсутствие зависимости внутренней энергии от занимаемого газом объема указывает на то, что молекулы идеального газа подавляющую часть времени не взаимодействуют друг с другом. Действительно, если бы молекулы не взаимодействовали между собой, во внутреннюю энергию входила бы слагаемым потенциальная энергия взаимодействия, которая зависела бы от среднего расстояния между молекулами, т. е. от V.
Отметим, что взаимодействие должно иметь место при столкновениях, т. е. при сближении молекул на очень малое расстояние. Однако такие столкновения в разреженном газе происходят редко. Подавляющую часть времени каждая молекула проводит в свободном полете.
Теплоемкостью какого-либо тела называется величина, равная количеству тепла, которое нужно сообщить телу, чтобы повысить его температуру на один кельвин.
Величина теплоемкости зависит от условий, при которых происходит нагревание тела. Наибольший интерес представляет теплоемкость для случаев, когда нагревание происходит при постоянном объеме или при постоянном давлении. В первом случае теплоемкость называется теплоемкостью при постоянном объеме (обозначается Сv), во втором — теплоемкостью при постоянном давлении (СР).
Если нагревание происходит при постоянном объеме, тело не совершает работы над внешними телами и, следовательно, согласно первому началу термодинамики, все тепло идет на приращение внутренней энергии тела.
Если нагревание газа происходит при постоянном давлении, то газ будет расширяться, совершая над внешними телами положительную работу. Следовательно, для повышения температуры газа на один кельвин в этом случае понадобится больше тепла, чем при нагревании при постоянном объеме,— часть тепла будет затрачиваться на совершение газом работы. Поэтому, теплоемкость при постоянном давлении должна быть больше, чем теплоемкость при постоянном объеме.
Уравнения, формулы и символы из текста:
р, V, Т 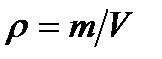
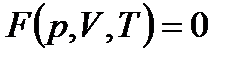 ;
; 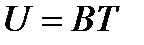
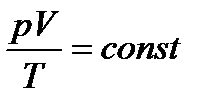 ; Сv; СР
; Сv; СР
Текст 4 Агрегатные состояния и фазовые переходы
Всевозможные состояния, в которых может находиться то или иное вещество, прежде всего разбиваются на так называемые агрегатные состояния: твердое, жидкое и газообразное. Эти состояния выделяются по основным физическим свойствам вещества.
Следует учесть, что у некоторых веществ нет резкой границы между различными агрегатными состояниями. Например, при нагревании стекла происходит постепенное его размягчение и невозможно установить, когда оно переходит из твердого состояния в жидкое. При очень большом внешнем давлении твердые металлы начинают «течь», т. е. подобно жидкости, принимают форму сосуда, в котором они находятся.
Различные состояния одного и того же вещества можно отличать друг от друга также по значениям физических величин, которые характеризуют эти состояния, например, по значениям объема, температуры и давления. Поэтому каждому агрегатному состоянию вещества соответствует бесконечное множество различных состояний, которые отличаются друг от друга различными значениями объема, давления, температуры и других физических величин. При изменении этих величин вещество переходит из одного состояния в другое, оставаясь твердым, жидким и газообразным.
Физические величины, характеризующие то или иное состояние вещества, иногда называют параметрами состояния. Основными параметрами являются: объем V, внешнее давление р и температура Т. Если между параметрами состояния существует какое-нибудь определенное однозначное соотношение, которое сохраняется при переходе из одного состояния в другое, то это соотношение называется уравнением состояния. Например, для разреженных газов соблюдается уравнение:
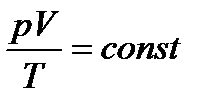
Это соотношение связывает между собой значения объема, давления и температуры для множества отличающихся друг от друга состояний данной массы газообразного вещества. Для других агрегатных состояний — твердого и жидкого — такие простые соотношения между параметрами не найдены.
Следует различать два вида переходов вещества из одного состояния в другое:
1) переходы, при которых меняются только численные значения параметров, характеризующих состояние вещества (объема, давления, температуры и др.), но состав, строение вещества, его агрегатное состояние не изменяются. Такими переходами являются сжатие, расширение, нагревание газов, а также твердых и жидких тел при условии, что эти тела остаются твердыми, жидкими и газообразными, и, кроме того, в них не происходит заметных изменений в составе, структуре, физических свойствах;
2) переходы, при которых происходит изменение или агрегатного состояния вещества, или существенные изменения в составе, строении и физических свойствах вещества. Такие переходы называются фазовыми переходами: к ним относятся испарение и конденсация, плавление и отвердевание, кристаллизация и перекристаллизация, переходы металлов в сверхпроводящее состояние и т. д.
При некоторых фазовых переходах происходит изменение агрегатного состояния вещества, например, вещество из твердого состояния переходит в жидкое или газообразное и наоборот. При этом изменяется взаимное расположение молекул, расстояние между ними, характер их теплового движения. Постоянство состава вещества при фазовых переходах такого рода можно иллюстрировать на примере воды: таяние льда или испарение воды не сопровождается изменением состава молекулы воды (Н20).
При других фазовых переходах агрегатное состояние вещества сохраняется, но в веществе происходят существенные изменения в строении или в структуре (взаимном расположении молекул), вследствие чего заметно изменяются физические свойства вещества. К таким переходам относятся: потеря ферромагнитных свойств железом при нагревании его до температуры 780 °С и выше, переход некоторых металлов в сверхпроводящее состояние при очень низких температурах (когда электрическое сопротивление этих металлов уменьшается до нуля), переход кристаллического вещества из одной модификации в другую и т. Д
Дата: 2019-02-25, просмотров: 424.