Сорбция сильноосновными анионитами. Рассмотрим свойства ионообменных смол и закономерности их применения в технологии урана для его извлечения из производственных сернокислых растворов. Вначале рассмотрим применение сильнеосновных анионитов.
В кислых растворах наиболее вероятная форма нахождения урана [UO2(SO4)3]4-. В таком виде уран в основном и сорбируется на аниоиитах, особенно при рН<2.
В этом случае процесс сорбции может быть описан уравнениями
4[R4N]+ Cl- + [UO2(SO4)3]4- Û [R4N]4[UO2(SO4)4] + 4Cl-
4[R4N]+ NO3- + [UO2(SO4)3]4- Û [R4N]4[UO2(SO4)4] + 4 NO3-
Одновременно, хотя и в меньшей степени, идет конкурентная сорбция присутствующих анионов SO42-, НSO4-, Fe(SO4)2-, Fe(SO4)33-, некоторых анионных форм V, P, As, Mo, а также Cl- и NO3-. Катионы Fe2+, Ca2+, Mg2+, Na+, K+, Cu2+, Co2+, Ni2+, Ti4+ и некоторые другие не сорбируются.
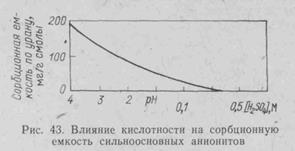
При высокой кислотности особенно сказывается конкурентная сорбция НSO4-, заметно снижающая емкость смолы по урану. Поэтому сорбция урана. Вообще говоря, идет лучше при относительно высоких рН среды (табл. 20).
При снижении кислотности и повышении концентрации урана емкость смолы растет, так как вместо четырехзарядных анионов [UO2(SO4)3]4- сорбируются преимущественно двухзарядные комплексы [UO2(SO4)3]4- . Далее при очень низкой кислотности 9рН~ 2,5) вследствие гидролиза образуются комплексные анионы [U2O5(SO4)3]4- и [U2O5(SO4)2]2-, еще больше увеличивающие емкость анионита по урану. Таким образом, очевидно большое влияние рН среды на емкость ионита. Однако, несмотря на то, что емкость анионита с повышением рН растет, скорость сорбции заметно снижается в результате затруднения диффузии ионов.
Таблица 20
Зависимость емкости смолы по урану при сорбции от рН среды и концентрации урана в растворе
| рН | Концентрация U, г/л | Емкость смолы г U/л | рН | Концентрация U, г/л | Емкость смолы г U/л |
| 1,4 | 1 | 46 | 3,4 | 1 | 70 |
| 1,9 | 1 | 58 | 3,6 | 1,6 | 87 |
| 2,4 | 1 | 64 | 3,0 | 16,0 | 120 |
| 2,9 | 1 | 68 | 2,1 | 160,0 | 180 |
Влияние кислотности на емкость сильноосновных смол подтверждают данные рис. 43 и табл. 20. Емкость смол существенно зависит от присутствия солей, о чем подробно будет сказано ниже.
Все же в общем урна сорбируется много лучше, чем сульфат-, бисульфат—ионы и анионные комплексы железа. Однако необходимо подчеркнуть депрессирующее действие некоторых анионов на сорбцию, что объясняется их конкуренцией с анионными формами урана (рис. 44).
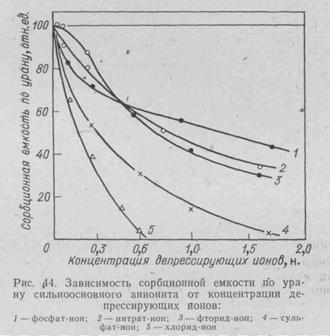
Депрессирующее действие некоторых реагентов используют при десорбции (регенерации, элюации) урана из смолы. Десорбция в принципе является обратным процессом по отношению к сорбции (см. уравнение сорбции). Поэтому для десорбции обычно применяют азотную, соляную, крепкую серную кислоты, хлоридные или нитратные растворы. Эффективно применение подкисленных нитратных растворов, но иногда по экономическим соображениям используют смесь NaCl и серной кислоты.
Важно отметить, что при десорбции требуется не только выделить уран из фазы смолы в раствор, но и сконцентрировать его в максимально малом объеме.
Одновременно с десорбцией урана идет и десорбция других анионов, причем наблюдается движущийся фронт десорбции, определяемый сродством (константами равновесия) анионов к смоле, в соответствии с хроматографическим принципом М. С. Цвета (1903 г.). Это явление иногда используют для разделения сорбированных и вымываемых веществ, собирая отдельно фракции элюата (рис. 45).
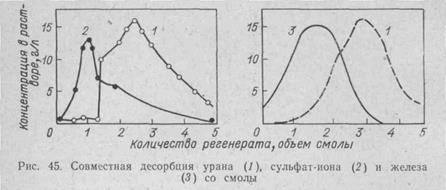
Как видно из рис. 45, разделение урана и железа затруднено, но тем не менее и здесь можно предварительно, извлечь до 60% железа, почти не затронув урана, и вывести эту фракцию на отдельную переработку. Последующая фракция может содержать 90% урана и 40% железа. Конечные фракции регенерата (элюата) с малым содержанием урана следует использовать для новой десорбции.
Объем растворов урана после десорбции значительно меньше объема исходных растворов, что позволяет эффективно концентрировать уран в регенерате. Из регенерата уран обычна осаждают аммиаком, NаОН или Мg0. После отделения фильтрацией осадка диураната десорбирующий раствор подкисляют и пускают в оборот в качестве регенерата. При этом следует учитывать накопление в нем SO42-.
Ряд веществ оказывает резко выраженное депрессирующее действие на сорбцию. Действие таких депрессоров-ядов специфично. Наблюдаются случаи отравления смолы в результате накопления в ней некоторых анионов. Рассмотрим несколько таких анионов.
1. Анионы, содержащие пятивалентный ванадий, VO3- и VO43-, поглощенные смолой, не десорбируются обычными десорбентами. Необходимо специальное вымывание их раствором сернистой кислоты или перевод ванадия перед сорбцией урана ц^несорбируемую четырехвалентную форму.
2. Молибдат-ион МоО42- очень прочно связывается со смолой. Вымывается только при обработке смолы раствором NаОН.
3. Кремниевая кислота, присутствующая в растворе в коллоидной форме или в виде Na2SiO3, прочно удерживается в порах ионита и результате сорбции силикатных ионов или коагуляции. Удалить ее можно обработкой смолы концентрированным раствором NaNO3.
4. В некоторых случаях, например при переработке руд ЮАР, растворы после выщелачивания содержат ионы СN-, что ведет к образованию политионатов и выделению серы.
Сорбция сильнокислотными катионитами. Одним из типичных представителей ионитов этого класса является советский катионит КУ-2 - сильнокислотный ионит полимеризационного типа, получаемый сульфохлорированием сополимера стирола и дивинилбензола с последующим омылением. Очень крутая изотерма сорбции урана (VI) (рис. 46, а) этим катионитом свидетельствует о большом сродстве ионов к смоле. Кроме того, КУ-2 отличает высокая скорость процессов сорбции и десорбции (по некоторым данным, сорбционное равновесие наступает в течение 6—10 мин). Представляет интерес зависимость обменной емкости катионита КУ-2 от значения рН среды. Эта зависимость показана на рис. 46, б, где представлены результаты экспериментов не только для КУ-2, но и для некоторых других катионитов, выпускаемых в СССР. Обращают на себя внимание значительный рост емкости всех катионитов с увеличением рН растворов и превышение в области высоких рН фактической емкости значений полной обменной емкости (теоретической) по сульфогруппам. Это явление обусловлено сорбцией ионов уранила общей формулой UO2[OUO2]n+, где п изменяется по мере увеличения рН среды от 0 до 1,2.
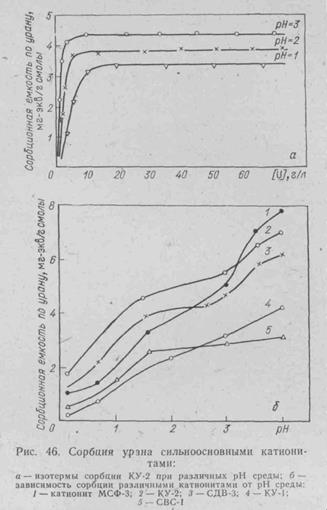 Одно из положительных свойств катионита КУ-2 - хорошая и полная десорбция урана из фазы смолы с помощью раствора нитрата аммония. В технологии урана катионит КУ-2 применяют очень редко из-за его низкой селективности. Действительно, даже в сернокислых средах, где селективная сорбция урана выше, чем в других средах, коэффициенты распределения урана и примесей таковы (для 0,5 н. Н2SO4): UO22+ -29,2; Тh-263; Мg-124; Fе(Ш)-255; А1 - 540; Сu(П)-128;. Се(III) -103.
Одно из положительных свойств катионита КУ-2 - хорошая и полная десорбция урана из фазы смолы с помощью раствора нитрата аммония. В технологии урана катионит КУ-2 применяют очень редко из-за его низкой селективности. Действительно, даже в сернокислых средах, где селективная сорбция урана выше, чем в других средах, коэффициенты распределения урана и примесей таковы (для 0,5 н. Н2SO4): UO22+ -29,2; Тh-263; Мg-124; Fе(Ш)-255; А1 - 540; Сu(П)-128;. Се(III) -103.
Некоторого отделения урана от других катионов можно добиться в процессе элюирования вследствие способности урана к комплексообразованию с сульфат-ионами, что, например, не свойственно РЗЭ. В то же время применением комплексообразователей можно связать ряд элементов-примесей в прочные комплексы с целью предотвратить их сорбцию. Например, ЭДТА связывает в комплексы Fe, Мо, V, Сu и Рb, что значительно повышает селективность сорбции урана.
В заключение можно сказать, что сильноосновные, a в некоторых случаях и сильнокислотные иониты 1-го класса — активные и надежные сорбенты. Они не очень селективны, так как наряду с ураном сорбируют SO42-, Fe, P, As, V, Al, Th, РЗЭ и др., что создает определенные трудности и осложнения. Существенный недостаток ионитов 1-го класса в том, что их емкость резко снижается в присутствии солей - «фоновых» примесей в растворе.
Иониты 2-го класса, проявляющие свойства слабых кислот или оснований, характеризуются большей селективностью сорбции урана по сравнению с ионитами 1-го класса и меньшей чувствительностью к «фоновым» примесям. Поэтому они имеют важное значение.
Сорбция ионитами 2-го класса. К ионитам 2-го класса относятся советские смолы: СГ-1—слабокислотный катионит, АН-2-ф—слабоосновной анионит, а также среднеосновные аниониты, ЭДЭ-10П и вофатит a-150.
Смолы этого класса обладают важными с технологической точки зрения свойствами: они меньше зависят от солевого состава раствора и более избирательны в определенных условиях.
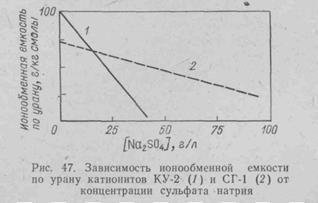
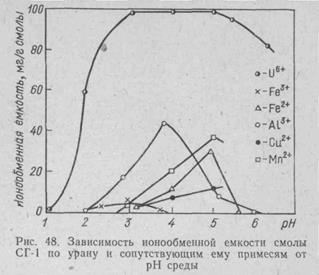
СГ-1 —слабокислотный карбоксильный ионит с функциональной группой СООН, подобный слабой кислоте (типа уксусной), синтезируют на основе акриловой и метакриловой кислот с соответствующей поперечной связкой. Действие этого ионита основано на комплексообразовании UO22+ с карбоксильной группой. О свойствах его в сравнении с ионитом КУ-2 можно судить по рис. 47. В соответствии с особенностями типичного слабокислотного катионита заметная сорбция урана смолой СГ-1 начинается лишь при рН==1,8—1,9. При дальнейшем повышении рН она резко возрастает. Оптимальными являются значения рН= 2,8-3,5. На рис. 48 приведены результаты сорбции некоторых катионов катионитом СГ-1 из раствора, содержащего, г/л: U 1; Fe3+ 0,05; Fe2+ 2,5; Аl3+ 1; Мn2+ 5.
Как видно из рис. 48, при рН=2,8—3,5 для смолы характерны хорошая ионообменная емкость и высокая селективность сорбции урана. В диапазоне указанных рН трехвалентного железа в растворе очень мало, так как оно выпадает в осадок в виде гидроокиси. То же самое можно сказать о Сu2+ и Мn4+. А13+- мало, и он вытесняется из смолы ураном. Все элементы, находящиеся в анионной форме, смолой СГ-1 практически не сорбируются. Кроме того, требуемого значения рН==2,8—3,5 достигают обычно предварительной добавкой извести («рН-ная -обработка»). При этом вместе с Fе(ОН)3 осаждаются Аs, Sb, P и другие примеси, и в растворе, направляемом на сорбцию, их содержится мало.
Нитрат-, хлорид- и ацетат-ионы не влияют на емкость смолы СГ-1, даже если их содержание превышает 100 г/л. Следовательно, с помощью смолы СГ-1 можно вести сорбцию из разбавленных хлоридных и азотнокислых растворов. Однако большое количество комплексообразователей урана (РО43-, F-,С204-) снижает сорбционную емкость смолы СГ-1 по урану, и их присутствие в растворе необходимо строго контролировать.
Сравнительно низкая стоимость СГ-1, его механическая и химическая стойкость, хорошая сорбционная емкость по урану позволили широко применять этот катионит в урановой промышленности СССР. Недостаток СГ-1—несколько «замедленная» кинетика сорбции и необходимость «рН-ной обработки» растворов перед сорбцией.
Регенерацию урана из смолы СГ-1 осуществляют с помощью растворов Н2SO4 с рН<1. При этом удается извлечь до 95% урана в малый объем кислоты и получить очень чистые регенераты с концентрацией урана 25—30 г/л.
Другим представителем 2-го класса ионитов может служить слабоосновной анионит АН-2-ф. В его состав входят активные ионогенные группы —NH2, =NH и ºN. Свойства смолы АН-2-ф характеризует рис. 49.

При увеличении кислотности с 10 до 30 г/л сорбционная емкость этого ионита по урану изменяется не очень сильно, а по железу уменьшается почти в 6 раз. Солевой состав раствора на сорбцию влияет мало. Промывка смолы после насыщения 2%-ной Н2SO4 дополнительно вымывает железо. Таким образом, действие смолы АН-2-ф очень селективно. Влияние примесей на сорбционную емкость для смолы АН-2-ф в несколько раз меньше, чем для смолы Амберлит IRА-400. Даже ванадий влияет незначительно.
При сорбции из карбонатных растворов можно применять только сильноосновные аниониты. При этом следует иметь в виду отрицательное влияние присутствия в растворах депрессирующих сорбцию урана СО32-, НСО3- и особенно SO42-, образующегося при окислении в щелочной среде соединений серы; низкой эквивалентной доли урана в сумме анионных составляющих жидкой фазы.
Таким образом, мы видим, что обоснованный выбор ионита для переработки того или иного типа урановой руды может и должен быть сделан после определения оптимальных условий выщелачивания и уточнения солевого состава получаемых растворов.
Дата: 2019-02-25, просмотров: 593.