БИЛЕТ № 1
Биосинтез холестерина. Схема процесса. Атеросклероз и связь нарушений метаболизма холестерина и липопротеинов.
3 основные стадии: I – превращение активного ацетата в мевалоновую кислоту, II – образование сквалена из мевалоновой кислоты, III – циклизация сквалена в холестерин. Рассмотрим стадию превращения активного ацетата в мевалоновую кислоту. Начальным этапом синтеза мевалоновой кислоты из ацетил-КоА является образование ацетоацетил-КоА посредством обратимой тиолазной реакции.
Затем при последующей конденсации ацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется β-гидрокси-β-метилглутарил-КоА. Далее β-гидрокси-β-метилглутарил-КоА под действием регуляторно-го фермента НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается в мевалоновую кислоту.
Самым распространённым заболеванием является атеросклероз, которое характеризуется отложением ХС в стенке сосудов и тканей. Вокруг ХС формируются бляшки, развивается соединительная ткань (склероз), развивается кальцификация сосудов, тромбозы, нарушается кровоснабжение тканей. Болезнь развивается тогда, когда между клетками тканей и ЛП крови нарушается гомеостаз, развивается гиперлипопротеинэмия. Как правило, в крови растёт содержание фракций ЛПОНП и ЛПНП, которые снабжают клетку ХС. Снижение содержания ЛПВП – назначение которых удалять избыточный ХС. В клетки сосудов проникают все ЛП за исключением хиломикронов. Поскольку в их состав входят ФЛ, ТГ и белки, они быстро распадаются и удаляются из клетки. ХС выходит в межклеточное пространство. Он является чужеродным, поэтому его окружают макрофаги. Все вещества, фагоцитирующие ЛП крови, разрушают ферменты лизосом за исключением ХС. Накапливаясь в большом количестве, откладывается в межклеточном пространстве, инкапсулируясь соединительной тканью, он ведёт к развитию склероза, к образованию атеросклеротических бляшек. Развитию его способствует курение, употребление алкоголя, сахарный диабет, обильная жирная пища и гипертоническая болезнь, т.е. все заболевания, которые ведут к повреждению стенок сосудов токсинами.
БИЛЕТ № 2
БИЛЕТ № 3
Свойства и биологическая роль белков. Белки как гидрофильные коллоиды. Реакции осаждения белков, использование реакций осаждения в медицинской практике. Методы очистки и разделения белков.
Содержание и формы билирубина в крови. Диагностическое значение форм билирубина.
Билирубин образуется при распаде гемопротеидов (гемоглобин – вердоглобин – биливердин – билирубин). В крови содержится прямой и непрямой (связанный с альбуминами) билирубин. Общее содержание билирубина определяется суммой прямого и непрямого билирубина. Общий билирубин 8,5-20,5 ммоль/литр. Прямой билирубин меньше 5 ммоль/литр. Непрямой билирубин расчетная величина – общий билирубин минус прямой билирубин. У новорожденных общий билирубин 20,5-200 ммоль/литр. Повышение содержания билирубина наблюдается при гемолитических процессах, острых и хронических гепатитах, закупорке желчевыводящих путей. Для дифференцивальной диагностики желтух проводят качественную реакцию на определение форм билирубина по реакции с деазореактивом (реактив Эрлиха). При развитии окраски непосредственно после добавления реактива – реакция прямая (реакция Ван ден Берга). Прямой билирубин образуется путем конъюгации его с глюкуроновой кислотой в клетках печени. Непрямой билирубин адсорбирован на белках плазмы крови и дает цветную реакцию только после предварительной обработки (осаждение белка, например спиртом). У здорового человека на долю непрямого билирубина приходится 75%, на долю прямого 25% от общего билирубина. При паренхиматозной желтухе нарушается билирубиновыдилительная функция печени, а также превращение непрямого билирубина в прямой. В крови повышено содержание обеих форм, особенно непрямого. При механической желтухе наблюдается повышенное содержание прямого билирубина. После поражения паренхимы повышается и непрямой. При гемолитической желтухе повышено содержание непрямого билирубина, в незначительной степени и прямого билирубина, что свидетельствует о нарушении билирубиновыделительной функции печени. Также содержание непрямого билирубина повышается при: физиологической желтухе новорожденных, синдроме Криглера-Найяра, болезни Жильбера, токсических гепербилирубинэмиях (отравление хлороформом, тетрахлоридом углерода), вирусном гепатите.
БИЛЕТ № 4
1. Белки как амфотерные электролиты. Механизм образования заряда. Изоэлектрическая точка белков. Свойства белков в изоэлектрическом состоянии.
Белки – это амфотерные соединения. R-COOH+OH-R-COO-+H2O R-NH2+H+R-CH3+. Величина и знак заряда определяется соотношением а/к и рН раствора. То значение рН, при котором суммарный заряд белка равен 0, т.е. + равен -, называется изоэлектрической точкой (РI). Белки в изоэлектрическом состоянии характеризуется: минимальной устойчивостью и вязкостью в растворе, отсутствует подвижность в электрическом поле, максимальная способность к осаждению. При сдвиге рН белок приобретает заряд, растворимость и подвижность в электрическом поле. При сдвиге рН белок становится или катионом и движется к катоду, или анионом и движется к аноду.
Б – амфотерные полиэлектролиты, содержат кислые(аспарагиновая, глутаминова) и основные(лизин, аргинин, гистидин) АМК.В растворе приобретают заряд, становятся катионами или анионами в зависимости от рН. Суммарный заряд Б зависит от соотношения АМК и рН р-ра. З-ие рН, при кот.суммарный заряд Б равен 0 – изоэлектрическая точка. Белок в ИТ – цвиттер-ион.
Св-ва Б в ИТ:1)мин устойчивость в р-ре, нет заряда, нет элктростатического отталкивания, молекулы Б слипаются и выпадают в осадок.2)мах спасобность к осаждению.3)мин вязкость из-за низкой концентрации белка в р-ре.4)неподвижны в электрическом поле.5)при сдвиге рН, Б приобретает заряд, раствоимость и подвижность в эл.поле. Заряд «+» - Б-поликатион, заряд «-» - Б-полианион.
Денатурация – нарушение нативной пространственной структуры белка, приводящее к потере или уменьшению растворимости, утрата специфической биологической активности, изменению ряда физико-химических свойств. Денатурация не сопровождается разрывом пептидных связей, т.е. не разрушается первичная структура, а связи оказываются снаружи и все изменяется. Свойства денатурированного белка: 1) повышается число реактивных групп, т.к. появляются ранее скрытные группы 2) понижается растворимость, белок может выпасть в осадок (при потере факторов устойчивости: заряд и гидратная оболочка) 3) изменяется конфигурация 4) изменяется биологическая активность 5) легко расщепляется протеолитическими ферментами. Факторы приводящие к денатурации белка: 1) физические – температура, УФ облучение, ультразвук, гаммаоблучение, стерилизация 2) химические реагенты: концентрированные кислоты, щелочи, соли тяжелых металлов.
Содержание глюкозы в крови. Возрастные особенности.
Возрастные показатели уровня сахара в крови. Норма взрослого человека – 3,5-5,5 ммоль/л, если больше 11 ммоль/л, то сахар появляется в моче – это пороговое вещество. Если меньше 3,3 ммоль/л – гипогликемия, больше 6 ммоль/л – гипергликемия. Недоношенные - 1,1-3,33, новорожденные - 2,22-3,33, 1 месяц – 2,7-4,44, 7 лет – 3,33-5,55, до 60 лет – 4,44-6,38, старше 60 – 4,61-6,10.
Глюкоза – это пороговое вещество и если ее больше в крови чем 11 ммоль/л она появляется с мочой. Глюкоза в норме обнаруживается только в суточном диурезе, в отдельных порциях она не обнаруживается; гликозурия бывает почечная и внепочечная. Почечная глюкозурия – нарушается механизм реабсорбции глюкозы в почках за счет врожденного или приобретенного дефекта белка переносчика. Характеризуется пониженным порогом почечной проницаемости и наблюдается при: ренальном диабете, развитии вторичных ренальных глюкозурий при хронических нефритах. Внепочечная глюкозурия – связана с гипергликемией. Причина: 1) дефицит инсулина при сахарном диабете – диабетическая. 2) избыток контринсулярных гормонов в крови – недиабетическая 3) раздражение ЦНС или сильное психическое напряжение – нервная. 4) эмоциональная. В детском возрасте наблюдается функциональная гликозурия, алиментарная – при злоупотреблении сахара.
БИЛЕТ № 5
Содержание белков в плазме крови, возрастные особенности.
Белки плазмы крови – это альбумины, глобулины и фибриноген. Общее количество белка 65-85 грамм в литре крови. Возрастные особенности: новорожденные 46-70, 1-2 года 56-75, до 69 лет 64-83, после 60 лет 62-81. Гипопротеинемия возникает вследствие: голодания, при повышенной потере белка – заболевания почек, кровопотери, новообразованиях, нарушениях синтеза белка – заболеваниях печени. Гиперпротеинемия: дегидротации (травмы, ожоги, холера), появление парапротеинемии, т е при появлении патологических белков при миеломной болезни и болезни Вальденстрема.
Общее содержание белков в плазме крови 65-85 гр в литре или 7%. Основные белки плазмы крови – это альбумины 59 гр в литре и глобулины 20-30 гр в литре, фибриноген 2-4 гр в литре. Методы разделения белков плазмы крови – это электрофорез на бумаге осуществляется в щелочном буфере рН=8,6. В щелочной среде все белки плазмы крови приобретают отрицательный заряд и перемещаются в одну сторонуПри острой инфекции кол-во гаммаглобулинов увеличивается, при нарушении белковосинтезирующей функции печени количество альбуминов уменьшается.
Функции белков плазмы крови: 1) поддержание онкотического давления 2) регулируют и поддерживают КОС за счет белковой и гемоглобиновой буферной системы крови 3) иммуноглобулины участвуют в поддержании гуморального иммунитета 4) транспорт микроэлементов, таких как Cu Fe Ca Mg и других 5) при белковом голодании являются резервом аминокислот 6) специальные белковые молекулы осуществляют транспорт липидов, углеводов, витаминов, конечных продуктов обмена и так далее.
БИЛЕТ № 6
Современные представления о строении белков. Уровни структуры белковой молекулы. Видовая специфичность белков. Конформация белковой молекулы (вторичная и третичная структуры). Типы связей в белках. Четвертичный уровень структуры. Доменный принцип структурной организации.
Белок (протеины) – protos – предшествующий всему, первичный, наиглавнейший, определяющий всё остальное.
Белки – это высокомолекулярные азотсодержащие органические вещества, состоящие из аминокислот, соединённых в цепи с помощью пептидных связей и имеющих сложную структурную организацию.
Уровни структуры белка. Первичная структура белка: последовательность а/к в полипептидной цепи соединенные пептидной связью (ковалентная). Последовательность а/к, их количество, лежат в основе первичной структуры белка, в которой заложена информация о последующих уровнях структуры и биологических функциях белка. Вторичная структура белка: 1) а-спираль имеет жесткие параметры – правозакрученная спираль, шаг спирали между двумя витками 3,6 а/к, высота 0,54 нм, конформация повторяется через 5 витков или 18 а/к, многочисленные Н связи между группами NH и С-О от первой к четвертой а/к-те. 2) бета структура – слоисто-складчатая, удерживается водородными связями, пептидные цепи располагаются антипараллельно. 3) неупорядоченная нерегулярная структура – а+в структуры – перекрест где встречаются а/ альфа и бета. Третичная структура белка: упаковка полипептидной цепи в пространстве. 1) в фибриллярных белках – коллаген и эластин – 3 а-спираль, бета слой (актин, миозин) 2) в глобулярных белках – все три типа вторичных структур. Два типа связи в третичной структуре: 1) ковалентная – пептидная и дисульфидная 2) слабые связи – многочисленные водородные связи, ионные взаимодействия. Упаковка идет таким образом, что гидрофобные связи находятся ниже (по типу жирной капли) – легко разрываются при изменении рН, температуры, ионов. Четвертичная структура – это ассоциация 4х субъединиц, которые определенным образом ориентированны в пространстве относительно друг друга. Для того чтобы Нb удерживался в форме тетрамера возникают связи между одинаковыми полипептидными цепочками, а также между разными полипептидными цепочками. Субъединицы расположены в пространстве таким образом, что в центре Нb образуется центральная полость (впадина), в которой находятся 2,3-дифосфоглицириновая кислота. По мере присоединения кислорода к молекуле гемоглобина конформация четвертичной структуры меняется, при этом альфа цепи сближаются, бета расходятся, т.о. молекула Нb как бы дышит Присоединяется одна молекула кислорода к первой субъединице, что приводит к конформационным изменениям других субъединиц.
Видовая и индивидуальная специфичность набора белков в данном организме определяет особенности его строения и функционирования. Набор белков в дифференцирующихся клетках одного организма определяет морфологические и функциональные особенности каждого типа клеток.
Строение коферментов
Коферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами:
- ковалентными связями;
- ионными связями;
- гидрофобными взаимодействиями и т.д.
Один кофермент может быть коферментом для нескольких ферментов. Многие коферменты являются полифункциональными (например, НАД, ПФ). В зависимости от апофермента зависит специфичность холофермента.
Все коферменты делят на две большие группы: витаминные и невитаминные.
Коферменты витаминной природы – производные витаминов или химические модификации витаминов.
1 группа: тиаминовые – производные витамина В1. Сюда относят:
- тиаминмонофосфат (ТМФ);
- тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ) или кокарбоксилаза;
- тиаминтрифосфат (ТТФ).
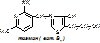
ТПФ имеет наибольшее биологическое значение. Входит в состав декарбоксилазы кетокислот: ПВК, a-кетоглутаровая кислота. Этот фермент катализирует отщепление СО2.
Кокарбоксилаза участвует в транскетолазной реакции из пентозофосфатного цикла.
2 группа: флавиновые коферменты, производные витамина В2. Сюда относят:
- флавинмононуклеотид (ФМН);
- флавинадениндинуклеотид (ФАД).
Ребитол и изоалоксазин образуют витамин В2. Витамин В2 и остаток фосфорной к-ты образуют ФМН. ФМН в соединении с АМФ образуют ФАД.
ФАД и ФМН являются коферментами дегидрогеназ. Эти ферменты катализируют отщепление от субстрата водорода, т.е. участвуют в реакциях окисления–восстановления. Например СДГ – сукцинатдегидрогеназа – катализирует превращение янтарной к-ты в фумаровую. Это ФАД-зависимый фермент. [рис. COOH-CH2-CH2-COOH® (над стрелкой – СДГ, под – ФАД и ФАДН2) COOH-CH=CH-COOH]. Флавиновые ферменты (флавинзависимые ДГ) содержат ФАД, который в них является первоисточником протонов и электронов. В процессе хим. реакций ФАД превращается в ФАДН2. Рабочей частью ФАД является 2 кольцо изоалоксазина; в процессе хим. реакции идет присоединение двух атомов водорода к азотам и перегруппировка двойных связей в кольцах.
3 группа: пантотеновые коферменты, производные витамина В3 – пантотеновой кислоты. Входят в состав кофермента А, НS-КоА. Этот кофермент А является коферментом ацилтрансфераз, вместе с которой переносит различные группировки с одной молекулы на другую.
4 группа: никотинамидные, производные витамина РР - никотинамида:
Представители:
- никотинамидадениндинуклеотид (НАД);
- никотинамидадениндинуклеотидфосфат (НАДФ).
Коферменты НАД и НАДФ являются коферментами дегидрогеназ (НАДФ-зависимых ферментов), например малатДГ, изоцитратДГ, лактатДГ. Участвуют в процессах дегидрирования и в окислительно-восстановительных реакциях. При этом НАД присоединяет два протона и два электрона, и образуется НАДН2.
Рис. рабочей группы НАД и НАДФ: рисунок витамина РР, к которому присоединяется один атом Н и в результате происходит перегруппировка двойных связей. Рисуется новая конфигурация витамина РР + Н+]
5 группа: пиридоксиновые, производные витамина В6. [рис. пиридоксаля. Пиридоксаль+ фосфорная к-та= пиридоксальфосфат]
- пиридоксин;
- пиридоксаль;
- пиридоксамин.
Эти формы взаимопревращаются в процессе реакций. При взаимодействии пиридоксаля с фосфорной кислотой получается пиридоксальфосфат (ПФ).
ПФ является коферментом аминотрансфераз, осуществляет перенос аминогруппы от АК на кетокислоту – реакция переаминирования. Также производные витамина В6 входят как коферменты в состав декарбоксилаз АК.
Коферменты невитаминной природы – вещества, которые образуются в процессе метаболизма.
1) Нуклеотиды – УТФ, УДФ, ТТФ и т.д. УДФ-глюкоза вступает в синтез гликогена. УДФ-гиалуроновая к-та используется для обезвреживания различных веществ в трансверных реакциях (глюкоуронил трансфераза).
2) Производные порфирина (гем): каталаза, пероксидаза, цитохромы и т.д.
3) Пептиды. Глутатион – это трипептид (ГЛУ-ЦИС-ГЛИ), он участвует в о-в реакциях, является коферментом оксидоредуктаз (глутатионпероксидаза, глутатионредуктаза). 2GSH«(над стрелкой 2Н) G-S-S-G. GSH является восстановленной формой глутатиона, а G-S-S-G – окисленной.
4) Ионы металлов, например Zn2+ входит в состав фермента АлДГ (алкогольдегидрогеназы), Cu2+ - амилазы, Mg2+ - АТФ-азы (например, миозиновой АТФ-азы).
Могут участвовать в:
-присоединении субстратного комплекса фермента;
-в катализе;
-стабилизация оптимальной конформации активного центра фермента;
-стабилизация четвертичной структуры.
Содержание остаточного азота в крови. Компоненты остаточного азота.
Содержание небелкового азота 15-25 ммоль/л. Небелковый азот крови представлен мочевиной 50%, амк 25%, эрготионеином 8%, мочевой кислотой 4%, креатином 5%, креатинином 2,5% - источник энергии АТФ, аммиаком и индиканом 0,5%, а также полипептидами, нуклеатидами, нуклеазами, глутатионом, билирубином, холином, гистидином. Т.о., в состав небелкового азота крови входит азот конечных продуктов обмена простых и сложных белков.
Небелковый азот крови называют также остаточным азотом, т.е. остающимся в фильтрате после осаждения белков (реакция осаждения белков плазмы крови). Главным конечным продуктом обмена белков является мочевина (образуется в печени), норма = 3,3-6,6 ммоль. Нарастания содержания мочевины в крови до 1,6-20 ммоль/л – является признаком нарушения функции почек средней тяжести, до 35 – тяжелой тяжести, свыше 50 ммоль/л – очень тяжелое нарушение с неблагоприятным прогнозом. Азот мочевины/остаточный азот * 100%. Норма меньше 48%. При почечной недостаточности повышается до 90%, а при нарушении мочеобразовательной функции печени снижается до менее 45%. Увеличение мочевины говорит о усиленном распаде белков тканей, уменьшение количества мочевины – при безбелковой диете, нарушении функции печени.
Мочевая кислота является конечным продуктом обмена пуриновых оснований в норме 0,18-0,24 ммоль/л. гиперурикэмия – повышение содержания мочевой кислоты – симптом подагры – 0,5-0,9 ммоль/л.
БИЛЕТ № 7
Хромопротеины
Для них простетическая часть окрашена (chromos – краска). К хромопротеинам относятся гемоглобин, миоглобин, каталаза, пероксидаза, ряд флавинсодержащих ферментов (сукцинатдегидрогеназа, альдегидоксидаза, ксантиноксидаза), цитохромы (гемсодержащие белки) и т.д. Велика биологическая роль этих белков – участвуют в физиологических процессах: дыхание клетки, транспорте кислорода и углекислого газа, окислительно-восстановительных процессах.
Гемоглобин. Его белковая часть представлена глобином, небелковая – гемом. Это олигомерный белок, т.е. имеет четвертичную структуру, состоящую из 4 субъединиц.
a цепи построены из 141 АК-остатка.
b цепи из 146 АК-остатков [рис. 4-х субъединиц, в каждой нарисована точка - гем].
Каждая из субъединиц связана с гемом:
Основная функция гемоглобина – транспортная (кислород, углекислый газ). Также он представляет собой основную буферную систему крови (75% от всей буферной емкости крови).
Различают:
- HbO2 – оксигемоглобин (связан с молекулой O2);
- HbCO – карбоксигемоглобин;
- HbCO2 – карбгемоглобин;
- HbOH – метгемоглобин (образуется при соединении с нитросоединениями, не способен связывать кислород).
Типы гемоглобина. Всего известно более 100 типов, но их все делят на 2 группы:
1) Физиологические гемоглобины;
2) Патологические (аномальные).
К физиологическим гемоглобинам относятся:
- Hb P – примитивный гемоглобин, имеет место быть у 1-2 недельного эмбриона;
- Hb F – фетальный или гемоглобин плода, к моменту рождения составляет около 70% всего гемоглобина в крови;
- Hb A, Hb A2, Hb A3 – это гемоглобины взрослого организма. На Hb A приходится около 90-96%.
Физиологические типы гемоглобинов отличаются глобулиновой частью (АК-составом). Например Hb A содержит 2a и 2b субъединицы, а Hb F – 2a и 2g субъединицы.
К аномальным (возникающих при наследственных заболеваниях) гемоглобинам относятся:
- HbS – гемоглобин, сопутствующий серповидно-клеточной анемии. Отличается от нормального тем, что с N-конца в 6 положении b–цепи глутамин заменен на валин.
Миоглобин по сравнению с гемоглобином имеет третичную структуру, одну полипептидную цепь, один гем и может связывать одну молекулу кислорода. Гемоглобин и миоглобин функционируют вместе. Гемоглобин доставляет кислород из легких к тканям, а миоглобин перераспределяет его внутри клетки (доставляет к митохондриям).
Оба белка – гемопротеины, т.е. гемсодержащие белки.
Аэробное окисление углеводов, схема процесса. Образование пировиноградной кислоты из глюкозы, последовательность реакций. Челночные механизмы транспорта водорода.
Три этапа аэробного распада углеводов: 1) гликолиз до ПВК, при этом образуется 8 АТФ 2) окислительное декарбоксилирование ПВК, при этом образуется 6 АТФ 3) АцКоА запускает ЦТК, в итоге образуется 24 АТФ, т.о. на одну молекулу глюкозы приходится 38 молекул АТФ.
Митохондриальная мембрана не проницаема для Н, он транспортируется через челночные механизмы – глицеролфосфатный челночный механизм, Маолат-аспартатная челночная система.
Гликоген распадается в печени и в мышцах,
1.глю → 2ПВК +2АТФ+НАДН (анаэробный процесс,10 р-ий)
2.2ПВК + 1/2О2 → СН3-С(О)-SКоА+2НАДН
3. СН3-С(О)-SКоА В ЦТК, либо +Н2О → СО2 + 4Н2
Челночные механизмы: существуют так называемые челночные механизмы, с помощью которых электроны, отщепляемые от НАДН при его окислении в цитоплазме, могут проникать внутрь митохондрий и поступать в дыхательную цепь.
1)малатаспартатный: под действием цитоплазмат. Малат-ДГ НАДН окисляется оксалацетатом, кот при этом вос-ся до малата. Малат проникает внутрь митохондрий. Здесь в матриксе митохондрии происходит обратная реакция под действием малат-ДГ и образованный в результате ее оксалацетат снова переходит с помощью механизма активного переноса через мембраны митохондрий в цитоплазму.
2)глицерофосфатный: с помощью фермента глицеро-ф-ДГ, коФ кот явл НАДН, продукт гликолиза диоксиацетон-ф восстанавливается в глицеро-ф. Глицерофосфат свободно проникает через мембраны митохондрий, захватив с собой электроны от НАДН, который превратился в НАД. Здесь под действием внутрнмитохондриальной глицеро-ф-ДГ, кот отличается от глицеро-ф-ДГ цитоплазмы, происходит обратная реакция превращения глицеро-ф в диоксиацетон-ф. Глицеро-ф-ДГ митохондрий в качестве кофермента использует не НАД+, а флавиновую группировку. Образовавшийся диоксиацетон-ф проникает через мембраны митохондрий обратно в цитоплазму, и цикл окисления цитоплазматической НАДН таким образом замыкается. Флавиновая глицеро-ф-ДГ а передает полученные в результате окисления глицеро-ф электроны на КоФ О дыхательной цепи. Т.о. в процессе их переноса на молекулярный кислород происходит не три, а два акта фосфорилирования. Глицерофосфатный челночный механизм является односторонним в том смысле, что он обеспечивает перенос электронов только внутрь митохондрий.
БИЛЕТ № 8
БИЛЕТ № 9
1. ДНК. Первичная, вторичная и третичная структура ДНК. Биологическая роль ДНК.
Нуклеиновые кислоты ДНК и РНК – сложные высокомолекулярные соединения, которые состоят из нескольких компонентов более простого строения. В молекуле ДНК углевод представлен дезоксирибозой, а в молекуле РНК рибозой. ДНК и РНК содержат фосфорную кислоту, а также по два пуриновых (аденин, гуанин) и пиримидиновых (цитозин, урацил, тимин) оснований. ДНК: Н3РО4, Дезоксирибоза, Аденин, Гуанин, Цитозин, Тимин. Структурной единицей нуклеиновой кислоты является нуклеотид. Они состоят из трех компонентов: азотистого основания, углевода и фосфорной кислоты. Первичная структура нуклеиновых кислот – это последовательное расположение нуклеотидов в полинуклеотидной цепи ДНК или РНК. Между нуклеотидами имеется 3’,5’-фосфодиэфирная связь. Вторичная структура нуклеиновых кислот –
ДНК представляет собой двойную спираль (это биополимер) состоящий из двух антипараллельных цепочек, закрученных вокруг одной и той же оси. Цепочки соединяются водородными связями которые образуются между азотистыми основаниями. Цепочки имеют противоположную полярность, т.е. у одной цепочки направление 5’ к 3’, а у другой 3’ к 5’. Спираль ДНК закручивается вправо, общий виток 3,4нм, расстояние между цепочками 2нм. Основой структурной организации ДНК составляет принцип комплементарности – аденин соединяется с Тимином, цитозин с гуанином. Третичная структура – двойная спираль ДНК на некоторых участках может подвергаться дальнейшей спирализации с образованием суперспирали или открытой кольцевой формы, что часто вызвано ковалентным соединением их открытых концов. Суперспиральная структура обеспечивает экономную упаковку огромной молекулы ДНК в хромосоме: вместо 8 см в вытянутой форме ДНК укладывается в 5 нм. Суперспирализация ДНК может быть нарушена разрывом в одной из цепей или обеих цепях двойной спирали под действием ДНКазы.
Биологическая роль ДНК: 1) хранение и передача генетической информации о структуре белка. 2) способна к репликации (самоудваению). 3) способна к репарации (восстановление поврежденной структуры). 4) Участвует в транскрипции (в синтезе мРНК). ДНК находится в ядре, в митохондриях.
Функции ДНК:
1. ДНК является носителем генетической информации. Функция обеспечивается фактом существования генетического кода.
2. Воспроизведение и передача генетической информации в поколениях клеток и организмов. Функция обеспечивается процессом репликации.
3. Реализация генетической информации в виде белков, а также любых других соединений, образующихся с помощью белков-ферментов. Функция обеспечивается процессами транскрипции и трансляции
Содержание кальция и фосфора в плазме крови.
Общее содержание: плазма –2,3-2,75 ммоль/л, ионизированный – 1,05-1,3 ммоль/л, в эритроцитах- следы. Источники: молочные продукты, бобовые, злаки, орехи. Принимает участие в процессах нервно-мышечной возбудимости (как антагонист ионов калия), мышечного сокращения, свертываемости крови, образует структурную основу костного скелета, влияет на проницаемость клеточной мембраны. Понижение (гипокальциемия) вызывают: понижение функции паращитовидных желез,беременность,алиментарные дистрофии,рахит у детей, острый панкреатит, стеаторея при панкреатитах, закупорка желчных протоков, почечная недостаточность. Повышение конц-ции (гиперкальциемия) вызывает: повышение ф паращитовидных желез, переломы костей, полиартриты, метастазы злокачественных опухолей в кости, множественные миеломы, передозировка витамина D и кальция, желтухи.
Фосфор относится к жизненно необходимым веществам, он входит в состав всех тканей организма, особенно мышц и мозга, участвует во всех видах обмена веществ, необходим для нормального функционирования нервной системы, сердечной мышцы и т.д.В тканях организма и пищевых продуктах фосфор содержится в виде фосфорной кислоты и органических соединений фосфорной кислоты (фосфатов). Основная его масса находится в костной ткани в виде фосфата кальция, остальной фосфор входит в состав мягких тканей и жидкостей. В мышцах происходит наиболее интенсивный обмен соединений фосфора. Фосфорная кислота участвует в построении молекул многих ферментов, нуклеиновых кислот и т.д. Содержание органических соединений фосфора в крови человека меняется в значительных пределах. Однако количество неорганического фосфора более или менее постоянно - 3 - 5,5 мг% . Увеличивается содержание неорганического фосфора при молочной диете, а также при ряде заболеваний почек, при переломах в стадии заживления. сахарном диабете, акромегалии, аддисоновой болезни и др.; уменьшается концентрация неорганического фосфора в сыворотке крови при повышении функции паращитовидных желез и ряде других заболеваний.
БИЛЕТ № 10
БИЛЕТ № 11
Митохондриальная цепь окисления водорода. Образование электрохимического трансмембранного потенциала, его использование.
Перенос 2х протонов из матрикса в межмембранное пространство сопряжен с образованием градиента концентраций протонов водорода (дельта МюН). Именно в этом месте возникает пункт сопряжения, окисления и фосфорилирования. Трансмембранный электрохимический потенциал – это разница протонов между матриксом и наружной частью. Образуется АТФ (АДФ+Фн) путем фосфорилирования с использованием энергии окисления водорода.
В цикле трикарбоновых кислот электроны, освободившиеся при окислении, переносятся на акцепторные молекулы коферментов (НАД), которые вовлекают их далее в цепь переноса электронов (ЭТЦ - электронтранспортную цепь). Эти события внутри митохондрий происходят в их матриксе. Остальные реакции, связанные с дальнейшим переносом электронов и синтезом АТФ, связаны с внутренней митохондриальной мембраной, с кристами митохондрий. Освободившиеся в процессе окисления в цикле трикарбоновых кислот электроны, акцептированные на коферментах, переносятся затем в дыхательную цепь, где они соединяются с молекулярным кислородом, образуя молекулы воды. Дыхательная цепь представляет собой ряд белковых комплексов, встроенных во внутреннюю митохондриальную мембрану, и является главной системой превращения энергии в митохондриях. Здесь происходят последовательное окисление и восстановление элементов дыхательной цепи, в результате чего высвобождается небольшими порциями энергия. За счет этой энергии в трех точках цепи из АДФ и фосфата образуется АТФ. то есть происходит процесс окислительного фосфорилирования.
При переносе электронов в митохондриальной мембране каждый комплекс дыхательной цепи направляет свободную энергию окисления на перемещение протонов (положительных зарядов) через мембрану, из матрикса в межмембранное пространство, что приводит к образованию разности потенциалов на мембране: положительные заряды преобладают в межмембранном пространстве, а отрицательные - со стороны матрикса митохондрий. При достижении определенной разности потенциалов (220 мВ) белковый комплекс АТФ-синтетазы начинает транспортировать протоны обратно в матрикс, при этом превращает одну форму энергии в другую: образует АТФ из АДФ и неорганического фосфата. Так происходит сопряжение окислительных процессов с синтетическим - с фосфорилированием АДФ. Пока происходит окисление субстратов, - идет сопряженный с этим синтез АТФ, то есть окислительное фосфорилирование.
Энергия, выделяющаяся в ходе этих реакций, трансформируется в трансмембранный протонный потенциал. Фермент АТФ-синтаза использует этот градиент для синтеза АТФ, преобразуя его энергию в энергию химических связей.
Анализ желудочного сока.
Переваривание белков начинается в желудке. рН желудочного сока 1,0-2,0 (1,5-2,5). Состав желудочного сока: HCl, пепсиноген, у детей ренин (химозин). Роль HCl в переваривании белков. 1) набухание и денатурация белков – нативный денатурирующий агент. 2) оказывает бактерицидное действие. 3) создает определенное значение рН. 4) стимулирует выработку секретина. 5) ускоряет всасывание железа. 6) активирует пепсиноген в пепсин в 2е стадии: а) частичный протеолиз б) аутокатализ. Пепсин – протеолитический фермент, вырабатывается в форме пепсиногена в слизистой оболочке желудка; отличается высокой устойчивостью в кислой среде, pI < 1, гидролизует преимущественно пептидные связи, образованные аминогруппами а/к (ароматических).
Ренин – активный фермент, катализирует свертывание молока, т.е. превращение казеиногена в казеин.
У новорожденных слабощелочная реакция рН=6.
Виды кислотности желудочного сока: 1) общая кислотность – 40-60 титр. ед – свободная HCl, связанная с белками HCl, кислые фосфорнокислые соли, органические кислоты. 2) свободная HCl – количество Н+ и Сl- ионов 20-40 титр. ед. 3) связанная HCl – недиссоциированная соляная кислота белково-солянокислых комплексов 2-15 титр. ед.
Сумма свободной и связанной HCl – общая соляная кислота, она немного меньше общей кислотности, т.к. 2-5 титр. ед составляет кислотность, обусловленная кислыми фосфатами.
БИЛЕТ № 12
БИЛЕТ № 13
Хромопротеины
Для них простетическая часть окрашена (chromos – краска). К хромопротеинам относятся гемоглобин, миоглобин, каталаза, пероксидаза, ряд флавинсодержащих ферментов (сукцинатдегидрогеназа, альдегидоксидаза, ксантиноксидаза), цитохромы (гемсодержащие белки) и т.д. Велика биологическая роль этих белков – участвуют в физиологических процессах: дыхание клетки, транспорте кислорода и углекислого газа, окислительно-восстановительных процессах.
Гемоглобин. Его белковая часть представлена глобином, небелковая – гемом. Это олигомерный белок, т.е. имеет четвертичную структуру, состоящую из 4 субъединиц.
a цепи построены из 141 АК-остатка.
b цепи из 146 АК-остатков [рис. 4-х субъединиц, в каждой нарисована точка - гем].
Каждая из субъединиц связана с гемом:
Основная функция гемоглобина – транспортная (кислород, углекислый газ). Также он представляет собой основную буферную систему крови (75% от всей буферной емкости крови).
Различают:
- HbO2 – оксигемоглобин (связан с молекулой O2);
- HbCO – карбоксигемоглобин;
- HbCO2 – карбгемоглобин;
- HbOH – метгемоглобин (образуется при соединении с нитросоединениями, не способен связывать кислород).
Типы гемоглобина. Всего известно более 100 типов, но их все делят на 2 группы:
1) Физиологические гемоглобины;
2) Патологические (аномальные).
К физиологическим гемоглобинам относятся:
- Hb P – примитивный гемоглобин, имеет место быть у 1-2 недельного эмбриона;
- Hb F – фетальный или гемоглобин плода, к моменту рождения составляет около 70% всего гемоглобина в крови;
- Hb A, Hb A2, Hb A3 – это гемоглобины взрослого организма. На Hb A приходится около 90-96%.
Физиологические типы гемоглобинов отличаются глобулиновой частью (АК-составом). Например Hb A содержит 2a и 2b субъединицы, а Hb F – 2a и 2g субъединицы.
К аномальным (возникающих при наследственных заболеваниях) гемоглобинам относятся:
- HbS – гемоглобин, сопутствующий серповидно-клеточной анемии. Отличается от нормального тем, что с N-конца в 6 положении b–цепи глутамин заменен на валин.
Миоглобин по сравнению с гемоглобином имеет третичную структуру, одну полипептидную цепь, один гем и может связывать одну молекулу кислорода. Гемоглобин и миоглобин функционируют вместе. Гемоглобин доставляет кислород из легких к тканям, а миоглобин перераспределяет его внутри клетки (доставляет к митохондриям).
Оба белка – гемопротеины, т.е. гемсодержащие белки.
Аэробное окисление углеводов, схема процесса. Образование пировиноградной кислоты из глюкозы, последовательность реакций. Челночные механизмы транспорта водорода.
Три этапа аэробного распада углеводов: 1) гликолиз до ПВК, при этом образуется 8 АТФ 2) окислительное декарбоксилирование ПВК, при этом образуется 6 АТФ 3) АцКоА запускает ЦТК, в итоге образуется 24 АТФ, т.о. на одну молекулу глюкозы приходится 38 молекул АТФ.
Митохондриальная мембрана не проницаема для Н, он транспортируется через челночные механизмы – глицеролфосфатный челночный механизм, Маолат-аспартатная челночная система.
Гликоген распадается в печени и в мышцах,
1.глю → 2ПВК +2АТФ+НАДН (анаэробный процесс,10 р-ий)
2.2ПВК + 1/2О2 → СН3-С(О)-SКоА+2НАДН
3. СН3-С(О)-SКоА В ЦТК, либо +Н2О → СО2 + 4Н2
Челночные механизмы: существуют так называемые челночные механизмы, с помощью которых электроны, отщепляемые от НАДН при его окислении в цитоплазме, могут проникать внутрь митохондрий и поступать в дыхательную цепь.
1)малатаспартатный: под действием цитоплазмат. Малат-ДГ НАДН окисляется оксалацетатом, кот при этом вос-ся до малата. Малат проникает внутрь митохондрий. Здесь в матриксе митохондрии происходит обратная реакция под действием малат-ДГ и образованный в результате ее оксалацетат снова переходит с помощью механизма активного переноса через мембраны митохондрий в цитоплазму.
2)глицерофосфатный: с помощью фермента глицеро-ф-ДГ, коФ кот явл НАДН, продукт гликолиза диоксиацетон-ф восстанавливается в глицеро-ф. Глицерофосфат свободно проникает через мембраны митохондрий, захватив с собой электроны от НАДН, который превратился в НАД. Здесь под действием внутрнмитохондриальной глицеро-ф-ДГ, кот отличается от глицеро-ф-ДГ цитоплазмы, происходит обратная реакция превращения глицеро-ф в диоксиацетон-ф. Глицеро-ф-ДГ митохондрий в качестве кофермента использует не НАД+, а флавиновую группировку. Образовавшийся диоксиацетон-ф проникает через мембраны митохондрий обратно в цитоплазму, и цикл окисления цитоплазматической НАДН таким образом замыкается. Флавиновая глицеро-ф-ДГ а передает полученные в результате окисления глицеро-ф электроны на КоФ О дыхательной цепи. Т.о. в процессе их переноса на молекулярный кислород происходит не три, а два акта фосфорилирования. Глицерофосфатный челночный механизм является односторонним в том смысле, что он обеспечивает перенос электронов только внутрь митохондрий.
Поддержание постоянства концентрации глюкозы в крови. Источники и пути расходования глюкозы в организме. Гормональная регуляция уровня глюкозы в крови. Гипо- и гипергликемия, причины их возникновения.
Уровень глюкозы в крови регулирует ряд гормонов. Инсулин понижает уровень сахара в крови, а все остальные повышают его – адреналин, глюкогон, глюкокортикоиды, соматотропный гормон. Глюкоза в организм человека поступает с пищей и образуется в результате протекания следующих процессов: распад гликогена, глюконеогенез. Глюкоза расходуется на: 1) синтез гликогена 2) ПФЦ (рибоза5фосфат + НАДФН) 3) гликолиз, в результате образуется 2 ПВК (высвобождается 8 АТФ). Далее ПВК в анаэробных условиях превращается в 2 МК и 2 АТФ. В аэробны условиях происходит окислительное декарбоксилирование ПВК до 2 АцКоА (6 АТФ), который запускает ЦТК, в результате чего образуется СО2, Н2О и 24 АТФ. Кортизол угнетает синтез белков в тканях и не использованные на синтез а/к идут на глюконеогенез, а в печени усиливается биосинтез ключевого фермента глюконеогенеза пируваткарбоксилазы. Возрастные показатели уровня сахара в крови. Норма взрослого человека – 3,5-5,5 ммоль/л, если больше 11 ммоль/л, то сахар появляется в моче – это пороговое вещество. Если меньше 3,3 ммоль/л – гипогликемия, больше 6 ммоль/л – гипергликемия. Гипергликемия – причины: физиологическая гипергликемия – алиментарная, эмоциональная; при сахарном диабете; при гипертиреозе, адренокортицизме, гиперпитуитаризме. Гипогликемия – причины: длительное голодание; нарушение всасывания (заболевания ЖКТ), хронические заболевания печени (нарушение синтеза гликогена); нарушение секреции контринсулярных гормонов – гипопитуитаризм, хроническая недостаточность коры надпочечников; гипотиреоз; заболевания ЦНС (инсульты); передозировка инсулина и пероральных диабетических средств; нарушение режима питания у больных с сахарным диабетом; заболевания поджелудочной железы (инсулинома).
БИЛЕТ № 14
БИЛЕТ № 15
Образование макроэргических соединений в цепи тканевого дыхания. Характеристика процесса с помощью коэффициента Р/О. Разобщение окисления водорода и фосфорилирования АДФ в дыхательной цепи.
Коэффициент Р/О – это количество АТФ, которое образовалось в дых цепи. Р/О может быть равно 3 или 2 АТФ. Три АТФ образуется при участии НАДН, две АТФ при участии ФАДН2.
В окислительном фосфорилировании не образуется дельта МюН, т.к. есть вещества, которые принимают протоны на себя. В окислительном фосфорилировании не происходит образования АТФ и энергия выделяется в виде тепла. Это такие вещества как динитрофенилгидрозин или ДНФГ, пестициды, гербициды, алкоголь.
Чрезвычайно важной функцией цепи дых.катализаторов, связанных с внутренней мембраной митохондрий, наряду с переброской электронов от субстратов дыхания на кислород, является аккумуляция части освобождающейся энергии (около 50 %) в фосфатных связях высокоэргических (или макроэргических ) соединений (гл.образом АТФ). Процесс сопряжения тканевого дыхания и фосфорилирования получил название окислительного фосфорилирования. Синтез АТФ из АДФ и фосф.к-ты осуществляется в митохондриях при миграции электронов от субстрата к кислороду ч/з цепь дых.катализаторов. при этом обнаружено,что отношение Р/О, т.е. число молекул неорганического фосфата,перешедших в органическую форму (АТФ), в расчете на кажый поглощенный атом кислороа близко к 3.
Разобщение окисления и фосфорилирования — это состояние, при котором энергия, освобождающаяся в процессе транспорта электронов по дыхательной цепи, не способна аккумулироваться в макроэргических связях АТФ и поэтому выделяется в виде теплоты.
Для этого состояния характерны уменьшение ресинтеза АТФ и увеличение потребления кислорода клетками. В основе разобщения окисления и фосфорилирования могут лежать следующие механизмы:
а) уменьшение градиента концентраций ионов водорода между матриксом митохондрий и цитоплазмой;
б) уменьшение трансмембранного электрического потенциала на внутренней митохондриальной мембране;
в) нарушения АТФ-синтетазного ферментного комплекса;
г) использование энергии градиента концентраций ионов водорода не на синтез АТФ, а на другие цели (транспорт ионов кальция из цитоплазмы в митохондрии, транспорт фосфата, АДФ, АТФ и др.).
БИЛЕТ № 16
БИЛЕТ № 17
Основные пути использования аминокислот после всасывания. Синтез креатина, креатинфосфата, биологическая роль. Образование креатинина.
Свободные а/к после всасывания в кишечнике участвуют в процессах анаболизма и катаболизма. Анаболизм направлен на синтез 1)тканевых белков, белков плазмы крови, на синтез защитных и транспортных белков, 2) пептидов, таких как глутатион, кот. участвует в ок.вос. реакциях, окситоцин, вазопрессин 3) заменимых а/к 4) азотсодержащих соединений небелковой природы – пурины и пиримидины- ФАД- кофактор ферментов оксидоредуктаз (НАД и НАДФ), креатинин, кот участвует в процессах мышечного сокращения, гем, биогенные амины ( адреналин, норадреналин, гистамин, ГАМК) 5) на синтез углеводов – глюкогенные а/к 6) липидов – кетогенные а/к. В процессах катоболизма а/к распадаются до конечных продуктов обмена CO2 H2O NH3, кот. превращается в мочевину и выводится с мочой. При реакциях катоболизма выделяется энергия, образование АТФ.
Биосинтез креатина протекает в две стадии в почках, в печени, в поджелудочной железе. Из печени с током крови креатин поступает в мышечную ткань, где фосфорилируясь превращается в креатинфосфат (который после дефосфорилирования превращается в креатинин, выделяющийся с мочой), участвует в химических процессах связанных с мышечным сокращением, источник энергии АТФ. Судьба амк: 1) на биосинтез Б 2) превр в Л и У 3) окисл до конечных продуктов 4)используются на синтез N-содержащих небелковых соединений: азотистые основания, гормоны(катехоламины, йодтироксины), пептид(глутатион), креатин.
Синтез креатина. 2 тадии, исп 3 амк (арг, гли, мет)
I стадия (в почках)
NH2-C(NH)-NH-(CH2)3-CH(NH2)-COOH арг + NH2 - CH2 COOH гли (глицинамидинотрансфераза) →
NH2-C(NH)-NH-CH2-COOH гуанидинацетат + (NH2)(СООН)СН-(CH2)3 - NH2 орнитин
II стадия (в печени)
NH2-C(NH)-NH-CH2-COOHгуанидинацетат +СН3–S(adenosyle)-(CH2)2-CH(NH2)-COOH 5-аденозилметионин→ NH2-C(NH)-N(СН3)- CH2-COOH креатин + аденозилгомоцистеин →гомоцистеин→цистеин
Гомоцистеин – 21ая амк, не участвующая в синтезе Б.
Из печени креатин транспортируется в мыш.тк, сердце, г.м., и там подвергается фосфорилированию, с образованием креатинфосфата – это макроэрг, кот используется как запасная форма фосфата, кот транспортируется на АДФ с ресинтезом АТФ, катализ – креатинфосфокиназа, она им 3 изофермента(ММ, МВ, ВВ).
Нормальные величины содержания креатина в плазме крови: 15, 25-76,25 мкмоль/л, т.е. 13-53 мкмоль/л у мужчин, 27-71 мкмоль/л у женщин. При концентрации креатина более 122 мкмоль/л он выделяется с мочой.
Креатин в моче здоровых людей практически отсутствует (ммоль/сут): новорожденные – следы, 1 мес – 0,07, 1 год – 0,4, 5 лет – 0,5, 10 лет 1,5, взрослые – «-». Повышение содержания в моче возможно при: миопатиях; прогрессирующей мышечной дистрофии; поражениях печени; сахарном диабете; эндокринных заболеваниях (гипертиреоз, болезнь Аддисона, акромегалия); инфекционных заболеваниях; лихорадочных состояниях; красной волчанке; переломах; ожогах; белковом голодании; беременности; у детей.
Гидролиз креатинфосфата ведет к образованию креатинина. Креатинин образуется также при неферментативной дегидратации креатина (2% от общего количества креатинина). Нормальные величины (мкмоль/л): новорожденные – 27-88, 1год – 18-35, подростки – 44-88, мужчины 44-100, женщины 44-88. Концентрация креатинина в крови является довольно постоянной величиной, не зависящей от питания и других факторов. Поэтому для диагностики используется клиренс эндогенного креатинина для оценки клубочковой фильтрации почек. Повышение концентрации в крови при: нарушении функции почек (острая и хроническая недостаточность), мочекаменной болезни. Креатинин попадает в мочу путем клубочковой фильтрации. Суточное выделение креатинина индивидуально и постоянно, отражает мышечную массу. Содержание в моче (ммоль/л): 0,08 – новорожденные, 0,4 – 1 мес, 0,7 – 1 год, 2,7 – 5 лет, 6,0 – 10 лет, 7,1-17,7 – взрослые. При тяжелом нарушении функции почек содержание креатинина достигает 800-900 мкмоль/л. Клиренс – очищение. Креатинин не реабсорбируется в почках, по его уровню можно судить о скорости клубочковой фильтрации. Отклонение говорит о нарушении функции деятельности почки. Понижение содержания креатинина говорит о почечной недостаточности.
БИЛЕТ № 18
БИЛЕТ № 19
Содержание мочевой кислоты в крови. Причины гиперурикемии.
Мочевая кислота крови является конечным продуктом распада пуриновых оснований. Нормальные величины: новорожденные 0,2 ммоль/сутки, год 1-2ммоль/сутки, 6 лет 1-8, 12лет 3-5ммоль/сутки. 0,10-0,40 ммоль/л – у мужчин до 60 лет, 0,24-0,50 – у женщин до 60 лет, 0,25-0,47 – у мужчин старше 60 лет, 0,19-0,43 – у женщин старше 60 лет.
Повышение содержания мочевой кислоты – гиперурикемия – наблюдается при: подагре, лейкозах, витамин В12-дефицитных анемиях, полицитемиях, острых инфекциях, заболеваниях печени, тяжелой форме сахарного диабета, хронической экземе, псориазе, отравлениях барбитуратами, оксидом углерода, метанолом, заболеваниях почек.
БИЛЕТ № 20
Современные представления о регуляции биосинтеза белков. Регуляция действия генов. Строение и функционирование лактозного оперона кишечной палочки. Индукция и репрессия синтеза белков в организме человека.
Синтез белка регулируется внешними и внутренними условиями, которые диктуют клетке синтез такого количества белка и таких белков, которые необходимы для выполнения физиологических функций. Общую теорию регуляции синтеза белка разработали Ф. Жакоб и Ж. Моно. Сущность этой теории сводится к «выключению» или «включению» генов как функционирующих единиц, к возможности или невозможности проявления их способности передавать генетическую информацию для синтеза специфических белков. Согласно теории Жакоба и Моно в биосинтезе белка у бактерий участвуют по крайней мере три типа генов: структурные гены, ген-регулятор и ген-оператор. Структурные гены определяют первичную структуру белка. Синтез мРНК на структурных генах молекулы ДНК непосредственно контролируется определенным участком, называемым геном-оператором. Он служит пусковым механизмом для функционирования структурных генов. Ген-оператор локализован на крайнем отрезке структурного гена или структурных генов, регулируемых им. «Считывание» генетического кода, т.е. формирование мРНК, начинается с промотора - участка ДНК, являющегося точкой инициации для синтеза мРНК, и далее распространяется последовательно вдоль оператора и структурных генов. Координированный одним оператором одиночный ген или группа структурных генов образует оперон.
Функция гена-регулятора состоит, в том, чтобы через белок-репрессор прекращать деятельность структурных генов, синтезирующих мРНК. Репрессор, кроме того, обладает способностью строго специфически связываться с определенными низкомолекулярными веществами, называемыми индукторами, или эффекторами. Когда такой индуктор соединяется с репрессором, последний теряет способность связываться с геном-оператором, который таким образом выходит из-под контроля гена-регулятора, и начинается синтез мРНК.
Регуляция может быть позитивной и негативной. Пример негативной регуляции – лактозный оперон. Бактеральная клетка синтезирует ферменты, принимающие участие в метаболизме лактозы, лишь в том случае, когда лактоза присутствует в окружающей среде и клетка испытывает недостаток глюкозы. При поступлении в клетку лактозы (индуктора) молекулы ее связываются с белком-репрессором и блокируют связь между репрессором и геном-оператором. При этом ген-оператор и структурные гены начинают снова функционировать и синтезировать необходимую мРНК, которая «дает команду» рибосомам синтезировать р-галактозидазу. Одновременно ген-регулятор продолжает вырабатывать репрессор, но он блокируется новыми молекулами лактозы, поэтому синтез фермента продолжается. Как только молекулы лактозы будут полностью расщеплены, репрессор освобождается и, поступив в ДНК, связывает ген-оператор и блокирует синтез мРНК, а, следовательно, синтез Р-галактозидазы в рибосомах. Таким образом, биосинтез мРНК, контролирующий синтез белка в рибосомах, зависит от функционального состояния репрессора. Если репрессор, который представляет собой белок, построенный из 4 субъединиц, находится в активном состоянии, не связан с индуктором, то он блокирует ген-оператор и синтез мРНК не происходит. При поступлении метаболита-индуктора в клетку его молекулы связывают репрессор, превращая его в неактивную форму (или, возможно, снижая его сродство к гену-оператору). Структурные гены выходят из-под запрещающего контроля и начинают синтезировать нужную мРНК.
БИЛЕТ № 21
Парные соединения мочи.
После всасывания ядовитых продуктов обмена (крезола, фенола, скатола, индола) они через воротную вену попадают в печень, где они подвергаются обезвреживанию путем связывания с серной или глюкуроновой кислотой с образованием нетоксичных парных кислот, которые выделяются с мочой.
Катализируют реакции ФАФС – 3-фосфоаденозин-5-фосфосульфат и УДФГК – уридиндифосфоглюкуроновая кислота.
Индолиндоксилиндоксилсерная кислотаживотный индикан.
БИЛЕТ № 22
Специфичность.
Непрямое дезаминирование.
1)Трансаминирование
АК + альфа-КГ аминотрансфераза, вит.В6®альфа-кеток-та + глутамат
Механизм: 1. АК+ФП Û альфа-кетокта + ФП-амин
2. ФП-амин + альфа-КГ Û ФП +глутамат
Аминотрансферазы облад.субстратной специфичностью:
Ала+a-КГ АЛТ, В6 Û ПВК / глутамат
Аспартат +a-КГ АСТ, В6 Û оксалоацетат +глутамат
2)окислительное дезаминирование глутамата
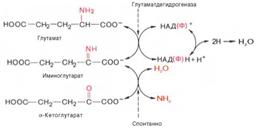
Роль: - синтез заменимых АК
- Т-первая реакция непрямого дезаминирования с образованием кетокислот, к-рые используются на гюконеогенез, или окисляются в ЦТК
- р.обратимы;их можно рассм.как р.анаболизма, так и катаболизма.
В тканях при физиологич.знач.рН(7,3-7,4) активна только 1 L-оксидаза – глутамат-ДГ;ее небелковым компонентом является НАД или НАДФ. Оксидазы остальных АК активны только про рН=10, а при этом они неактивны.(в кач.небелк.компонента имеют ФМН) – прямому ок-ному дезаминированию подверг.только глутамат.
Минеральные вещества мочи.
В моче содержатся практически все минеральные вещества, которые входят в состав крови и других тканей организма. Из 50–65 г сухого остатка, образующегося при выпаривании суточного количества мочи, на долю неорганических компонентов приходится 15–25 г.
Ионы натрия и хлора. В норме около 90% принятых с пищей хлоридов выделяется с мочой (8–15 г NaCl в сутки). При ряде патологических состояний (хронический нефрит, диарея, острый суставной ревматизм и др.) выведение хлоридов с мочой может быть снижено. Максимальная концентрация ионов Na+и Сl– (в моче по 340 ммоль/л) может наблюдаться после введения в организм больших количеств гипертонического раствора.
Ионы калия, кальция и магния. Многие исследователи считают, что практически все количество ионов калия, которое имеется в клубочковом фильтрате, всасывается обратно из первичной мочи в проксимальном сегменте нефрона. В дистальном сегменте происходит секреция ионов калия, которая в основном связана с обменом между ионами калия и водорода. Следовательно, обеднениеорганизма калием сопровождается выделением кислой мочи.
Ионы Са2+ и Mg2+ выводятся через почки в небольшом количестве (см. табл. 18.1). Принято считать, что с мочой выделяется лишь около 30% всего количества ионов Са2+ и Mg2+, подлежащего удалению из организма. Основная масса щелочноземельных металловвыводится с калом.
Бикарбонаты, фосфаты и сульфаты. Количество бикарбонатов в моче в значительной мере коррелирует с величиной рН мочи. При рН 5,6 с мочой выделяется 0,5 ммоль/л, при рН 6,6 – 6 ммоль/л, при рН 7,8 – 9,3 ммоль/л бикарбонатов. Уровень бикарбонатовповышается при алкалозе и понижается при ацидозе. Обычно с мочой выводится менее 50% всего количества выделяемых организмомфосфатов. При ацидозе выведение фосфатов с мочой возрастает. Повышается содержание фосфатов в моче при гиперфункции паращитовидных желез. Введение в организм витамина D снижает выделение фосфатов с мочой.
Серосодержащие аминокислоты: цистеин, цистин и метионин – являются источниками сульфатов мочи. Эти аминокислотыокисляются в тканях организма с образованием ионов серной кислоты. Общее содержание сульфатов в суточном количестве мочиобычно не превышает 1,8 г (в расчете на серу).
Аммиак. Как отмечалось, существует специальный механизм образования аммиака из глутамина при участии фермента глутаминазы, которая в большом количестве содержится в почках. Аммиак выводится с мочой в виде аммонийных солей. Содержание последних вмоче человека в определенной степени отражает кислотно-основное равновесие. При ацидозе их количество в моче увеличивается, а при алкалозе снижается. Содержание аммонийных солей в моче может быть снижено при нарушении в почках процессов образованияаммиака из глутамина.
БИЛЕТ № 23
1. Образование и обезвреживание аммиака. Биосинтез мочевины, последовательность реакций. Роль печени в мочевинообразовании. Возрастные особенности
Источники аммиака:
1)дезаминирование АК(в тканях и кишечнике)
2)дезаминирование аминов
3)дезаминирование азотистых оснований
Аммиак в крови – 12-65мкмоль/л(10-120мкг%), в моче – 35,7 – 71,4ммоль/сут(0,5-1,0г)
Аммиак исключительно токсичен.
Обезвреживание:
1)образование амидов(локально)
Гутамат + NH3,NH4+,АТФ, магний++, глутамин-синтетаза®глутамин +АДФ +Фн
Глутамин®почки( –аммиак, глутаминаза) Глутамат ®-аммиак®2аммоний+®аммониогенез
®альфа-КГ
®печень, синтез мочевины
®синтез пуринов, пиримидинов.
2)восстановительное аминирование
А. альфа-КГ (глутаматДГ, аммоний, 2Н, НАДФ)®глутамат, Н2О, НАДФН
Б. глутамат + ПВК (трансаминирование)Ûальфа-КГ +ала
3)образование аммонийных солей
4)синтез мочевины.
Аммиак образуется при распаде пуриновых и пиримидиновых азотистых оснований, окислительном дезаминировании аминокислот в тканях, дезаминирование биогенных аминов.
Орнитиновый цикл мочевинообразования – основной механизм обезвреживания аммиака в организме. Мочевина является главным конечным продуктом белкового обмена, она синтезируется в печени.
На первом этапе синтезируется макроэргическое соединение – карбамоилфосфат. На втором этапе происходит конденсация карбамоилфосфата и орнитина с образованием цитрулина. Далее цитрулин взаимодействует с аспартатом и образуется аргининосукцинат, который под действием аргининосукцинат-лиазы распадается на фумарат и аргинин, который под действием аргиназы расщепляется на мочевину и орнитин.
БИЛЕТ № 24
1. Процессы образования конечных продуктов обмена простых белков. Основные источники аммиака. Роль глутамина в обезвреживании аммиака и синтезе ряда соединений.
Источники аммиака:
1)дезаминирование АК(в тканях и кишечнике)
2)дезаминирование аминов
3)дезаминирование азотистых оснований
Аммиак в крови – 12-65мкмоль/л(10-120мкг%), в моче – 35,7 – 71,4ммоль/сут(0,5-1,0г)
Аммиак исключительно токсичен.
Обезвреживание:
1)образование амидов(локально)
Гутамат + NH3,NH4+,АТФ, магний++, глутамин-синтетаза®глутамин +АДФ +Фн
Глутамин®почки( –аммиак, глутаминаза) Глутамат ®-аммиак®2аммоний+®аммониогенез
®альфа-КГ
®печень, синтез мочевины
®синтез пуринов, пиримидинов.
2)восстановительное аминирование
А. альфа-КГ (глутаматДГ, аммоний, 2Н, НАДФ)®глутамат, Н2О, НАДФН
Б. глутамат + ПВК (трансаминирование)Ûальфа-КГ +ала
3)образование аммонийных солей
4)синтез мочевины.
Аминокислота R-CH-NH2-COOH окисляется до NH3 (обезвреживается и превращается в мочевину, которая выводится с мочой) и R-C=O-COOH CO2 + R- COOH бета окисление до АцКоА ЦТК АТФ + Н2О + СО2
БИЛЕТ № 25
1. Распад пуриновых и пиримидиновых азотистых оснований. Конечные продукты, пути выведения.
Пуриновые азотистые основания окисляются до мочевой кислоты: 1) плохо растворима в Н2О 2) рКм/к= 5,75 при рН меньше 5,75 мочевая кислота в основном находится в протонированной форме, при рН больше 5,75 мочевая кислота образует соли с Na – ураты, кот в 17 раз лучше растворимы в воде, чем мочевая кислота.3) растворимость мочевой кислоты резко снижается при низкой температуре. Роль мочевой кислоты: 1) является конечным продуктом распада 2) проявляет свойства антиоксиданта 3) по структуре похожа на кофеин, поэтому оказывает влияние на функцию цнс. Судьба мочевой кислоты. М/К поступает в кровь, связывается с глобулинами плазмы и это значительно повышает ее растворимость. М/К в крови в норме 0,15-0,42 ммоль/л. из организма м/к в основном выводится с мочой 250-270 миллиграмм в сутки. Повышение концентрации м/к в крови называется гиперурикемия, кот бывает 2 видов: 1) продукционная – образуется в результате повышенного образования м/к 2) ретенционная – в результате снижения выведения с мочой В последствии развивается подагра, при кот наблюдается накопление уратов в тканях, наиболее чувствительны суставы, в кот накопление уратов вызывает воспалительную реакцию и сильные боли, наблюдается образование камней в мочевыводящих путях. Лечение подагры: 1) диета с исключением продуктов с высоким содержанием пуринов ( икра, печень, почки, мясо, красное вино) – болезнь аристократов 2) препарат аллопуринол – структурный аналог гипоксантина, действует как конкурентный ингибитор к , в результате образуется именьше м/к.
Особенности у новорожденных: на 2-3 день после рождения у детей наблюдается мочекислый инфаркт новорожденных – повышенное выведение м/к с мочой, кот приобретает ярко янтарно-коричневый цвет, связано это с повышенным распадом нуклеопротеидов - физиологическое состояние, кот проходит через 5-7 дней.
Глюкозурия и ее причины.
Глюкоза – это пороговое вещество и если ее больше в крови чем 11 ммоль/л она появляется с мочой. Глюкоза в норме обнаруживается только в суточном диурезе, в отдельных порциях она не обнаруживается; глюкозурия – увеличение глюкозы. Почечная и внепочечная.
Почечная глюкозурия – нарушается механизм реабсорбции глюкозы в почках за счет врожденного или приобретенного дефекта белка переносчика. Характеризуется пониженным порогом почечной проницаемости и наблюдается при: ренальном диабете, развитии вторичных ренальных глюкозурий при хронических нефритах.
Внепочечная глюкозурия – связана с гипергликемией. Причина:
1) дефицит инсулина при сахарном диабете – диабетическая.
2) избыток контринсулярных гормонов в крови – недиабетическая
3) травматическое, токсическое, механическое раздражение ЦНС или сильное психическое напряжение – нервная.
4) при травмах головного мозга, после наркоза, при отравлении морфином, при эмоциональных нагрузках, стрессе – эмоциональная
5) В детском возрасте наблюдается функциональная глюкозурия, алиментарная – при злоупотреблении сахара.
6) Физиологическая глюкозурия – алиментарная, при стрессах, у беременных.
Кроме глюкозы, в моче могут быть обнаружены и другие сахара: пентозурия – при употреблении большого кол-ва фруктов; лактозурия – у кормящих грудью женщин; галактозурия – при галактоземии.
БИЛЕТ № 26
1. Обмен фенилаланина и тирозина. Использование тирозина для синтеза катехоламинов, тироксина и меланинов. Наследственные нарушения обмена фенилаланина и тирозина ( фенилкетонурия, алкаптонурия).
Фенилаланин – незаменимая а/к, которая поступает с пищей, используется на синтез тканевых белков. Основной путь распада идет через тирозин, который в свою очередь распадается на фумарат и ацетоацетат 2АцКоА ЦТК.
Распад фенилаланина и тирозина до конечных продуктов.
Фенилаланин в реакции гидроксилирования под действием гидроксилазы, кофактор ВН4 – тетрагидробиотерин превращается в тирозин, из которого в дальнейшем образуется гомогентизиновая кислота, которая превращается в малеилацетоуксусную кислоту, а потом в фумарилацетоуксусную кислоту, которая распадается на фумаровую кислоту и ацетоуксусную кислоту.
Наследственное нарушение распада фенилаланина и тирозина: 1) ФКУ – фенилаланинкетонурия – 2 формы. А) классическая ФКУ. Б) ФКУ в результате дефицита кофактора ВН4 (встречается в 2%). Причина классической ФКУ – врожденная недостаточность фермента фенилаланингидроксилазы в печени, нарушается основной путь распада фенилаланина через тирозин. У большинства наблюдается повышенное содержание в крови и моче фенилаланина и его метаболитов. Фенил ПВК – оказывает токсическое действие, тормозит транспорт через мембрану внутрь клеток, это нарушает синтез белков и нейромедиаторов нервной ткани, у детей наблюдается умственная отсталость. Характерный признак ФКУ – специфический запах плесени (мышиный) от мочи и пота ребенка.
Диагностика ФКУ: 1) экспресс метод определяет фенил ПВК в моче с FeCl3, наблюдается образование продукта зеленого цвета (тест проводят на пеленке). 2) определение концентрации фенилаланина и его метаболитов в крови и моче. При заболевании фенилаланина в крови в 15 раз больше нормы. 3) тест на дефицит кофактора ВН4. Лечение ФКУ: 1)диетотерапия – используют смеси со сниженным содержанием фенилаланина.
2) Алкаптонурия причина – врожденная недостаточность фермента оксидазы гомогентизиновой кислоты, накопление этой кислоты в организме, она выводится с мочой, которая на воздухе темнеет, т.к. образуется полимер черного цвета – алкаптон. С возрастом гомогентизиновая кислота накапливается в соединительной ткани, наблюдается охроноз – потемнение ушных раковин, носа, щек и других мест.
У 50% больных наблюдается артрит, т.к. гомогентизиновая кислота тормозит синтез коллагена.
Синтез катехоламинов из тирозина– дофамин, норадреналин, адреналин – синтезируются в нейронах и в мозговом веществе надпочечников. НА и дофамин являются нейромедиаторами. АД – гормон стресса – увеличивает ЧСС, АД, участвует в активном гликогенолизе и липолизе (с образованием энергии). Синтез меланина происходит в меланоцитах из тирозина. Наследственное нарушение синтеза меланина: 1)альбинизм – нарушение в меланоцитах. Причина – недостаточность фермента тирозиназы – наблюдается выраженная депигментация кожи, волос, глаз (кожа розовая, радужка светло-голубая, цвет волос белый, предрасположенность к раку кожи). 1:39000 детей. Синтез тиреоидных гормонов происходит в щитовидной железе в составе тиреоглобулина – это гликопротеид, с молекулярной массой 660кДа – в своем составе имеет 115 остатков тирозина. 1 стадия синтеза – концентрирование и активация иодидов в щитовидной железе. 2 стадия синтеза - йодирование остатков тирозина в составе тиреоглобулина. 3 стадия – происходит освобождение Т3 (трийодтирозин) и Т4 (тироксин) из тиреоглобулина, которые активируют тиреоидный гормон, они поступают в кровь и с помощью тироксин связывающих глобулинов транспортируются в ткани.
2. Окисление высших жирных кислот. Последовательность реакций β-окисления. Связь окисления жирных кислот с цитратным циклом и дыхательной цепью.
Свободная жирная кислота независимо от длины углеводородной цепи является метаболически инертной и не может подвергаться никаким биохимическим превращениям, в том числе окислению, пока не будет активирована. Активация жирной кислоты протекает на наружной поверхности мембраны митохондрий при участии АТФ, коэнзима A (HS-KoA) и ионов Mg2+. Реакция катализируется ферментом ацил-КоА-синтетазой. В результате реакции образуется ацил-КоА, являющийся активной формой жирной кислоты. Переносчиком активированных жирных кислот с длинной цепью через внутреннюю митохондриальную мембрану служит карнитин. После прохождения ацилкарнитина через мембрану митохондрий происходит обратная реакция – расщепление ацилкарнитина
Внутримитохондриальное окисление жирных кислот.Ацил-КоА под действием Ацил-КоА дегидрогеназы превращается в Еноил-КоА→под действ. Еноил-КоА-гидратазы в 3-гидроксиацил-КоА →3-оксиацил-КоА →Ацил-КоА и .ацетил-КоА. Образовавшийся ацетил-КоА подвергается окислению в цикле трикарбоновых кислот, а ацил-КоА, укоротившийся на два углеродных атома, снова многократно проходит весь путь β-окисления вплоть до образования бутирил-КоА, который в свою очередь окисляется до 2 молекул ацетил-КоА.
При каждом цикле β-окисления образуются одна молекула ФАДН2 и одна молекула НАДН. Последние в процессе окисления в дыхательной цепи и сопряженного с ним фосфорилирования дают: ФАДН2 – 2 молекулы АТФ и НАДН – 3 молекулы АТФ, т.е. в сумме за один цикл образуется 5 молекул АТФ. При окислении пальмитиновой кислоты образуется 5 х 7 = 35 молекул АТФ. В процессе β-окисления пальмитиновой кислоты образуется 8 молекул ацетил-КоА, каждая из которых, «сгорая» в цтк, дает 12 молекул АТФ, а 8 молекул ацетил-КоА дадут 12 х 8 = 96 молекул АТФ.
БИЛЕТ № 27
Обмен триптофана. Образование серотонина, биологическая роль. Кинурениновый и серотониновый пути превращения триптофана.
Обмен триптофана – незаменимая а/к, используется на синтез белков. 2 пути обмена: 1) основной – кинуриновый. 2) серотониновый (1%).
Синтез НАД из триптофана важен, т.к. на этом пути используется витамин В6, поэтому при недостатке этого витамина наблюдаются симптомы, сходные с пеллагрой.
Наследственные нарушения обмена триптофана: болезнь Хартнупа – недостаток белков-переносчиков триптофана в кишечной стенке. Избыток триптофана превращается в индикан, который выводится с мочой и окисляется в индиго синего цвета – симптом голубых пеленок, признаки пеллагры. Биологическая роль серотонина: 1) является нейромедиатором. 2) активирует агрегацию и адгезию тромбоцитов. 3) стимулирует сужение сосудов, сокращение гладких мышц. 4) в эпифизе из серотонина образуется мелатонин, который участвует в регуляции сна
Трп – незаменимая АК. В физиологических условиях более 95% триптофана окисляется по кинурениновому пути и не более 1% – по серотониновому. Серотонин в организме подвергается окислительному дезаминированию с образованием индолилук-сусной кислоты, которая выделяется с мочой. Содержание этой кислоты в моче повышено при поражениях кишечника злокачественными карци-ноидами, когда около 60% триптофана окисляется по серотониновому пути.
серия р-ций→серия р-ций +ФРПФ→рибонуклеотид никотин.к-ты +АТФ, +глутамин→НАД+ перенос е в дых.цепи→НАДФ+
ТРп гидроксилаза, О2→Н2О →5-окситриптофан декарбоксилаза, ПФ→ серотонин
- сужает сосуды
- стимулирует активность мозга
- регулирует сон, поведение, кровяное давление, температуру
- стимулирует секрецию гастроинтестинальных Г
- стимулирунт перистальтику
- серотонин – мелатонин(образ.в шишковид.железе)
Кетонурия и ее причины.
Представители кетоновых тел: бета-оксимасляная и ацетоуксусная кислоты, ацетон. Они образуются в печени из АцКоА. Нормальное содержание ацетона в сыворотке крови менее 10 мг/л. В моче в норме менее 0,01 в сутки, в отдельных порциях не обнаруживаются. Суточная экскреция кетоновых тел с мочой 20-50 мг. Кетонурия – резкое увеличение содержания кетонов в моче в результате их усиленного образования и нарушения процесса окисления. Наблюдается при: сахарном диабете, голодании, кахексии, гиперинсулинизме, тиреотоксикозах, в послеоперационном периоде, гликогенозах I, II, IV типов, акромегалии, инфекционных заболеваниях, интоксикации.
БИЛЕТ № 28
Креатинурия и ее причины.
Креатин синтезируется в печени, почках, поджелудочной железе и транспортируется в мышечную ткань. В мышцах и в ткани головного мозга он превращается в креатинфосфат, относящийся к фосфогенам – соединениям, являющимся запасными носителями энергии. Гидролиз фосфата ведет к образованию креатинина. Нормальные величины содержания креатина в плазме крови: 15, 25-76,25 мкмоль/л, т.е. 13-53 мкмоль/л у мужчин, 27-71 мкмоль/л у женщин. При концентрации креатина более 122 мкмоль/л он выделяется с мочой.
Креатин в моче здоровых людей практически отсутствует (ммоль/сут): новорожденные – следы, 1 мес – 0,07, 1 год – 0,4, 5 лет – 0,5, 10 лет 1,5, взрослые – «-». Повышение содержания в моче возможно при: миопатиях; прогрессирующей мышечной дистрофии; поражениях печени; сахарном диабете; эндокринных заболеваниях (гипертиреоз, болезнь Аддисона, акромегалия); инфекционных заболеваниях; лихорадочных состояниях; красной волчанке; переломах; ожогах; белковом голодании; беременности; у детей.
БИЛЕТ № 29
Протеинурия и ее причины.
Протеинурия – высокое содержание белка в моче. По степени протеинурия может быть: а) слабо выраженная б) умеренно выраженная в) выраженная. Слабо выраженная – 156-506 мг/сут: при остром и хроническом гломерулонефрите; наследственном нефрите, тубулопатии, интерстициальном нефрите, обструктивной уропатии. Умеренно выраженная – 500-2000 мг/сут – при: остром и хроническом гломерулонефрите; наследственном нефрите. Выраженная – более 2000 мг/сут – при: нефротическом синдроме, амилоидозе.
По локализации различают: а) преренальную – при усиленном распаде белка в тканях и гемолизе, б) ренальную – клубочковая (более выраженная), канальцевая (менее выраженная), в) постренальную – связана с поражением мочевыводящей системы (мочеточник, мочевой пузырь, уретра, половые органы).
Физиологические протеинурии связаны с временным появлением белка в моче и встречаются при: напряжении мышц, спортивных соревнованиях, приеме холодной ванны, душа, после эмоций. Функциональная протеинурия – ортостатическая протеинурия. Белок Бенс-Джонса – выделяется с мочой при миеломной болезни, макроглобулинемии Вальденстрема.
Повышение экскреции белка с мочой – протеинурия. В норме он не обнаруживается в отдельных порциях, в зависимости от причин их делят на 2 вида: 1) почечные, которые обусловлены функциональным нарушением почечного фильтра (увеличение порога почечной фильтрации) и органические повреждения нефрона.
- функциональная: а) физиологическая – у детей до 4-10 дня, связана с высокой проницаемостью капилляров б) ортостатическая или циклическая – 6-12 лет – наблюдается в дневное время, связана с приходящими изменениями гемодинамики почки (повреждение проницаемости почечного фильтра) в) инсультная – у детей раннего возраста – связана с повышенным раздражением почечного фильтра под действием пальпации, пониж или повыш to, испуга, обезвоживания.
- органические – наблюдаются при поражении или воспалении почечного фильтра – гломерулярные, или при нарушениях канальцев почек – тубулярные. В гломерулярной или клубочковой форме почечный фильтр начинает фильтровать белки разной молекулярной массы, в зависимости от этого выделяют: а) селективная форма – фильтруются белки с относительно небольшой массой – 100 кДа – альбумины, трансферин, антитрипсин б) неселективные – в мочу попадают почти все белки плазмы крови. Тубулярная форма – нарушение проницаемости реабсорбции белков, т.е. развитие патологических процессов в канальцах, тубулопатия – чаще наследственного характера.
2) внепочечные: а - повышение концентрации общего белка в плазме или появление необычных белков - парапротеинов в плазме крови: а) преренальная – канальцы несправляются с реабсорбцией больших количеств белков, возникает перегрузка б) перегрузочная – легкие цепи Ig миеломных белков определяются в моче при миеломной болезни, белки Бенс-Донсона. Гемоглобин и миоглобин появляется в крови и моче при распаде мышечной ткани. б - попадание белка из мочевыводящих путей при их воспалении и других процессах – постренальная протеинурия.
БИЛЕТ № 30
БИЛЕТ № 31
БИЛЕТ № 32
Роль воды в организме. Содержание и распределение воды в тканях. Возрастные особенности. Регуляция водного обмена.
Вода организма образует 2 водных пространства: внутриклеточное(2/3общей воды) и внеклеточное(1/3). Небольшое кол-во воды входит в жидкости полостей тела: боюшной, плевральной и т.п., а также в цереброспинальную, анутриглазную, внутрисуставную жид.. Внеклеточное пр-во включает: 1) внутрисосудистый вод.сектор, т.е. плазму крови, объем к-рой сост.8%общей воды, и 2) интерстициальный вод.сектор, содержащий ¼ всей воды(15%массы тела) и являющийся наиб.подвижным при избытке или недостатке воды в теле.
25%-интерстициальная жидкость
8%-плазма (внутрисосудистый фактор)
67%-внутриклеточная жидкость.
Вода является основным веществом, из которого состоит организм человека.
Содержание воды в теле зависит от возраста, пола, массы тела. У здорового взрослого мужчины массой 70 кг общее содержание воды в организме составляет около 60% массы тела, т.е. 42 л. У женщин общее количество воды в организме приближается к 50% массы тела, т.е. меньше, чем у мужчин, что обусловлено большим содержанием бедной водой жировой ткани и меньшим – мышечной. У новорожденного ребенка содержание воды в теле достигает 80% массы тела и затем с возрастом постепенно уменьшается вплоть до старости. Это – одно из проявлений старческой инволюции, зависящее от изменения свойств коллоидных систем (снижение cпособности молекул белков связывать воду) и от возрастного уменьшения клеточной массы, главным образом мышечной ткани. Общее содержание воды зависит также от массы тела: у тучных оно меньше, чем у лиц с нормальной массой тела, у худых – больше. Это связано с тем, что в жировой ткани воды значительно меньше, чем в тощих тканях (не содержащих жира).
Вода выполняет важные функции в организме:
- Она является обязательной составной частью всех клеток и тканей.
- Выступает в роли универсального растворителя органических и неорганических веществ.
- В водной среде протекает большинство химических реакций, т.е. процессов обмена веществ,
лежащих в основе жизнедеятельности организма.
- Она участвует в транспорте субстратов, необходимых для клеточного метаболизма, и выведении из организма вредных продуктов обмена веществ.
- Вода определяет физико-химическое состояние коллоидных систем, в частности дисперсность белков, что обусловливает их функциональные особенности.
Регуляция
Осмотическая регуляция.Поступление воды в организм обеспечивается изменением питьевого поведения, которое зависит от чувства жажды. Центр жажды составляют нейроны ряда областей головного мозга: образований, окружающих 3-й желудочек, преоптической зоны и гипоталамуса. Их особенностью является наличие больших вакуолей, заполненных жидкостью с определенной осмоляльностью. Таким образом, в формировании жажды принимают участие различные системы гипоталамических нейронов, интегрирующие сенсорные влияния, обусловленные видом и вкусом воды с внутренними сигналами, идущими от осморецепторов, локализованных в перижелудочковой, преоптической зонах и в гипоталамусе. Система сравнения, расположенная около нейронов СОЯ, может контролировать их активность и таким образом оказывать влияния на высвобождение АДГ Волюмическая регуляция, важнейший механизм сохранения вводно-электролитного баланса, также участвует в формировании жажды. Волюморецепторы каротидного синуса и дуги аорты и барорецепторыпредсердий, устьев полых вен и легочной вены реагируют соответственно на изменения объема и давления циркулирующей крови. В реализации осмо- и волюморефлексов - основных инструментов регуляции осмотического гомеостаза участвуют гуморальные механизмы.Гуморальная регуляция вводно-электролитного обмена осуществляется гормонами и местно образующимися физиологически активными веществами, в частности простагландинами Е. Основными гормонами, регулирующими осмотический гомеостаз, являются вазопрессин (АДГ), гормоны РААС(ангиотензин-2 и альдостерон), ПНУФ (атриопептин). Аргинин – вазопрессин (ВП), или антидиуретический гормон (АДГ), представляет собой нонапептид, образующийся нейроэндокринными нейронами супраоптического (СОЯ), паравентрикулярного (ПВЯ) и ряда добавочных ядер гипоталамуса. Активация ВП-нейронов возникает при увеличении осмоляльности плазмы крови на 1-2 % и при гиповолемии за счет импульсов от осмо- и волюморецепторов. Основной эффект ВП можно свести к эуосмии - поддержанию осмотического давления крови и тем самым межклеточной жидкости, что создает условия для сохранения стабильного объема клеток в организме, определяющего их эффективное функционирование, и установлению соответствия объемациркулирующей крови емкости сосудистого русла.Главным органом-мишенью для гормонов – регуляторов водно-электролитного обмена являются почки. Основное значение ВП связано с регуляцией конечного этапа реабсорбции воды в почечных канальцах.БИЛЕТ № 33
БИЛЕТ № 34
Транспорт
Транпортируется кровью только в составе ЛП, обеспечивающих поступление в ткани экзогенного ХС, определяют потоки ХС между органами и выведение избытка ХС из организма.
-- транспорт экзогенного ХС
ХС поступает с пищей 300-500мг/сут, в осн.в виде эфиров. Гидролиз, всас-е в сост.мицелл, этерификация в кл.слизистой кишечника→своб.ХС и его эфиры включ.в сост.ХМ и поступ.в кровь. После удаления жиров из ХМ под действием ЛП-липазы ХС в составе остаточных ХМ→печень. Поступает механизмом эндоцитоза, гидролизуется ферментами лизосом и образ.свободный ХС.
-- транспорт эндогенного ХС в составе ЛОНП(пре-бета-ЛП)
Печень – основное место синтеза эндогенного ХС из Ац-КоА. Он соед.с экзогенным в сост.остаточных ХМ→общий фонд ХС. В гепатоцитах триацилглицеролы и ХС упаков-ся в ЛПОНП→секретируются в кровь, где на них действует ЛП-липаза и гидролизует из до глицерола и ЖК.
-- транспорт ХС в составе ЛПНП.
Содержат 55%ХС и его эфиров. Таким образом доставляется в ткани и печень(75%), имеющие на своей пов-ти рецептор ЛПНП, содержащий углевод.часть.
-- роль ЛПВП
Синтезируются в печени и немного в тонком киш. Переносят ХС и фосфоглицерины в печень. Также обратный транспорт ХС в печень осущ. с помощью ЛПНП, после этого выдел.в виде производных с фекалиями.
Атеросклероз (от греч. ἀθέρος, «мякина, кашица» и σκληρός, «твёрдый, плотный») — хроническое заболевание артерий эластического и мышечно-эластического типа, возникающее вследствие нарушения липидного обмена и сопровождающееся отложением холестерина и некоторых фракций липопротеидов в интиме сосудов. Отложения формируются в виде атероматозных бляшек. Последующее разрастание в них соединительной ткани (склероз), и кальциноз стенки сосуда приводят к деформации и сужению просвета вплоть до облитерации (закупорки).
Атерогенными свойствами обладают не все липопротеиды, а только низкой (ЛПНП) и очень низкой плотности (ЛПОНП).
БИЛЕТ № 35
Современные представления о строении белков. Уровни структуры белковой молекулы. Видовая специфичность белков. Конформация белковой молекулы (вторичная и третичная структуры). Типы связей в белках. Четвертичный уровень структуры.
Первичная структура белка: последовательность а/к в полипептидной цепи соединенные пептидной связью (ковалентная). Последовательность а/к, их количество, лежат в основе первичной структуры белка, в которой заложена информация о последующих уровнях структуры и биологических функциях белка. Вторичная структура белка: 1) а-спираль имеет жесткие параметры – правозакрученная спираль, шаг спирали между двумя витками 3,6 а/к, высота 0,54 нм, конформация повторяется через 5 витков или 18 а/к, многочисленные Н связи между группами NH и С-О от первой к четвертой а/к-те. 2) бета структура – слоисто-складчатая, удерживается водородными связями, пептидные цепи располагаются антипараллельно. 3) неупорядоченная нерегулярная структура – а+в структуры – перекрест где встречаются а/ альфа и бета. Третичная структура белка: упаковка полипептидной цепи в пространстве. 1) в фибриллярных белках – коллаген и эластин – 3 а-спираль, бета слой (актин, миозин) 2) в глобулярных белках – все три типа вторичных структур. Два типа связи в третичной структуре: 1) ковалентная – пептидная и дисульфидная 2) слабые связи – многочисленные водородные связи, ионные взаимодействия. Упаковка идет таким образом, что гидрофобные связи находятся ниже (по типу жирной капли) – легко разрываются при изменении рН, температуры, ионов. Четвертичная структура – это ассоциация 4х субъединиц, которые определенным образом ориентированны в пространстве относительно друг друга. Для того чтобы Нb удерживался в форме тетрамера возникают связи между одинаковыми полипептидными цепочками, а также между разными полипептидными цепочками. Субъединицы расположены в пространстве таким образом, что в центре Нb образуется центральная полость (впадина), в которой находятся 2,3-дифосфоглицириновая кислота. По мере присоединения кислорода к молекуле гемоглобина конформация четвертичной структуры меняется, при этом альфа цепи сближаются, бета расходятся, т.о. молекула Нb как бы дышит Присоединяется одна молекула кислорода к первой субъединице, что приводит к конформационным изменениям других субъединиц.
Переваривание и всасывание простых и сложных липидов в желудочно-кишечном тракте. Основные этапы: эмульгирование, липолиз, мицеллярная и мукозная стадии, транспорт продуктов гидролиза, их использование.
Расщепление липидов происходит в 12—перстной кишке, куда поступают липаза с соком поджелудочной железы и конъюгированные желчные кислоты в составе желчи. Эмульгирование жира — обязательное условие для переваривания, так как делает гидрофобный субстрат более доступным для действия гидролитических ферментов — липаз. Эмульгирование происходит при участии желчных кислот , которые из—за своей амфифильности, окружают каплю жира и снижают поверхностное натяжение, что приводит к дроблению капли.
Гидролиз жира осуществляется при участии панкреатической липазы , которая, сорбируясь на поверхности капель жира, расщепляет эфирные связи в триацилглицеринах (ТАГ). Жирные кислоты отщепляются прежде всего из —положения. В результате образуется — диацилглицерин, затем —моноацилглицерин, который является основным продуктом гидролиза: 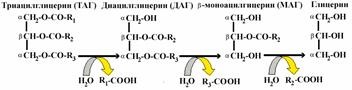
Всасывание происходит также при участии желчных кислот, которые образуют вместе с моноацилглицеринами, холестерином и жирными кислотами смешанные мицеллы — растворимые комплексы, обеспечивающие переход продуктов гидролиза в клетки слизистой кишечника. Желчные кислоты с током крови доставляются в печень, затем снова секретируются желчью в кишечник, то есть повторно используются, циркулируя по кругу: печень — кишечник — печень.
БИЛЕТ № 36
Хромопротеины
Для них простетическая часть окрашена (chromos – краска). К хромопротеинам относятся гемоглобин, миоглобин, каталаза, пероксидаза, ряд флавинсодержащих ферментов (сукцинатдегидрогеназа, альдегидоксидаза, ксантиноксидаза), цитохромы (гемсодержащие белки) и т.д. Велика биологическая роль этих белков – участвуют в физиологических процессах: дыхание клетки, транспорте кислорода и углекислого газа, окислительно-восстановительных процессах.
Гемоглобин. Его белковая часть представлена глобином, небелковая – гемом. Это олигомерный белок, т.е. имеет четвертичную структуру, состоящую из 4 субъединиц.
a цепи построены из 141 АК-остатка.
b цепи из 146 АК-остатков [рис. 4-х субъединиц, в каждой нарисована точка - гем].
Каждая из субъединиц связана с гемом:
Основная функция гемоглобина – транспортная (кислород, углекислый газ). Также он представляет собой основную буферную систему крови (75% от всей буферной емкости крови).
Различают:
- HbO2 – оксигемоглобин (связан с молекулой O2);
- HbCO – карбоксигемоглобин;
- HbCO2 – карбгемоглобин;
- HbOH – метгемоглобин (образуется при соединении с нитросоединениями, не способен связывать кислород).
Типы гемоглобина. Всего известно более 100 типов, но их все делят на 2 группы:
1) Физиологические гемоглобины;
2) Патологические (аномальные).
К физиологическим гемоглобинам относятся:
- Hb P – примитивный гемоглобин, имеет место быть у 1-2 недельного эмбриона;
- Hb F – фетальный или гемоглобин плода, к моменту рождения составляет около 70% всего гемоглобина в крови;
- Hb A, Hb A2, Hb A3 – это гемоглобины взрослого организма. На Hb A приходится около 90-96%.
Физиологические типы гемоглобинов отличаются глобулиновой частью (АК-составом). Например Hb A содержит 2a и 2b субъединицы, а Hb F – 2a и 2g субъединицы.
К аномальным (возникающих при наследственных заболеваниях) гемоглобинам относятся:
- HbS – гемоглобин, сопутствующий серповидно-клеточной анемии. Отличается от нормального тем, что с N-конца в 6 положении b–цепи глутамин заменен на валин.
Миоглобин по сравнению с гемоглобином имеет третичную структуру, одну полипептидную цепь, один гем и может связывать одну молекулу кислорода. Гемоглобин и миоглобин функционируют вместе. Гемоглобин доставляет кислород из легких к тканям, а миоглобин перераспределяет его внутри клетки (доставляет к митохондриям).
Оба белка – гемопротеины, т.е. гемсодержащие белки.
Аэробное окисление углеводов, схема процесса. Образование пировиноградной кислоты из глюкозы, последовательность реакций. Челночные механизмы транспорта водорода.
Билет 7
БИЛЕТ № 37
|
|
|
|
БИЛЕТ № 38
|
|
| Синтез гема и его регуляция. Нарушение синтеза гема, Порфирии. Обмен железа: источники, транспорт, депонирование.билет Н b является хромопротеидом и относится к подгруппе неэнзимных (неферментных) хромопротеидов. Гемоглобин состоит из белковой части – глобин и небелковой части – гем. Нb состоит из 4 субъединиц, каждая из них состоит из гема, который соединен с глобином (состоит из 2х альфа и 2х бета цепей). Глобин синтезируется из а/к на рибосомах. Связь гема и глобина. Железо имеет валентность +2, имеет 6 координационных связей, 2 из них идут к атомам азота пиррольных колец, 5ая к азоту имидозольного кольца гистидина. 6ая соединяется с кислородом и образуется оксигемоглобин, который отдает кислород и образуется связь с имидозольным кольцом гистидина. Часть а/к вблизи окружения гема называются инвариантными - они не изменяются, замена а/к невозможна, если этого не происходит развиваются аномалии.
Синтез гема. В 1948 году Давид Ротенберг и Паул Фишер изучали синтез гема, они выделили основные ферменты, которые участвуют в синтезе гема, их место расположение (костный мозг, печень, почки, слизистая кишечника).
Исходные продукты синтеза гема – сукцинилКоА, глицин. В начале синтез происходит в митохондриях и под действием фермента синтетазы дельта-аминолевуленовой кислоты кофермент - В1, В6, липолевая кислота, и образуется альфа-амино-бета-кетоадипиновая кислота, затем дельта-аминолевуленовая кислота, она из митохондрий выходит в цитоплазму клетки и там происходит конденсация 2х молекул дельта-аминолевуленовой кислоты под действием дегидротазы дельта-аминолевуленовой кислоты и образуется одно циклическое соединение – порфобилиноген.
Далее происходит конденсация четырех молекул порфобилиногена по принципу «голова к хвосту», под действием уропорфириногена-1-синтетазы и уропорфириногена-3-косинтазы образуется уропорфириноген 3. Затем уропорфириноген 3 под действием декарбоксилазы превращается в копропорфириноген 3, который возвращается в митохондрии и все оставшиеся реакции происходят там. Из копропорфириногена 3 под действием копропорфириногеноксидазы образуется пропорфириноген 9. Далее происходит восстановление пропорфириногена 9 в протопорфирин 9 и внедряется железо (гемоксидаза), в результате чего образуется гем.
Регуляция синтеза гема происходит по принципу обратной связи, т.е. гем ингибирует первый фермент синтеза (синтетазу дельта-аминолевуленовой кислоты), а также может ингибироваться и второй фермент (дегидротаза дельта-аминолевуленовой кислоты). Если отмечается снижение концентрации глобина в клетке, то происходит самопроизвольное окисление протопорфирина 9 в пропорфериноген 9, т.о. железо не внедряется и накапливается в клетке, концентрация железа увеличивается и происходит активация процесса синтеза глобина.
Обмен железа. В организме железо находится в 2х видах – клеточное железо и внеклеточное железо. Клеточное железо – входит в состав ферментных гемопротеидов (гемоглобин, миоглобин). Внеклеточное железо – это белки, которые связывают железо и транспортируют его (трансферин, лактоферин). Железо в организме совершает постоянный кругооборот. При распаде клеточных структур железо освобождается и 9/10 используется повторно, а 1/10 выводится из организма. Замена железа происходит с пищей, с продуктами содержащими железо (мясо, печень, почки, салат, сухофрукты, абрикос, укроп). 25 мг железа в сутки поступает в желудок, где железо высвобождается и только 1 мг подвергается всасыванию с помощью аскорбиновой кислоты в желудке, основная масса железа всасывается в 12перстной кишке. Способствуют всасыванию - белки, продукты содержащие аскорбиновую кислоту, чай и кофе ингибирует этот процесс; алкоголь улучшает всасывание железа.
Железо поступает в кровь, соединяется с трансферрином, который относится к бета-глобулиновой фракции, и в результате образуется комплекс и железо транспортируется к органам депо – печень, костный мозг, селезенка, плацента. Т.О. трансферин (15 типов – С) транспортирует железо в депо, где оно высвобождается и поступает в клетку.
Железо поступает в клетку и откладывается в форме ферритина – это не токсичное, хорошо растворимое в воде соединение, одна молекула феритина может соединять до 4,5 тысяч атомов железа. В феритине Fe3+.
Гемосидерин содержит гранулы железа – это белок, он является токсичным, т.к. содержит очень много железа и т.к. в организме человека нет путей экскреции железа из клетки развивается гемосидероз. Ему подвергается печень вследствие осложнения таких заболеваний, как гемолитическая и апластическая анемия. Лечение – переливание крови.
|
|
БИЛЕТ № 39
|
|
|
|
БИЛЕТ № 40
|
|
|
|
БИЛЕТ № 41
| Денатурация белков. Факторы и признаки денатурации. Изменение конфигурации белковых молекул. Физико-химические свойства денатурированных белков. Денатурация – нарушение нативной пространственной структуры белка, приводящее к потере или уменьшению растворимости, утрата специфической биологической активности, изменению ряда физико-химических свойств. Денатурация не сопровождается разрывом пептидных связей, т.е. не разрушается первичная структура, а связи оказываются снаружи и все изменяется. Свойства денатурированного белка: 1) повышается число реактивных групп, т.к. появляются ранее скрытные группы 2) понижается растворимость, белок может выпасть в осадок (при потере факторов устойчивости: заряд и гидратная оболочка) 3) изменяется конфигурация 4) изменяется биологическая активность 5) легко расщепляется протеолитическими ферментами. Факторы приводящие к денатурации белка: 1) физические – температура, УФ облучение, ультразвук, гаммаоблучение, стерилизация 2) химические реагенты: концентрированные кислоты, щелочи, соли тяжелых металлов.
|
|
|
| Электрофорез белков сыворотки крови. Метод свободного электрофореза, детально разработанный лауреатом Нобелевской премии А. Тизелиусом, основан на различии в скорости движения белков (подвижности белков) в электрическом поле, которая определяется величиной заряда белка при определенных значениях рН и ионной силы раствора.
В норме количество белков в сыворотке крови 65-85 грамм на литр. Ближе всего в старту располагается гамма глобулиновая фракция, затем бета и альфа глобулиновая фракция. Самая подвижная это альбуминовая фракция 55-65%.
|
БИЛЕТ № 1
Общее понятие об обмене веществ. Катаболизм и анаболизм. Основные этапы. Значение АТФ и других макроэргических соединений в обеспечении энергией процессов жизнедеятельности.
Обмен веществ(метаболизм) - совокупность физиологических(пищеварение, внешнее дыхание, всасывание) и биохимических (хим. превращения б, ж, у, поступающих с пищей) процессов, обеспечивающих жизнедеятельность организма во взаимосвязях с внешней средой, направленных на самовоспроизведение и самосохранение. Метаболизм представлен катаболизмом и анаболизмом. Катаболизм – расщепление химических компонентов с выделением энергии – экзергонические реакции. Анаболизм – реакции синтеза с затратой энергии – эндергонические реакции
Катаболизм, 3 стадии:
1. превращение полимера в мономеры: Б,Ж,У → АМК, моносахариды, ж.к, глицерин в ЖКТ
2. превращение мономеров в унифицированный продукт: АМК, моносахара, ж.к, глицерин→ацетилКоА
3.третья стадия катаболизма – первая стадия анаболизма. АцетилКоА идет в ЦТК, в ЦТК образуются субстраты, используемые на синтез новых соединений (α-кетоглутарат – глутамат, сукцинилКоА – гем); АДФ фосфорилируется в АТФ.
Биологическая роль обмена веществ:
1. аккумуляция энергии при распаде химических соединений;
2. использование энергии для синтеза собственных веществ организма;
3. распад обновляемых структурных компонентов клетки;
4. происходит синтез и распад биомолекул специального назначения.
Макроэрги́ческие соедине́ния - группа природных веществ, молекулы которых содержат богатые энергией, или макроэргические, связи; присутствуют во всех живых клетках и участвуют в накоплении и превращении энергии. Разрыв макроэргических связей в молекулах М.с. сопровождается выделением энергии, используемой для биосинтеза и транспорта веществ, мышечного сокращения, пищеварения и других процессов жизнедеятельности организма. Все известные М.с. содержат фосфорильную (—РО3Н2) или ацильную группу.
АТФ - служит универсальным переносчиком и основным аккумулятором химической энергии в живых клетках, кофермент многих ферментов, донор энергии, необходимой для протекания биосинтетических реакций.
Макроэрги: нуклеозидтрифосфаты и нуклеозиддифосфаты (АТФ, ГДФ и их аналоги), ацетил-КоА, сукцинил-КоА, креатинфосфат, фосфоенолпируват.
2. Производные моносахаридов, образующиеся в организме (фосфорные эфиры, уроновые кислоты, аминосахара), их биологическое значение.
Фосфорные эфиры: 1) глюкозо6фосфат – активная форма глюкозы, с нее начинается превращения углеводов. Глюкоза + АТФ под действием гексокиназы превращается в глюкозо6фосфат, глюкозо1фосфат. Глю6ф идет на синтез гликогена. При распаде гликогена образуется глюкозо1фосфат и из нее глкозо6фосфат. Глюкозо6фосфат участвует в гликолизе, в результате чего образуется ПВК. С глюкозо6фосфата начинается ПФЦ, в результате чего образуется рибозо5фосфат. 2) Рибозо5фосфат – образуется в пирофосфатном цикле, входит в структуру мононуклеотидов – НАД, ФАД, АТФ, ДНК, РНК. Рибозо5фосфат + АТФ образуется фосфорибозилпирофосфат, который идет на синтез пуриновых азотистых оснований. Уроновая кислота – глюкуроновая кислота, в 6 положении СООН группа. Аминосахар – глюкоозамин, фруктозамин, галактозамин. Уроновые кислоты и аминосахара являются структурными компонентами ГАГ – высокомолекулярные соединения, мономером является дисахаридная единица, которая представлена уроновой кислотой, которая соединена альфа-1,3 гликозидной связью с аминосахаром. Моносахариды в свою очередь делятся, во первых, по характеру карбонильной группы на альдозы и кетозы и, во-вторых,по числу атомов углерода в молекуле на триозы, тетрозы, пентозы и т.д. Моносахариды и их производные выполняют, во-первых, энергетическую функцию: окислительное расщепление этих соединений дает организму 55-60 % необходимой ему энергии. Во-вторых, промежуточные продукты распада моносахаридов и их производных используются в клетках для синтеза других необходимых клетке веществ, соединений других классов; из промежуточных продуктов метаболизма глюкозы в клетках могут синтезироваться липиды и заменимые аминокислоты. В третьих, моносахариды и их производные выполняют структурную функцию, являясь мономерными единицами других, более сложных молекул, таких как полисахариды или нуклеотиды.
Дата: 2019-02-19, просмотров: 427.