Стероидные гормоны объединяются по хим.строению (циклопентанпергидрофенантрен), в основе – холестерин (зоостерин).
Холестерин(С27) → прегненолон (С21, синтез во всех органах) → Прогестерон (21):
- С21-стероиды (глюкокортикоиды, минералокортикоиды)
- С19-стероиды (муж.половые Г)
- С18-стероиды (жен.половые Г)
- желтое тело (конечный продукт)
Биосинтез стероидных гормонов в организме происходит в органах, производящих гормоны (надпочечники, яичники, семенники и др), откуда они (обычно в виде комплексов с белками) разносятся током крови к клеткам органов-мишеней, где вступают во взаимод. со специфич. белковыми (цитоплазматич.) рецепторами, расположенными либо на клеточной мембране, либо в цитоплазме. Стероидные гормоны обратимо связываются с рецепторами за счет водородных связей и гидрофобных взаимод., образуя стероид-рецепторные комплексы. Последние передают гормональный сигнал, либо оставаясь на месте (мембранные рецепторы), либо проникая в ядро клетки и вступая там во взаимод. с генами.
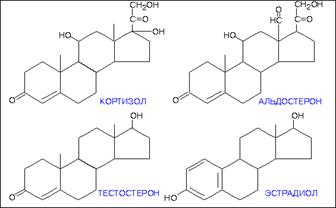
Кортизол- замедляет биосинтез Б во всех тканях, активирует синтез Б-Ф в печени – ключ. Ф глюконеогенеза, создаются условия для использования АМК на глюконеогенез. Стероидный диабет.
Альдостерон – минералокортикоид, способствует реабсорбции натрия и хлора в почечных канальцах; в крови повышается Na и Cl, нарушается осмот.давление, приток жидкости и задержка жидкости, повышается АД. Половые гормоны регул.синтез гонадотропных Г, в крови соед.с альбуминами, распадаютя в печени.
Тестостерон участвует в развитии мужских половых органов, вторичных половых признаков; регулирует сперматогенез и половое поведение, а также оказывает влияние на азотистый и фосфорный обмен.
Эстадиол - стимулирует развитие матки, маточных труб, влагалища, стромы и протоков молочных желез, пигментацию в области сосков и половых органов, формирование вторичных половых признаков по женскому типу, рост и закрытие эпифизов длинных трубчатых костей. Способствует своевременному отторжению эндометрия и регулярным кровотечениям, в больших концентрациях вызывает гиперплазию эндометрия, подавляет лактацию, угнетает резорбцию костной ткани, стимулирует синтез ряда транспортных белков.
Содержание белков в плазме крови, возрастные особенности.
Белки плазмы крови – это альбумины, глобулины и фибриноген. Общее количество белка 65-85 грамм в литре крови. Возрастные особенности: новорожденные 46-70, 1-2 года 56-75, до 69 лет 64-83, после 60 лет 62-81. Гипопротеинемия возникает вследствие: голодания, при повышенной потере белка – заболевания почек, кровопотери, новообразованиях, нарушениях синтеза белка – заболеваниях печени. Гиперпротеинемия: дегидротации (травмы, ожоги, холера), появление парапротеинемии, т е при появлении патологических белков при миеломной болезни и болезни Вальденстрема.
Общее содержание белков в плазме крови 65-85 гр в литре или 7%. Основные белки плазмы крови – это альбумины 59 гр в литре и глобулины 20-30 гр в литре, фибриноген 2-4 гр в литре. Методы разделения белков плазмы крови – это электрофорез на бумаге осуществляется в щелочном буфере рН=8,6. В щелочной среде все белки плазмы крови приобретают отрицательный заряд и перемещаются в одну сторонуПри острой инфекции кол-во гаммаглобулинов увеличивается, при нарушении белковосинтезирующей функции печени количество альбуминов уменьшается.
Функции белков плазмы крови: 1) поддержание онкотического давления 2) регулируют и поддерживают КОС за счет белковой и гемоглобиновой буферной системы крови 3) иммуноглобулины участвуют в поддержании гуморального иммунитета 4) транспорт микроэлементов, таких как Cu Fe Ca Mg и других 5) при белковом голодании являются резервом аминокислот 6) специальные белковые молекулы осуществляют транспорт липидов, углеводов, витаминов, конечных продуктов обмена и так далее.
БИЛЕТ № 6
Современные представления о строении белков. Уровни структуры белковой молекулы. Видовая специфичность белков. Конформация белковой молекулы (вторичная и третичная структуры). Типы связей в белках. Четвертичный уровень структуры. Доменный принцип структурной организации.
Белок (протеины) – protos – предшествующий всему, первичный, наиглавнейший, определяющий всё остальное.
Белки – это высокомолекулярные азотсодержащие органические вещества, состоящие из аминокислот, соединённых в цепи с помощью пептидных связей и имеющих сложную структурную организацию.
Уровни структуры белка. Первичная структура белка: последовательность а/к в полипептидной цепи соединенные пептидной связью (ковалентная). Последовательность а/к, их количество, лежат в основе первичной структуры белка, в которой заложена информация о последующих уровнях структуры и биологических функциях белка. Вторичная структура белка: 1) а-спираль имеет жесткие параметры – правозакрученная спираль, шаг спирали между двумя витками 3,6 а/к, высота 0,54 нм, конформация повторяется через 5 витков или 18 а/к, многочисленные Н связи между группами NH и С-О от первой к четвертой а/к-те. 2) бета структура – слоисто-складчатая, удерживается водородными связями, пептидные цепи располагаются антипараллельно. 3) неупорядоченная нерегулярная структура – а+в структуры – перекрест где встречаются а/ альфа и бета. Третичная структура белка: упаковка полипептидной цепи в пространстве. 1) в фибриллярных белках – коллаген и эластин – 3 а-спираль, бета слой (актин, миозин) 2) в глобулярных белках – все три типа вторичных структур. Два типа связи в третичной структуре: 1) ковалентная – пептидная и дисульфидная 2) слабые связи – многочисленные водородные связи, ионные взаимодействия. Упаковка идет таким образом, что гидрофобные связи находятся ниже (по типу жирной капли) – легко разрываются при изменении рН, температуры, ионов. Четвертичная структура – это ассоциация 4х субъединиц, которые определенным образом ориентированны в пространстве относительно друг друга. Для того чтобы Нb удерживался в форме тетрамера возникают связи между одинаковыми полипептидными цепочками, а также между разными полипептидными цепочками. Субъединицы расположены в пространстве таким образом, что в центре Нb образуется центральная полость (впадина), в которой находятся 2,3-дифосфоглицириновая кислота. По мере присоединения кислорода к молекуле гемоглобина конформация четвертичной структуры меняется, при этом альфа цепи сближаются, бета расходятся, т.о. молекула Нb как бы дышит Присоединяется одна молекула кислорода к первой субъединице, что приводит к конформационным изменениям других субъединиц.
Видовая и индивидуальная специфичность набора белков в данном организме определяет особенности его строения и функционирования. Набор белков в дифференцирующихся клетках одного организма определяет морфологические и функциональные особенности каждого типа клеток.
Дата: 2019-02-19, просмотров: 415.