В. bronchiseptica и В. avium представляют собой мелкие грамотрицательные палочки, имеющие жгутики. Являются паразитами млекопитающих и птиц. Локализуются и размножаются среди ресничек эпителия дыхательного тракта. Антигенные и другие свойства, а также принципы идентификации и дифференциальной диагностики описаны выше.
В. bronchiseptica крайне редко вызывает у людей заболевание, напоминающее паракоклюш. Иногда обнаруживается в носоглотке людей со сниженным иммунитетом, а также у людей, содержащих домашних животных (кроликов, собак и др.). Возможно бессимптомное носительство у человека. Патогенность В. avium для человека не доказана.
16.3.2. Бруцеллы (род Brucella )
Бруцеллы являются возбудителями бруцеллеза — острого или хронического антропозоо-нозного инфекционного заболевания, которое характеризуется интоксикацией, преимущественным поражением опорно-двигательного аппарата, нервной, сердечно-сосудистой, мочеполовой систем и других органов, аллерги-зацией организма, затяжным течением, приводящим, как правило, к инвалидизации.
Характеристика возбудителя: возбудители бруцеллеза относятся к роду Brucella , который включает в себя следующие виды: В. melitensis , В. abortus , В. suis , В. ovis , В. canis , В. meotomae . Название рода связано с именем Д. Брюса, открывшего в 1886 г. возбудителя бруцеллеза.
Морфология. Бруцеллы — мелкие грамотрицательные микробы шаровидной, овоидной или палочковидной формы. Спор не образуют, неподвижны. При действии специфического бактериофага или при выращивании на среде с 10 % иммунной сыворотки образуют нежную капсулу.
Культуральные свойства. Аэробы. Требовательны к питательным средам: на простых питательных средах не растут, растут на сложных питательных средах (сыво-роточно-декстрозный и кровяной агар).
Характеризуются замедленным ростом на питательных средах, посевы инкубируют не менее 3 недель. В жидких средах вызывают равномерное помутнение с небольшим осадком, но без пленки на поверхности. На плотных средах формируют мелкие круглые выпуклые гладкие прозрачные голубовато-серые колонии. Гемолиза не дают, пигмента не образуют. Наблюдается диссоциация от S- к R-формам колоний. В гладкой форме некоторые штаммы бруцелл лизируются бруцеллезным фагом. Температурный оптимум роста — 37 °С, оптимум рН 6,6—7,4. Под действием антибиотиков превращаются в L-формы. Хорошо культивируются в желточном мешке куриного эмбриона.
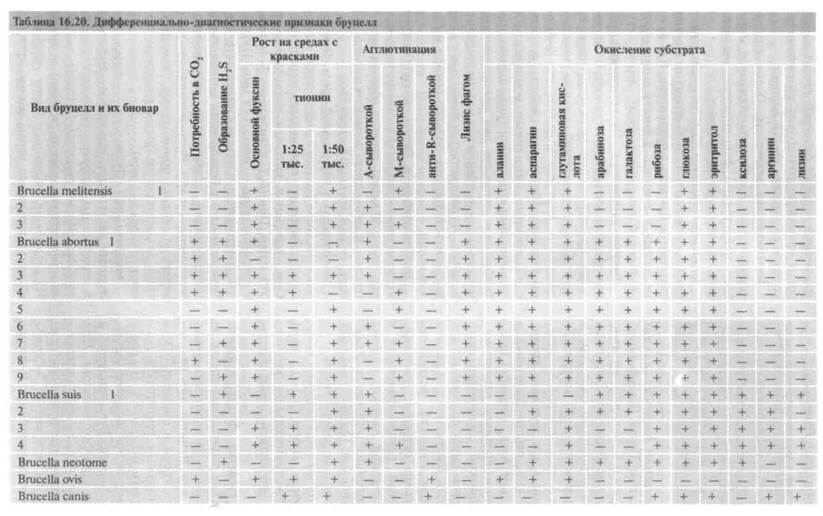
Биохимическая активность. Очень низкая: содержат каталазу и оксидазу, нитраты редуцируют в нитриты, цитраты не утилизируют, реакция Фогеса—Проскауэра отрицательна, продуцируют сероводород. Дифференциально-диагностические признаки бруцелл представлены в табл. 16.20.
Антигенная структура. Сложная и близкая для разных видов бруцелл. Имеют соматический О- и капсульный антигены. Различные виды бруцелл различаются количественным соотношением А- (абортус) и М- (мелитен-зис) антигенов.
Факторы патогенности. Бруцеллы являются факультативными внутриклеточными паразитами млекопитающих, включая человека. Обладают высокой инвазивной способностью, образуют фермент агрессии гиалурони-дазу. Основными факторами вирулентности являются эндотоксин и капсула.
Устойчивость в окружающей среде и к анти микробным препаратам. Бруцеллы длительно сохраняются в окружающей среде: в молоке — до 45 дней; в масле, сливках, простокваше и свежих сырах — в течение всего периода их пищевой ценности; в брынзе — до 60 дней; в замороженном мясе — свыше 5 мес, в засоленных шкурах — 2 мес, в шерсти — до 3-4 мес, в воде — до 5 мес; в почве — до 3 мес Малоустойчивы к высокой температуре, при кипячении погибают моментально, при 60 °С — в течение 30 мин.
Чувствительны к большинству антибиотиков; к действию обычно применяемых анти-
септиков и дезинфектантов в обычных концентрациях.
Эпидемиология. Резервуаром возбудителя в природе являются сельскохозяйственные и домашние животные — крупный и мелкий рогатый скот, свиньи, реже — олени, лошади, собаки, кошки.
Бруцеллез распространен на всех континентах, особенно в странах с развитым животноводством. Источник инфекции — больные сельскохозяйственные и домашние животные. Возбудителями бруцеллеза крупного рогатого скота являются В. abortus , мелкого рогатого скота — В. melitensis , свиней — В. suis , оленей — В. neotome , собак — В. canis , баранов — В. ovis . Наибольшее эпидемическое значение для человека имеют В. melitensis , В. abortus и В. suis . Больной человек не заразен, является биологическим тупиком. Как для всех зоонозов, для бруцеллеза характерна множественность механизмов и путей передачи. Больные животные выделяют бруцеллы с молоком, мочой, калом, околоплодными водами и др. Человек заражается главным образом фекально-ораль-но пищевым путем (сырое молоко, молочные продукты, мясо и др.) и контактно при уходе за больными животными и т. п. Восприимчивость человека к бруцеллам высокая. Заболевания носят спорадический характер или в виде отдельных вспышек, что зависит от видовой принадлежности возбудителей.
Патогенез. Бруцеллы проникают в организм через кожу или слизистые оболочки и распространяются по лимфатическим путям. В отличие от туляремии, сибирской язвы, при бруцеллезе на месте внедрения не развивается первичный аффект. Иногда наблюдается увеличение регионарных лимфатических узлов. Дальнейшая судьба возбудителя зависит от ряда факторов: вирулентности, величины инфицирующей дозы, иммунореактивности организма. При попадании в организм больших доз вирулентных бруцелл очень быстро может наступить диссеминация возбудителя. При малых инфицирующих дозах и при пониженной вирулентности бруцеллы могут длительно задерживаться в регионарных лимфатических узлах, фаза генерализации запаздывает или вообще отсутствует. В основе развивающихся в ранний период бруцеллеза диффузных изменений сосудов и паренхиматозных органов лежит токсическое действие бруцелл. Из кровотока бруцеллы оседают в воспалительных очагах,
лимфатических узлах, селезенке и костном мозге, где длительно могут сохраняться, располагаясь внутрик-леточно. При обострениях процесса бруцеллы вновь усиленно размножаются, попадают в кровоток, вызывая повторные волны генерализации. Длительное пребывание возбудителя в организме приводит к его аллергизации. Со 2—3-й недели, а иногда и с самого начала заболевания на первый план в патогенезе выдвигаются аллергические поражения. Аллергия при бруцеллезе играет двоякую роль. С одной стороны, аллергическое воспаление лежит в основе большинства клинических проявлений болезни, особенно в хронической стадии. С другой стороны, аллергическая реакция препятствует распространению бруцелл в организме, что имеет большое значение для предупреждения повторных генерализаций процесса.
Клиника. Инкубационный период колеблется в пределах 1—3 недель, но может затягиваться и до нескольких месяцев. Болезнь начинается постепенно, иногда — остро. Болезнь протекает с длительной лихорадкой, ознобами, потливостью, болями в суставах, мышцах, с симптомами поражения сердечнососудистой, нервной, мочеполовой систем, опорно-двигательного аппарата и т. д. Клиника бруцеллеза характеризуется большим полиморфизмом и зависит от характера пораженного органа. Выделяют острый (с давностью до 3 мес), подострый (с давностью до 6 мес), хронический (с давностью свыше 6 мес.) и латентный бруцеллез. При хроническом бруцеллезе возможны состояния компенсации, субкомпенсации и декомпенсации. Хронический бруцеллез может быть первично-хронический или вторично-хронический; то же относится и к латентному бруцеллезу.
Иммунитет при бруцеллезе клеточно-гумо-ральный, в основном нестерильный и относительный. После выздоровления иммунитет угасает, возможна реинфекция. Ввиду относительности иммунитета, большие инфицирующие дозы бруцелл могут вызвать его прорыв у больных хроническим или латентным бруцеллезом, что ведет к тяжелому течению болезни.
Микробилогическая диагностика. Материалом для исследования служат: кровь, пунктат красного костного мозга, моча, испражнения, молоко и молочные продукты, кусочки органов.
Для диагностики бруцеллеза используют все методы микробиологической диагностики. Серодиагностику и аллергические пробы проводят в базовых лабораториях, чистую культуру бруцелл выделяют и идентифициру-
ют в специальных лабораториях с соблюдением правил техники безопасности.
Посев крови для выделения гемокультуры проводят в первые дни болезни при наличии лихорадки; при отрицательных результатах исследование многократно повторяют (бактериемия может наблюдаться в течение года и более). Учитывая медленный рост бруцелл, посевы выдерживают в термостате до 1 мес. Пунктат костного мозга засевают на те же среды; миелокультуры при бруцеллезе удается получить в 1,5—2 раза чаще, чем гемокуль-туру. Миелокультуры могут быть получены в остром, под остром и даже хроническом периоде заболевания. Мочу для выделения урино-культуры предварительно центрифугируют, из осадка делают посевы. Уринокультуры выделяют как при остром бруцеллезе, так и в период реконвалесценции. Процент высеваемости невелик и зависит от периода заболевания (5—14%). Аналогичным образом поступают с молоком. Копрокультуры выделяют крайне редко. Нередко культура бруцелл выделяется из желчи. Незначительный процент положительных результатов дают бактериологические исследования мокроты, суставной жидкости, влагалищных выделений и др. Наибольшую высеваемость бруцелл, особенно из бактериально загрязненного материала, получают при посевах исследуемого материала в желток свежего куриного яйца или в желточный мешок куриного эмбриона. Зараженные яйца выдерживают в термостате 5 дней, а затем делают высев на питательные среды.
Для биопробы используют белых мышей и морских свинок. Животных заражают кровью внутрибрюшинно; осадком мочи и молока — подкожно. Через 20—30 дней у зараженного животного берут кровь и ставят с ней реакцию агглютинации. Затем животных забивают, вскрывают и делают посевы крови из сердца, взвеси внутренних органов и лимфатических узлов. Выделенные чистые культуры бруцелл дифференцируют по способности роста в отсутствие повышенной концентрации углекислого газа, выделению сероводорода, чувствительности к бруцеллезному фагу и бактериостатическому действию анилиновых красителей (фуксина и тионина). Преимуществом биологического метода ис-
следования является возможность выделения бруцелл из материалов, контаминированных посторонней микрофлорой или содержащих небольшое количество возбудителей.
В сыворотке больных бруцеллезом накапливаются агглютинирующие (вначале IgM, затем IgG), неполные блокирующие (IgA, IgG) и опсонические (IgG) антитела. Для их выявления с диагностической целью используют реакцию Райта (развернутая агглютинация) и Хеддельсона (пластинчатая агглютинация), РПГА, РИФ, ИФА, реакцию Кумбса, опсо-нофагоцитарную реакцию. Реакция агглютинации — один из основных диагностических методов при бруцеллезе у людей и сельскохозяйственных животных. Агглютинины, как правило, появляются в крови в ранние сроки после заражения, поэтому наибольшую диагностическую ценность реакция агглютинации представляет при остром бруцеллезе. РСК также является специфической для бруцеллеза, она появляется позже, чем реакция агглютинации, но держится дольше, что повышает ее диагностическую ценность у больных хроническим бруцеллезом. Гемагглютинирующие антитела в РПГА можно обнаружить в 91—100 % случаев у больных острым и подострым бруцеллезом; при хроническом бруцеллезе и резидуальных явлениях гемагглютинины обнаруживаются реже, однако значительно чаще, чем агглютинины. РИФ выявляет антитела в сыворотке при остром, подостром и хроническом бруцеллезе чаще, чем реакция агглютинации. Реакция Кумбса рекомендуется в качестве диагностического метода при хронических и латентных формах бруцеллеза. Опсонофагоцитарную реакцию проводят с 15—20-го дня болезни. Она основана на способности сегментоядерных нейтрофилов фагоцитировать бруцеллы благодаря наличию в крови человека специфических опсонинов, нарастающих в процессе бруцеллезной инфекции. Реакция специфична и чувствительна, однако не отражает количества опсонинов в крови. В условиях массового обследования на бруцеллез применяют пластинчатую реакцию агглютинации Хеддельсона в сочетании с кожно-аллергической пробой Бюрне. Рекомендуется определять состав сывороточных иммуноглобулинов в различные фазы заболевания. В ранние сроки после заражения появляются IgM, в более
поздние — IgG. Эти иммуноглобулины дифференцируют с помощью цистеиновой пробы.
Аллергический метод применяют для выявления ГЗТ к бруцеллам, наблюдающейся у больных бруцеллезом, инфицированных бру-целлами лиц и привитых живой бруцеллезной вакциной. Ее ставят с 15-20-го дня болезни. Аллергическая реакция бывает положительной в течение многих лет после перенесенного заболевания и у привитых. Серологические реакции и кожно-аллергическая проба по своему диагностическому значению не равноценны, вследствие чего не могут заменить друг друга. Это обуславливает необходимость применения комплексного сероаллергичес-кого метода, являющегося наиболее надежным способом диагностики бруцеллеза.
Лечение. При остром и хроническом бруцеллезе с выраженными признаками активности необходимо назначение антибиотиков широкого спектра. Наиболее эффективно сочетание стрептомицина с препаратами широкого спектра действия. Антибиотики не действуют на бруцеллы, расположенные внутриклеточ-но, поэтому их можно назначать только при наличии бактериемии, а при хроническом бруцеллезе они неэффективны. Кроме того, антибиотики не предупреждают рецидивов бруцеллеза, поэтому широко применяется специфическая иммунотерапия убитой лечебной бруцеллезной вакциной (5—7 внутривенных вливаний в нарастающих дозах 1—2 раза в неделю) или бруцеллина (внутримышечно по 2 раза в неделю). При острых и рецидивирующих формах назначают бруцеллезный иммуноглобулин.
Профилактика. Направлена на ликвидацию источника инфекции; на разрыв механизма и путей передачи инфекции и на создание невосприимчивости коллектива. Для специфической профилактики применяют живую бруцеллезную вакцину, предложенную П. А. Вершиловой, из штамма ВА-19А, полученную из В. abortus и создающую перекрестный иммунитет против других видов бруцелл. Вакцинацию проводят по эпидпоказаниям. Не специфическая профилактика такая же, как и при других зоонозах, и сводится в основном к санитарно-ветеринарным мероприятиям.
16.3.3. Франциселлы (род Francisella )
Francisella tularensis является возбудителем туляремии — острого или хронического системного природно-очагового заболевания человека и животных, которое характеризуется лихорадкой, интоксикацией и поражением лимфатических узлов.
Возбудитель туляремии Francisella tularensis был открыт в местечке Туляре (Калифорния) в 1911 г. Г. Мак-Коем и X. Чепином; детально изучен Э. Френсисом. Выделяют 3 подвида, отличающихся по антигенным свойствам и вирулентности: голарктический, распространенный в Европе, Азии и Северной Америке, умеренно патогенный для домашних кроликов; среднеазиатский, распространенный в долинах рек Средней Азии, умеренно патогенный для домашних кроликов; неарктический, или американский, распространенный в Северной Америке, высокопатогенный для домашних кроликов. Голарктический подвид делится на биовары: японский, распространенный на Японских островах; эритроми-циночувствительный, распространенный в Европе, Азии, Северной Америке и чувствительный к антибиотикам-макролидам; эритромицинустойчивый, распространенный в Восточной Европе и Западной Сибири.
Морфология. Возбудитель туляремии представляет собой очень мелкие (0,3—0,5 мкм) полиморфные грамотрицательные палочки; спор не образует, неподвижен, может образовывать капсулу.
Культуральные свойства. Факультативный анаэроб. На простых питательных средах не растет. Культивируются на желточных средах (среда Мак-Коя или Чепина) или на средах с добавлением крови и цистеина (среда Френсиса). Оптимальная температура роста 37—38 С, оптимум рН 6,8—7,4. На плотных средах образует мелкие колонии молочно-белого цвета. Хорошо культивируется в желточном мешке куриного эмбриона. При культивировании на искусственных питательных средах происходит аттенуация бактерий и превращение их из вирулентной S-формы в авирулентную и неиммуногенную R-форму.
Вакцинные штаммы бактерий представляют собой промежуточную форму изменчивости, которую обозначают как SR-вариант.
Биохимическая активность. Очень низкая, ферментируют до кислоты глюкозу и мальтозу; непостоянно ферментируют маннозу, левулезу, образуют сероводород.
Антигенная структура. Содержит соматический О- и поверхностный Vi-антигены. Имеют антигенную близость с бруцеллами. В R-фор-ме теряют Vi-антиген, а вместе с ним вирулентность и иммуногенность.
Факторы патогенности. Неарктический подвид обладает высокой патогенностью для человека при кожном пути заражения, голарктический и среднеазиатский подвиды умеренно патогенны. Вирулентными являются S-формы колоний. Патогенные свойства связаны с оболоченным антигенным комплексом и токсическими веществами типа эндотоксина. Возбудитель патогенен для млекопитающих многих видов, особенно для мелких грызунов и зайцев. Из лабораторных животных к нему высокочувствительны морские свинки и белые мыши.
Экологическая ниша. Резервуаром возбудителя в естественных условиях являются дикие животные (около 50 видов), главным образом мелкие грызуны и зайцы; среди домашних животных — овцы, свиньи, крупный рогатый скот.
Устойчивость в окружающей среде. В окружающей среде бактерии могут долго сохраняться, особенно при низкой температуре. Они нестойки к высоким температурам и УФ-лучам. При 60 °С гибнут через 5-10 мин, а при кипячении — через 1—2 мин. При 0— 4 °С сохраняются в воде и фураже до 6 мес. Чувствительны к большинству антибиотиков (стрептомицин, тетрациклин, левомицетин, эритромицин и др.). Высокочувствительны к действию обычно применяемых антисептиков и дезинфектантов (лизол, хлорамин убивают их через 3—5 мин).
Эпидемиология. Туляремия — природно-очаговое заболевание. Источником инфекции в естественных условиях являются главным образом мелкие грызуны (полевые мыши, водяные крысы, ондатры, хомяки) и зайцы. На территории природных очагов туляремией могут заражаться овцы, свиньи, крупный
|
|
рогатый скот. Как и для всех зоонозов, для туляремии характерна множественность механизмов путей и факторов передачи. Передача возбудителя среди млекопитающих чаще всего происходит через кровососущих членистоногих: иксодовые клещи, комары, в меньшей степени блохи, слепни и гамазовые клещи. Человек заражается контактным, алиментарным, аэрозольным и трансмиссивным путями. Восприимчивость человека очень высока.
Туляремия распространена в Европе, в том числе в России, а также в Азии, Северной Америке; встречается в виде спорадических случаев или эпидемических вспышек. Болеют чаще жители сельской местности и лица, имеющие профессиональный контакт с грызунами (сельскохозяйственные работы, охота и т. д.).
Патогенез. Возбудитель туляремии попадает в организм человека через кожу, слизистые оболочки глаз, дыхательных путей, желудочно-кишечного тракта. В патогенезе туляремии выделяют несколько фаз: внедрение и первичная адаптация возбудителя, лимфогенное распространение, первичные регионарно-очаговые и общие реакции организма, гематогенные метастазы и генерализация процесса, вторичные очаги, реактивно-аллергические изменения, обратный метаморфоз и выздоровление. Ведущее значение в патогенезе имеет фаза лимфогенного распространения возбудителя. В месте его внедрения нередко развивается первичный аффект с регионарным первичным лимфаденитом. Периаденит выражен умеренно. Микроб и его токсины проникают в кровь, что приводит к бактериемии и генерализации процесса, метастазированию и развитию вторичных туляремийных бубонов.
Иммунитет. После перенесенной инфекции сохраняется длительно, иногда пожизненно; развивается аллергизация организма к антигенам возбудителя.
Клиника. Инкубационный период длится от нескольких часов до 3 недель, в среднем 3-7 дней. Болезнь начинается остро, внезапно, без продрома с повышения температуры тела до 38—39 °С; появляется озноб, резкая головная боль, интоксикация. Клиническая картина обусловлена характером пораженных органов. Различают бубонную, язвенно-бубонную, глазо-бубон-ную, абдоминальную, легочную и генерализованную (септическую) клинические формы туляремии. Болезнь протекает длительно (около месяца). Летальность при заражении неарктическим подвидом — около 6 %; при заражении другими подвидами — 0,1 % и ниже.
Микробиологическая диагностика. Материал для исследования — кровь, пунктат из бубона,
соскоб из язвы, отделяемое конъюнктивы, налет из зева, мокрота и др. — определяется кчиничес-кой формой болезни. Кроме того, на исследование можно брать воду и пищевые продукты. В природных очагах туляремии проводят плановые систематические исследования для выделения возбудителя туляремии от грызунов.
Для диагностики применяют все методы микробиологической диагностики. Исследование проводят в режимных лабораториях.
Бактериологический метод в диагностике туляремии у человека редко дает положительные результаты. Чистую культуру, как правило, выделяют после накопления ее на восприимчивых лабораторных животных. Для биопробы применяют белых мышей и морских свинок. Мышей заражают подкожно, морских свинок — внутрибрюшинно; животные погибают на 3—6-е сутки, иногда позднее. Зараженных животных содержат в особых условиях (как при диагностике чумы) и наблюдают за ними в течение 6—14 дней. Если экспериментальные животные на протяжении 7—15 дней не погибают, их забивают на 15-20-й день и трупы вскрывают. При наличии туляремии обнаруживают пато-логоанатомические изменения в виде продуктивного процесса с некрозом. Чистую культуру выделяют из внутренних органов на желточной среде, глюкозоцистеиновом кровяном агаре, среде Емельяновой и др. При идентификации опираются на морфологию и тинкториальные свойства возбудителя, отсутствие роста на МПА, агглютинацию гомологичной сывороткой, па-тогенность для белых мышей и морских свинок. Чистую культуру можно выделить, заражая 12-дневные куриные эмбрионы в желточный мешок. Для выделения чистой культуры возбудителя из воды последнюю центрифугируют или фильтруют через бактериальные фильтры и полученным осадком заражают лабораторных животных. При исследовании пищевых продуктов их промывают мясопептонным бульоном — МПБ, цетрифугируют и осадком заражают лабораторных животных.
Параллельно с бактериологическим исследованием из исследуемого материала готовят мазки-отпечатки, которые окрашивают по Романовскому—Гимзе. В мазках из органов можно обнаружить мелкие кокковидные и палочковидные бактерии, которые распола-
гаются внутриклеточно и в виде скоплений, образуя нежную капсулу.
Для серодиагностики используют развернутую реакцию агглютинации, РПГА, РСК на холоде, РИФ.
Аллергические пробы применяют для ранней диагностики туляремии (с 5-го дня от начала болезни). Используют два вида тулярина и, соответственно, 2 способа их введения: накожный и внутрикожный. Так как концентрация аллергена в обоих видах тулярина различная, недопустимо использовать накожный тулярин для внутрикожной пробы и наоборот. Результаты аллергической реакции учитывают в динамике через 24—36—48 ч. За положительный результат принимают инфильтрат диаметром не менее 5 мм. У вакцинированных или переболевших туляремией лиц в течение ряда лет аллергические пробы остаются положительными (анамнестическая реакция).
Лечение. Применяют антибиотики стрепто-мицинового и тетрациклинового ряда. В случаях затяжного течения заболевания проводят комбинированную антибиотикотерапию и вакцинотерапию с применением убитой лечебной вакцины, которая вводится различными путями в дозах от 1 до 15 млн микробных тел с интервалом 3—6 дней. Курс лечения 6— 10 инъекций.
Профилактика. Проводится в направлении всех трех звеньев эпидемического процесса: мероприятия 1 -й группы направлены на источник инфекции; мероприятия 2-й группы — на разрыв механизма и путей передачи; мероприятия 3-й группы — на восприимчивый коллектив. Для специфической профилактики применяют живую туляремийную вакцину, полученную отечественными учеными Б. Я. Эльбертом и Н. А. Гайским из штамма № 15. Вакцина обеспечивает прочный иммунитет при заражении европейским и голарктическим подвидами и эффективна против американской разновидности возбудителя. Вакцинацию проводят по эпидемическим показаниям, а также лицам, относящимся к группам риска. Допускается одновременная вакцинация против туляремии и бруцеллеза; туляремии и чумы; а также против туляремии и некоторых других инфекций.
Не специфическая профилактика такая же, как при других зоонозах, и направлена, в первую очередь, на борьбу с грызунами.
16.3.4. Легионеллы (род Leogionella )
Болезнь легионеров (син. питтсбургская пневмония, лихорадка Понтиак, лихорадка Форт-Брагг) — группа инфекционных болезней, вызываемых Legionella pneumophila , характеризующихся поражением респираторного тракта, развитием тяжелых пневмоний и сопровождающихся нарушениями со стороны ЦНС и почек.
Болезнь получила название в связи со вспышкой среди участников съезда организации «Американский легион» в 1976 г. в г. Филадельфии (США).
Морфологические и культуральные свойства. Возбудитель был открыт в 1977 г. Д. Мак-Дейдом и С. Шепардом; отнесен к семейству Legionellaceae роду Legionella и является наиболее важным представителем этого рода.
Легионеллы — грамотрицательные палочки размером 2/3*0,5/0,7 мкм, иногда встречаются нитевидные формы до 20 мкм; подвижны, имеют жгутики и фимбрии. Спор не образуют. Характерно наличие внутренней и внешней мембран; полисахаридная капсула отсутствует; имеют внутриклеточные жировые вакуоли, а также множество рибосом. Нуклеоид диффузно распределен в цитоплазме. Геномная ДНК имеет молекулярную массу 2,5х109 Да, что соответствует примерно 3000 генов. Аэробы. Требовательны к условиям культивирования. Растут при определенном наборе аминокислот, ростовых факторов, рН среды и температуры на искусственных питательных средах (угольно-дрожжевом агаре). Легионеллы являются факультативными внутриклеточными паразитами, поэтому растут в желточном мешке куриных эмбрионов, в культуре клеток животных и человека (фибробласты легкого человека). Время генерации составляет 2—4 ч, характерно высокое накопление возбудителя (до 10^12-10^13мк/мл).
На плотной среде через 3—5 суток образуют характерные колонии с коричневым пигментом, диффундирующим в агар.
Легионеллы имеют сложную ферментативную систему: набор протеолитических ферментов, эстераз, гликолитических ферментов.
Ферментативная активность зависит от среды культивирования и условий обитания.
Антигенность и вирулентность. Антигенная структура достаточно сложная, основными антигенами являются типо- и группоспецифи-ческие. По антигенам у легионелл выделяют не менее 8 серогрупп. Имеется антигенное родство между L . pneumophila и Chlamydia psittaci .
Факторами патогенности являются термостабильный белково-полисахаридный эндотоксин, проявляющийся гемолитической активностью, и цитолизин, обладающий ци-тотоксическим, а также протеолитическим действием.
Резистентность. Легионеллы устойчивы к действию физических и химических факторов. Устойчивость к большинству дезинфек-тантов такая же, как у неспорообразующих бактерий. Чувствительны к УФ-облучению, а также к антибиотикам (рифампицин, эритромицин, тетрациклин и др.). В водопроводной воде и водоемах выживают до одного года.
К легионеллам чувствительны морские свинки, белые мыши, обезьяны (гамадрилы, макаки).
Патогенез и клиника. Входные ворота инфекции — дыхательные пути. Возбудитель вызывает пневмонию, т. е. воспалительно-некротическое воспаление, захватывающее бронхиолы и альвеолы. При гибели бактерий высвобождается эндотоксин, который вызывает интоксикацию, обуславливает системное поражение с дыхательной и почечной недостаточностью, энцефалопатией, нарушениями деятельности сердечно-сосудистой системы.
Инкубационный период — от 2 до 10 дней. Выделяют три клинические формы легио-неллеза: 1) болезнь легионеров, протекающую с тяжелой пневмонией; 2) лихорадка Понтиак — респираторное заболевание без пневмонии; 3) лихорадка Форт-Брагг — острое лихорадочное заболевание с экзантемой.
Заболевание начинается остро, протекает с повышенной до 40 °С температурой, ознобом, головными болями, кашлем с мокротой (иногда с примесью крови), недомоганием, диареей и другими симптомами. Иногда развивается инфекционно-токсический шок со смертельным исходом. Летальность при леги-онеллезе достигает 20 %.
Эпидемиология. Легионеллы распространены повсеместно, обитают в естественных и искусственных водоемах, часто паразитируют в амебах. Наибольшее эпидемиологическое значение имеет наличие возбудителя в системах водоснабжения и кондиционирования воздуха. Поступление возбудителя в организм происходит при вдыхании водных аэрозолей, образующихся в душевых, в кондиционерах, в ваннах. Заболевание чаще встречаются в летне-осенние месяцы, от больного человека здоровому не передается. Легионеллез зарегистрирован в странах Европы, в том числе в России и в США.
Заболевания животных и птиц неизвестны.
Иммунитет. Иммунитет после перенесенного заболевания носит выраженный клеточный характер, штаммоспецифичен. Антитела и фагоцитоз большой роли не играют.
Микробиологическая диагностика. Поскольку клиническая диагностика легионеллеза сложна, решающими при постановке диагноза являются данные микробиологических и серологических исследований: обнаружение на 2—10-е сутки антигенов в крови и в моче (в ИФА, РИА и других методах с помощью моно-клональных антител), обнаружение через 1-3 недели антител в крови (ИФА). Применяют генодиагностику (ПЦР), а также выявление возбудителя в мокроте, слизи, биоптатах. Для посева материала обычно используют среду Мюллера—Хинтона с добавлением солей железа и L-цистеина. Можно использовать биопробу на морских свинках или белых мышах.
Лечение. Применяют антибиотики: эритромицин в сочетании с рифампицином. Могут применяться фторхинолоны.
Профилактика. Специфическая профилактика не разработана. Меры неспецифической санитарно-гигиенической профилактики сводятся в основном к гигиеническому содержанию, периодической очистке кондиционеров, душевых установок, выявлению водного резервуара возбудителей и его оздоровлению.
16.3.5. Бартонеллы (род Bartonella )
Бартонеллы объединяют группу грамотри-цательных факультативно-аэробных внутриклеточных бактерий, нуждающихся для своего роста в гемине или продуктах расщепления
эритроцитов. Бартонеллы вызывают ряд болезней, именуемых бартонеллезами.
Возбудители бартонеллезов выделены в отдельные семейство Bartonellaceae подгруппы альфа-2 протеобактерий, включающее 12 видов, 5 из которых патогенны для человека.
Морфологические и культуральные свойства. Бартонеллы — короткие палочки размером 0,34-0,5x1*3 мкм, иногда кокковидной формы. Грамотрицательны, по Романовскому—Гимзе окрашиваются в красно-фиолетовый цвет. Для В. henselae и В. bacilliformis характерно наличие 1—4 жгутиков, имеются пили. Бактерии имеют трехслойную клеточную стенку, состоящую из 12 протеинов (молекулярная масса 28—174 кДа); размер генома невелик.
Внутриклеточные паразиты, размножаются простым делением в эритроцитах и клетках системы моноцитарных фагоцитов, эндоте-лиальных клетках; требовательны к условиям культивирования. Растут на питательных средах, содержащих кровяной агар, могут культивироваться в РКЭ, в платяных вшах, кошачьих блохах. Оптимальная температура 26-37 "С.
Бартонеллы чувствительны к действию обычных дезинфектантов.
Факторы патогенности. Плохо изучены. Известно, что внедрение бартонелл в клетку происходит с помощью адгезинов, т. е. протеинов внешней мембраны. На месте внедрения иногда возникает «первичный аффект» (например, при болезни кошачьих царапин). Основными мишенями бартонелл являются эритроциты и эндотелиальные клетки. В местах прикрепления бартонелл к чувствительным клеткам формируются скопления (кластеры) микроорганизмов, возникает воспалительная реакция с разрастанием клеток эндотелия и прилегающих тканей. Часть клеток эндотелия подвергается некрозу. В результате этого процесса развивается ангиоматоз или лимфоаде-нопатия с поражением костномозговых клеток и эритроцитов. Бактерии при этом могут быть обнаружены в эритроцитах и клетках эндотелия сосудов, селезенки, лимфатических узлах, печени, костного мозга, кожи.
Эпидемиология, клиника и диагностика. Человек высоковосприимчив к некоторым видам бартонелл. Резервуаром и источни-
ком возбудителя является больной или носитель, иногда — обезьяны. Механизм передачи, трансмиссивный или парентеральный.
Бартонеллез широко распространен, встречается в Южной и Северной Америке, а также в Европе, в том числе в России. Клиника болезней, вызываемых бартонеллами, крайне разнообразна — от легких местных расстройств лимфо- и кровообращения (болезнь кошачьих царапин, лимфоаденопатия, бациллярный ангиоматоз кожи) до более тяжелых острых, часто рецидивирующих (траншейная лихорадка) или длительно текущих болезней (пурпурный гепатит, эндокардит, перуанская бородовка и др.). Наиболее злокачественно протекает лихорадка Оройя, при которой смертность достигает 40 %.
После перенесенного заболевания остается иммунитет.
Диагноз ставится на основании клинико-эпидемиологических данных и подтверждается микробиологическими методами. Применяют микроскопию, мазки крови, окрашенные по Романовскому—Гимзе, посев крови на среды с кровяным агаром, заражение РКЭ, культур клеток, а также серологические методы (РСК, РПГА, ИФА, ПЦР).
Лечение и профилактика. Прогноз зависит от формы бартонеллеза. Лечение — антибиотиками (группа тетрациклина, макролиды, фторхинолоны), а также другими антибкате-риальными препаратами (новарсенол).
Специфическая профилактика не разработана. Неспецифические меры борьбы сводятся к уничтожению переносчиков (москиты, вши, блохи, клещи), устранению контактов с больными, санации домашних животных (кошек).
Возбудитель болезни кошачьих царапин (син. лимфоретикулез доброкачественный). Известен в США, Франции и России. Возбудитель В. henselae назван в честь Д. Хенсель, выделившей возбудителя.
Заражение человека происходит контактным путем, через повреждения кожи или конъюнктиву глаза. Инкубационный период 3—12 суток. Проявляется в виде одиночных или группы папул или папулопустул на месте царапин или укуса кошки с последующим развитием лимфаденита и нарушением обще-
го самочувствия. Возможно заражение через укус кошачьих блох.
Лечение — антибиотиками. Прогноз благоприятный.
Возбудитель окопной или траншейной ли хорадки (син. волынская лихорадка и др.). Возбудитель B . quintana . Острая форма барто-неллеза, отличается полиморфностью клинического проявления с острым началом (температура 39—39,5 °С), нарушением общего самочувствия, появлением розеолезной сыпи (у 20—80 %). Возможны повторные приступы лихорадки и рецидивы.
Заражение — трансмиссивно платяными вшами через расчесы. Заболевание неконтагиозно. Инкубационный период 10—14 суток. Прогноз благоприятный. Диагноз ставится на основании клинико-эпидемиологических данных, а также обнаружения антигенов и антител в крови постановкой ПЦР. Иммунитет непродолжительный. Лечение — антибиотиками.
Возбудитель болезни Карриона {В. bacil - liformis ). Болезнь распространена в Южной Америке (Перу, Эквадор, Колумбия и др.). Выделяют две формы: 1) острая, протекающая с высокой температурой, резко выраженной анемией и летальностью до 40 %, известная как лихорадка Оройя; 2) кожная форма, развивающаяся спустя 1—2 мес. после острой формы с формированием на коже и слизистых оболочках сыпи и множественных кровоточащих папул, в силу чего болезнь получила название перуанской бородавки.
Тождество двух форм болезни доказано студентом медицинского факультета г. Лимы Д. Каррионом (в опыте самозаражения), по имени которого и названо заболевание.
Переносчиками инфекции являются москиты. Инкубационный период 17—21 сутки. Резервуар возбудителя — мышевидные грызуны. Заболевание неконтагиозно. После перенесенного заболевания остается пожизненный иммунитет.
Клинико-эпидемиологический диагноз подтверждается выявлением бартонелл в крови и серологическими реакциями.
Лечение — антибиотиками.
Возбудитель бациллярного гепатита. Заболевание протекает с преимущественным поражением паренхимы печени, вследствие бациллярного поражения мелких сосудов печени (фор-
мирования в них кист), что ведет к застойным явлениям в этом органе. Развивается гепатосп-леномегалия, анемия, тромбоцитопения.
Диагноз подтверждается микроскопическим исследованием препаратов.
16.3.6. Аэробные неферментирующие грамотрицательные палочки
Группа аэробных неферментирующих бактерий включает оксидазаположительные грамотрицательные палочки, окисляющие, а не ферментирующие углеводы (см. ниже). К неферментирующим относят представителей родов Pseudomonas , Burkholderia , Alcaligenes , Eikenella , Flavobacterium , Kingella , Moraxella и некоторые другие. Многие из этих бактерий хорошо растут на простых питательных средах и в норме обитают в окружающей среде (почве, воде, на растениях), а также обнаруживаются в организме человека. В то же время они являются возбудителями оппортунистических инфекций человека и животных.
16.3.6.1. Псевдомонады (род Pseudomonas )
Таксономическое положение. Современная классификация псевдомонад основана на методах молекулярной гибридизации и куль-туральных особенностях микроорганизмов. Некоторые бактерии рода Pseudomonas сравнительно недавно получили новое наименование — Burkholderia .
Род Pseudomonas включает вид Pseudomonas aeruginosa — синегнойную палочку, возбудитель многих ГВЗ; род Burkholderia — виды Burkholderia ( Pseudomonas ) mallei — возбудитель сапа и Burkholderia ( Pseudomonas ) pseudomallei — возбудитель, вызывающий мелиоидоз и другие.
Pseudomonas aeruginosa (синегнойная палочка)
А. Люкке в 1862 г. было впервые описано нагноение раны с характерным сине-зеленым окрашиванием повязок, вызванное синегнойной палочкой. В чистой культуре Pseudomonas aerugi nosa была выделена лишь в 1882 г. С. Жессаром.
Морфологические и тинкториальные свойс тва. P . aeruginosa относится к семейству Pseudomonadaceae . Это грамотрицательные прямые палочки размером 1—3 мкм, расположенные одиночно, попарно или в виде коротких цепочек. Синегнойные палочки под-
вижны за счет наличия одного, редко двух полярно расположенных жгутиков. Спор не образуют, имеют пили (фимбрии). При определенных условиях могут продуцировать капсулоподобную внеклеточную слизь поли-сахаридной природы. Встречаются также, так называемые, мукоидные штаммы, образующие повышенное количество слизи. Такие бактерии выделяются чаще всего из мокроты больных муковисцидозом.
Культуральные свойства. Все псевдомонады — облигатные аэробы, которые хорошо растут на простых питательных средах. Возбудитель довольно часто находится в патологическом материале в ассоциации с другими микроорганизмами, поэтому для выделения чистой культуры синегнойной палочки применяют селективные или дифференциально-диагностические питательные среды с добавлением антисептиков — малхитовый агар с добавлением бриллиантового зеленого или ЦПХ-агар с ацетамидом или N-цетипиридоний хлоридом. Оптимальная температура роста 37 °С, однако синегнойная палочка способна расти при 42 °С, что позволяет отличать ее от других псевдомонад. На жидкой питательной среде бактерии образуют характерную серовато-серебристую пленку на поверхности. Колонии синегнойной палочки гладкие округлые, суховатые или слизистые (у капсульных штаммов). Культуры синегнойной палочки, выделенные от больных муковисцидозом, продуцируют мукоидные колонии вследствие избыточной продукции альгината и экзополисахаридов. На кровяном агаре вокруг колоний синегнойной палочки наблюдаются зоны гемолиза.
При культивировании на плотных питательных средах P . aeruginosa продуцирует триметиламин, придающий культурам этих бактерий своеобразный сладковатый запах жасмина, земляничного мыла или карамели. Характерным биологическим признаком бактерий вида P . aeruginosa является способность синтезировать водорастворимые пигменты, окрашивающие в соответствующий цвет повязки больных или питательные среды при их культивировании. Чаще всего они вырабатывают феназиновый пигмент — пиоцианин сине-зеленого цвета, но могут образовывать и зеленый флюоресцирующий в УФ-лучах
пигмент флюоресцеин (пиовердин), а также красный (пиорубин), черный (пиомеланин) или желтый (alfa-оксифеназин).
Биохимические свойства. Синегнойная палочка обладает низкой сахаролитической активностью: не ферментирует глюкозу и другие углеводы, однако для получения энергии способна их окислять. Для дифференциальной диагностики, позволяющей отличать псевдомонады от других грамотрицательных палочек, применяют OF-тест (тест окисления-ферментации глюкозы) на среде Хью-Лейфсона. С этой целью делают посев чистой культуры псевдомонад в две пробирки с этой полужидкой или, иногда, жидкой средой. Одну пробирку инкубируют в аэробных условиях, другую — в анаэробных. Псевдомонады способны только окислять глюкозу (цвет индикатора меняется только в пробирке после аэробного инкубирования). P . aeruginosa восстанавливает нитраты в нитриты, редуцируя их до газообразного азота, а также обладает протеолитической активностью: разжижает желатину, гидролизует казеин. Синегнойная палочка имеет каталазу и цитохромоксидазу (псевдомонада оксидазапозитивны), участвующую в переносе электронов при дыхании.
Многие штаммы синегнойной палочки продуцируют бактериоцины, называемые пиоци-нами или пиоцианинами, — протеины, обладающие бактерицидными свойствами. Для эпидемиологического маркирования и внутривидовой идентификации P . aeruginosa проводят пиоцинотипирование штаммов, выделенных от больных и из окружающей среды. С этой целью определяют спектр продуцируемых исследуемым штаммом пиоцинов или чувствительность этого штамма к пиоцинам других псевдомонад.
Антигенные свойства. Синегнойная палочка имеет сложную антигенную структуру: у нее обнаружены О- и Н-антигены. Липополисахарид клеточной стенки является типо- или группо-специфическим термостабильным О-антиге-ном, на основе которого проводят серотипиро-вание штаммов P . aeruginosa . Термолабильный жгутиковый Н-антиген бывает двух типов и обладает протективным действием, поэтому на его основе созданы вакцинные препараты. На поверхности клеток синегнойной палочки обнаружены также антигены пилей (фимбрий).
Кроме того, P . aeruginosa продуцирует целый ряд внеклеточных продуктов, обладающих антигенными свойствами: экзотоксин А, протеа-зу, эластазу, внеклеточную слизь.
Факторы патогенности. P . aeruginosa обладает целым рядом факторов патогенности, которые вовлечены в патогенез синегнойной инфекции.
Факторы адгезии и колонизации. Адгезивные свойства бактерий определяются наличием пилей (фимбрий) на поверхности клеток P . aeruginosa . Синегнойная палочка обладает тропизмом к эпителию мочевого пузыря, респираторного тракта, конъюнктивы глаз. Экстрацеллюлярная слизь синегнойной палочки покрывает поверхность микробной клетки, но в отличие от капсулы, не имеет четких границ и легко выделяется во внешнюю среду. Гликолипопротеид, входящий в состав внеклеточной слизи P . aeruginosa , также принимает участие в процессе адгезии (преимущественно на муцине эпителия дыхательных путей). Это капсулоподобное вещество обладает антигенными и токсическими свойствами, защищает бактерии от фагоцитоза, участвует в развитии лейкопении. Мукоидные штаммы синегнойной палочки, продуцирующие большое количество слизи, обусловливают хроническое течение заболевания, в особенности при муко-висцидозе, остеомиелите, хроническом отите.
Токсины. Л ПС наружной мембраны клеточной стенки P . aeruginosa обладает свойствами эндотоксина и участвует в развитии лихорадки, олигурии, лейкопении у больных.
Экзотоксин А синегнойной палочки является цитотоксином, который вызывает глубокие нарушения клеточного метаболизма в результате подавления синтеза белка во всех клетках и тканях. Подобно дифтерийному токсину, он является АДФ-рибозизилтрансферазой, которая ингибирует фактор элонгации EF-2 и поэтому вызывает нарушение синтеза белка. Доказано, что он также подавляет синтез иммуноглобулинов, вызывает нейтропению. Экзотоксин А обладает высокой летальностью при введении его в очищенном виде животным. Например, при внутрибрюшинном введении мышам 0,1 мкг токсина они погибают через 40—50 ч после инъекции. Токсинообразование у различных штаммов синегнойной палочки контролиру-
ется структурным геном в составе хромосомы, а также регуляторным геном-репрессором при участии ионов железа. Экзотоксин А продуцируется в неактивной форме и активируется при участии различных ферментов внутри организма. Экзотоксин А является протективным антигеном: антитоксические антитела защищают клетки от его повреждающего действия, а также препятствуют развитию бактериемии и синегнойного сепсиса.
Экзоэнзим S (экзотоксин S) обнаруживается только у высоковирулентных штаммов синегнойной палочки. Механизм его повреждающего действия на клетки пока неясен, однако известно, что инфекции, обусловленные экзоэнзим S-продуцирующими штаммами синегнойной палочки, нередко заканчиваются летально. Экзотоксины А и S нарушают также активность фагоцитов.
Лейкоцидин является цитотоксином с выраженным токсическим воздействием на грану-лоциты крови человека.
Энтеротоксин и факторы проницаемости играют определенную роль в развитии местных тканевых поражений при кишечных формах синегнойной инфекции, вызывая нарушения водно-солевого обмена.
Ферменты агрессии. P . aeruginosa продуцирует гемолизины двух типов: термолабильную фосфолипазу С и термостабильный гликолипид. Фосфолипаза Сразрушает фосфолипиды в составе сурфактантов на альвеолярной поверхности легких, вызывая развитие ателектазов (бронхо-эктазов) при бронхолегочной патологии.
Нейраминидаза участвует в колонизации муцина респираторного тракта, поэтому играет важную роль в патогенезе бронхолегочных заболеваний синегнойной этиологии и муко-висцидоза.
Различные протеолитические ферменты (протеазы трех типов, эластаза), а также экзо токсин А вызывают геморрагии, деструкцию тканей и некроз в очагах поражения при инфекциях глаз, пневмониях, септицемии синегнойной этиологии. Эластаза синегнойной палочки расщепляет эластин, казеин, фибрин и гемоглобин. Протеаза разрушает сывороточные IgA. Высокая протеолитическая активность штаммов P . aeruginosa является маркером их патогенности.
Резистентность. Отличительной особенностью P . aeruginosa является очень ограниченная потребность в питательных веществах, что обеспечивает ей сохранение жизнеспособности в условиях почти полного отсутствия источников питания. Известно, что синегнойная палочка хорошо сохраняется в пресной, морской и даже дистиллированной воде. В водопроводной воде P . aeruginosa живет и размножается более 2,5 месяцев. Доказано также, что культуры синегной-ной палочки сохраняют жизнеспособность даже в растворах дезинфицирующих средств (например, фурациллина), предназначенных для хранения катетеров и различных медицинских инструментов, промывания ран в ожоговых и хирургических стационарах.
В то же время P . aeruginosa чувствительна к высушиванию, действию хлорсодержащих дезинфицирующих препаратов. Она легко ина-ктивируется при воздействии высоких температур (при кипячении, автоклавировании).
Довольно высокая устойчивость P . aerugi nosa к антибиотикам объясняется плохой проницаемостью наружной мембраны бактерий из-за врожденного дефекта поринов, а также способностью синтезировать пенициллиназу.
Экология псевдомонад. Естественной средой обитания псевдомонад являются почва и различные пресные и соленые водоемы. Однако они широко распространены не только в природе. Около 5—10 % здоровых людей являются носителями различных штаммов P . aeruginosa (они в норме колонизируют кишечник) и около 70 % пациентов, находящихся в стационаре. В клинике псевдомонады также встречаются повсеместно: в водопроводных и вентиляционных системах, на фруктах и овощах, комнатных растениях, на поверхности мыла, щетках для мытья рук, полотенцах, в дыхательных аппаратах и т. д. Способность псевдомонад расти в очень слабых водных растворах веществ и в дистиллированной воде, применяемой для приготовления различных растворов, объясняет их возможное присутствие в препаратах антисептиков, детергентов и в растворах для инъекций.
Эпидемиология. Заболевание может развиться в результате аутоинфицирования (эндогенное заражение) или экзогенно. Источником инфекции являются люди (больные или бактерионосители), а также различные естест-
венные резервуары природы. Поэтому си-негнойную инфекцию можно считать сапро-антропонозом. Механизмы и пути заражения при инфекциях, вызванных синегнойной палочкой, могут быть различными: возможны контактный, респираторный, кровяной или фекально-оральный механизмы заражения.
Синегнойная инфекция может возникнуть как у иммунодефицитных лиц с тяжелой сопутствующей патологией (диабет, ожоговая болезнь, лейкоз, муковисцидоз, иммуносуп-рессия при онкологических заболеваниях и трансплантации органов), так и на фоне нормальной иммунологической реактивности организма. Показано, что адгезивная активность P . aeruginosa усиливается при повышении температуры окружающей среды и атмосферного давления, поэтому посещение бассейна, бани, принятие лечебных ванн также могут спровоцировать синегнойную инфекцию.
Синегнойная палочка является возбудителем внутрибольничных (госпитальных) инфекций, т. е. заболеваний, возникающих у людей, находящихся на лечении в стационаре. Заражение синегнойной инфекцией в клинике может быть связано с медицинскими манипуляциями (катетеризация мочевого пузыря, эндоскопическое исследование, промывание ран, перевязка, обработка антисептиками ожоговой поверхности, применение аппарата для искусственной вентиляции легких и др.), когда инфицирование происходит через грязные руки персонала, инструменты или при использовании контаминированных растворов.
Патогенез. Синегнойные палочки обычно проникают в организм человека через поврежденные ткани. Прикрепляясь, они заселяют раневую или ожоговую поверхность, слизистые оболочки или кожу, и размножаются. При отсутствии у человека иммунных механизмов против синегнойной инфекции локальный процесс (инфекция мочевыво-дящих путей, кожи, респираторного тракта) может генерализоваться. Бактериемия приводит к диссеминации возбудителя и развитию сепсиса, часто приводящего к формированию вторичных гнойных очагов инфекции. Под воздействием факторов патогенности (экзотоксина, ферментов агрессии) происходит нарушение функционирования органов и сис-
тем. Как осложнение, может развиться синдром диссеминированного внутрисосудистого свертывания, шок, а также респираторный дистресс-синдром.
Клиника. Синегнойная палочка вызывает ГВЗ различной локализации: раневые инфекции, ожоговую болезнь, менингиты, инфекции мочевыводящих путей, кожи (гангренозная эктима, ecthyma gangrenosum ), заболевания глаз (кератит), некротическую пневмонию, сепсис. P . aeruginosa является возбудителем злокачественного наружного отита у диабетиков. Смертность от синегнойного сепсиса составляет около 50 %.
Иммунитет. В сыворотке крови здоровых людей, а также переболевших инфекциями си-негнойной этиологии обнаруживают антитоксические и антибактериальные антитела, однако эти антитела типоспецифические и их роль в защите от повторных заболеваний мало изучена..
Микробиологическая диагностика. Материал для исследования: кровь (при септицемии), спинномозговая жидкость (при менингите), гной и раневое отделяемое (при инфицированных ранах и ожоговых поражениях), моча (при инфекциях мочевыводящих путей), мокрота (при муковисцидозе и инфекциях респираторного тракта) и др. Бактериоскопия мазков из исследуемого материала малоинформативна из-за отсутствия у синегнойной палочки морфологических и тинкториальных особенностей. Основным методом диагностики является бактериологическое исследование клинического материала, которое позволяет не только идентифицировать возбудитель, но и определить чувствительность бактерий к антимикробным препаратам. При идентификации P . aeruginosa учитывают их рост на ЦПХ-агаре, возможное пигментообразова-ние, наличие специфического запаха при росте культуры на плотной питательной среде, положительный цитохромоксидазный тест, выявление термофильно(рост при 42 °С), а также способность окислять глюкозу в OF-тесте. Для внутривидовой идентификации бактерий применяют серотипирование, пиоцинотипирование, а также определяют чувствительность выделенной культуры к бактериофагам.
Серологический метод исследования направлен на обнаружение специфических антител к антигенам синегнойной палочки
(обычно экзотоксину А и Л ПС) с помощью РСК, РПГА, опсонофагоцитарной реакции и некоторых других тестов.
Лечение. При лечении синегнойной инфекции применяют антибиотики, причем рекомендуется использование комбинации препаратов из разных групп. Антимикробная терапия назначается только после получения результатов антибиотикограммы. При ургентных инфекциях антибиотики назначаются эмпирически. Препаратами выбора являются цефалоспорины (цефтазидим, цефоперазон) и другие р-лактам-ные препараты (тикарциллин, мезлоциллин, пиперациллин, имипенем), аминогликозиды (гентамицин, тобрамицин, амикацин), а также азтреонам и ципрофлоксацин.
Для лечения тяжелых форм синегнойной инфекции применяют также гипериммунную плазму, полученную из крови добровольцев, иммунизированных поливалентной корпускулярной синегнойной вакциной.
При местном лечении инфекций кожи (трофических язвах, эктиме, ожоговых ранах), вызванных P . aeruginosa , применяют антисинегнойный гетерологичный иммуноглобулин, получаемый из сыворотки крови баранов, гипериммунизированных взвесью культур синегнойных палочек 7 различных иммунотипов, убитых формалином.
Кроме того, для лечения гнойных инфекций кожи, абсцессов, термических ожогов, осложненных синегнойной инфекцией, циститов, маститов и др. заболеваний синегнойной этиологии (кроме сепсиса) можно применять синегнойный бактериофаг («бактериофаг пи-оцианеус») или поливалентный жидкий пио-бактериофаг.
Специфическая профилактика. Эффективная стерилизация, дезинфекция и антисептика, а также соблюдение правил асептики являются основными мерами неспецифической профилактики синегнойной инфекции в стационаре. План профилактических мероприятий обязательно должен включать контроль за обсемененностью внешней среды (воздух, различные предметы, инструменты и аппаратура), соблюдение правил личной гигиены.
С целью неспецифической профилактики больным рекомендуется назначать иммуно-модуляторы.
Пациентам с ослабленным противоинфекци-онным иммунитетом показана также пассивная специфическая иммунизация гипериммунной плазмой или нормальным человеческим иммуноглобулином в профилактических целях.
Для создания активного иммунитета применяют вакцины. В настоящее время известно много способов получения вакцин против синегнойной инфекции: имеются вакцины из ЛПС, полисахаридные субкорпускулярные (химические) вакцины, рибосомные вакцины, препараты из жгутиковых антигенов и компонентов внеклеточной слизи, а также анатоксины из внеклеточных протеаз и экзотоксина А. Активная иммунизация против инфекций, вызываемых P . aeruginosa , показана больным из групп риска (пациентам с муковисцидозом, диабетом, а также иммунодефицитным лицам). Однако в связи с тем, что иммунный ответ на вакцинные препараты у людей с иммуноде-фицитами бывает поздним и не всегда полноценным, большое значение придается комбинированию методов активной и пассивной иммунизации. В нашей стране применяются поливалентная корпускулярная синегнойная вакцина (из 7 штаммов P . aeruginosa ) и стафи-ло-протейно-синегнойная вакцина.
16.3.6.2. Буркхольдерии (род Burkholderia )
Возбудитель сапа — Burkholderia ( Pseudomonas ) mallei
Возбудитель сапа — Burkholderia mallei был открыт в 1882 г. Ф. Леффлером и X. Шутцем.
Биологические свойства. Возбудитель сапа — мелкая грамотрицательная палочка; жгутиков, спор и капсул не имеет. Аэроб. Хорошо растет на простых питательных средах, пигмента не образует. Штаммы возбудителя сапа различаются по антигенной структуре. Ведущим фактором патогенности является эндотоксин (маллеин), который действует на клетки гладкой мускулатуры различных органов, вызывает лихорадку и снижение массы тела.
Резистентность. Burkholderia mallei чувствительны к высушиванию, нагреванию и многим дезинфектантам (кроме лизола). Во влажной среде и гниющих материалах сохраняется около месяца.
Эпидемиология. Сап — зооантропонозная особо опасная инфекция. Основным резервуа-
ром возбудителя и источником инфекции являются парнокопытные животные (лошади, ослы, мулы, верблюды, зебры), а также хищники, поедающие мясо этих животных. Случаи заражения человека от животных обычно связаны с профессиональной деятельностью человека (ветеринарные врачи, работники животноводства). Заболевание может передаваться от человека к человеку, однако заболеваемость людей обычно носит спорадический характер. Описаны случаи внутрисемейного заражения сапом.
Механизм заражения чаще всего контактный (при уходе за больными животными), возможны также фекально-оральный (путь заражения — пищевой) и респираторный механизмы передачи возбудителя.
Сап встречаетсявстранахСредиземноморья, Юго-Восточной Азии. В России существует опасность завоза инфекции из-за рубежа.
Патогенез и клиника. Входными воротами инфекции являются слизистые оболочки глаз, носа, верхних дыхательных путей, поврежденные кожные покровы. На месте проникновения возбудителя образуются папулы, которые затем превращаются в пустулы и язвы. Инфекционный процесс редко носит локальный характер. При сапе наблюдается бактериемия, септицемия с образованием вторичных гнойных очагов в мышцах и внутренних органах.
Инкубационный период составляет в среднем 1—5 дней. Заболевание протекает тяжело. Во внутренних органах формируются гранулемы и абсцессы. Острая форма сапа длится 7-14 дней и в 100 % случаев заканчивается летально.
Иммунитет. Изучен плохо.
Микробиологическая диагностика. Основана на обнаружении возбудителя в отделяемом из носа, в содержимом гнойных язв, мокроте или крови, а также в секционном материале после аутопсии. Исследование проводят только в специализированных лабораториях с соблюдением правил работы с возбудителями особо опасных инфекций. Применяют бактериоскопический (ориентировочный), бактериологический (выделение и идентификация возбудителя) и серологический (РСК, реакция агглютинации) методы. Кожно-аллергическая проба с маллеином (фильтратом бульонной культуры возбудителя) также позволяет поставить диагноз сапа.
Лечение. Применяют антибиотики — ами-ногликозиды, тетрациклины.
Специфическая профилактика. Не разработана. Не Специфическая профилактика сапа включает тщательной соблюдение правил индивидуальной защиты при уходе за больными животными и при работе с инфекционным материалом, а также ветеринарный надзор с целью выявления больных животных и инфицированных продуктов животного происхождения.
Возбудитель мелиоидоза — Burkholderia ( Pseudomonas ) pseudomallei
Возбудитель мелиоидоза (ложного сапа) — Burkholderia pseudomallei был выделен в 1912 г. английским врачом Р. Уайтмором в Бирме.
Биологические свойства. Burkholderiapseudoma - llei — мелкая подвижная неспорообразующая грамотрицательная палочка. Окрашивается биполярно. Аэроб. Хорошо растет на простых питательных средах, образует кремовые или оранжевые колонии, гладкие или шероховатые. Растет медленно (около 72 ч). Подобно синегнойной палочке, может расти при температуре 42 "С. Окисляет глюкозу, лактозу и некоторые другие углеводы. Имеет О- и Н-анти-гены. Среди факторов патогенности называют летальный и дерматонекротический токсины, ЛПС, протеазы и гемолизин.
Резистентность. Burkholderia pseudomallei довольно устойчива в окружающей среде: в отличие от возбудителя сапа, сохраняет жизнеспособность при высушивании, в течение месяца сохраняется в моче, фекалиях и трупах животных. Однако весьма чувствительна к различным дезинфектантам.
Эпидемиология. Возбудитель мелиоидоза распространен в природе: его выделяют из образцов почвы, воды, на рисовых полях, с поверхности овощей и фруктов.
Мелиоидоз — зоонозное инфекционное заболевание, протекающее по типу септи-копиемии. Источником инфекции являются грызуны, различные сельскохозяйственные (свиньи, лошади, крупный и мелкий рогатый скот) и дикие животные. Случаев заражения человека от человека не описано.
Возбудитель проникает в организм человека через поврежденную кожу (контактный меха-
низм заражения), слизистые оболочки (респираторный и фекально-оральный механизмы). Не исключается также заражение через переносчиков (кровяной механизм, путь передачи инфекции — трансмиссивный). Естественная восприимчивость людей невысокая.
Мелиоидоз — эндемичное заболевание, встречается преимущественно в странах Юго-Восточной Азии и Австралии.
Патогенез и клиника. Патогенез мелиоидоза мало изучен. Из первичного очага возбудитель быстро попадает в кровь, вызывая бурную интоксикацию. Оседая в различных внутренних органах, он приводит к возникновению множественных абсцессов.
Инкубационный период составляет в среднем 2—3 дня. Заболевание протекает остро, хотя возможно и латентное течение. Болезнь в большинстве случаев заканчивается летально.
Иммунитет. Не изучен.
Микробиологическая диагностика. Материал для исследования — кровь, моча, испражнения, мокрота, рвотные массы, гной, секционный материал. Применяемые методы исследования: бактериоскопический (обнаруживают биполярно окрашенные палочки), бактериологический (выделение и идентификация возбудителя), биологический (биопроба на мышах или морских свинках) и серологический (реакция агглютинации, РСК, РПГА).
Лечение. Применяют сульфаниламидные препараты и антибиотики.
Специфическая профилактика. Не разработана. Основные профилактические мероприятия сводятся к ветеринарному надзору и санитарно-разъяснительной работе в очагах возникновения болезни.
16.3.6.3. Кингеллы (род Kingella )
Бактерии рода Kingella получили свое название в честь американского бактериолога Э. Кинг, которая впервые подробно описала их. Кингеллы относят к группе так называемых неферментирующих грамотрицательных бактерий.
Кингеллы являются представителями нор-мофлоры полости рта и носоглотки, однако способны вызывать оппортунистические инфекции.
Таксономическое положение. Род Kingella включает 3 вида: К. kingae , К. denitrificans ,
К. indologenes , из которых К. kingae имеет наибольшее медицинское значение. Семейство кингелл не определено.
Морфологические и тинкториальные свойс тва. Кингеллы — грамотрицательные прямые палочки длиной 1 мкм с закругленными или квадратно очерченными концами, расположенные попарно или в виде коротких цепочек. Спор и капсул не образуют. Жгутиков не имеют. Обычно неподвижны, однако могут иметь фимбрии (пили), благодаря которым способны передвигаться рывками, особенно по поверхности твердого субстрата.
Культуральные свойства. Аэробы или факультативные анаэробы, лучше культивируются в аэробных условиях. Оптимальная температура роста 33—37 "С. Плохо растут на простых питательных средах, так как нуждаются в факторах роста животного происхождения. На кровяном агаре образуют зоны р-гемолиза.
Кингеллы способны образовывать колонии двух типов: 1) плоские, распространяющиеся по поверхности, вызывающие коррозию плотной питательной среды, — R-формы. Этот тип колоний связан со способностью бактерий к движению благодаря наличию фимбрий; 2) гладкие, выпуклые S-колонии, характерные для неподвижных кингелл, не имеющих фимбрий.
Биохимические свойства. Кингеллы обладают слабо выраженной биохимической активностью: сбраживают глюкозу и некоторые другие углеводы до кислоты, без газообразования. Обладают слабой протеолитической активностью: расщепляют казеин, могут образовывать индол на среде с триптофаном. Оксидазаположительны, катала-заотрицательны.
Антигенные свойства. Мало изучены. Имеют О-антиген.
Факторы патогенности. Вирулентность кингелл, вероятно, определяется наличием эндотоксина, а также фимбриями. Адгезины бактерий и пили обеспечивают их способность к адгезии.
Резистентность. Кингеллы малоустойчивы в окружающей среде. Довольно быстро погибают при высоких температурах: уже при температуре 45 "С их гибель наступает через 10—15 мин. Они также высокочувствительны
к антисептикам и антибиотикам (например, пенициллину, ампициллину и эритромицину).
Эпидемиология и клиника. Кингеллы выделяют со слизистых оболочек верхних дыхательных путей и полости рта человека, считая их представителями нормальной микрофлоры полости рта, комменсалами носоглотки человека.
Бактерии рода Kingella вызывают так называемые оппортунистические инфекции у лиц со сниженным иммунитетом. К. kingae , например, является возбудителем менингитов, артритов и остеомиелитов, а также септических эндокардитов, в особенности у людей с искусственными клапанами сердца. Считается, что эти бактерии способны проникать в кровоток даже при таких простых манипуляциях, как чистка зубов, если эта процедура сопровождается повреждением десен или другими микротравмами.
Иммунитет. Мало изучен.
Микробиологическая диагностика. Основана на применении бактериологического метода исследования различных клинических материалов: крови (при септическом эндокардите или септицемии), спинномозговой жидкости (при менингите), синовиальной жидкости (при септическом артрите) и др.
Лечение. Поскольку кингеллы отличаются высокой чувствительностью к Р-лактамным антибиотикам и макролидам, пенициллин, ампициллин и эритромицин могут быть назначены при лечении заболеваний, вызванных этими микроорганизмами.
Специфическая профилактика. Не разработана.,
16.3.6.4. Моракселлы (род Moraxella ) и бранхамеллы (подрод Branhamella )
Бактерии рода Moraxella являются представителями нормальной микрофлоры слизистых оболочек верхних дыхательных путей человека и некоторых животных. Могут вызывать различные заболевания у людей с нарушениями иммунитета.
Подобно кингеллам, моракселлы относятся к группе неферментирующих грамотрицательных бактерий. Впервые были выделены офтальмологами В. Мораксом и К. Аксенфельдом в 1896 г. Бактерии под-рода Branhamella названы так в честь американского бактериолога С. Э. Брэнэм (S. E. Branham).
"Таксономическое положение. Семейство моракселл не определено. Род Moraxella разделен на два подро-
да. Подрод Moraxella объединяет 6 видов бактерий: Moraxella lacunata (типовой вид), М. atlantae, M. bovis, М. nonliquefaciens, M. osloensis, М. phenylpyruvica. К под-роду Branhamella относятся следующие виды бактерий: Branhamella catarrhalis, В. caviae, В. cuniculi, В. ovis.
Морфологические и тинкториальные свойства. Моракселлы — это мелкие грамотрицатель-ные палочки (подрод Moraxella) или кокки (подрод Branhamella), расположенные попарно или в виде коротких цепочек. Для моракселл характерен плео-морфизм — в культурах наблюдается изменчивость размера и формы клеток: встречаются нитевидные клетки и длинные цепочки бактерий. Плеоморфизм моракселл усиливается в отсутствие кислорода или при температуре выше оптимальной. У бранхамелл клетки имеют форму кокков, они обычно мелкие, расположены одиночно или попарно; соприкасающиеся стороны клеток уплощены.
Клеточная стенка моракселл имеет истинные воски. Все моракселлы образуют капсулу. Они неподвижны. Бактерии подрода Moraxella могут иметь фимбрии. Так же как и у кингелл, у моракселл имеется способность к движению рывками по твердой поверхности благодаря наличию фимбрий.
Культуральные свойства. Моракселлы — аэробы. Оптимальная температура роста 33—35 °С, бранхамел-лы могут расти и при 22 °С. Все бактерии рода Moraxella требовательны к составу питательных сред, нуждаются в добавлении аминокислот, биотина, лактата (сукци-ната) в качестве источника углерода и энергии.
Бактерии подрода Moraxella на плотных питательных средах могут образовывать два типа колоний: 1) шероховатые с неровными краями, иногда с коррозией питательной среды у фимбриеобразующих штаммов; 2) очень мелкие гладкие колонии е ровными краями у штаммов без фимбрий.
Бактерии, относящиеся к подроду Branhamella, образуют мутные складчатые колонии с приподнятым центром.
Биохимические свойства выражены слабо. Моракселлы относятся к неферментирующим бактериям, поэтому при утилизации углеводов кислото-образование не наблюдается. Могут восстанавливать нитраты. Каталаза- и оксидазапозитивны.
Branhamella catarrhalis по своим морфологическим и тинкториальным свойствам похожа на бактерии рода Neisseria, однако отличается от них по биохимическим свойствам: неспособностью окислять углеводы, а также ДНКазной активностью. В. catarrhalis продуцирует бутират эстеразу, обнаружение которой
используется при экспресс-диагностике заболеваний, вызываемых этим микроорганизмом.
Антигенные свойства моракселл мало изучены.
Факторы патогенности. Вирулентность моракселл определяется наличием эндотоксина, фимбрий. Бранхамеллы способны, кроме того, продуцировать ДНКазу.
Резистентность. Все моракселлы малоустойчивы в окружающей среде. Отличаются также высокой чувствительностью к пенициллину, за исключением Branhamella catarrhalis, продуцирующей beta-лактамазу.
Эпидемиология и клиника. Бактерии рода Moraxella обнаруживаются в норме на слизистых оболочках верхних дыхательных путей человека и животных. Однако способны вызывать различные заболевания, преимущественно у людей со сниженной иммунологической реактивностью. Эти заболевания развиваются как эндогенные оппортунистические инфекции. Они характеризуются различной локализацией и клинической симптоматикой. Моракселлы могут вызывать у человека эндокардит, конъюнктивит, менингит, уретрит, различные респираторные инфекции (бронхит, пневмонию, фарингит, отит, синусит).
Иммунитет. Мало изучен.
Микробиологическая диагностика. Основана на бактериологическом исследовании материала, взятого от больных.
Лечение. Большинство моракселл чувствительны к Р-лактамным антибиотикам. Однако, учитывая способность бранхамелл продуцировать beta-лактамазу, для лечения инфекций, вызванных всеми видами моракселл и бранхамелл, рекомендуется применять антибиотики других групп.
Специфическая профилактика. Не разработана..
16.3.6.5. Ацинетобактер (род Acinetobacter )
Относится к нормофлоре человека, вызывает госпитальные инфекции.
Таксономия. Род Acinetobacter, вид Acinetobacter cal- coaceticus, 2 варианта: anitratus и lwoffi.
Морфология и тинкториальные свойства. Короткие толстые полиморфные грамотрицательные палочки длиной 1,5—2,5 мкм; часто имеют кокковидную или овоидную форму. В мазке располагаются беспорядочно, но могут наблюдаться в виде коротких цепочек. Спор не образуют. Отмечается наличие фимбрий. Жгутиков не имеют. Могут образовывать капсулу.
Культуральные и биохимические свойства. По типу дыхания ацинетобактерии — строгие аэробы.
Метаболизм дыхательного типа. Хорошо растут на обычных питательных средах, при температуре 30—35 °С, рН — 7. На плотных средах образуют мелкие блестящие колонии. При росте на кровяном агаре возможно образование зоны аlfa-гемолиза. Биохимические свойства ацинетобактерий выражены слабо. Полисахариды не разлагают, но некоторые виды способны ферментировать моносахариды с образованием кислоты, на чем основана их видовая дифференциация. Индол и сероводород не образуют, лизин не декарбоксилируют.
Факторы патогенности. ЛПС клеточной стенки. Капсула, которая препятствует фагоцитозу, адгезины, обеспечивающие прикрепление микроба к эпителию.
Эпидемиология и клиника. Ацинетобактерий широко распространены в природе. Обитают в почве, воде. Часто обнаруживаются на коже и на слизистой носоглотки здоровых людей.
Вызывают госпитальные инфекции (второе место после псевдомонад), сепсис, перитониты, эндокардиты, раневую и ожоговую инфекции, особенно у детей младшего и среднего возраста. Выделяются при поражении кожных покровов и слизистых оболочек респираторного и урогенитального трактов. Возникновение инфекции наблюдается, как правило, у иммунодефицитных лиц.
Микробиологическая диагностика. Материал для исследования — кровь, гной, раневое отделяемое. Возможен микроскопический метод исследования. Выделяют чистую культуру, идентификация проводится по биохимичесим свойствам.
Лечение. Микроб чувствителен к неомицину и по-лимиксину.
Специфическая профилактика. Не разработана.
Дата: 2019-02-19, просмотров: 463.