Облигатные анаэробные бактерии представляют собой чрезвычайно многочисленную сборную группу микробов, относящихся к различным родам и семействам, морфологически представленную как грамположитель-ными, так и грамотрицательными кокками, палочками, а также извитыми и ветвящимися формами; характеризуются строгим анаэробиозом и чувствительны к токсическому действию кислорода воздуха, обладают сложными питательными потребностями.
Облигатные анаэробные бактерии, имеющие клиническое значение в патологии чело-
века и животных, можно условно разделить на две группы: 1) образующие споры, или клост- ридии; 2) неспорообразующие анаэробы.
К первой группе относятся возбудители анаэробных клостридиальных инфекций: столбняка, ботулизма, газовой гангрены, псевдо-мембранозного колита (см. разд. 16.5).
Бактерии второй группы чрезвычайно многочисленны и разнообразны по видовому составу, принадлежат к различным таксономическим группам, но в организме человека и животных все эти микробы способны вызывать сходный патологический процесс, клинически характеризующийся гнойно-септическими заболеваниями различной локализации. Среди облигатных анаэробных бактерий есть патогенные ( Treponemapallidum , Borreliarecurrentis ), условно-патогенные и сапрофитические виды. Большинство облигатных анаэробных бактерий — условно-патогенные микробы, которые преобладают в нормальной микрофлоре человека и животных. К облигатным анаэробным бактериям относятся палочковидные бактерии — представители родов Anaerorhabdus , Bacteroides , Bilophila , Butyrivibrio , Centipeda , Desulfomonas , Fusobacterium , Leptotrichia , Mitsuokella , Mobiluncus , Porphyromonas , Prevotella , Selenomonas , Succinimonas , Succinivibrio , Wolinella и кокки родов Acidaminococcus , Megasphaera и Veillonella . Классификация облигатных анаэробных бактерий, имеющих клиническое значение, представлена в табл. 16.21.
16.4.1. Бактероиды (род Bacteroides )
Морфология. Вариабельные по своим размерам грамотрицательные палочки, которые отличаются высокой степенью полиморфизма. Морфология варьирует от коккобациллярных до ветвящихся форм. Большинство неподвижно, спор не образуют. Некоторые виды образуют капсулу. Типовой вид — Bacteroides fragilis . Бактерии группы Bacteroides fragilis (В. thetaio - taomicron , В. ovatus , В. vulgatus , В. distasonis ) в мазках из клинического материала представлены бледными полиморфными палочками с закругленными концами. Клетки В. ureolyticus и В. gracilis тонкие, с закругленными концами. Культуральные свойства. Облигатные анаэробы, хемоорганотрофы. Культивируются на анаэробном кровяном агаре, тиогликолевой
среде; лучше растут на комплексных средах (например, агаре с сердечно-мозговым экстрактом) в условиях анаэробиоза. Образуют жемчужно-серые или белые колонии. Добавление гемина и менадиона (витамин К) стимулирует рост культуры. На анаэробном кровяном агаре бактероиды группы «фрагилис» образуют серовато-белые, прозрачные или мутноватые мелкие S-формы колоний без зоны гемолиза; В. ovatus чаще образует слизистые колонии, а колонии В. thetaiotaomicron обычно белого цвета. Ключевые признаки группы — способ ность расти в присутствии 20% желчных солей, Резистентность к канамицину (100 мкг), ванкомицину (5 мкг) и колистину (10 мкг). На плотных питательных средах с желчью колонии могут быть окружены осадком желчных солей. На анаэробном кровяном агаре В. ureolyticus и В. gracilis образуют мелкие полупрозрачные колонии, у некоторых изолятов — распластанные на поверхности. Вызывают зеленое окрашивание и коррозию среды. Для роста нуждаются во внесении в среду фумаратов и формиатов.
Биохимическая активность. Протеолитическая активность умеренная, лецитиназу не образуют, не вызывают гемолиза эритроцитов, гиппурат не гидролизуют (родовой признак), образование индола непостоянно. В. ureolyticus уреаза-положителен, В. gracilis — уреазаотрицателен. Основные дифференциальные признаки представлены в табл. 16.22.
Антигенная структура. Содержат соматический О-АГ, могут иметь Н- и К-АГ.
Факторы патогенности. Образуют капсулу и продуцируют супероксиддисмутазу, что защищает бактерии от бактерицидного действия внеклеточных и внутриклеточных факторов, а также фагоцитов. Содержат эндотоксин, отличающийся от ЛПС других грамотрица-тельных бактерий и проявляющий умеренную биологическую активность. Штаммы Bacteroides fragilis продуцируют нейраминида-зу, гиалуронидазу, фибринолизин, являющиеся факторами патогенности.
Экологическая ниша. Колонизируют слизистые полости рта, верхних дыхательных путей, гениталий и кишечника.
Устойчивость в окружающей среде. При попадании на воздух мгновенно погибают.
Чувствительность к антимикробным препара там. Резистентны к пенициллинам, цефалоспо-ринам I и II поколений, особенно В. distasonis и В. thetaiotaomicron . Препараты выбора — ле-вомицетин, метронидазол, имипенем. Чувствительны к действию обычно применяемых антисептиков и дезинфектантов.
16.4.2. Порфиромонады (род Porphyromonas )
Морфология. Короткие грамотрицатель-ные палочки размером 1,0/3,0x0,5/0,8 мкм. Неподвижны, спор не образуют. Клетки из молодых культур могут быть грамвари-абельны. Род представлен тремя видами: P . asaccharolytica (типовой вид), P . gingivalis и P . endodontalis .
Культуральные свойства. На анаэробном кровяном агаре на 6—14-е сутки культивирования образуют слизистые темно-коричневые или черные колонии. Быстрое пигментообразова-ние наблюдается на агаре с кровью кролика. Рост существенно стимулирует внесение в питательную среду белковых гидролизатов, например пептона или дрожжевого экстракта. До появления пигмента (через 24—48 ч анаэробного культивирования) колонии флюоресцируют рубиново-красным или коралловым цветом при длинноволновом УФ-облучении. Для роста нуждаются в гемине и менадионе.
Биохимическая активность. Очень низкая. Инертны по отношению к углеводам. Дифференциальные признаки весьма немногочисленны: P . asaccharolytica синтезирует alfa-фукозидазу а Р. gingivalis агглютинирует эритроциты барана. Все виды образуют индол. Ключевые признаки — отсутствие способности расти в присутствии 20% желчных солей, Резистентность к канамицину (100 мкг) и колистину (10 мкг), но чувствительность к ванкомицину (5 мкг).
Антигенная структура. Мало изучена.
Факторы патогенности. P . gingivalis связывает и разрушает фибриноген, продуцирует коллагеназу повреждающую дентин, а также агглютинирует эритроциты.
Экологическая ниша. Колонизируют слизистые полости рта и верхних дыхательных путей.
Устойчивость в окружающей среде. При попадании на воздух мгновенно погибают.
МОРФОЛОГИЯ
Грамотриштельные
Палочки
Кокки
Извитые
Грамположител ьн ые
Палочки
Кокки
Ветвящиеся
РОД
Bacteroides
Porphyromonas
Prevotella
Fusobacterium
Leptotrichia Mobiluncus Wolinella
Veillonella
Trepomema Borrelia
Propionibacterium
Eubacterium Lactobacillus
Bifidobacterium
Peptococcus
Peptostreptococcus Actinomyces
В. fragilis
В. thetaiotaomicron
В. vulgaris и т. д.
P. assacharolyticum
P. endodontalis
P. gingivalis
R melaoinogenica
P. oralis
P. bivia и т. д.
F, nucleatum
F. necrophorum
F. varium и т. д.
L. buccalis и т. д.
М. curtisii
М. mulierisH т.д.
W. recta и т. д.
V. parvulla
V. atipica
V. dispar и т. д.
Т. pallidum и т. д.
В. reccurentis и т. д.
P. acnes
P. aviduin и т. д.
Е. lentum и т. д.
L. acidophylus и т. д.
В. adolescent is
В. longum и т. д.
Р, niger
P. magnus
P. micros
P. anaerobius и т. д.
A. bovis
A. israelii и г, д.
вид
Чувствительность к антимикробным препа ратам. Резистентны к пенициллинам и цефа-лоспоринам. Препараты выбора — метронида-зол, левомицетин, имипенем и клиндамицин. Чувствительны к действию обычно применяемых антисептиков и дезинфектантов.
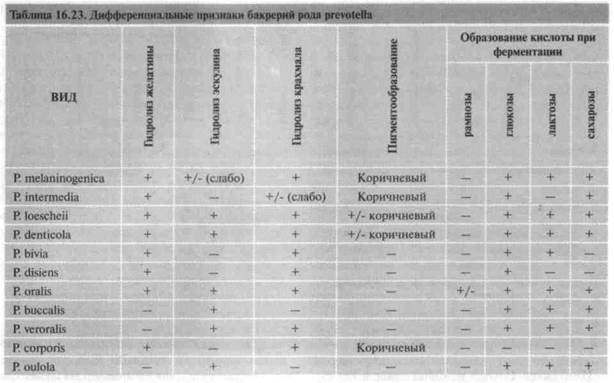
16.4.3. Превотеллы (род Prevotella )
Морфология. Полиморфные неподвижные аспорогенные палочки, близкие к бактероидам. В мазке напоминают порфиромонады. Типовой вид — Prevotella melaninogenica .
Культуральные свойства. Хемоорганотрофы, облигатные анаэробы. На анаэробном кровяном агаре образуют пигментированные от светло-коричневых до черных колонии. Морфология колоний может быть различной. Например, P . intermedia образует коричневато-черные сухие колонии, а колонии Р. melaninogenica , P . loescheii и P . denticola — коричневатые, гладкие и блестящие, что обусловлено наличием капсулы. Обычно пигмент образуется на 5—14-е сутки культивирования на агаре с кровью кролика. До образования пигмента колонии превотелл могут флюоресцировать ярко-красным цветом при проходящем УФ-облучении.
Биохимическая активность. Проявляют умеренную сахаролитическую активность. Основные продукты ферментации углеводов — сукцинаты и ацетаты. Дифференциальные признаки различных видов представлены в табл. 16.23. Ключевые признаки превотелл — отсутствие способности расти в присутствии 20% желчных солей, Резистентность к кана-мицину (100 мкг) и ванкомицину (5 мкг), но чувствительность к колистину (10 мкг).
Антигенная структура. Мало изучена.
Факторы патогенности. Основной фактор патогенности — эндотоксин, активность которого выше, чем у бактероидов (особенно у P . bivia ). P . melaninogenica и P . intermedia выделяют также фосфолипазу А, нарушающую целостность мембран эпителиальных клеток, что вызывает их гибель.
Экологическая ниша. Колонизируют слизистые полости рта, верхних дыхательных путей, гениталий и кишечника.
Устойчивость в окружающей среде. При попадании на воздух мгновенно погибают.
Чувствительность к антимикробным препа ратам. Резистентны к пенициллинам и цефа-лоспоринам. Препараты выбора — метронида-зол, левомицетин, имипенем и клиндамицин. Чувствительны к действию обычно применяемых антисептиков и дезинфектантов.
16.4.4. Лептотрихии (род Leptotrichia )
Морфология. Прямые или слегка изогнутые
неподвижные грамотрицательные- палочки размером 5+15x1+1,5 мкм с закругленными или заостренными концами. Две или более клетки объединены в септированные нити различной длины. В старых культурах нити длиной до 200 мкм могут переплетаться друг с другом. При лизисе клеток в нити появляются крупные кокковидные тела или луковицеобразные вздутия. Вдоль оси клетки равномерно распределены гранулы.
Культуральные свойства. Анаэробы. Для оптимального роста необходимо 5 % С02. Гетеротрофы со сложными пищевыми потребностями.
Биохимическая активность. Ферментируют глюкозу до кислоты без образования газа; главные продукты — молочная и уксусная кислоты; масляную кислоту не образуют. Не образуют сероводород и аммиак, каталазаот-рицательны. Нитраты не восстанавливают; желатину не разжижают.
Экологическая ниша. — ротовая полость человека.
Устойчивость в окружающей среде. Нагревание при 60 °С в течение 10 мин ведет к гибели клеток.
Чувствительность к антимикробным препара там. Чувствительны к действию обычно применяемых антисептиков и дезинфектантов.
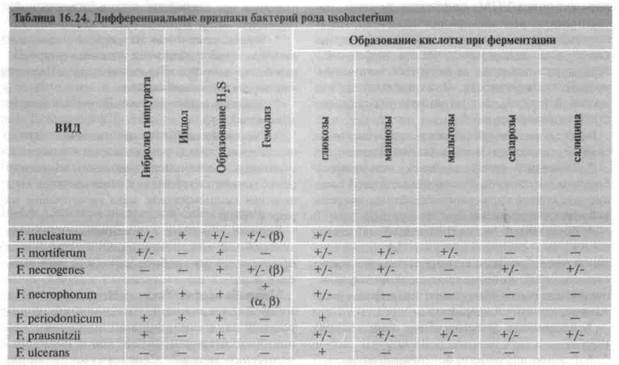
16.4.5. Фузобактерии (род Fusobacterium )
Морфология. Полиморфные, часто вере
тенообразные, неподвижные аспорогенные
палочки. В мазках из клинического матери
ала фузобактерии представлены длинными
тонкими веретенообразными нитевидными
клетками с заостренными концами. Иногда
образуют короткие цепочки из двух (редко
трех) клеток. Некоторые из них могут иметь
эллиптические утолщения.
Культуральные свойства. Облигатные анаэробы. Окисление среды подавляет рост мно-
гих видов. На анаэробном кровяном агаре образуют мелкие (1—2 мм) выпуклые желтоватые колонии, окруженные зоной ос-гемолиза. На жидких средах образуют осадок. Через 48 ч F . necrophorym формирует мелкие колонии палевого цвета без зоны гемолиза, иногда наблюдается зеленое окрашивание прилегающих участков питательной среды после контакта с воздухом.
Биохимическая активность. Хемоорганотрофы. Утилизируют пептон и углеводы, но в целом ферментативная активность низкая (табл. 16.24). Основные продукты метаболизма — масляная (реже молочная) и уксусная кислоты. Обычно катала-заотрицательны. Характерные особенности — образование больших количеств масляной кислоты как конечного продукта метаболизма и индола, что придает культурам гнилостный запах.
Антигенная структура. Мало изучена.
Факторы патогенности. У фузобактерий обнаружены фосфолипаза А, которая облегчает инвазию бактерий в глубокие ткани, и лейко-цидин, который обладает цитотоксическим действием на различные клетки.
Экологическая ниша. Колонизируют слизистые полости рта, верхних дыхательных путей, гениталий и кишечника.
Устойчивость в окружающей среде. При попадании на воздух мгновенно погибают.
Чувствительность к антимикробным препа ратам. По сравнению с бактероидами более чувствительны к антибиотикам, хотя выделены штаммы F . necrophorum , продуцирующие р-лактамазу. Большинство фузобактерий чувствительны к цефокситину, левомицетину, клиндамицину, имипенему и метронидазолу Чувствительны к действию обычно применяемых антисептиков и дезинфектантов.
16.4.6. Селеномонады (род Selenomonas )
Морфология. Клетки — от изогнутых дуг до спиральных палочек, концы которых обычно сужаются и закругляются, что придает клетке форму почки или месяца. Длинные клетки и цепочки клеток имеют спиральную форму. Подвижные, лофотрихи, активно кувыркаются. Встречаются длинные клетки с несколькими пучками жгутиков. Грамотрицательные. Капсулу не образуют. Типовой вид — Selenomonas sputigena.
Культуральные свойства. Строгие анаэробы. Растут на сложных питательных средах, нуждаются в орга-
нических факторах роста. Температурный оптимум роста 35—40 °С, могут расти в диапазоне температур 20-45 °С; оптимум рН 4,4-5,0.
Биохимическая активность. Хемоорганотрофы. Метаболизм бродильного типа. Субстратами служат углеводы, аминокислоты и молочная кислота. При сбраживании глюкозы образуются ацетат, пропионат, С02 и лактат. Каталазу не образуют.
Антигенная структура и факторы патогенности. Изучены недостаточно.
Экологическая ниша. ЖКТ млекопитающих; встречаются также в грязной речной воде.
Устойчивость в окружающей среде. При попадании на воздух мгновенно погибают.
Чувствительность к антимикробным препаратам. Чувствительны к действию обычно применяемых антисептиков и дезинфектантов.
Эпидемиология анаэробной неклостриди-альной инфекции плохо изучена.
Патогенез. Так как неспорообразующие анаэробные бактерии являются преобладающими представителями нормальной микрофлоры организма человека, то и подавляющее большинство анаэробных инфекций (до 90 %) носит эндогенный характер. При снижении резистентности организма анаэробы нормальной микрофлоры транслоцируются через тканевые барьеры, в норме для них непреодолимые, и вызывают гнойно-септический процесс. К патологическим состояниям, способствующим развитию анаэробной инфекции, относят: сахарный диабет, терапию кортикостероидными гормонами и цитостатиками, иммунодепрессантами, лейкопению, гипогаммаглобулинемию, спле-нэктомию, коллагеновые заболевания, гипоксию тканей, повреждение и некроз тканей, сопутствующую аэробную инфекцию, инородные тела, отложение солей кальция и расстройства периферического кровообращения. Плохое кровоснабжение и некроз тканей снижают их окислительно-восстановительный потенциал, что способствует бурному размножению анаэробов. В ряде случаев, например, при аспирационной пневмонии анаэробы из полости рта и верхних дыхательных путей могут быть занесены в легкие, в норме свободные от этих микробов, колонизировать их и вызывать гнойно-воспалительный процесс.
Иммунитет. Изучен недостаточно; в любом случае он нестойкий и непродолжительный.
Клиника. Облигатные анаэробные бактерии, как и все УПМ, не обладают органным тропизмом, поэтому клиническая картина анаэробной неклостридиальной инфекции, как и всех оппортунистических инфекций, весьма разнообразна и не имеет нозологической специфичности. Она определяется не видом бактерий, а состоянием иммунного статуса организма.
Наиболее частыми клиническими признаками анаэробной неклостридиальной инфекции являются:
• Зловонный запах гнойного отделяемого. Большинство облигатных анаэробных бактерий продуцирует летучие жирные кислоты, обладающие резким неприятным запахом.
• Локализация воспалительного очага около поврежденной слизистой оболочки. Нарушение при травме или оперативном вмешательстве целостности слизистых оболочек может привести к контаминации подлежащих тканей облигатными анаэробными бактериями нормальной микрофлоры.
• Локализация воспалительного очага в месте укуса.
• Развитие инфекции на фоне лечения аминогли-козидными антибиотиками. Ряд анаэробов (бактеро-
иды) обладает природной устойчивостью к аминогли-козидным антибиотикам.
• Образование газа в тканях, который может наблюдаться при целлюлитах, вызванных пептостреп-тококками.
• Черное окрашивание экссудата, обусловленное наличием среди возбудителей темнопигментирован-ных бактероидов. Эти микробы продуцируют черный или темно-коричневый пигмент.
• Затяжное, вялое, часто субклиническое течение заболевания.
• Обширные некротические изменения тканей, несоответствие между выраженностью клинических симптомов и объемом деструктивных изменений (преобладание деструктивных изменений над клинической симптоматикой), мало кровоточащие на разрезе ткани.
Главное значение в постановке диагноза анаэробной неклостридиальной инфекции приобретает микробиологическая диагностика.
Микробиологическая диагностика. Для микробиологической диагностики анаэробной неклостридиальной инфекции используют бактериоскопический и бактерио-логичесиий методы. Серологический метод имеет ограниченное практическое примене-
|
|
|
|
ние из-за отсутствия коммерческих наборов диагностикумов. Для экспресс-диагностики применяется ГЖХ.
Бактериоскопический метод при диагностике анаэробной неклостридиальной инфекции имеет незначительную информативность, поскольку анаэробы морфологически не отличаются от аэробных микробов, кроме редких случаев, когда анаэробы имеют характерную морфологию, как, например, Fusobacterium nucleatum .
Поскольку облигатные анаэробные бактерии высокочувствительны к токсическому действию кислорода воздуха, для работы с ними необходимо использовать анаэробную микробиологическую технику исследования. Для транспортировки образцов, предназначенных для исследования на облигатные анаэробные бактерии, используют флаконы с транспортными средами, создающие анаэробные условия при транспортировке.
Бактериологическое исследование на облигатные анаэробные бактерии длительно, дорого и трудоемко. Окончательный ответ получают через 7—10 дней с момента забора патологического материала. Посев производят на кровяные среды, обогащенные факторами роста (гемин, менадион, редуцирующие добавки). Посевы инкубируют в анаэробных условиях в анаэростатах или перчаточных боксах. Идентификацию выделенных чистых культур проводят на основании изучения культуральных, морфологических и тинк-ториальных свойств и ферментативной активности. Антигенные свойства облигатных анаэробных бактерий изучают редко из-за отсутствия коммерческих наборов диагностических сывороток. Для создания анаэробиоза в анаэростате сначала из последнего откачивают воздух, а затем заполняют бескислородной газовой смесью или используют химическое связывание свободного кислорода. Для контроля анаэробиоза в процессе инкубации посевов используют индикаторы анаэробиоза — резазурин или метиленовую синь. Для выявления в исследуемом материале темнопигментированных бактероидов, превотелл, порфиромонад пробу исследуют в лучах длинноволнового ультрафиолетово-
го света. При наличии указанных микробов микроколонии или весь материал светятся красным светом.
Идентификацию облигатных анаэробных бактерий проводят в два этапа. На первом этапе ориентировочно определяют родовую принадлежность изолированных культур (табл. 16.25). На втором этапе проводят окончательную идентификацию до вида по биохимическим тестам, антигенным свойствам и по изучению конечных продуктов бактериального метаболизма в среде культивирования с помощью метода ГЖХ. При наличии в первичном посеве культур медленно растущих облигатных анаэробных бактерий, а также при выявлении в жидкой среде видов анаэробов, не выросших в первичном посеве на плотной среде, время получения окончательного развернутого ответа затягивается на 2—3 суток.
Анаэродиски с антибиотиками и бриллиантовым зеленым: зона задержки роста > 12 мм — чувствительны, зона задержки роста < 12 мм — устойчивы.
Газовая хроматография. Для экспресс-диагностики анаэробной инфекции применяют метод ГЖХ, основанный на хроматографи-ческом определении в материале от больных специфических продуктов метаболизма облигатных анаэробных бактерий — летучих жирных кислот, которые служат метаболическими маркерами возбудителя в исследуемом материале.
Высокоспецифичными конечными продуктами метаболизма углеводов у облигатных анаэробных бактерий являются жирные кислоты: короткоцепочечные или летучие жирные кислоты С2—С7 и длинноцепочеч-ные — нелетучие. Определение в исследуемом материале наличия жирных кислот с помощью ГЖХ является убедительным доказательством анаэробной этиологии воспалительного процесса. Технически проще определять ГЖХ летучие жирные кислоты; при этом метаболическими маркерами облигатных анаэробных бактерий являются изомасляная и масляная, изовалериановая и валериановая, изокапроновая и капроновая, гексановая и каприловая кислоты. Аэробные бактерии летучие жирные кислоты не проду-
цируют. Обнаружение в исследуемом материале одной или нескольких летучих жирных кислот, особенно изокислот с разветвленной углеродной цепочкой, является убедительным доказательством наличия облигатных анаэробных бактерий. Для более подробной информации о метаболической активности присутствующих в исследуемом материале микробов определяют длинноцепочечные жирные кислоты. Важное значение при индикации облигатных анаэробных бактерий в патологическом материале приобретают ложноположительные и ложноотрицательные результаты ГЖХ-анализа. Причины ложных результатов ГЖХ-анализа при исследовании на анаэробы представлены в табл. 15.2.
Лечение. Препаратами выбора для лечения анаэробной неклостридиальной инфекции
являются химиопрепараты нитроимидазоль-ного ряда: метронидазол, тинидазол, орни-дазол и другие, и антибиотик клиндамицин. Препараты резерва — производные нитро-ниазолов (ниридазол и др.), которые превосходят по своей активности метронидазол и тинидазол в 100—200 раз.
Основными направлениями в лечении анаэробной неклостридиальной инфекции являются: создание в организме больного условий, делающих размножение возбудителей невозможным (дренирование гнойников, удаление мертвых тканей, антибактериальная химиотерапия, гепарин, повторные ревизии раны); предотвращение внедрения бактерий в здоровые ткани; обезвреживание и выделение токсинов возбудителей (инфу-зионная терапия, гепарин, экстракорпораль-
ная дезинтоксикация); создание в организме больного условий, способствующих борьбе с возбудителем (гемотрансфузии, улучшение микроциркуляции и оксигенации очагов, коррекция системных и органных нарушений, иммуностимуляция).
Профилактика. Специфическая профилактика не разработана. Не специфическая профилактика заключается в назначении при плановых операциях на органах брюшной полости и малого таза, за 24 ч до операции, 100 мл раствора метронидазола или другого нитроимидазольного препарата внутривенно, в своевременной обработке ран и выявлении гнойно-воспалительных очагов.
Дата: 2019-02-19, просмотров: 399.