Асептика – комплекс мер, направленных на предупреждение попадания возбудителя инфекции в рану, органы больного при операциях, лечебных и диагностических процедурах. Методы асептики применяют для борьбы с экзогенной инфекцией, источниками которой являются больные и бактерионосители.
Антисептика – совокупность мер, направленных на уничтожение микробов в ране, патологическом очаге или организме в целом, на предупреждение или ликвидацию воспалительного процесса.
Дезинфекция— процедура, предусматривающая обработку загрязненного микробами предмета с целью их уничтожения до такой степени, чтобы они не смогли вызвать инфекцию при использовании данного предмета. Как правило, при дезинфекции погибает большая часть микробов (в том числе все патогенные), однако споры и некоторые резистентные вирусы могут остаться в жизнеспособном состоянии.
Методы дезинфекции. Различают три основных методы: тепловой, химический и УФ-облучение. Выбора того или иного метода также зависит от дезинфецирующего материала.
Тепловая дезинфекция. Очень эффективным является действие горячей воды и насыщенного пара. Температура в 100 ˚С в течение 5 минут убивает все вегетативные формы бактерий и все вирусы.
погибают все вегетативные формы бактерий и большинство вирусов. Температура 100 °С в течение 5 мин убивает все вегетативные формы бактерий и все вирусы.
Добавление соды в воду имеет дополнительные преимущества: сода растворяет белки и жиры, которые могут находиться на поверхности предмета, предупреждает коррозию инструментов и оседание на них кальция. Подобным образом можно обрабатывать инструменты, иглы, шприцы и т. д.
Для дезинфекции применяют также сухое тепло, например, прокаливание.
Тепловая дезинфекция — это единственный метод, который не вызывает загрязнения окружающей среды; кроме того, он является наиболее эффективным и дешевым.
Разновидностью тепловой дезинфекции является пастеризация — метод, созданный Л. Пастером и применяемый для обработки в основном молока, а также соков, вина и пива. При используемом обычно режиме — 60-;70 °С в течение 20—30 мин — погибает большинство вегетативных форм бактерий (особенно важно уничтожение бруцелл и Mycobacterium bovis, которые могут находиться в молоке), но сохраняется часть энтерококков, молочнокислых бактерий и споры. Поэтому пастеризованное молоко помещают на холод для предотвращения и прорастания спор и размножения бактерий.
Химическая дезинфекцияпроводится с помощью различных дезинфицирующих веществ. Дезинфектанты действуют, например, растворяя липиды клеточных оболочек (детергенты) или разрушая белки и нуклеиновые кислоты (денатураты, оксиданты). Активность каждого из дезинфектантов неодинакова для различных микроорганизмов и зависит от температуры, рН и прочих условий.
В качестве контрольных микроорганизмов для изучения действия дезинфектантов используют S. typhi и S. aureus.
Обеззараживанию с помощью данного метода подлежат, например, поверхность операционного стола, стены процедурного кабинета, кожа, некоторые инструменты — все то, что невозможно обработать теплом. Еще одним примером химической дезинфекции является хлорирование воды.
Использование большинства дезинфицирующих веществ опасно для медперсонала, они загрязняют окружающую среду, многие из них дорогостоящи.
Ультрафиолетовое облучениепроизводится с помощью специальных бактерицидных ламп (настенных, потолочных, передвижных и др.) для обеззараживания воздуха, различных поверхностей в операционных, перевязочных, микробиологических лабораториях, предприятиях пищевой промышленности и т. д. Действие ультрафиолетовых лучей приводит к разрушению ДНК микробов в результате образования тиминовых димеров.
Очень незначительна роль механической дезинфекции: проветривания, вентиляции, обработки пылесосом и т. п
19. Определение понятия «антибиотики». Классификация антибиотиков по источнику получения, химическому составу, механизму действия, антимикробному спектру. Единицы измерения активности антибиотиков. Медицинские требования к антибиотикам
Антибиотики — химиотерапевтические вещества, продуцируемые микроорганизмами, животными клетками, растениями, а также их производные и синтетические продукты, которые обладают избирательной способностью угнетать и задерживать рост микроорганизмов, а также подавлять развитие злокачественных новообразований.
В основу главной классификации антибиотиков положено их химическое строение.
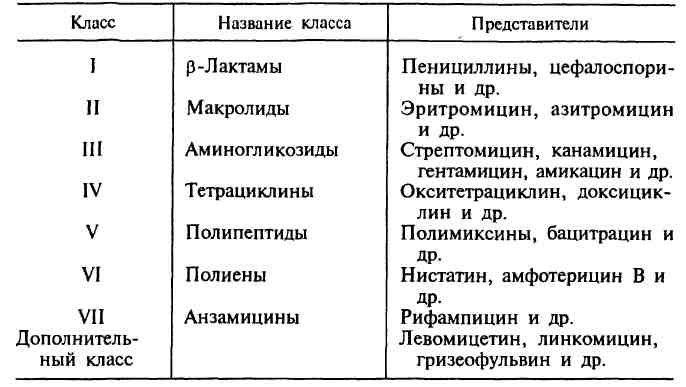
По спектру действия антибиотики делят на пять групп в зависимости от того, на какие микроорганизмы они оказывают воздействие. Кроме того, существуют противоопухолевые антибиотики, продуцентами которых также являются актиномицеты. Каждая из этих групп включает две подгруппы: антибиотики широкого и узкого спектра действия.
Антибактериальные антибиотики составляют самую многочисленную группу препаратов. Преобладают в ней антибиотики широкого спектра действия, оказывающие влияние на представителей всех трех отделов бактерий. К антибиотикам широкого спектра действия относятся аминогликозиды, тетрациклины и др. Антибиотики узкого спектра действия эффективны в отношении небольшого круга бактерий.
В отдельные группы выделяют противотуберкулезные, противолепрозные, противосифилитические препараты.
Противогрибковые антибиотики включают значительно меньшее число препаратов. Широким спектром действия обладает, например, амфотерицин В, эффективный при кандидозах; в то же время нистатин, действующий на грибы рода Candida, является антибиотиком узкого спектра действия.
Антипротозойные и антивирусные антибиотики насчитывают небольшое число препаратов.
Противоопухолевые антибиотики представлены препаратами, обладающими цитотоксическим действием.
Действие антибиотиков на микроорганизмы связано с их способностью подавлять те или иные биохимические реакции, происходящие в микробной клетке.
В зависимости от механизма действия различают пять групп антибиотиков:
1. АБ, нарушающие синтез клеточной стенки. β-лактамы. Препараты этой группы характеризуются самой высокой избирательностью действия: они убивают бактерии и не оказывают влияния на клетки макроорганизма, так как последние не имеют главного компонента клеточной стенки бактерий — пептидогликана. В связи с этим β-лактамные антибиотики являются наименее токсичными для макроорганизма;
2. АБ, нарушающие синтез клеточных мембран. Полимиксины, полиены;
3. АБ, нарушающие синтез белка; Аминогликозиды, тетрациклины, макролиды, левомицетин.
4. АБ — ингибиторы синтеза нуклеиновых кислот. Хинолоны нарушают синтез ДНК, рифампицин — синтез РНК;
5. АБ, подавляющие синтез пуринов и аминокислот. Сульфаниламиды.
Источники антибиотиков.
Основными продуцентами природных антибиотиков являются микроорганизмы, которые, находясь в своей естественной среде (в основном, в почве), синтезируют антибиотики в качестве средства выживания в борьбе за существование. Животные и растительные клетки также могут вырабатывать некоторые вещества с селективным антимикробным действием, однако широкого применения в медицине в качестве продуцентов антибиотиков они не получили.
Способы получения.
• биологический синтез (так получают природные антибиотики — натуральные продукты ферментации, когда в оптимальных условиях культивируют микробы-продуценты, которые выделяют антибиотики в процессе своей жизнедеятельности);
• биосинтез с последующими химическими модификациями (так создают полусинтетические антибиотики). Сначала путем биосинтеза получают природный антибиотик, а затем его первоначальную молекулу видоизменяют путем химических модификаций.
• химический синтез (так получают синтетические аналоги природных антибиотиков).
20. Лекарственная устойчивость микроорганизмов. Определение понятия, виды и механизмы её формирования, роль плазмид. Пути преодоления лекарственной устойчивости микроорганизмов.
Антибиотикорезистентность — это устойчивость микробов к антимикробным химиопрепаратам. Природная устойчивость. Некоторые виды микробов природно устойчивы к определенным семействам антибиотиков или в результате отсутствия соответствующей мишени (например, микоплазмы не имеют клеточной стенки, поэтому не чувствительны ко всем препаратам, действующим на этом уровне), или в результате бактериальной непроницаемости для данного препарата (например, грамотрицательные микробы менее проницаемы для крупномолекулярных соединений, чем грамположительные бактерии, так как их наружная мембрана имеет «маленькие» поры). Приобретенная устойчивость. Приобретение резистентности — это биологическая закономерность, связанная с адаптацией микроорганизмов к условиям внешней среды. Проблема формирования и распространения лекарственной резистентности микробов особенно значима для внутрибольничных инфекций, вызываемых так называемыми «госпитальными штаммами», у которых, как правило, наблюдается множественная устойчивость к антибиотикам.
Генетические основы приобретенной резистентности. Устойчивость к антибиотикам определяется и поддерживается генами резистентности (r-генами) и условиями, способствующими их распространению в микробных популяциях. Приобретенная лекарственная устойчивость может возникать и распространяться в популяции бактерий в результате:
• мутаций в хромосоме бактериальной клетки с последующей селекцией мутантов. Особенно легко селекция происходит в присутствии антибиотиков, так как в этих условиях мутанты получают преимущество перед остальными клетками популяции, которые чувствительны к препарату. Мутации возникают независимо от применения антибиотика, т. е. сам препарат не влияет на частоту мутаций и не является их причиной, но служит фактором отбора. Далее резистентные клетки дают потомство и могут передаваться в организм следующего хозяина, формируя и распространяя резистентные штаммы. Мутации могут быть: 1)единичные и 2) множественные.
• переноса трансмиссивных плазмид резистентности (R-плазмид). Плазмиды резистентности обычно кодируют перекрестную устойчивость к нескольким семействам антибиотиков. Некоторые плазмиды могут передаваться между бактериями разных видов, поэтому один и тот же ген резистентности можно встретить у бактерий, таксономически далеких друг от друга.
• переноса транспозонов, несущих r-гены (или мигрирующих генетических последовательностей). Транспозоны могут мигрировать с хромосомы на плазмиду и обратно, а также с плазмиды на другую плазмиду. Таким образом гены резистентности могут передаваться далее дочерним клеткам или при рекомбинации другим бактериям-реципиентам.
Реализация приобретенной устойчивости. Изменения в геноме бактерий приводят к тому, что меняются и некоторые свойства бактериальной клетки, в результате чего она становится устойчивой к антибактериальным препаратам. Реализация приобретенной лекарственной устойчивости возможна на каждом из следующих этапов:
• модификация мишени. Фермент-мишень может быть так изменен, что его функции не нарушаются, но способность связываться с химиопрепаратом (аффинность) резко снижается или может быть включен «обходной путь» метаболизма, т. е. в клетке активируется другой фермент, который не подвержен действию данного препарата.
• «недоступность» мишени за счет снижения проницаемости клеточной стенки и клеточных мембран или «эффлюко-механизма, когда клетка как бы «выталкивает» из себя антибиотик.
• инактивация препарата бактериальными ферментами. Некоторые бактерии способны продуцировать особые ферменты, которые делают препараты неактивными (например, бета-лактамазы, аминогликозид-модифицирующие ферменты). Бета-лактамазы — это ферменты, разрушающие бета-лактамное кольцо с образованием неактивных соединений. Гены, кодирующие эти ферменты, широко распространены среди бактерий и могут быть как в составе хромосомы, так и в составе плазмиды.
Для борьбы с инактивирующим действием бета-лактамаз используют вещества — ингибиторы. Эти вещества содержат в своем составе бета-лактамное кольцо и способны связываться с бета-лактамазами, предотвращая их разрушительное действие на бета-лактамы. При этом собственная антибактериальная активность таких ингибиторов низкая.
Предупредить развитие антибиотикорезистентности у бактерий практически невозможно, но необходимо использовать антимикробные препараты таким образом, чтобы не способствовать развитию и распространению устойчивости (в частности, применять антибиотики строго по показаниям, избегать их использования с профилактической целью, через 10—15 дней ан-тибиотикотерапии менять препарат, по возможности использовать препараты узкого спектра действия, ограниченно применять антибиотики в ветеринарии и не использовать их как фактор роста).
1. Создание новых препаратов, активных в отношении антибиотико-устойчивых микроорганизмов. Путем трансформации были синтезированы полусинтетические пенициллины и цефалоспорины, нечувствительные к действию бета-лактамаз: метициллин, оксациллин. Практически любая молекула антибиотика может инактивироваться в микробной клетке за счет определенного механизма резистентности, поэтому спустя некоторое время после начала использования нового препарата отмечают распространение детерминант резистентности к этому соединению в плазмидах и транспозонах. В связи с этим эффективность каждого антибиотика начинает уменьшаться, что обусловливает необходимость синтеза все новых антимикробных препаратов.
2. Использование соединений, подавляющих определенные механизмы резистентности в бактериальной клетке. Наибольшие успехи в этом направлении достигнуты в результате применения неконкурентных ингибиторов бета-лактамаз, первый представитель — клавулановая кислота. Она обладает слабой антибактериальной активностью, и как антибактериальный препарат ее не используют.
3. Использование фосфогликолипидпых антибиотиков. Препараты этой группы взаимодействуют с половыми пилями микроорганизмов, в связи с чем в первую очередь подавляют R+-клетки, несущие детерминанты резистентности.
4. Использование соединений, обеспечивающих элиминацию плазмид из резистентных бактерий и действующих на детерминанты лекарственной устойчивости. Одним из способов, ведущих к элиминации плазмид из микробной клетки, стало применение ДНК-тропных веществ. Помимо непосредственного влияния на R-факторы, ДНК-тропные соединения за счет снижения мутаций замедляют развитие резистентности микроорганизмов к антимикробным препаратам.
5. Использование соединений, эффективно подавляющих процессы переноса детерминанты устойчивости при конъюгации бактерий. Наиболее интенсивно на этот процесс воздействуют рифампицин, кофеин, неомицин и нитрофураны. Нарушение трансдукции химиотерапевтическими веществами, подавляющими перенос фагами детерминант устойчивости к лекарственным веществам, может ограничивать распространение устойчивых штаммов.
Повышение эффективности химиотерапии за счет использования комбинаций различных антимикробных препаратов. Так, быстрого приобретения устойчивости золотистого стафилококка к новобиоцину удается избежать благодаря его применению с тетрациклином.
21. Методы определения чувствительности бактерий к антибиотикам.
1. Метод диффузии в агар. Определение чувствительности бактерий к антибиотикам методом дисков. Исследуемую бактериальную культуру засевают газоном на питательный агар в чашке Петри. На засеянную поверхность пинцетом помещают на одинаковом расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37 °С до следующего дня. По диаметру зон задержки роста исследуемой культуры бактерий судят о ее чувствительности к антибиотикам. Метод дисков не дает надежных данных при определении чувствительности микроорганизмов к плохо диффундирующим в агар полипептидным антибиотикам. Если эти антибиотики предполагается использовать для лечения, рекомендуется определять чувствительность микроорганизмов методом серийных разведений.
2. Методы определения минимальных бактерицидных концентраций, т. е. минимального уровня антибиотика, который позволяет in vitro предотвратить видимый рост микробов в питательной среде или полностью ее стерилизует. Это количественные методы, которые позволяют рассчитать дозу препарата, так как концентрация антибиотика в крови должна быть значительно выше минимальной ингибирующей концентрации для возбудителя инфекции. Введение адекватных доз препарата необходимо для эффективного лечения и профилактики формирования устойчивых микробов.
Определение чувствительности бактерий к антибиотикам методом серийных разведений. Вначале готовят основной раствор, содержащий определенную концентрацию антибиотика в специальном растворителе. Из него готовят все последующие разведения в бульоне, после чего к каждому разведению добавляют 0,1 мл исследуемой бактериальной суспензии. В последнюю пробирку вносят 1 мл бульона и 0,1 мл суспензии бактерий (контроль культуры). Посевы инкубируют при 37 °С до следующего дня, после чего отмечают результаты опыта по помутнению питательной среды, сравнивая с контролем культуры. Последняя пробирка с прозрачной питательной средой указывает на задержку роста исследуемой культуры бактерий под влиянием содержащейся в ней минимальной ингибирующей концентрации (МИК) антибиотика.
Ускоренные способы, с применением автоматических анализаторов.
Дата: 2019-02-19, просмотров: 503.