Скорость химической реакции. Закон действия масс. Константа скорости. Порядок реакции. Молекулярность реакции. Кинетические уравнения реакций I и II порядков.
Активные молекулы. Энергия активации. Зависимость скорости реакции от температуры. Период полупревращения вещества. Сорбция. Теория Ленгмюра. Цепные реакции. Катализ. Влияние катализатора на энергию активации реакции.
Скорость химической реакции в данный момент времени выражается производной концентрации по времени.
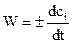
Зависимость скорости реакции от концентраций реагирующих веществ выражается законом действия масс: скорость реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ, в степенях равных их стехиометрическим коэффициентам.
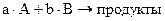
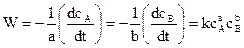
k – удельная скорость.
Для сложной реакции кинетическое уравнение записывается в виде:
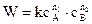
n1 и n2 - частные порядки реакции. Общий порядок 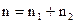
Зависимость скорости реакции от температуры выражается уравнением Аррениуса?
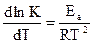
Еа – энергия активации.
Для вычисления Еа необходимо знать значения двух констант скорости при двух различных температурах.
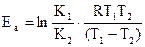
Кинетическое уравнение реакции первого порядка:
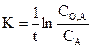
Период полупревращения не зависит от начальной концентрации вещества.
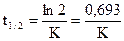
Кинетическое уравнение реакции второго порядка при равных начальных концентрациях реагентов.
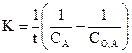
Период полупревращения вещества:
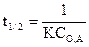
Энергия активации Еа каталитической реакции ниже Еа для той же реакции в отсутствии катализатора. Снижение Еа объясняется тем, что каталитическая реакция протекает по новому механизму, который складывается из элементарных реакций с меньшими энергиями активации, чем некаталитическая реакция.
Скорость реакции с участием катализатора может быть изменена осуществлением под действием катализатора цепного механизма реакции.
Раздел 2. Основы коллоидной химии
Тема 2.1. Дисперсные системы
Студент должен знать и уметь: отличать дисперсные системы от истинных растворов; классификацию дисперсных систем; особенности дисперсных систем и способы их получения; свойства дисперсных систем; строение и заряд коллоидной частицы; ПАВ.
ПАВ – вещества, накапливающиеся в поверхностном слое, на границе раздела фаз. Молекулы ПАВ имеют определенное строение – содержат функциональную группу ( 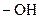 ,
, 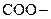 ,
, 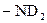 ,
, 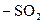 и др.) и углеводородный радикал. ПАВ понижают поверхностное натяжение на границе раздела фаз, наблюдается положительная адсорбция.
и др.) и углеводородный радикал. ПАВ понижают поверхностное натяжение на границе раздела фаз, наблюдается положительная адсорбция.
Тема 2.2. Растворы ВМС
Общая характеристика и особенности растворов ВМС
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Каковы роль и место физической и коллоидной химии среди других наук? Возникновение и развитие науки.
2. Сформулируйте основные положения молекулярно-кинетической теории газов.
3. Чем отличается движение молекул в газе от движения их в жидкости?
4. Каков физический смысл и численное значение газовой постоянной?
5. Дайте формулировки и приведите математические выражения газовых законов.
6. Каковы причины отклонений свойств реальных газов от законов идеальных газов? Уравнением состояния реального газа Ван-дер-Ваальса.
7. Какой пар называют насыщенным паром? Давление насыщенного пара.
8. Парциальное давление газа. Сформулируйте закон Дальтона.
9. Вязкость жидкостей. Каковы виды вязкости?
10. Поверхностное натяжение. Каков физический смысл поверхностного натяжения? Методы определения.
11. Сформулируйте I закон термодинамики и приведите его математическое выражение.
12. Рассмотрите применение I закона термодинамики к различным термодинамическим процессам.
13. Что такое энтальпия?
14. Теплоемкость веществ. Виды теплоемкости. Какова связь изобарной и изохорной теплоемкостей газов?
15. Закон Гесса. При каких условиях он выполняется?
16. Что называют энтальпией образования сложного вещества? Приведите примеры.
17. Что называют энтальпией сгорания вещества. Приведите примеры.
18. Тепловой эффект химической реакции. Каковы способы его определения?
19. Термохимическое уравнение реакции, особенности. Приведите пример.
20. II закон термодинамики. Какова его физическая сущность?
21. Как определить работу расширения идеального газа в различных процессах (P, V, T, Q – const)?
22. КПД цикла Карно. Сформулируйте теорему Карно-Клаузиуса.
23. Энтропия. Каков ее физический смысл и значение?
24. Рассмотрите энтропию как критерий направленности самопроизвольного процесса.
25. Дайте определение термина «свободная энергия системы». Изобарно-изотермический и изохорно-изотермический потенциалы.
26. Принцип минимума свободной энергии системы. Каков предел протекания самопроизвольного процесса в изолированной системе?
27. Дайте определение следующих понятий: «фаза», «компонент», «вариантность».
28. Правило фаз Гиббса. Дайте современную интерпретацию.
29. Рассмотрите фазовую диаграмму состояния однокомпонентной системы на примере воды.
30. Проведите анализ диаграммы состояния двухкомпонентной системы на примере бинарного сплава.
31. Кривые охлаждения. Термический анализ.
32. Рассмотрите применение уравнения Клаузиуса-Клапейрона и различным равновесным состояниям при фазовых переходах.
33. Обратимые реакции. Сформулируйте общие условия химического равновесия в гомогенных реакциях.
34. Сформулируйте закон равновесия.
35. Константа равновесия, различные формы записи. Какова связь между ними?
36. Положение равновесия. Какие факторы влияют на положение равновесия? Принцип Ле-Шателье.
37. Химическое сродство. Приведите уравнение изотермы химической реакции.
38. Стандартная энергия Гиббса и Гельмгольца.
39. Определение состава равновесной смеси.
40. Определение оптимальных условий проведения химического процесса.
41. Дайте определение понятий «раствор», «насыщенный раствор», «компонент раствора», «растворимость».
42. Сформулируйте закон Рауля.
43. Какими способами можно выразить состав раствора?
44. Осмотическое давление растворов. Закон Вант-Гоффа. Что такое «изотопический коэффициент».
45. Каковы закономерности понижения температуры кристаллизации растворителя в разбавленном растворе? Криоскопия и эбулиоскопия.
46. Закон распределения вещества между двумя несмешивающимися жидкостями. Рассмотрите его применение для расчетов экстракционных процессов.
47. Растворимость газов в жидкостях. От каких факторов зависит? Закон Генри.
48. Рассмотрите диаграммы состояния равновесия жидкость – пар в двойной системе.
49. Неидеальные растворы. Каковы причины отклонений от закона Рауля?
50. Что такое азеотропные смеси?
51. Сформулируйте законы Коновалова.
52. Каковы физико-химические закономерности ректификации жидких смесей?
53. Химическая кинетика. Что она изучает?
54. Дайте определение понятий «скорость процесса», «средняя скорость», «истинная скорость», «начальная скорость».
55. Сформулируйте закон действия масс.
56. Константа скорости реакции. Каков ее физический смысл и размерность?
57. Молекулярность реакции. Порядок реакции. Дайте классификацию реакций по порядку и молекулярности.
58. Выведите кинетические уравнение реакций I и II порядков.
59. Период полупревращения вещества. Как он зависит от начальных концентраций реагентов в реакциях различных порядков.
60. Как зависит скорость химической реакции от температуры? Правило Вант-Гоффа. Уравнение Аррениуса.
61. Активные молекулы. Что называют энергией активации?
62. Каковы особенности цепных реакций?
63. Что называют катализатором? Катализ, виды катализа. Ингибиторы.
64. Какое влияние оказывает катализатор на энергию активации химической реакции?
65. Каковы особенности процесса сорбции? Влияние на него различных факторов.
66. Сформулируйте основные положения теории Ленгмюра. Изотерма адсобрции.
67. Дисперсные системы. Дайте классификацию дисперсных систем по агрегатному состоянию.
68. Каковы особенности дисперсных систем? Способы их получения.
69. Что называют ПАВ?
70. Каковы строение и заряд коллоидной частицы?
ЗАДАЧИ
1. Приведите к н.у. газ, который при 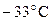 и
и 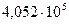 Па занимает объем 12 м3.
Па занимает объем 12 м3.
2. При н.у. объем газа равен 100 м3. До какой температуры нужно нагреть газ, чтобы при 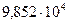 Па объем его стал равен 122 м3.
Па объем его стал равен 122 м3.
3. Плотность газообразного хлора при н.у. 3,124 кг/м3. Вычислите плотность хлора при 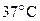 и том же давлении.
и том же давлении.
4. При 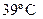 и 98740 Па масса 640 см3 равна 1,73 г. Вычислите молекулярную массу (кг) и плотность при
и 98740 Па масса 640 см3 равна 1,73 г. Вычислите молекулярную массу (кг) и плотность при 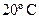 .
.
5. Стальной баллон наполнили азотом при давлении 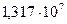 Па и
Па и 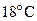 . При какой температуре давления азота достигнет рабочего давления
. При какой температуре давления азота достигнет рабочего давления 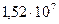 Па.
Па.
6. Сосуд объемом 7 л содержит 0,4 г водорода, 3,15 г азота при 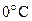 . Определите парциальные давления газов и общее давление газовой смеси.
. Определите парциальные давления газов и общее давление газовой смеси.
7. Определите изменение внутренней энергии при испарении 90 г воды при температуре ее кипения. Скрытая теплота парообразования воды 40714,2 кДж/моль, удельный объем водяного пара 1,699 л/г. Давление нормальное, объемом жидкости пренебречь.
8. Какую работу могут совершить 12 кг водорода при увеличении температуры на 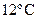 при постоянном давлении.
при постоянном давлении.
9. При изотермическом процессе к азоту, занимающему объем 500 л и находящемуся под давлением 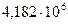 Па, подводится 2514 кДж теплоты. Определите объем и давление к концу процесса.
Па, подводится 2514 кДж теплоты. Определите объем и давление к концу процесса.
10. Определите теплоту сгорания спирта 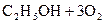

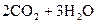 (ж) исходя из следующих данных:
(ж) исходя из следующих данных:
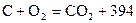 к Дж/моль
к Дж/моль
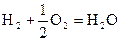 (ж) + 285 к Дж/моль
(ж) + 285 к Дж/моль
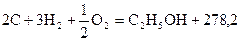 к Дж/моль
к Дж/моль
11. Определите теплоту образования сероуглерода 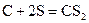 , используя следующие термохимические уравнения:
, используя следующие термохимические уравнения:
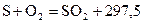 кДж/моль
кДж/моль
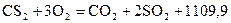 кДж/моль
кДж/моль
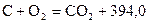 кДж/моль
кДж/моль
12. Тепловой эффект реакции 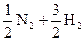

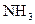 при постоянном давлении составляет 46,3 кДж/моль. Определите тепловой эффект при V = const Т = 298 К.
при постоянном давлении составляет 46,3 кДж/моль. Определите тепловой эффект при V = const Т = 298 К.
13-22. Вычислите тепловые эффекты при стандартных условиях, используя справочные данные следующих реакций:
13. 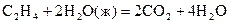
14. 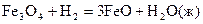
15. 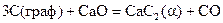
16. 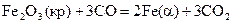
17. 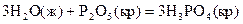
18. 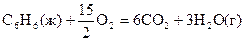
19. 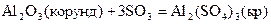
20. 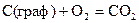
21. 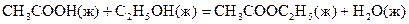
22. 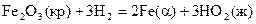
23. Вычислите массовую теплоемкость сплава состава (мас.%) Bi 50,7; Pb 25,0; Cd 10,1; Sn 14,2 если Ср 298 ( 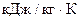 ) Bi 0,122; Pb 0,129; Cd 0,231; Sn 0,221.
) Bi 0,122; Pb 0,129; Cd 0,231; Sn 0,221.
24. Рассчитайте КПД идеальной машины Карно, получающей пар при 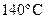 и выпускающей его при 105ºС.
и выпускающей его при 105ºС.
25. При охлаждении 42 г азота от 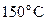 до
до 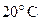 давление повышается от
давление повышается от 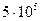 до
до 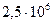 Па. Определите изменение энтропии в данном процессе, если
Па. Определите изменение энтропии в данном процессе, если 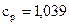
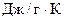 .
.
26-28. Вычислите изменение энтропии при стандартных условиях для реакций:
26. 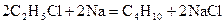
27. 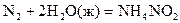
28. 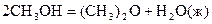
29-30. Определите число степеней свободы для следующих систем:
29. S (ромб)  S (мон.)
S (мон.)  S (пар)
S (пар)
30. S (ж)  S (пар)
S (пар)
31-34. Рассчитайте состав равновесной смеси в идеально-газовой реакции при Т = 298 К и Р = 1 атм. В переходном состоянии вещества взяты в эквимолярных количествах.
31. 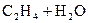

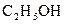
32. 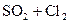

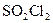
33. 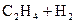

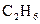
34. 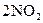

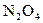
35-37. Вычислите константу равновесия идеальной газовой химической реакции при 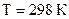 , воспользовавшись таблицами стандартных термодинамических величин.
, воспользовавшись таблицами стандартных термодинамических величин.
35. 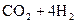

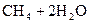
36. 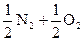

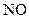
37. 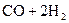

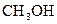
38-39. В какую сторону сместится равновесие реакций а) при понижении температуры; б) при понижении давления.
38. 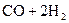

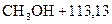 кДж
кДж
39. 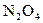

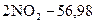 кДж
кДж
40. Для реакции 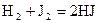 , протекающей при
, протекающей при 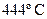 Кс = 50. Определите направление реакции, если начальные концентрации реагентов равны
Кс = 50. Определите направление реакции, если начальные концентрации реагентов равны 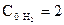 ,
, 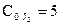 ,
, 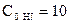 моль/л.
моль/л.
41. Осмотическое давление раствора неэлектролита при 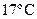 равно
равно 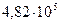 Па. Определите осмотическое давление при
Па. Определите осмотическое давление при 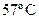 .
.
42. Растворимость кислорода в воде при давлении 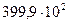 н/м2 и Т = 298 К равна
н/м2 и Т = 298 К равна 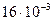 кг/м3. Определите коэффициент Генри.
кг/м3. Определите коэффициент Генри.
43. Коэффициент распределения йода между амиловым спиртом и водой равен 230. Встряхивают до равновесия 1 л воды с 400 см3 амилового спирта, содержащего 2,5 г йода. Вычислите количество йода, извлеченного водой.
44. Давление насыщенного пара этилового эфира 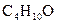 при Т = 293 К равно 5892,5 Па. Вычислите давление пара эфира над раствором, содержащим 0,015 кг бензальдегида (М = 106) в 0,1 кг эфира.
при Т = 293 К равно 5892,5 Па. Вычислите давление пара эфира над раствором, содержащим 0,015 кг бензальдегида (М = 106) в 0,1 кг эфира.
45. Вычислите давление пара над раствором анилин-эфир, с концентрацией последнего 95 мас.% при Т = 293 К. Давление пара чистого эфира 58920 Па.
46. Давление насыщенного пара бензола при Т = 303,2 К равно 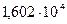 Па, а толуола -
Па, а толуола - 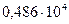 Па. Вычислите давление пара над раствором, полученным смешением 0,1 кг бензола с 0,1 кг толуола.
Па. Вычислите давление пара над раствором, полученным смешением 0,1 кг бензола с 0,1 кг толуола.
47. Равновесие концентрации янтарной кислоты, распределенной между водой и эфиром, приведены ниже.
| В воде, г/л | 43,4 | 43,8 | 47,4 |
| В эфире, г/л | 7,1 | 7,4 | 7,9 |
Справедлив ли закон распределения?
48. Какова температура начала кристаллизации раствора, содержащего 2 г NaCl на 100 г воды.
49. При какой температуре закипит 1% раствор сахара в воде, если эбулиоскопическая постоянная воды равна 0,512 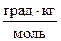 .
.
50. Вычислите молярные доли воды и спирта в 100 г раствора (вода – 60 г, спирт – 40 г).
51. Во сколько раз увеличится скорость прямой реакции 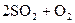
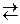
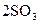 , протекающей в закрытом сосуде, если увеличить давление в 5 раз при Т = const.
, протекающей в закрытом сосуде, если увеличить давление в 5 раз при Т = const.
52. Термическое разложение окиси этилена является реакцией первого порядка. При 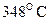 период полупревращения составляет 363 мин. Определите константу скорости реакции.
период полупревращения составляет 363 мин. Определите константу скорости реакции.
53. Константа скорости реакции разложения муравьиной кислоты при 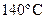 равна
равна 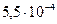 , а при
, а при 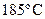 –
– 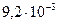 с-1. Вычислите температурный коэффициент скорости в указанном интервале температур.
с-1. Вычислите температурный коэффициент скорости в указанном интервале температур.
54. Роданирование n-метилстирола в уксусной кислоте (реакция I порядка) при 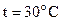 и начальных концентрациях реагентов
и начальных концентрациях реагентов 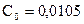 моль/л прошло за 10 мин. на 43,8%. Вычислите константу скорости реакции.
моль/л прошло за 10 мин. на 43,8%. Вычислите константу скорости реакции.
55. Константа скорости реакции при 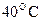 равна
равна 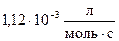 . На сколько процентов пройдет реакция за 25 мин., если исходные концентрации реагентов 0,008 моль/л.
. На сколько процентов пройдет реакция за 25 мин., если исходные концентрации реагентов 0,008 моль/л.
56. Определите порядок и константу скорости реакции при 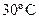 и начальных концентрациях реагентов 0,0688 моль/л по следующим данным:
и начальных концентрациях реагентов 0,0688 моль/л по следующим данным:
| t, сек | С, моль/л |
| 1222 | 0,05586 |
| 2083 | 0,04989 |
| 2695 | 0,04502 |
| 3720 | 0,04126 |
| 5340 | 0,03517 |
| 7200 | 0,030309 |
57. Для реакции роданирования n-метилстирола в уксусной кислоте получены следующие константы скоростей:
| t ºС | 30 | 40 | 50 | 60 |
К, 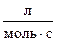
| 0,128 | 0,200 | 0,279 | 0,576 |
Определите энергию активации данной реакции.
58. Константы скорости реакции при температурах 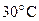 и
и 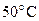 соответственно равны
соответственно равны 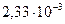 и
и 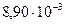
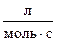 . Определите константу скорости реакции при
. Определите константу скорости реакции при 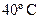 .
.
59. Определите графические константы а и 1/n в уравнении изотермы адсорбции Фрейндлиха ( 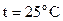 ), если:
), если:
| С м моль/л | 0,018 | 0,031 | 0,062 | 0,126 |
| Х/m | 0,467 | 0,624 | 0,801 | 1,110 |
Адсорбат – 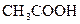 , адсорбент – кровяной уголь.
, адсорбент – кровяной уголь.
60. Вычислить суммарную площадь поверхности 1 г золота, раздробленного на правильные кубики с длиной ребра 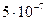 см. Плотность золота 19,3 г/см3.
см. Плотность золота 19,3 г/см3.
Варианты контрольных заданий
Контрольная работа № 1
| Номер варианта | Номер вопроса | |||||||
| Теоретический | Задача | |||||||
| 1 | 1 | 11 | 21 | 31 | 1 | 13 | 26 | 31 |
| 2 | 2 | 12 | 22 | 32 | 9 | 14 | 29 | 32 |
| 3 | 3 | 13 | 23 | 33 | 3 | 11 | 15 | 40 |
| 4 | 4 | 14 | 24 | 34 | 7 | 16 | 30 | 33 |
| 5 | 5 | 15 | 25 | 35 | 17 | 23 | 25 | 34 |
| 6 | 6 | 16 | 26 | 36 | 4 | 18 | 27 | 35 |
| 7 | 7 | 17 | 27 | 37 | 5 | 19 | 28 | 39 |
| 8 | 8 | 18 | 28 | 38 | 8 | 20 | 24 | 36 |
| 9 | 9 | 19 | 29 | 39 | 6 | 12 | 21 | 38 |
| 10 | 10 | 20 | 30 | 40 | 2 | 10 | 22 | 37 |
Контрольная работа № 2
| Номер варианта | Номер вопроса | ||||
| Теоретический | Задача | ||||
| 1 | 41 | 58 | 69 | 41 | 53 |
| 2 | 42 | 56 | 62 | 42 | 60 |
| 3 | 43 | 55 | 70 | 43 | 58 |
| 4 | 44 | 53 | 68 | 44 | 52 |
| 5 | 45 | 51 | 64 | 45 | 54 |
| 6 | 46 | 57 | 67 | 46 | 55 |
| 7 | 47 | 52 | 65 | 47 | 56 |
| 8 | 48 | 59 | 63 | 48 | 57 |
| 9 | 49 | 60 | 66 | 49 | 51 |
| 10 | 50 | 54 | 61 | 50 | 59 |
ПЕРЕЧЕНЬ ЛАБОРАТОРНЫХ РАБОТ
1. Определение теплоты растворения вещества колориметрическим методом.
2. Термический анализ.
3. Изучение адсорбции на поверхности твердого тела.
ЛИТЕРАТУРА
Основная
1. Гамеева О.С. Физическая и коллоидная химия. – М: Высшая школа, 1977.
2. Ахметов Б.В. Физическая и коллоидная химия. – М: Высшая школа, 1986.
3. Гамеева О.С. Сборник задач и упражнений по физической и коллоидной химии. – М: Высшая школа, 1980.
4. Краткий справочник физико-химических величин / под ред. Равделя, Пономаревой. – М: Химия, 1983.
Дополнительная
1. Киреев В. Краткий курс физической химии. – М: Высшая школа, 1980.
2. Карапетьянц М.Х. Введение в теорию химических процессов. – М: Высшая школа, 1982.
Дата: 2018-12-28, просмотров: 628.