Методические рекомендации и контрольные задания
Для обучающихся заочно по специальности
Химическая технология органических веществ»
Дзержинск
Физическая и коллоидная химия. Методические рекомендации и контрольные задания для обучающихся заочно.
| Составитель | А.В. Шишулина, преподаватель химических дисциплин, к.х.н., доцент НГТУ (Дзержинского политехнического института) |
| Рецензент | Н.И. Александрова, председатель комиссии химических дисциплин Дзержинского химического техникума им. Красной Армии |
| Ответственный за выпуск | Л.Л. Пеньковская, зам. директора по научно-методической работе Дзержинского химического техникума им. Красной Армии |
| Редактор | Н.И. Александрова, председатель комиссии химических дисциплин Дзержинского химического техникума им. Красной Армии |
ВВЕДЕНИЕ
В результате изучения дисциплины «Физическая и коллоидная химия» студент должны знать основные законы данной дисциплины, свойства агрегатных состояний веществ, свойства истинных и коллоидных растворов, кинетические закономерности химических превращений; уметь производить расчеты параметров газовых смесей, термохимические и кинетические расчеты химических реакций, определять направленность химического процесса и равновесие с использование справочной литературы и счетной техники.
В методических указаниях представлены: тематический план аудиторной работы, программа курса, контрольные вопросы и задачи по всем разделам курса, варианты контрольных работ.
В каждой теме приведены краткие теоретические сведения и методические указания, которые помогут студентам-заочникам в самостоятельном изучении курса.
Большинство приведенных задач требует при решении использования справочной литературы.
Вопросы для самоконтроля приведены в разделе «Контрольные вопросы».
Методические указания написаны в соответствии с действующей программой курса физической и коллоидной химии для студентов-заочников образовательных учреждений среднего профессионального образования.
ТЕМАТИЧЕСКИЙ ПЛАН
| № п/п | Наименование разделов и тем | Максим. нагрузка студентов | Кол-во аудиторных часов при очной форме обучения | Самост. работа студентов | ||
| Всего | Лабор. работы | Практ. занятия | ||||
| 1 | Введение | 3,5 | 0,5 | 3 | ||
| Раздел 1. Физическая химия | ||||||
| 2 | Тема 1.1. Молекулярно-кинетическая теория агрегатных состояний вещества | 22 | 5 | 4 | 17 | |
| 3 | Тема 1.2. Основы химической термодинамики | 39,5 | 14,5 | 4 | 8 | 25 |
| 4 | Тема 1.3. Фазовое равновесие | 15 | 5 | 2 | 2 | 10 |
| 5 | Тема 1.4. Химическое равновесие | 22 | 7 | 6 | 15 | |
| Контрольная работа № 1 | ||||||
| 6 | Тема 1.5. Растворы электролитов и неэлектролитов | 25 | 10 | 6 | 15 | |
| 7 | Тема 1.6. Химическая кинетика и катализ | 22 | 7 | 4 | 4 | 15 |
| Раздел 2. Основы коллоидной химии | ||||||
| 8 | Тема 2.1. Дисперсные системы | 10,5 | 0,5 | 10 | ||
| 9 | Тема 2.2 Растворы ВМС | 7,5 | 0,5 | 7 | ||
| Контрольная работа № 2 | ||||||
| ИТОГО по дисциплине | 167 | 50 | 10 | 30 | 117 | |
СОДЕРЖАНИЕ РАЗДЕЛОВ И ТЕМ
Введение
Физическая и коллоидная химия, ее роль и место среди других наук, возникновение и развитие.
Раздел 1. Физическая химия
Тема 1.1. Молекулярно-кинетическая теория агрегатных состояний вещества
Студент должен знать:
- сущность молекулярно-кинетической теории, формулировки и математические выражения газовых законов, физический смысл и численные значения универсальной газовой постоянной, основные свойства агрегатных состояний вещества, сущность и способы определения вязкости и поверхностного натяжения.
Основное уравнение кинетической теории газов 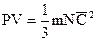 .
.
Среднеквадратичную скорость 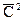 можно определить как
можно определить как 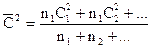
Средняя кинетическая энергия поступательного движения молекул прямо пропорциональна абсолютной температуре.
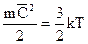
Основные газовые законы
Закон Бойля-Мариотта. 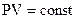 . При постоянной температуре объем постоянной массы газа обратно пропорционален его давлению.
. При постоянной температуре объем постоянной массы газа обратно пропорционален его давлению.
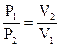
Закон Шарля. 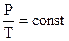 . При постоянном объеме давление данной массы газа прямо пропорционально абсолютной температуре.
. При постоянном объеме давление данной массы газа прямо пропорционально абсолютной температуре.
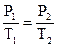
Закон Гей-Люссака. 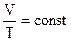 . При постоянном давлении объемы данной массы газа пропорциональны абсолютным температурам.
. При постоянном давлении объемы данной массы газа пропорциональны абсолютным температурам.
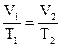
Закон Авогадро. Равные объемы газов, измеренные при одинаковой температуре и давлении, содержат одинаковое число молекул. Отсюда следует, что объемы, занимаемые 1 моль газа должны быть одинаковыми для всех газов. Этот объем называется молярным объемом газа и равен 22,4 л.
Закон Дальтона. Парциальное давление газа в смеси равно тому давлению газа, которым он обладал бы один, занимая объем смеси при той же температуре. 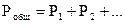
Парциальное давление каждого газа в газовой смеси рассчитывают исходя из общего давления 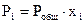 ,
, 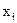 - молярная доля каждого газа в смеси.
- молярная доля каждого газа в смеси.
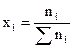
Уравнение состояния идеального газа Менделеева-Клапейрона: 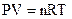
Уравнение состояния реального газа Ван-дер-Ваальса: 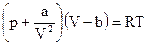
Дата: 2018-12-28, просмотров: 384.