Основные понятия и определения химической термодинамики. I и II законы термодинамики, их физическая сущность. Энтальпия. Теплоемкость. Виды теплоемкости. Термохимия. КПД цикла Карно. Энтропия, физический смысл, значение. Свободная энергия системы. Изобарно-изотермический и изохорно-изотермический потенциалы.
Студент должен уметь:
- рассчитывать теплоемкость веществ;
- определять работу и теплоту в термодинамических процессах;
- рассчитывать тепловые эффекты химических реакций;
- рассчитывать изменение энтропии в химической реакции;
- определять стандартные энергии Гиббса и Гельмгольца химического процесса.
Первый закон термодинамики
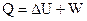
Теплота, поглощаемая системой в ходе процесса, расходуется на изменение внутренней энергии системы и на совершение работы над окружающей средой.
Теплота, поглощаемая системой при 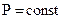 равна изменению энтальпии
равна изменению энтальпии 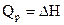 .
.
Если совершается только работа расширения 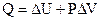 , при
, при 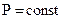
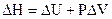 для газовых реакций
для газовых реакций 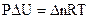 , тогда
, тогда 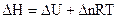 ,
, 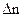 - суммарное изменение числа молей участников реакции. Расчет стандартной энтальпии химической реакции проводят по энтальпиям образования и энтальпиям сгорания участников реакции. Данные можно взять в справочнике [4].
- суммарное изменение числа молей участников реакции. Расчет стандартной энтальпии химической реакции проводят по энтальпиям образования и энтальпиям сгорания участников реакции. Данные можно взять в справочнике [4].
Тепловой эффект химической реакции можно рассчитать, основываясь на законе Гесса методом комбинирования химических реакций.
Теплоемкость – это количество теплоты, необходимое для нагревания единицы массы вещества (удельная теплоемкость) или 1 моль вещества (молярная теплоемкость) на 1 К.
Средняя теплоемкость 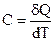
Истинная теплоемкость 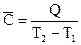
В зависимости от условий проведения процесса различают изобарную Ср и изохорную Cv теплоемкости.
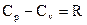
Второй закон термодинамики
Невозможен циклический процесс, единственным результатом которого было бы превращение всей теплоты, взятой от теплоисточника в работу (без одновременного переноса некоторого количества теплоты от более горячего тела к более холодному).
Все самопроизвольные процессы заключаются в переходе из упорядоченного состояния в менее упорядоченное. Степень «беспорядка» измеряется энтропией.
Математическое выражение II закона термодинамики 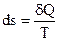 .
.
Физический смысл энтропии вытекает из статистической теории Больцмана. Энтропия является функцией термодинамической вероятности системы.
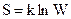
Изменение энтропии в химической реакции определяют по стандартным энтропиям участников реакции.
Стандартную энергию Гиббса и энергию Гельмгольца – критерии направленности самопроизвольного процесса и равновесия – рассчитывают по термодинамическим данным с использованием справочной литературы [4] по уравнениям:
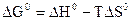
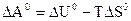
Для реакций, протекающих в газовой фазе, учитывают изменение числа молей участников реакции 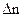 .
.
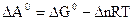
Максимальная полезная работа, произведенная системой, равна убыли термодинамического потенциала.
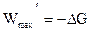
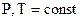
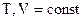
Дата: 2018-12-28, просмотров: 337.