МИНИСТЕРСТВО ОБРАЗОВАНИЯ, НАУКИ И МОЛОДЕЖНОЙ ПОЛИТИКИ НИЖЕГОРОДСКОЙ ОБЛАСТИ
Государственное бюджетное профессиональное образовательное учреждение
ДЗЕРЖИНСКИЙ ХИМИЧЕСКИЙ ТЕХНИКУМ ИМЕНИ КРАСНОЙ АРМИИ
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Методические рекомендации и контрольные задания
Для обучающихся заочно по специальности
Химическая технология органических веществ»
Дзержинск
Физическая и коллоидная химия. Методические рекомендации и контрольные задания для обучающихся заочно.
| Составитель | А.В. Шишулина, преподаватель химических дисциплин, к.х.н., доцент НГТУ (Дзержинского политехнического института) |
| Рецензент | Н.И. Александрова, председатель комиссии химических дисциплин Дзержинского химического техникума им. Красной Армии |
| Ответственный за выпуск | Л.Л. Пеньковская, зам. директора по научно-методической работе Дзержинского химического техникума им. Красной Армии |
| Редактор | Н.И. Александрова, председатель комиссии химических дисциплин Дзержинского химического техникума им. Красной Армии |
ВВЕДЕНИЕ
В результате изучения дисциплины «Физическая и коллоидная химия» студент должны знать основные законы данной дисциплины, свойства агрегатных состояний веществ, свойства истинных и коллоидных растворов, кинетические закономерности химических превращений; уметь производить расчеты параметров газовых смесей, термохимические и кинетические расчеты химических реакций, определять направленность химического процесса и равновесие с использование справочной литературы и счетной техники.
В методических указаниях представлены: тематический план аудиторной работы, программа курса, контрольные вопросы и задачи по всем разделам курса, варианты контрольных работ.
В каждой теме приведены краткие теоретические сведения и методические указания, которые помогут студентам-заочникам в самостоятельном изучении курса.
Большинство приведенных задач требует при решении использования справочной литературы.
Вопросы для самоконтроля приведены в разделе «Контрольные вопросы».
Методические указания написаны в соответствии с действующей программой курса физической и коллоидной химии для студентов-заочников образовательных учреждений среднего профессионального образования.
ТЕМАТИЧЕСКИЙ ПЛАН
| № п/п | Наименование разделов и тем | Максим. нагрузка студентов | Кол-во аудиторных часов при очной форме обучения | Самост. работа студентов | ||
| Всего | Лабор. работы | Практ. занятия | ||||
| 1 | Введение | 3,5 | 0,5 | 3 | ||
| Раздел 1. Физическая химия | ||||||
| 2 | Тема 1.1. Молекулярно-кинетическая теория агрегатных состояний вещества | 22 | 5 | 4 | 17 | |
| 3 | Тема 1.2. Основы химической термодинамики | 39,5 | 14,5 | 4 | 8 | 25 |
| 4 | Тема 1.3. Фазовое равновесие | 15 | 5 | 2 | 2 | 10 |
| 5 | Тема 1.4. Химическое равновесие | 22 | 7 | 6 | 15 | |
| Контрольная работа № 1 | ||||||
| 6 | Тема 1.5. Растворы электролитов и неэлектролитов | 25 | 10 | 6 | 15 | |
| 7 | Тема 1.6. Химическая кинетика и катализ | 22 | 7 | 4 | 4 | 15 |
| Раздел 2. Основы коллоидной химии | ||||||
| 8 | Тема 2.1. Дисперсные системы | 10,5 | 0,5 | 10 | ||
| 9 | Тема 2.2 Растворы ВМС | 7,5 | 0,5 | 7 | ||
| Контрольная работа № 2 | ||||||
| ИТОГО по дисциплине | 167 | 50 | 10 | 30 | 117 | |
СОДЕРЖАНИЕ РАЗДЕЛОВ И ТЕМ
Введение
Физическая и коллоидная химия, ее роль и место среди других наук, возникновение и развитие.
Раздел 1. Физическая химия
Тема 1.1. Молекулярно-кинетическая теория агрегатных состояний вещества
Студент должен знать:
- сущность молекулярно-кинетической теории, формулировки и математические выражения газовых законов, физический смысл и численные значения универсальной газовой постоянной, основные свойства агрегатных состояний вещества, сущность и способы определения вязкости и поверхностного натяжения.
Основное уравнение кинетической теории газов 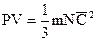 .
.
Среднеквадратичную скорость 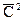 можно определить как
можно определить как 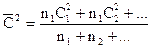
Средняя кинетическая энергия поступательного движения молекул прямо пропорциональна абсолютной температуре.
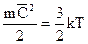
Основные газовые законы
Закон Бойля-Мариотта. 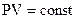 . При постоянной температуре объем постоянной массы газа обратно пропорционален его давлению.
. При постоянной температуре объем постоянной массы газа обратно пропорционален его давлению.
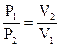
Закон Шарля. 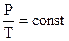 . При постоянном объеме давление данной массы газа прямо пропорционально абсолютной температуре.
. При постоянном объеме давление данной массы газа прямо пропорционально абсолютной температуре.
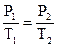
Закон Гей-Люссака. 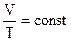 . При постоянном давлении объемы данной массы газа пропорциональны абсолютным температурам.
. При постоянном давлении объемы данной массы газа пропорциональны абсолютным температурам.
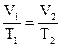
Закон Авогадро. Равные объемы газов, измеренные при одинаковой температуре и давлении, содержат одинаковое число молекул. Отсюда следует, что объемы, занимаемые 1 моль газа должны быть одинаковыми для всех газов. Этот объем называется молярным объемом газа и равен 22,4 л.
Закон Дальтона. Парциальное давление газа в смеси равно тому давлению газа, которым он обладал бы один, занимая объем смеси при той же температуре. 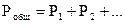
Парциальное давление каждого газа в газовой смеси рассчитывают исходя из общего давления 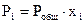 ,
, 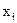 - молярная доля каждого газа в смеси.
- молярная доля каждого газа в смеси.
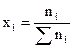
Уравнение состояния идеального газа Менделеева-Клапейрона: 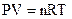
Уравнение состояния реального газа Ван-дер-Ваальса: 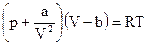
Первый закон термодинамики
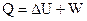
Теплота, поглощаемая системой в ходе процесса, расходуется на изменение внутренней энергии системы и на совершение работы над окружающей средой.
Теплота, поглощаемая системой при 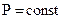 равна изменению энтальпии
равна изменению энтальпии 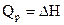 .
.
Если совершается только работа расширения 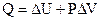 , при
, при 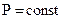
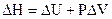 для газовых реакций
для газовых реакций 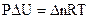 , тогда
, тогда 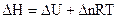 ,
, 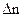 - суммарное изменение числа молей участников реакции. Расчет стандартной энтальпии химической реакции проводят по энтальпиям образования и энтальпиям сгорания участников реакции. Данные можно взять в справочнике [4].
- суммарное изменение числа молей участников реакции. Расчет стандартной энтальпии химической реакции проводят по энтальпиям образования и энтальпиям сгорания участников реакции. Данные можно взять в справочнике [4].
Тепловой эффект химической реакции можно рассчитать, основываясь на законе Гесса методом комбинирования химических реакций.
Теплоемкость – это количество теплоты, необходимое для нагревания единицы массы вещества (удельная теплоемкость) или 1 моль вещества (молярная теплоемкость) на 1 К.
Средняя теплоемкость 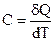
Истинная теплоемкость 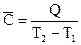
В зависимости от условий проведения процесса различают изобарную Ср и изохорную Cv теплоемкости.
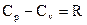
Второй закон термодинамики
Невозможен циклический процесс, единственным результатом которого было бы превращение всей теплоты, взятой от теплоисточника в работу (без одновременного переноса некоторого количества теплоты от более горячего тела к более холодному).
Все самопроизвольные процессы заключаются в переходе из упорядоченного состояния в менее упорядоченное. Степень «беспорядка» измеряется энтропией.
Математическое выражение II закона термодинамики 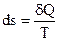 .
.
Физический смысл энтропии вытекает из статистической теории Больцмана. Энтропия является функцией термодинамической вероятности системы.
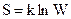
Изменение энтропии в химической реакции определяют по стандартным энтропиям участников реакции.
Стандартную энергию Гиббса и энергию Гельмгольца – критерии направленности самопроизвольного процесса и равновесия – рассчитывают по термодинамическим данным с использованием справочной литературы [4] по уравнениям:
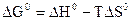
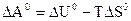
Для реакций, протекающих в газовой фазе, учитывают изменение числа молей участников реакции 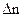 .
.
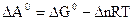
Максимальная полезная работа, произведенная системой, равна убыли термодинамического потенциала.
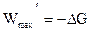
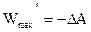
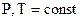
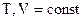
Законы Коновалова.
1. Повышение относительного содержания компонента в жидкой фазе всегда вызывает увеличение относительного содержания его в паре. В бинарной системе пар, по сравнению с жидкостью, из которой он получен, при равновесии богаче более летучим компонентом.
2. Точки максимума и минимума на кривой общего давления пара отвечают растворам, состав которых одинаков с составом равновесного с ним пара.
Тема 2.2. Растворы ВМС
Общая характеристика и особенности растворов ВМС
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Каковы роль и место физической и коллоидной химии среди других наук? Возникновение и развитие науки.
2. Сформулируйте основные положения молекулярно-кинетической теории газов.
3. Чем отличается движение молекул в газе от движения их в жидкости?
4. Каков физический смысл и численное значение газовой постоянной?
5. Дайте формулировки и приведите математические выражения газовых законов.
6. Каковы причины отклонений свойств реальных газов от законов идеальных газов? Уравнением состояния реального газа Ван-дер-Ваальса.
7. Какой пар называют насыщенным паром? Давление насыщенного пара.
8. Парциальное давление газа. Сформулируйте закон Дальтона.
9. Вязкость жидкостей. Каковы виды вязкости?
10. Поверхностное натяжение. Каков физический смысл поверхностного натяжения? Методы определения.
11. Сформулируйте I закон термодинамики и приведите его математическое выражение.
12. Рассмотрите применение I закона термодинамики к различным термодинамическим процессам.
13. Что такое энтальпия?
14. Теплоемкость веществ. Виды теплоемкости. Какова связь изобарной и изохорной теплоемкостей газов?
15. Закон Гесса. При каких условиях он выполняется?
16. Что называют энтальпией образования сложного вещества? Приведите примеры.
17. Что называют энтальпией сгорания вещества. Приведите примеры.
18. Тепловой эффект химической реакции. Каковы способы его определения?
19. Термохимическое уравнение реакции, особенности. Приведите пример.
20. II закон термодинамики. Какова его физическая сущность?
21. Как определить работу расширения идеального газа в различных процессах (P, V, T, Q – const)?
22. КПД цикла Карно. Сформулируйте теорему Карно-Клаузиуса.
23. Энтропия. Каков ее физический смысл и значение?
24. Рассмотрите энтропию как критерий направленности самопроизвольного процесса.
25. Дайте определение термина «свободная энергия системы». Изобарно-изотермический и изохорно-изотермический потенциалы.
26. Принцип минимума свободной энергии системы. Каков предел протекания самопроизвольного процесса в изолированной системе?
27. Дайте определение следующих понятий: «фаза», «компонент», «вариантность».
28. Правило фаз Гиббса. Дайте современную интерпретацию.
29. Рассмотрите фазовую диаграмму состояния однокомпонентной системы на примере воды.
30. Проведите анализ диаграммы состояния двухкомпонентной системы на примере бинарного сплава.
31. Кривые охлаждения. Термический анализ.
32. Рассмотрите применение уравнения Клаузиуса-Клапейрона и различным равновесным состояниям при фазовых переходах.
33. Обратимые реакции. Сформулируйте общие условия химического равновесия в гомогенных реакциях.
34. Сформулируйте закон равновесия.
35. Константа равновесия, различные формы записи. Какова связь между ними?
36. Положение равновесия. Какие факторы влияют на положение равновесия? Принцип Ле-Шателье.
37. Химическое сродство. Приведите уравнение изотермы химической реакции.
38. Стандартная энергия Гиббса и Гельмгольца.
39. Определение состава равновесной смеси.
40. Определение оптимальных условий проведения химического процесса.
41. Дайте определение понятий «раствор», «насыщенный раствор», «компонент раствора», «растворимость».
42. Сформулируйте закон Рауля.
43. Какими способами можно выразить состав раствора?
44. Осмотическое давление растворов. Закон Вант-Гоффа. Что такое «изотопический коэффициент».
45. Каковы закономерности понижения температуры кристаллизации растворителя в разбавленном растворе? Криоскопия и эбулиоскопия.
46. Закон распределения вещества между двумя несмешивающимися жидкостями. Рассмотрите его применение для расчетов экстракционных процессов.
47. Растворимость газов в жидкостях. От каких факторов зависит? Закон Генри.
48. Рассмотрите диаграммы состояния равновесия жидкость – пар в двойной системе.
49. Неидеальные растворы. Каковы причины отклонений от закона Рауля?
50. Что такое азеотропные смеси?
51. Сформулируйте законы Коновалова.
52. Каковы физико-химические закономерности ректификации жидких смесей?
53. Химическая кинетика. Что она изучает?
54. Дайте определение понятий «скорость процесса», «средняя скорость», «истинная скорость», «начальная скорость».
55. Сформулируйте закон действия масс.
56. Константа скорости реакции. Каков ее физический смысл и размерность?
57. Молекулярность реакции. Порядок реакции. Дайте классификацию реакций по порядку и молекулярности.
58. Выведите кинетические уравнение реакций I и II порядков.
59. Период полупревращения вещества. Как он зависит от начальных концентраций реагентов в реакциях различных порядков.
60. Как зависит скорость химической реакции от температуры? Правило Вант-Гоффа. Уравнение Аррениуса.
61. Активные молекулы. Что называют энергией активации?
62. Каковы особенности цепных реакций?
63. Что называют катализатором? Катализ, виды катализа. Ингибиторы.
64. Какое влияние оказывает катализатор на энергию активации химической реакции?
65. Каковы особенности процесса сорбции? Влияние на него различных факторов.
66. Сформулируйте основные положения теории Ленгмюра. Изотерма адсобрции.
67. Дисперсные системы. Дайте классификацию дисперсных систем по агрегатному состоянию.
68. Каковы особенности дисперсных систем? Способы их получения.
69. Что называют ПАВ?
70. Каковы строение и заряд коллоидной частицы?
ЗАДАЧИ
1. Приведите к н.у. газ, который при 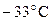 и
и 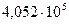 Па занимает объем 12 м3.
Па занимает объем 12 м3.
2. При н.у. объем газа равен 100 м3. До какой температуры нужно нагреть газ, чтобы при 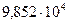 Па объем его стал равен 122 м3.
Па объем его стал равен 122 м3.
3. Плотность газообразного хлора при н.у. 3,124 кг/м3. Вычислите плотность хлора при 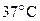 и том же давлении.
и том же давлении.
4. При 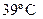 и 98740 Па масса 640 см3 равна 1,73 г. Вычислите молекулярную массу (кг) и плотность при
и 98740 Па масса 640 см3 равна 1,73 г. Вычислите молекулярную массу (кг) и плотность при 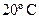 .
.
5. Стальной баллон наполнили азотом при давлении 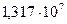 Па и
Па и 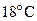 . При какой температуре давления азота достигнет рабочего давления
. При какой температуре давления азота достигнет рабочего давления 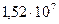 Па.
Па.
6. Сосуд объемом 7 л содержит 0,4 г водорода, 3,15 г азота при 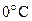 . Определите парциальные давления газов и общее давление газовой смеси.
. Определите парциальные давления газов и общее давление газовой смеси.
7. Определите изменение внутренней энергии при испарении 90 г воды при температуре ее кипения. Скрытая теплота парообразования воды 40714,2 кДж/моль, удельный объем водяного пара 1,699 л/г. Давление нормальное, объемом жидкости пренебречь.
8. Какую работу могут совершить 12 кг водорода при увеличении температуры на 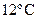 при постоянном давлении.
при постоянном давлении.
9. При изотермическом процессе к азоту, занимающему объем 500 л и находящемуся под давлением 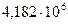 Па, подводится 2514 кДж теплоты. Определите объем и давление к концу процесса.
Па, подводится 2514 кДж теплоты. Определите объем и давление к концу процесса.
10. Определите теплоту сгорания спирта 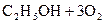

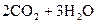 (ж) исходя из следующих данных:
(ж) исходя из следующих данных:
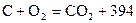 к Дж/моль
к Дж/моль
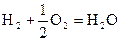 (ж) + 285 к Дж/моль
(ж) + 285 к Дж/моль
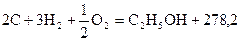 к Дж/моль
к Дж/моль
11. Определите теплоту образования сероуглерода 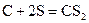 , используя следующие термохимические уравнения:
, используя следующие термохимические уравнения:
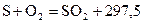 кДж/моль
кДж/моль
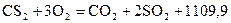 кДж/моль
кДж/моль
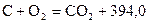 кДж/моль
кДж/моль
12. Тепловой эффект реакции 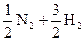

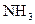 при постоянном давлении составляет 46,3 кДж/моль. Определите тепловой эффект при V = const Т = 298 К.
при постоянном давлении составляет 46,3 кДж/моль. Определите тепловой эффект при V = const Т = 298 К.
13-22. Вычислите тепловые эффекты при стандартных условиях, используя справочные данные следующих реакций:
13. 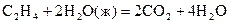
14. 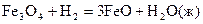
15. 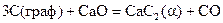
16. 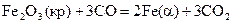
17. 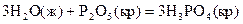
18. 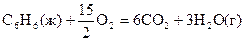
19. 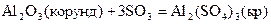
20. 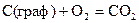
21. 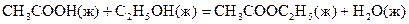
22. 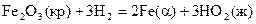
23. Вычислите массовую теплоемкость сплава состава (мас.%) Bi 50,7; Pb 25,0; Cd 10,1; Sn 14,2 если Ср 298 ( 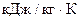 ) Bi 0,122; Pb 0,129; Cd 0,231; Sn 0,221.
) Bi 0,122; Pb 0,129; Cd 0,231; Sn 0,221.
24. Рассчитайте КПД идеальной машины Карно, получающей пар при 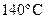 и выпускающей его при 105ºС.
и выпускающей его при 105ºС.
25. При охлаждении 42 г азота от 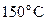 до
до 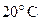 давление повышается от
давление повышается от 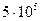 до
до 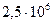 Па. Определите изменение энтропии в данном процессе, если
Па. Определите изменение энтропии в данном процессе, если 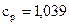
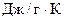 .
.
26-28. Вычислите изменение энтропии при стандартных условиях для реакций:
26. 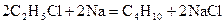
27. 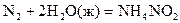
28. 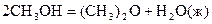
29-30. Определите число степеней свободы для следующих систем:
29. S (ромб)  S (мон.)
S (мон.)  S (пар)
S (пар)
30. S (ж)  S (пар)
S (пар)
31-34. Рассчитайте состав равновесной смеси в идеально-газовой реакции при Т = 298 К и Р = 1 атм. В переходном состоянии вещества взяты в эквимолярных количествах.
31. 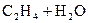

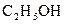
32. 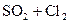

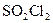
33. 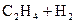

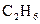
34. 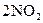

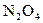
35-37. Вычислите константу равновесия идеальной газовой химической реакции при 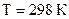 , воспользовавшись таблицами стандартных термодинамических величин.
, воспользовавшись таблицами стандартных термодинамических величин.
35. 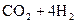

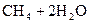
36. 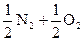

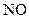
37. 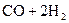

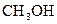
38-39. В какую сторону сместится равновесие реакций а) при понижении температуры; б) при понижении давления.
38. 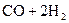

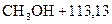 кДж
кДж
39. 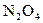

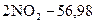 кДж
кДж
40. Для реакции 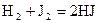 , протекающей при
, протекающей при 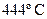 Кс = 50. Определите направление реакции, если начальные концентрации реагентов равны
Кс = 50. Определите направление реакции, если начальные концентрации реагентов равны 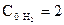 ,
, 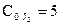 ,
, 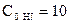 моль/л.
моль/л.
41. Осмотическое давление раствора неэлектролита при 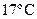 равно
равно 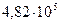 Па. Определите осмотическое давление при
Па. Определите осмотическое давление при 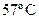 .
.
42. Растворимость кислорода в воде при давлении 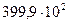 н/м2 и Т = 298 К равна
н/м2 и Т = 298 К равна 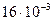 кг/м3. Определите коэффициент Генри.
кг/м3. Определите коэффициент Генри.
43. Коэффициент распределения йода между амиловым спиртом и водой равен 230. Встряхивают до равновесия 1 л воды с 400 см3 амилового спирта, содержащего 2,5 г йода. Вычислите количество йода, извлеченного водой.
44. Давление насыщенного пара этилового эфира 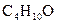 при Т = 293 К равно 5892,5 Па. Вычислите давление пара эфира над раствором, содержащим 0,015 кг бензальдегида (М = 106) в 0,1 кг эфира.
при Т = 293 К равно 5892,5 Па. Вычислите давление пара эфира над раствором, содержащим 0,015 кг бензальдегида (М = 106) в 0,1 кг эфира.
45. Вычислите давление пара над раствором анилин-эфир, с концентрацией последнего 95 мас.% при Т = 293 К. Давление пара чистого эфира 58920 Па.
46. Давление насыщенного пара бензола при Т = 303,2 К равно 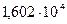 Па, а толуола -
Па, а толуола - 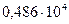 Па. Вычислите давление пара над раствором, полученным смешением 0,1 кг бензола с 0,1 кг толуола.
Па. Вычислите давление пара над раствором, полученным смешением 0,1 кг бензола с 0,1 кг толуола.
47. Равновесие концентрации янтарной кислоты, распределенной между водой и эфиром, приведены ниже.
| В воде, г/л | 43,4 | 43,8 | 47,4 |
| В эфире, г/л | 7,1 | 7,4 | 7,9 |
Справедлив ли закон распределения?
48. Какова температура начала кристаллизации раствора, содержащего 2 г NaCl на 100 г воды.
49. При какой температуре закипит 1% раствор сахара в воде, если эбулиоскопическая постоянная воды равна 0,512 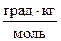 .
.
50. Вычислите молярные доли воды и спирта в 100 г раствора (вода – 60 г, спирт – 40 г).
51. Во сколько раз увеличится скорость прямой реакции 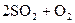
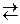
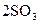 , протекающей в закрытом сосуде, если увеличить давление в 5 раз при Т = const.
, протекающей в закрытом сосуде, если увеличить давление в 5 раз при Т = const.
52. Термическое разложение окиси этилена является реакцией первого порядка. При 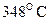 период полупревращения составляет 363 мин. Определите константу скорости реакции.
период полупревращения составляет 363 мин. Определите константу скорости реакции.
53. Константа скорости реакции разложения муравьиной кислоты при 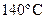 равна
равна 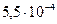 , а при
, а при 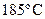 –
– 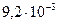 с-1. Вычислите температурный коэффициент скорости в указанном интервале температур.
с-1. Вычислите температурный коэффициент скорости в указанном интервале температур.
54. Роданирование n-метилстирола в уксусной кислоте (реакция I порядка) при 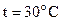 и начальных концентрациях реагентов
и начальных концентрациях реагентов 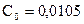 моль/л прошло за 10 мин. на 43,8%. Вычислите константу скорости реакции.
моль/л прошло за 10 мин. на 43,8%. Вычислите константу скорости реакции.
55. Константа скорости реакции при 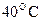 равна
равна 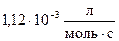 . На сколько процентов пройдет реакция за 25 мин., если исходные концентрации реагентов 0,008 моль/л.
. На сколько процентов пройдет реакция за 25 мин., если исходные концентрации реагентов 0,008 моль/л.
56. Определите порядок и константу скорости реакции при 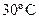 и начальных концентрациях реагентов 0,0688 моль/л по следующим данным:
и начальных концентрациях реагентов 0,0688 моль/л по следующим данным:
| t, сек | С, моль/л |
| 1222 | 0,05586 |
| 2083 | 0,04989 |
| 2695 | 0,04502 |
| 3720 | 0,04126 |
| 5340 | 0,03517 |
| 7200 | 0,030309 |
57. Для реакции роданирования n-метилстирола в уксусной кислоте получены следующие константы скоростей:
| t ºС | 30 | 40 | 50 | 60 |
К, 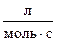
| 0,128 | 0,200 | 0,279 | 0,576 |
Определите энергию активации данной реакции.
58. Константы скорости реакции при температурах 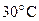 и
и 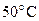 соответственно равны
соответственно равны 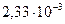 и
и 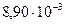
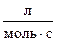 . Определите константу скорости реакции при
. Определите константу скорости реакции при 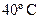 .
.
59. Определите графические константы а и 1/n в уравнении изотермы адсорбции Фрейндлиха ( 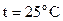 ), если:
), если:
| С м моль/л | 0,018 | 0,031 | 0,062 | 0,126 |
| Х/m | 0,467 | 0,624 | 0,801 | 1,110 |
Адсорбат – 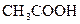 , адсорбент – кровяной уголь.
, адсорбент – кровяной уголь.
60. Вычислить суммарную площадь поверхности 1 г золота, раздробленного на правильные кубики с длиной ребра 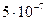 см. Плотность золота 19,3 г/см3.
см. Плотность золота 19,3 г/см3.
Варианты контрольных заданий
Контрольная работа № 1
| Номер варианта | Номер вопроса | |||||||
| Теоретический | Задача | |||||||
| 1 | 1 | 11 | 21 | 31 | 1 | 13 | 26 | 31 |
| 2 | 2 | 12 | 22 | 32 | 9 | 14 | 29 | 32 |
| 3 | 3 | 13 | 23 | 33 | 3 | 11 | 15 | 40 |
| 4 | 4 | 14 | 24 | 34 | 7 | 16 | 30 | 33 |
| 5 | 5 | 15 | 25 | 35 | 17 | 23 | 25 | 34 |
| 6 | 6 | 16 | 26 | 36 | 4 | 18 | 27 | 35 |
| 7 | 7 | 17 | 27 | 37 | 5 | 19 | 28 | 39 |
| 8 | 8 | 18 | 28 | 38 | 8 | 20 | 24 | 36 |
| 9 | 9 | 19 | 29 | 39 | 6 | 12 | 21 | 38 |
| 10 | 10 | 20 | 30 | 40 | 2 | 10 | 22 | 37 |
Контрольная работа № 2
| Номер варианта | Номер вопроса | ||||
| Теоретический | Задача | ||||
| 1 | 41 | 58 | 69 | 41 | 53 |
| 2 | 42 | 56 | 62 | 42 | 60 |
| 3 | 43 | 55 | 70 | 43 | 58 |
| 4 | 44 | 53 | 68 | 44 | 52 |
| 5 | 45 | 51 | 64 | 45 | 54 |
| 6 | 46 | 57 | 67 | 46 | 55 |
| 7 | 47 | 52 | 65 | 47 | 56 |
| 8 | 48 | 59 | 63 | 48 | 57 |
| 9 | 49 | 60 | 66 | 49 | 51 |
| 10 | 50 | 54 | 61 | 50 | 59 |
ПЕРЕЧЕНЬ ЛАБОРАТОРНЫХ РАБОТ
1. Определение теплоты растворения вещества колориметрическим методом.
2. Термический анализ.
3. Изучение адсорбции на поверхности твердого тела.
ЛИТЕРАТУРА
Основная
1. Гамеева О.С. Физическая и коллоидная химия. – М: Высшая школа, 1977.
2. Ахметов Б.В. Физическая и коллоидная химия. – М: Высшая школа, 1986.
3. Гамеева О.С. Сборник задач и упражнений по физической и коллоидной химии. – М: Высшая школа, 1980.
4. Краткий справочник физико-химических величин / под ред. Равделя, Пономаревой. – М: Химия, 1983.
Дополнительная
1. Киреев В. Краткий курс физической химии. – М: Высшая школа, 1980.
2. Карапетьянц М.Х. Введение в теорию химических процессов. – М: Высшая школа, 1982.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ, НАУКИ И МОЛОДЕЖНОЙ ПОЛИТИКИ НИЖЕГОРОДСКОЙ ОБЛАСТИ
Государственное бюджетное профессиональное образовательное учреждение
ДЗЕРЖИНСКИЙ ХИМИЧЕСКИЙ ТЕХНИКУМ ИМЕНИ КРАСНОЙ АРМИИ
Дата: 2018-12-28, просмотров: 402.