- Стадия альтерации (повреждения ). Выделяют первичную и вторичную альтерацию.
Первичная альтерация возникает в результате непосредственного действия на ткань повреждающего фактора (флогогенного фактора).
Вторичная альтерация - повреждение от действия факторов, образующиеся в процессе воспаления. Например, вследствие вторичных изменений в тканях, вызванных гипоксией; осмотического лизиса, действия лизосомальных ферментов (протеазы, липазы, гликозидазы, фосфатазы), активации СРО и др.
Основными патофизиологическими механизмами развития вторичной альтерации являются:
1. повреждение мембранных и межклеточных структур, а также внутриклеточных
ферментов.
2. расстройство энергетического обеспечения функций и биохимических процессов в поврежденной ткани;
3. нарушение трансмембранного переноса и градиента ионов.
Изменения, сопровождающие стадию альтерации, запускают следующую сосудисто-экссудативную стадию.
2. Вторая стадия воспаления - стадия сосудисто-экссудативных изменений .
1. Кратковременный (1-2 сек) спазм микрососудов, следующий непосредственно за действием флогогенного фактора под действием катехоламинов на специфические адренорецепторы.
2. Артериальная гиперемия (активная, рецепторно-обусловленная) - расширение артериол, капилляров, венул. Характерно увеличение притока артериальной крови при сохранении венозного оттока. В ее основе ферментативное (МАО) разрушение катехоламинов, действие медиаторов воспаления - нейропептида Р, гистамина, серотонина, брадикинина, обладающих сосудорасширяющим действием и способностью повышать проницаемость микрососудов за счет сокращения эндотелиальных клеток. Наблюдается увеличение размеров межэндотелиоцитарных щелей, появляются своеобразные "бреши" в эндотелии и усиливаются процессы микровезикулярного трансэндотелиального транспорта
3. Артериальную гиперемию сменяет венозная гиперемия. Для этой стадии характерно нарушение оттока, следствием чего является увеличение просвета посткапилляров и венул и замедление в них тока крови. Нарушение оттока результат краевого стояния лейкоцитов, микротромбообразования, сдавления сосуда из вне экссудатом.
4. Стаз крови – остановка поступательного движения крови.
На стадии венозной гиперемии формируется воспалительный отек:
Механизмы образования воспалительного отека
Отек – это избыточное накопление жидкости в полостях и тканевых пространствах организма.
Основа отека – процесс экссудации, т.е. выделения экссудата. Экссудат (лат. exsudo — выхожу наружу, выделяюсь; exsudatum: ex- из + sudo, sudatum потеть) — жидкость, выделяющаяся в ткани или полости организма из мелких кровеносных сосудов при воспалении.
Механизмы экссудации:
* повышение проницаемости сосудистой стенки за счет действия провоспалительных медиаторов воспаления
* повышение гидростатического давления тканевой жидкости крови, за счет усиления притока артериальной крови и сдавления окружающих тканей экссудатом.
- повышение коллоидно-осмотического давления в тканевой жидкости, за счет выхода ионов калия из клетки при нарастании ацидоза и повышения концентрации белков в экссудате за счет компонентов гноя и белков плазмы.
Характеристики жидкости, скапливающийся в воспалительном очаге, позволяют определить вид воспалительного процесса. Виды экссудата:
1. Серозный - в отеке содержится транссудат или экссудат, содержащий белок и не содержащий форменных элементов крови.
2. Фибринозный - в отечной жидкости содержится значительное количество фибрина, выпадающего в осадок на воспаленных тканях в виде нитей и пленок.
3. Гнойный - при котором в отечной жидкости содержится большое количество лейкоцитов, в основном погибших.
4. Геморрагический - с отечной жидкостью, содержащей эритроциты (кровь в экссудате).
5. Ихорозный - в отечной жидкости поселяется гнилостная микрофлора.
Значительную роль в переходе жидкой части крови через сосудистую стенку играют физико-химические изменения в очаге воспаления.
Реакция острой фазы воспаления.
Общая реакция организма, следующая непосредственно вслед за альтерацией и направленная на восстановление гомеостаза организма – называется реакцией острой фазы воспаления. Ряд биологически активных веществ, вырабатывающихся в этот период называют «белками острой фазы».
Запускают реакцию острой фазы бактериальные, вирусные инфекции, травмы, ожоги, злокачественные новообразования, тканевые инфаркты, воспалительные состояния. Основные компоненты РОФ:
- Лихорадка
- Лейкоцитоз, со сдвигом лейкоцитарной формулы влево
- Появление в крови белков острой фазы: вырабатываемых гепатоцитами при действии на печень цитокинов и некоторых гормонов. При этом основными индуктороми синтеза острофазных белков считается интерлейкин 1, интерлейкин 6, гамма-интерферон, фактор некроза опухолей. Белки острой фазы (более 20) разделяются на две группы: позитивные острофазные белки (концентрация их в плазме крови в процессе развития острофазовой реакции увеличивается в сотни и тысячи раз) и негативные острофазовые белки (их концентрация в плазме крови в процессе развития острофазовой реакции не изменяется, или даже уменьшается по сравнению с нормой).
Одной из основных функций острофазовых белков является модуляция воспалительной реакции и регенерации тканей. К «главным» белкам острой фазы относят С-реактивный белок и сывороточный амилоид А, концентрация которых в плазме крови после повреждения (воспаление, травма) в течение 6 – 8 часов возрастает в 100 – 1000 раз.
С - реактивный белок способен связывать широкий спектр лигандов - компонентов микроорганизмов, токсинов, частиц поврежденных тканей, препятствуя тем самым их распространению, активируют комплемент по классическому пути, стимулируют процессы фагоцитоза и элиминации вредных продуктов. СРБ взаимодействует с Т-лимфоцитами, фагоцитами и тромбоцитами, блокирует высвобождение фактора некроза опухолей из лейкоцитов, ингибирует выработку тромбина и поддерживает целостность сосудистого эпителия от альтерирующего воздействия на него медиаторов и цитокинов.
Сывороточный амилоид А способен усиливать адгезивность и хемотаксис фагоцитарных клеток и лимфоцитов.
Физико-химические изменения в очаге воспаления:
Ишемия, и, в значительно большей степени, венозная гиперемия и стаз, вызывают усиление гликолиза, в результате чего в тканях очага воспаления накапливается молочная кислота; а нарушения липидного обмена ведут к увеличению концентрации свободных жирных кислот и кислых по своей реакции кетоновых тел. Это приводит к тому, что в очаге воспаления накапливается большое количество свободных ионов водорода, то есть развивается состояние ацидоза.
В динамике изменения кислотно-основного состояния при воспалении различают три фазы. В самый начальный период воспалительной реакции развивается кратковременный первичный ацидоз, связанный с ишемией, в процессе которой в тканях увеличивается количество кислых продуктов. При наступлении артериальной гиперемии кислотно-основное состояние в тканях воспалительного очага нормализуется, а затем развивается длительный выраженный метаболический ацидоз, который вначале является компенсированным (происходит снижение щелочных резервов тканей, но их рН не меняется). По мере прогрессирования воспалительного процесса развивается уже некомпенсированный ацидоз вследствие нарастания концентрации свободных водородных ионов и истощения тканевых щелочных резервов. Концентрация водородных ионов повышается тем больше, чем сильнее выражено воспаление. Для гнойного воспаления характерен очень низкий рН (5.0 - 4.0).
В тканях воспалительного очага происходит резкое изменение осмотического и онкотического давления. При альтерации клеток высвобождается большое количество внеклеточного калия. В сочетании с увеличением количества водородных ионов это приводит к гиперионии в очаге воспаления, а последняя, вызывает повышение осмотического давления. Накопление полипептидов и других высокомолекулярных соединений (гиперонкия) приводит к возрастанию онкотического давления. В результате возрастает степень гидратации тканей и их тургор, то есть напряжение, которое при воспалении увеличивается в 7 - 10 раз, что в свою очередь усиливает альтерацию тканей.
Все описанные выше процессы (расширение и увеличение проницаемости микрососудов, физико-химические изменения в очаге воспаления) обеспечивают переход жидкой части крови через сосудистую стенку и образование воспалительного отека. Сдавливание отечной жидкостью микрососудов (в первую очередь – венул) усиливает состояние венозной гиперемии и стаза. Так формируется плазматический компонент экссудации. Одновременно с образованием отека создаются и благоприятные условия для активного перехода лейкоцитов крови через сосудистую стенку и их движения к центру воспалительного очага. Иначе говоря, для клеточной инфильтрации.
Лейкоцитарные реакции:
Завершающим этапом стадии артериальной гиперемии и максимально выражено в стадию венозной гиперемии происходит миграция лейкоцитов в очаг воспаления (рис.1)
Рис. 1.Миграция лейкоцитов в очаг воспаления, роль эндотелиоцитов.
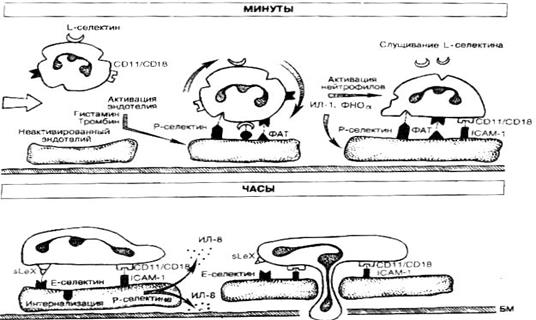
Нейтрофильные лейкоциты способны за 3 – 12 минут пройти через сосудистую стенку и двинуться в очаг воспаления. Массивное проникновение нейтрофилов через сосудистую стенку приходится на первые 2 часа после начала воспалительного процесса, а их максимальное накопление происходит через 4 – 6 часов. Процесс миграции лейкоцитов обеспечивается наличием взаимодействием адгезивных молекул на поверхности эндотелиальных клеток и мембранах лейкоцитов. Медиаторы воспаления увеличивают представительство адгезивных молекул на эндотелии и лейкоцитах. Характер и порядок движения лейкоцитов (нейтрофилов, моноцитов, лимфоцитов) определяется видом адгезивных молекул на эндотелии (см. рис 2):
Представительство адгезивных молекул на эндотелии в динамике воспаления различно (рис.2). В первые минуты активации эндотелия многократно возрастает экспрессия Р-селектина на эндотелии, обеспечивающего роллинг (неселективную адгезию лейкоцитов на эндотелии). Параллельно повышается экспрессия Е-селектина (обеспечивает необратимую адгезию клеток) и снижается к концу первых суток.
ICAM-1,2 (молекулы межклеточной адгезии) постоянно выявляется на покоящихся эндотелиальных клетках. ICAM-1,VCAM-1 (молекула сосудистой адгезии) - при активации эндотелия.
Рис.2. Динамика экспрессии адгезивных молекул на эндотелии при воспалении
 |
Дата: 2019-02-02, просмотров: 350.