Регенерация нервов
Мелисса Стюард, Акшаялакшми Шридар и Джейсон Майер
Тезисы
Регенерация нервной системы после повреждений от болезни или от раны требует либо восстановления, либо замены нервных клеток. В то время как низшие организмы обладают значительным потенциалом в нервной регенерации, высокоразвитые организмы же, включая человека, ограничены в своей способности к регенерации нервных клеток, что создает значительные проблемы для лечения травм и заболеваний нервной системы.
Эта глава посвящена современным подходам к нейронной регенерации, с обсуждением традиционных методов повышения нейронной регенерации, а также новые концепции в пределах таких областей, как стволовые клетки и клеточное перепрограммирование. Стволовые клетки определяются по их способности к самообновлению, а также по их способности дифференцироваться в различные типы клеток, и, следовательно, могут служить в качестве источника замены клеток поврежденных нейронов. Традиционно, взрослые стволовые клетки, выделенные из гиппокампа и субвентрикулярной зоны, послужили источником нервных стволовых клеток для замен. С развитием плюрипотентных стволовых клеток, в том числе человеческих эмбриональных стволовых клеток (ЭСК) и человеческих индуцированных плюрипотентных стволовых клеток (ИПСК), разрабатываются новые и интересные подходы для замены нервных клеток. Кроме того, с лучшим пониманием человеческого генома и эпигенетики, ученые добились успеха в прямом генетическом перепрограммировании соматических клеток, подвергая их нейрональной детерминации, минуя промежуточную стадию плюрипотентности. Такие прорывы ускоряют сроки получения зрелых нейрональных типов клеток из источника соматических клеток, подходящих конкретным пациентам, такие как фибробласты кожи или мононуклеарные клетки крови. В то время как обширные препятствия остаются в применении стратегий стволовых клеток и перепрограммирования, эти подходы произвели революцию в области регенеративной биологии и представили инновационные подходы к потенциальной регенерации нервной системы.
Аббревиатуры
6-OHDA 6-гидроксидофамин
ALS (БАС) Боковой амиотрофический склероз
AMD (ВМД) Возрастная макулярная дегенерация
BAM Brn-2, Ascl1 and Myt1l
BDNF Нейротрофический фактор мозга
bHLH Basic helix loop helix
CNTF цилиарный нейротрофический фактор
DA дофаминергический
EGF Эпидермальный фактор роста
ESCs Эмбриональные стволовые клетки
FAD Наследственный синдром Альцгеймера
FALS Наследственный боковой амиотрофический склероз
FGF2 Фактор роста фибробластов 2
FGF8 Фактор роста фибробластов 8
GDNF Глиальный нейротрофический фактор
hESCs Человеческие эмбриональные стволовые клетки
hPSCs Человеческие плюрипотентные стволовые клетки
iDA Индуцированный дофаминергический
IGF-1 инсулиноподобный ростовой фактор
iMN Индуцированная двигательная клетка переднего рога спинного мозга
iN Индуцированный неврональный
iNPCs Индуцированные нейральные клетки-предшественницы
iPSCs Индуцированные плюрипотентные стволовые клетки
L-DOPA L-3, 4-дигидроксифенилаланин
MEF фибробласт эмбриона мыши
miRNA Микрорибонуклеиновая кислота
mRNA рибонуклеиновая информационная кислота
NCAMs молекулы адгезии нервных клеток
NPCs Нейральные клетки-предшественницы
PB Прерывистая терапия
PD Болезнь Паркинсона
RCS Королевский хирургический колледж
RPE Пигментный эпителий сетчатки
SCNT Перенос ядра соматической клетки
SHH Звуковой ёж
SMA Спинальная мышечная атрофия
SMN1/SMN2 Выживание гена двигательных нейронов 1/2
SOD1 Супероксиддисмутаза
TGF Трансформирующий фактор роста
TH тирозингидроксилаза
Содержание
1 Вступление........................................................................................................................ 165
2 Традиционные подходы для улучшения регенерации центральной нервной системы.................. 168
3 Стволовые клетки в нейральной регенерации................................................................................. 169
3.1 Нервные стволовые клетки при расстройствах двигательных клеток переднего рога спинного мозга..................................................... 170
3.2 Болезнь Паркинсона.................................................................................................. 172
4 Плюрипотентные стволовые клетки в нейральной регенерации............................................................. 174
4.1 Расстройства двигательных клеток переднего рога спинного мозга........................................................................................... 175
4.2 Болезнь Паркинсона.................................................................................................. 176
4.3 Дегенеративные заболевания сетчатки................................................................................ 177
5 Перепрограммирование соматических клеток в нейронной клеточной линии.................................................... 178
5.1 Короткая история прямого перепрограммирования............................................................. 179
5.2 Парадигма прямого перепрограммирования .................................................................. 180
5.3 Методы перепрограммирования в нейральную детерминацию....................................................... 180
5.4 Прямое перепрограммирование в определенные нейральные подтипы.......................................... 182
5.5 Будущие последствия и вопросы о перепрограммировании в отношении регенерации......................................................................................................... 183
Ссылочная литература................................................................................................................................ 184
Вступление
Нервная система представляет собой сложно расположенные нервные клетки, которые координируют действия животного, в том числе передвижение, чувственное восприятие, а также различные аспекты гомеостаза. Информация передается через нервную систему с помощью рядов конкретных типов клеток, в основном за счет действия нейронов, которые отвечают за распространение информации в различные участки тела. Глиальные клетки включают другие основные типы клеток нервной системы, в том числе олигодендроциты, клетки Шванна и астроциты. Олигодендроциты и шванновские клетки служат первичной функцией заключением в оболочку нейронных аксонов, что позволяет эффективно и быстрое проводить нервные импульсы через центральную нервную систему и периферическую нервную системы соответственно. Астроциты играют многочисленные вспомогательные роли в нервной системе, такие, как поддержание ионного гомеостаза, обеспечение трофической поддержки нейронов, утилизация нейромедиатора и ремонт нервной системы из-за травм.
Повреждения нервной системы могут возникнуть в результате физических травм или из-за нейродегенеративных механизмов, связанных с болезнями, но независимо от того, основной причиной повреждения нервной системы, результатом обычно является неспособность нервных клеток передавать нервные импульсы в определенные области нервной системы.
Для того, чтобы восстановить функциональность, должен быть совершен один из трех видов ремонта нервной системы. Один такой тип ремонта – это восстановление нейрональных аксонов, которые были повреждены, в то время как остальные компоненты нейронов, в том числе тела клетки, остаются избавлены от повреждений. Альтернативные подходы будут включать восстановление поврежденных нервных клеток, а также генерацию новых нейронов, чтобы заменить те, что были утрачены. В то время как эти три механизма восстановления нервной системы представляют собой потенциальные стратегии, которые бы теоретически преодолели все виды ущерба и/или дегенерации, успешная реализация этих стратегий, как правило, осуществляется только в определенных областях нервной системы, а также в пределах нервной системы определенных видов животных, эволюционно более низких, при том обладающих большими регенеративными возможностями, чем у высших организмов.
В этих высших организмах, которые владеют ограниченной регенерацией нервной системы, такой ремонт нервной системы часто успешно достигается в периферической нервной системе и с ограниченно в центральной нервной системе. Основание для этого несоответствия не находится самих в нейронах, а, скорее, в глиальных клетках, обнаруженных в периферической нервной системе, по сравнению с теми, что в центральной нервной системе (Хюбнер и Штриттматтер 2009).
Среда периферической нервной системы отличается от центральной нервной системы, в значительной степени из-за присутствия шванновских клеток, обеспечивающих изоляцию миелина от аксонов нейронов, в то время как нейроны центральной нервной системы облачены олигодендроцитами.
Шванновские клетки обеспечивают благоприятные условия для регенерации в периферической нервной системе не только для периферийных нейронов, но и для тех нейронов центральной нервной системы, чьи аксоны распространяются на периферическую нервную систему.
Это благоприятная среда, обеспеченная шванновскими клетками, связана с несколькими факторами. Во-первых, шванновские клетки периферической нервной системы, как известно, продуцируют и секретируют многочисленные белки внеклеточного матрикса, в частности ламинин и фибронектин, которые служат обеспечению регенерации поврежденных аксонов (Bailey et al. 1993). Кроме того, в то время как белки внеклеточного матрикса прокладывают путь для регенерации аксонов, эти аксоны требуют вспомогательных факторов для дальнейшей помощи в прокладывании пути, чтобы дальше эффективно регенерировать всю область травмы. Чтобы преодолеть эту проблему, шванновские клетки также регулируют экспрессию различных белков клеточной адгезии в ответ на повреждения, в том числе нервные молекулы клеточной адгезии (NCAMs), а также членов кадгеринового семейства, в частности N-кадгерин (Торнтон et al. 2005). Эти белки клеточной адгезии, экспрессированные шванновские клетки служат в качестве связывающих партнеров для соответствующих белков адгезии, экспрессированный конусом роста аксонов, позволяя тем самым эти конусы роста перемещаться по месту повреждения и в конечном итоге сформировывать соответствующие синаптические связи с клетками-мишенями. Третий регенеративный механизм, обеспечиваемый шванновскими клетками, заключается в их способности продуцировать и секретировать различные нейротрофических факторы в ответ на травму, в том числе нейротрофический фактор головного мозга (BDNF), цилиарный нейротрофический фактор (CNTF) и глиальный нейротрофический фактор (GDNF) (Фростик et al. 1998; Теренги 1999). Наличие этих нейротрофических факторов, вероятно, служит для запуска программы регенерации поврежденных нейронов, что приводит к образованию конуса роста и инициирования прокладывания пути в конусе роста. Эти нейротрофические факторы могут также служить для обеспечения целевого сигнала для этих конусов роста, чтобы гарантировать, что они находят соответствующую цель. В центральной нервной системе, тем не менее, регенеративная способность значительно снижается по сравнению с периферической нервной системы. Тем не менее, эта разница во многом связана с окружающей средой внутри самой центральной нервной системы, в том числе в глиальных клетках (Fawcett 2006; Fawcett and Asher 1999; Yiu and He 2006). Первостепенное значение имеет тот факт, что в центральной нервной системе нейронные аксоны миелинизированы олигодендроцитами, а не шванновскими клетками периферической нервной системы. Многочисленные различия между этими двумя типами клеток, которые могут объяснить их дифференцированное воздействие на регенерацию периферической и центральной нервных систем (Fawcett 2006; Yiu and He 2006). Во-первых, после повреждения в периферической нервной системе, шванновские клетки могут стать пролиферативными снова и тем самым заменить на другие шванновские клетки, которые были потеряны при лечении повреждения. Олигодендроциты центральной нервной системы, однако, не пролиферируют в ответ на повреждение и, таким образом, те олигодендроциты, что потеряны, не заменяются.
Из-за этого, путь для регенерации аксонов не установлен в центральной нервной системе и аксональные конусы роста не способны надлежаще пролагать путь. Кроме того, остальные олигодендроциты после травмы не демонстрируют аналогичную стимуляцию роста по сравнению с шванновскими клетками, и, таким образом, внеклеточная среда в пределах центральной нервной системы после повреждения гораздо меньшей степени способствует восстановлению аксонов. Помимо различий между олигодендроцитами и шванновскими клетками, другие факторы в пределах центральной нервной системы также действуют в качестве барьера для нейральной регенерации. Другим важным фактором является степень гибели клеток, которая происходит в центральной нервной системе как реакция на повреждение (Horner and Gage 2000; Springer 2002). После травмы в области нервной системы, часто не только непосредственно поврежденные нейроны подвергаются апоптозу, но и нейроны в окружающем районе. Таким образом, площадь, пострадавшая от травм, значительно увеличивается за пределы тех клеток, которые были непосредственно затронуты травмой, и таким образом часто увеличивают тяжесть травмы. Увеличенная площадь повреждения также имеет глубокие последствия для регенерации аксонов, так как не только большим аксонам будет необходимо регенерировать, но и ей, вероятно, потребуется восстановление на большом расстоянии. Кроме того, после апоптотических событий из-за повреждения центральной нервной системы, также будет необходимо в конечном итоге заменить нейроны, которые были потеряны в этом процессе.
Дополнительным препятствием для регенерации центральной нервной системы будет множество глиальных клеток, которые остаются в поврежденной области. В ответ на повреждение, глиальные клетки центральной нервной системы, в частности, те, что в противном случае будет существовать в состоянии покоя, могут начать размножаться и образовать глиальные шрамы, который, по существу, служит в качестве физического барьера для регенерации аксонов (Bahr and Bonhoeffer 1994; Horner and Gage 2002). Эти глиальные клетки также продуцируют и секретируют ряд сигнальных факторов, в том числе членов семьи трансформирующего фактора роста (TGF), которые в значительной степени служат гибели клеток. Другие сигнальные факторы, продуцируемые этими глиальными клетками, могут служить в качестве нейропротекторов, чтобы помочь спасти поврежденные нейроны, но, тем не менее, сигналы, стимулирующие рост, предоставляемый этими глиальными клетками, в основном отсутствуют.
Болезнь Паркинсона
Болезнь Паркинсона (PD) - нейродегенеративное заболевание, которое приводит к прогрессирующей дегенерации дофаминергических (DA) нейронов в черной субстанции среднего мозга. DA-нейроны характеризуются выделением допамина в качестве нейромедиатора, который в свою очередь регулирует несколько путей в мозге, таких как те, что регулируют удовольствие и контроль двигательных функций. При PD производство дофамина снижается, связано это с возможным вырождением DA-нейронов (Дэви 2008). Симптомы этого заболевания включают в себя жесткость, медленное движение, тремор, поражение ходьбы и осанки, а иногда и слабоумие. Подобно ALS, болезнь протекает в двух формах: семейной и спорадической; некоторые формы семейной PD связаны с мутациями в белке-синуклеина, ведущего к его накоплению в виде кластеров, называемых Тельца Леви, в то время как мутации в Паркин приводят к PD в отсутствие телец (Chung и др. 2001). В отличие от некоторых других нейродегенеративных заболеваний, PD ограничивается одним подтипом нейронов, и внешними добавками допамина было доказано, что они могут быть эффективными в течение короткого периода времени. Следовательно, в настоящее время терапии PD включают L-3, 4-дигидроксифенилаланина (L-ДОФА) в дополнение к потере допамина через внешние источники (Первс и др. 2008). Тем не менее, неспособность L-ДОФА пересечь гематоэнцефалический барьер в связке с противоречивым уровнем дофамина приводит к повторного возникновения симптомов. Следовательно, несмотря на то, что медикаментозное лечение полезно, оно не обеспечивает долгосрочного облегчения или нейропротекции умирающих нейронов DA путем замены поврежденных нейронов DA. Таким образом, усилия были сосредоточены на трансплантации нейронов, которые могут интегрироваться в существующие схемы доставки допамина или трансплантации клеток, которые поддерживают концентрацию дофамина (Tsui и Isacson 2011; Wijeyekoon и Баркер, 2009). Трансплантация эмбриональной мезенцефалической ткани у пациентов с показало, что восстановление работоспособности в стриатуме приводит к увеличению высвобождения допамина (Линдваль и Бьорклунд 2011). Эти трансплантаты успешно были интегрированы в мозг пациента и сохраняли функциональность сроком до 10 лет
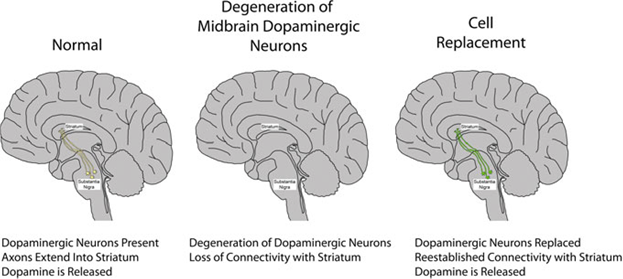
Рис. 2 Стратегии нейральной регенерации для дофаминергических нейронов. В среднем мозге, дофаминергические нейроны обычно находятся в пределах черной субстанции и расширяют аксоны в стриатум, где высвобождается допамин. После дегенерации дофаминергических нейронов из-за таких болезней, как PD, стриатальные нейроны теряют свой дофаминергический вклад. Благодаря использованию стволовых клеток есть надежда, что дофаминергические нейроны среднего мозга можно заменить и в конечном итоге восстановить связь с стриатумом.
после трансплантации (Пиччини и др. 1999). К сожалению, не все результаты таких экспериментов были столь эффективными. В некоторых клинических испытаниях пациенты мало или вообще не восстанавливались после 2-х лет (Freed et al 2001; Olanow et al 2003). Ряд таких факторов, как иммунное отторжение и крайние степени тяжести заболеваний влияют на воспроизводимость этих экспериментов. Кроме того, эмбриональные теменные ткани ограничены в количестве и не так легко доступны, что еще больше усложняет возможность лечения с помощью этого источника ткани. Тем не менее, эти эксперименты помогли продемонстрировать, что эксперименты по замене клеток потенциально могут быть успешны у пациентов с PD и заложили основу для исследований стволовых клеток в этой области.
Таким образом, нейронные стволовые клетки дают уникальную возможность обеспечить расширяемую популяцию клеток, которые потенциально могут быть использованы для трансплантации к животным с PD (рис. 2). Опытным путем было показано, что трансплантация нервных стволовых клеток в стриатумы 6-гидроксидопамина (6-OHDA) крысы с PD приводит к долгосрочной выживаемости этих клеток, наряду с небольшим отрастанием аксонов от пересаженных клеток (Armstrong et al 2003; Harrower et al 2006). Тем не менее, хотя и результаты этих исследований были многообещающими, эти клетки не дифференцируются в DA-нейроны, которые были бы необходимы, чтобы заменить те клетки, которые были потеряны. Таким образом, альтернативные подходы были сосредоточены на способности нервных стволовых клеток служить в качестве носителя для доставки фактора роста к стриатумам в попытке спасти носителей DA-нейронов, тем самым замедляя или предотвращая прогрессирование заболеваний (Akerud et al 2001; Behrstock et al 2006; Ebert et al 2008). Фактор роста, GDNF, был идентифицирован в качестве оптимального кандидата на спасителя фактора клеток роста, так как предыдущие исследования показали, что нервные стволовые клетки, избыточно экспрессирующие GDNF, могут повысить выживаемость принимающих DA-нейроны (Akerud et al 2001; Behrstock et al 2006), и даже восстановить некоторую степень функциональных возможностей принимающих нейронов (Ebert et al 2008), демонстрируя тем самым потенциал рекуперативного использования нейронных стволовых клеток.
Интересно, что также было показано, что инсулиноподобный ростовой фактор (IGF-1) имеет функциональный эффект у животных с болезнью Паркинсона. Тем не менее, в отличие от повышенного проростания невритов, связанного с доставкой GDNF, IGF-1 по-видимому действует как фактор выживания для обоих принимающих нейронов, а также пересаженных стволовых клеток. Таким образом, использование нейронных стволовых клеток для регенеративных целей в лечении PD оказалось в некоторой степени успешной на сегодняшний день.
Принимая во внимание способность нервных стволовых клеток быть расширенной в лабораторных условиях, наряду со способностью к генной инженерии этих клеток для роли средства доставки критических факторов роста, эти клетки чрезвычайно перспективны для нейронно-регенеративных подходов.
Болезнь Паркинсона
Подобно заболеваниям двигательных нейронов, указанным выше, PD также потребует замены нейронов, если они были потеряны (рис. 2). В последнее десятилетие были опубликованы многие протоколы, демонстрирующие вывод функциональных нейронов DA из hPSCs (Cho et al. 2008; Cooper et al. 2010; Hu and Zhang 2009; Perrier et al. 2004; Soldner et al. 2009; Sonntag et al. 2007; Swistowski et al. 2010). По аналогии с другими протоколами дифференцировки, дифференцировка облегчена использованием экзогенных факторов, таких как FGF8 для обеспечения идентичности среднего мозга, а позже дополнены такими факторами, как SHH. Другие протоколы также направлены на ингибирование сигнализации SMAD в сочетании с добавлением факторов, важных для производства DA-нейронов, таких как SHH, ингибиторы WNT, BDNF, GDNF, цАМФ и TGFb3 (Kriks et al. 2011). Зрелые клетки были получены после минимума (1 месяца), DA-нейроны среднего мозга были идентифицированы по наличию маркеров, таких как BIII-тубулина, тирозин гидроксилазе (TH), LMX1A, NURR и EN-1. Кроме того, другие исследования показали, что после трансплантации, hPSCs, которые были дифференцированы на DA-судьбу в пробирке, могут обратить вспять симптомы PD у животных (Ben-Hur et al. 2004; Hargus et al. 2010; Roy et al. 2006; Yang et al. 2008). Недавний прорыв - вывод большого числа функциональных нейронов DA из hESCs с использованием протокола SMAD-торможения (Kriks et al. 2011). При трансплантации в крыс и мышей с PD, большое количество DA-нейронов выживали в носителе в течение по крайней мере 4-5 месяцев. Более того, была продемонстрирована способность дофаминергических нейронов успешно иннервировать стриатум и аксоны не менее чем на 3 мм, а также с возможностью обратить вспять симптомов PD у животных.
Регенерация нервов
Мелисса Стюард, Акшаялакшми Шридар и Джейсон Майер
Тезисы
Регенерация нервной системы после повреждений от болезни или от раны требует либо восстановления, либо замены нервных клеток. В то время как низшие организмы обладают значительным потенциалом в нервной регенерации, высокоразвитые организмы же, включая человека, ограничены в своей способности к регенерации нервных клеток, что создает значительные проблемы для лечения травм и заболеваний нервной системы.
Эта глава посвящена современным подходам к нейронной регенерации, с обсуждением традиционных методов повышения нейронной регенерации, а также новые концепции в пределах таких областей, как стволовые клетки и клеточное перепрограммирование. Стволовые клетки определяются по их способности к самообновлению, а также по их способности дифференцироваться в различные типы клеток, и, следовательно, могут служить в качестве источника замены клеток поврежденных нейронов. Традиционно, взрослые стволовые клетки, выделенные из гиппокампа и субвентрикулярной зоны, послужили источником нервных стволовых клеток для замен. С развитием плюрипотентных стволовых клеток, в том числе человеческих эмбриональных стволовых клеток (ЭСК) и человеческих индуцированных плюрипотентных стволовых клеток (ИПСК), разрабатываются новые и интересные подходы для замены нервных клеток. Кроме того, с лучшим пониманием человеческого генома и эпигенетики, ученые добились успеха в прямом генетическом перепрограммировании соматических клеток, подвергая их нейрональной детерминации, минуя промежуточную стадию плюрипотентности. Такие прорывы ускоряют сроки получения зрелых нейрональных типов клеток из источника соматических клеток, подходящих конкретным пациентам, такие как фибробласты кожи или мононуклеарные клетки крови. В то время как обширные препятствия остаются в применении стратегий стволовых клеток и перепрограммирования, эти подходы произвели революцию в области регенеративной биологии и представили инновационные подходы к потенциальной регенерации нервной системы.
Аббревиатуры
6-OHDA 6-гидроксидофамин
ALS (БАС) Боковой амиотрофический склероз
AMD (ВМД) Возрастная макулярная дегенерация
BAM Brn-2, Ascl1 and Myt1l
BDNF Нейротрофический фактор мозга
bHLH Basic helix loop helix
CNTF цилиарный нейротрофический фактор
DA дофаминергический
EGF Эпидермальный фактор роста
ESCs Эмбриональные стволовые клетки
FAD Наследственный синдром Альцгеймера
FALS Наследственный боковой амиотрофический склероз
FGF2 Фактор роста фибробластов 2
FGF8 Фактор роста фибробластов 8
GDNF Глиальный нейротрофический фактор
hESCs Человеческие эмбриональные стволовые клетки
hPSCs Человеческие плюрипотентные стволовые клетки
iDA Индуцированный дофаминергический
IGF-1 инсулиноподобный ростовой фактор
iMN Индуцированная двигательная клетка переднего рога спинного мозга
iN Индуцированный неврональный
iNPCs Индуцированные нейральные клетки-предшественницы
iPSCs Индуцированные плюрипотентные стволовые клетки
L-DOPA L-3, 4-дигидроксифенилаланин
MEF фибробласт эмбриона мыши
miRNA Микрорибонуклеиновая кислота
mRNA рибонуклеиновая информационная кислота
NCAMs молекулы адгезии нервных клеток
NPCs Нейральные клетки-предшественницы
PB Прерывистая терапия
PD Болезнь Паркинсона
RCS Королевский хирургический колледж
RPE Пигментный эпителий сетчатки
SCNT Перенос ядра соматической клетки
SHH Звуковой ёж
SMA Спинальная мышечная атрофия
SMN1/SMN2 Выживание гена двигательных нейронов 1/2
SOD1 Супероксиддисмутаза
TGF Трансформирующий фактор роста
TH тирозингидроксилаза
Содержание
1 Вступление........................................................................................................................ 165
2 Традиционные подходы для улучшения регенерации центральной нервной системы.................. 168
3 Стволовые клетки в нейральной регенерации................................................................................. 169
3.1 Нервные стволовые клетки при расстройствах двигательных клеток переднего рога спинного мозга..................................................... 170
3.2 Болезнь Паркинсона.................................................................................................. 172
4 Плюрипотентные стволовые клетки в нейральной регенерации............................................................. 174
4.1 Расстройства двигательных клеток переднего рога спинного мозга........................................................................................... 175
4.2 Болезнь Паркинсона.................................................................................................. 176
4.3 Дегенеративные заболевания сетчатки................................................................................ 177
5 Перепрограммирование соматических клеток в нейронной клеточной линии.................................................... 178
5.1 Короткая история прямого перепрограммирования............................................................. 179
5.2 Парадигма прямого перепрограммирования .................................................................. 180
5.3 Методы перепрограммирования в нейральную детерминацию....................................................... 180
5.4 Прямое перепрограммирование в определенные нейральные подтипы.......................................... 182
5.5 Будущие последствия и вопросы о перепрограммировании в отношении регенерации......................................................................................................... 183
Ссылочная литература................................................................................................................................ 184
Вступление
Нервная система представляет собой сложно расположенные нервные клетки, которые координируют действия животного, в том числе передвижение, чувственное восприятие, а также различные аспекты гомеостаза. Информация передается через нервную систему с помощью рядов конкретных типов клеток, в основном за счет действия нейронов, которые отвечают за распространение информации в различные участки тела. Глиальные клетки включают другие основные типы клеток нервной системы, в том числе олигодендроциты, клетки Шванна и астроциты. Олигодендроциты и шванновские клетки служат первичной функцией заключением в оболочку нейронных аксонов, что позволяет эффективно и быстрое проводить нервные импульсы через центральную нервную систему и периферическую нервную системы соответственно. Астроциты играют многочисленные вспомогательные роли в нервной системе, такие, как поддержание ионного гомеостаза, обеспечение трофической поддержки нейронов, утилизация нейромедиатора и ремонт нервной системы из-за травм.
Повреждения нервной системы могут возникнуть в результате физических травм или из-за нейродегенеративных механизмов, связанных с болезнями, но независимо от того, основной причиной повреждения нервной системы, результатом обычно является неспособность нервных клеток передавать нервные импульсы в определенные области нервной системы.
Для того, чтобы восстановить функциональность, должен быть совершен один из трех видов ремонта нервной системы. Один такой тип ремонта – это восстановление нейрональных аксонов, которые были повреждены, в то время как остальные компоненты нейронов, в том числе тела клетки, остаются избавлены от повреждений. Альтернативные подходы будут включать восстановление поврежденных нервных клеток, а также генерацию новых нейронов, чтобы заменить те, что были утрачены. В то время как эти три механизма восстановления нервной системы представляют собой потенциальные стратегии, которые бы теоретически преодолели все виды ущерба и/или дегенерации, успешная реализация этих стратегий, как правило, осуществляется только в определенных областях нервной системы, а также в пределах нервной системы определенных видов животных, эволюционно более низких, при том обладающих большими регенеративными возможностями, чем у высших организмов.
В этих высших организмах, которые владеют ограниченной регенерацией нервной системы, такой ремонт нервной системы часто успешно достигается в периферической нервной системе и с ограниченно в центральной нервной системе. Основание для этого несоответствия не находится самих в нейронах, а, скорее, в глиальных клетках, обнаруженных в периферической нервной системе, по сравнению с теми, что в центральной нервной системе (Хюбнер и Штриттматтер 2009).
Среда периферической нервной системы отличается от центральной нервной системы, в значительной степени из-за присутствия шванновских клеток, обеспечивающих изоляцию миелина от аксонов нейронов, в то время как нейроны центральной нервной системы облачены олигодендроцитами.
Шванновские клетки обеспечивают благоприятные условия для регенерации в периферической нервной системе не только для периферийных нейронов, но и для тех нейронов центральной нервной системы, чьи аксоны распространяются на периферическую нервную систему.
Это благоприятная среда, обеспеченная шванновскими клетками, связана с несколькими факторами. Во-первых, шванновские клетки периферической нервной системы, как известно, продуцируют и секретируют многочисленные белки внеклеточного матрикса, в частности ламинин и фибронектин, которые служат обеспечению регенерации поврежденных аксонов (Bailey et al. 1993). Кроме того, в то время как белки внеклеточного матрикса прокладывают путь для регенерации аксонов, эти аксоны требуют вспомогательных факторов для дальнейшей помощи в прокладывании пути, чтобы дальше эффективно регенерировать всю область травмы. Чтобы преодолеть эту проблему, шванновские клетки также регулируют экспрессию различных белков клеточной адгезии в ответ на повреждения, в том числе нервные молекулы клеточной адгезии (NCAMs), а также членов кадгеринового семейства, в частности N-кадгерин (Торнтон et al. 2005). Эти белки клеточной адгезии, экспрессированные шванновские клетки служат в качестве связывающих партнеров для соответствующих белков адгезии, экспрессированный конусом роста аксонов, позволяя тем самым эти конусы роста перемещаться по месту повреждения и в конечном итоге сформировывать соответствующие синаптические связи с клетками-мишенями. Третий регенеративный механизм, обеспечиваемый шванновскими клетками, заключается в их способности продуцировать и секретировать различные нейротрофических факторы в ответ на травму, в том числе нейротрофический фактор головного мозга (BDNF), цилиарный нейротрофический фактор (CNTF) и глиальный нейротрофический фактор (GDNF) (Фростик et al. 1998; Теренги 1999). Наличие этих нейротрофических факторов, вероятно, служит для запуска программы регенерации поврежденных нейронов, что приводит к образованию конуса роста и инициирования прокладывания пути в конусе роста. Эти нейротрофические факторы могут также служить для обеспечения целевого сигнала для этих конусов роста, чтобы гарантировать, что они находят соответствующую цель. В центральной нервной системе, тем не менее, регенеративная способность значительно снижается по сравнению с периферической нервной системы. Тем не менее, эта разница во многом связана с окружающей средой внутри самой центральной нервной системы, в том числе в глиальных клетках (Fawcett 2006; Fawcett and Asher 1999; Yiu and He 2006). Первостепенное значение имеет тот факт, что в центральной нервной системе нейронные аксоны миелинизированы олигодендроцитами, а не шванновскими клетками периферической нервной системы. Многочисленные различия между этими двумя типами клеток, которые могут объяснить их дифференцированное воздействие на регенерацию периферической и центральной нервных систем (Fawcett 2006; Yiu and He 2006). Во-первых, после повреждения в периферической нервной системе, шванновские клетки могут стать пролиферативными снова и тем самым заменить на другие шванновские клетки, которые были потеряны при лечении повреждения. Олигодендроциты центральной нервной системы, однако, не пролиферируют в ответ на повреждение и, таким образом, те олигодендроциты, что потеряны, не заменяются.
Из-за этого, путь для регенерации аксонов не установлен в центральной нервной системе и аксональные конусы роста не способны надлежаще пролагать путь. Кроме того, остальные олигодендроциты после травмы не демонстрируют аналогичную стимуляцию роста по сравнению с шванновскими клетками, и, таким образом, внеклеточная среда в пределах центральной нервной системы после повреждения гораздо меньшей степени способствует восстановлению аксонов. Помимо различий между олигодендроцитами и шванновскими клетками, другие факторы в пределах центральной нервной системы также действуют в качестве барьера для нейральной регенерации. Другим важным фактором является степень гибели клеток, которая происходит в центральной нервной системе как реакция на повреждение (Horner and Gage 2000; Springer 2002). После травмы в области нервной системы, часто не только непосредственно поврежденные нейроны подвергаются апоптозу, но и нейроны в окружающем районе. Таким образом, площадь, пострадавшая от травм, значительно увеличивается за пределы тех клеток, которые были непосредственно затронуты травмой, и таким образом часто увеличивают тяжесть травмы. Увеличенная площадь повреждения также имеет глубокие последствия для регенерации аксонов, так как не только большим аксонам будет необходимо регенерировать, но и ей, вероятно, потребуется восстановление на большом расстоянии. Кроме того, после апоптотических событий из-за повреждения центральной нервной системы, также будет необходимо в конечном итоге заменить нейроны, которые были потеряны в этом процессе.
Дополнительным препятствием для регенерации центральной нервной системы будет множество глиальных клеток, которые остаются в поврежденной области. В ответ на повреждение, глиальные клетки центральной нервной системы, в частности, те, что в противном случае будет существовать в состоянии покоя, могут начать размножаться и образовать глиальные шрамы, который, по существу, служит в качестве физического барьера для регенерации аксонов (Bahr and Bonhoeffer 1994; Horner and Gage 2002). Эти глиальные клетки также продуцируют и секретируют ряд сигнальных факторов, в том числе членов семьи трансформирующего фактора роста (TGF), которые в значительной степени служат гибели клеток. Другие сигнальные факторы, продуцируемые этими глиальными клетками, могут служить в качестве нейропротекторов, чтобы помочь спасти поврежденные нейроны, но, тем не менее, сигналы, стимулирующие рост, предоставляемый этими глиальными клетками, в основном отсутствуют.
Традиционные подходы по улучшению регенерации центральной нервной системы
Из-за обобщенной неспособности центральной нервной системы регенерировать из-за травм и болезней, большие усилия были предприняты для улучшения регенеративных способностей нейронов центральной нервной системы. Учитывая, что гораздо большая степень регенерации нейронов наблюдается в периферической нервной системе, одним из первых усилий по улучшению регенерации центральной нервной системы стала трансплантация периферических нервов в центральную нервную систему. Прекрасный пример этого есть в исследовании Со и Агуайо (1985), в котором регенерация зрительного нерва была представлена возможной за счет использования периферических нервных трансплантатов. После аксотомии зрительного нерва, регенерация этих аксонов, как правило, не достигается из-за негостеприимной среды в пределах центральной нервной системы. Тем не менее, когда часть седалищного нерва была помещена рядом с местом аксотомии, где другой конец седалищного нерва соединен с высшим двухолмием, аксоны зрительного нерва были способны к значительной регенерации с помощью трансплантата периферического нерва в двухолмии. Такие эксперименты подтвердили принцип неспособности центральной нервной системы аксонов к регенерации, вероятно, не из-за присущих особенностей этих нейронов, а скорее из-за экологических факторов в пределах центральной нервной системы. Таким образом, большие усилия были сосредоточены на модуляции окружающей среды в пределах центральной нервной системы, в надежде, что эти подходы могут потенциально привести к повышенной регенерации аксонов.
В дополнение к выделению факторов, указанных ранее, астроциты центральной нервной системы, как известно, производят протеогликаны сульфата хондроитина в ответ на повреждения. Появление этих хондроитинсульфат протеогликанов сохраняется в течение нескольких месяцев после травмы, и было продемонстрировано, что является их наличие важным компонентом, лежащим в основе неспособности центральной нервной системы аксонов к регенерации (Лаабс et al. 2005). На основе экспериментов в пробирке с реактивными астроцитами, экспрессия хондроитинсульфат протеогликанов была в значительной степени ответственна за отказ нейронов в спинальных ганглиях расширить аксональные проекции (Smith-Thomas et al. 1995). Кроме того, эксперименты в естественных условиях с участием трансплантации нейронов ганглиев дорзальных корешков показывают, что они способны расширить аксоны в неповрежденной центральной нервной системе, но не в состоянии сделать это через эти поврежденные участки, богатые хондроитинсульфат протеогликанами (Davies et al. 1997, 1999; Silver and Miller 2004).
Кроме того, некоторые белки, найденные в пределах нервной системы, также были продемонстрированы в качестве препятствия на пути регенерации аксонов. Пожалуй, наиболее изученный класс таких белков известны как белки Nogo, с особым вниманием к Nogo-A (Grandpre и Strittmatter 2001; Zorner и Schwab 2010). Белки Nogo, как следует из их названия, служат в качестве ингибитора регенерации аксонов после травмы, и наиболее часто ассоциированы с миелинизацией в центральной нервной системе. Исследования показали, что методы обхода взаимодействия Nogo с регенерацией аксонов приводят к усилению регенерации и потенциальному расширению аксонов в глиальных рубцах. Предыдущие исследования показали, что у мышей, лишенных Nogo-A, кора головного мозга и спинного мозга обладают повышенной регуляцией экспрессии генов, связанных с ростом (Montani и др. 2009). Кроме того, использование антител Nogo-A-специфический продемонстрировало повышение всходов нейритов, в том числе регуляция белков, связанных с ростом (Craveiro и др 2008;. Zorner и Schwab 2010). Совсем недавно, такой подход с использованием антител против Nogo-A был использован в ходе первого этапа клинических испытаний для пациентов с повреждениями спинного мозга, с конечной целью повышения нейронной регенерации из-за травмы, удаляя ингибирование вследствие экспрессии белка Nogo (Hawryluk и др . аль 2008; Zorner и Schwab 2010).
Дата: 2019-02-02, просмотров: 339.