Химическая термодинамика – это наука, изучающая переходы энергии из одной формы в другую и из одной системы в другую. Она изучает химические системы термодинамическими функциями. U – внутренняя энергия, H – энтальпия, S – энтропия, G – свободная энергия Гиббса. Все эти функции зависят от P, V и Т, а также от начального и конечного состояния системы.
Изменение внутренней энергии системы под воздействием внешних факторов определяется по первому закону термодинамики: DU = Q – A.
1 Закон термодинамики: в любом процессе увеличение внутренней энергии системы равно количеству сообщенной системе теплоты минус количество работы, совершенной системой. Как известно из физики: А = PDV.
Если V = const, то DV = 0 и DU = QV. В изохорном процессе (то есть при постоянном объеме) изменение внутренней энергии системы равно количеству сообщенной или расходованной теплоты.
Если Р = const, то QP = DU + PDV. Величина Н = U + PV получила название энтальпии. В изобарном процессе (то есть при постоянном давлении) тепловой эффект реакции равен изменению энтальпии процесса: QP = DH = H2 – H1.
Таким образом, тепловые эффекты всех реакций рассчитывают, принимая давление постоянным.
Тепловые эффекты реакций принято относить к одному молю вещества. Количество теплоты, которое выделяется при образовании одного моля соединения из простых веществ называется теплотой образования данного соединения. Если элемент существует в виде нескольких аллотропических модификаций, то при расчете теплоты образования учитывается та форма элемента, которая наиболее устойчива при стандартных условиях.
Если при написании уравнения химического процесса справа записать тепловой эффект реакции DН, то уравнение называется термохимическим. В термохимическом уравнении химические символы обозначают не атомы или молекулы, а моли. Обязательно записывается агрегатное состояние вещества для данной реакции. Для кристаллического состояния (к), твердого (тв), жидкого (ж), газообразного (г). В случае экзотермического эффекта он записывается со знаком "плюс", в случае эндотермического – со знаком "минус". Например:
N2 + O2 = 2NO –180,5 кДж;
1/2N2 + 1/2O2 = NO –90,25 кДж.
Таким образом, теплота образования оксида азота(II) равна –90,25 кДж/моль или при образовании 1 моля NO поглощается 90,25 кДж.
При экзотермическом процессе выделяется теплота, следовательно, снижается внутренняя энергия системы и энтальпия: DU, DН < 0. При поглощении теплоты в эндотермическом процессе внутренняя энергия системы и энтальпия возрастают – DU, DН > 0.
Кроме теплоты образования важной характеристикой веществ является теплота, выделяющаяся при сгорании. Например: теплота сгорания ацетилена равна 1300 кДж/моль или С2Н2 + 2,5О2 = Н2О + СО2 + 1300 кДж.
Величина теплового эффекта зависит от природы исходных веществ и продуктов реакции, агрегатного состояния веществ и температуры. Для удобства все эффекты и теплоты образования указывают при стандартной температуре (25 0С или 298 К).
Основной принцип, на основе которого ведутся все термохимические расчеты, называется законом Гесса: тепловой эффект реакции DН зависит от начального и конечного состояния вещества и не зависит от числа промежуточных стадий.
Сграфит + 0,5О2 = СО + 110,5 кДж (1)
СО + 0,5О2 = СО2 + 283 кДж (2)
Сграфит + О2 = СО2 + 393,5 кДж (3)
Тепловой эффект реакции (3) равен сумме тепловых эффектов первых двух реакций, поскольку общее химическое уравнение реакций (1) и (2) равно реакции (3).
Закон Гесса вытекает из закона сохранения энергии. Практически важное следствие из закона Гесса – он используется для выражения величины теплового эффекта реакции через энтальпии образования: тепловой эффект химической реакции DН равен сумме энтальпий образования получающихся веществ за вычетом суммы энтальпий образования исходных веществ с учетом их стехиометрических коэффициентов: DН = SDНпрод - SDНисх.
аА + bВ = сС + dD;
DН = (сDНС + dDНD) – (aDHA + bDНB)
S – энтропия – это термодинамическая функция, являющаяся мерой неупорядоченности системы.
Характеристика состояния, основанная на измерении общих параметров системы, то есть P, V и Т, выражает так называемое макросостояние системы. Характеристика системы, основанная на определении координат и скорости каждой частицы, соответствует микросостоянию системы.
Например, в данном объеме при заданных температуре и давлении находятся 2 частицы. Если принять, что P, V и Т – const, то скорости и координаты частиц могут быть самыми разными, главное, чтобы средняя скорость и геометрически усредненное местоположение их были одинаковы. Таким образом, для одного единственного макросостояния возможно много микросостояний и чем их больше, тем больше беспорядочность в данной системе.
Число микросостояний, обеспечивающих данное макросостояние, называется термодинамической вероятностью состояния.
S [Дж/моль×К] = R×lnW, где W – термодинамическая вероятность.
DS = S1 – S0 = R×lnW1/W0
2 Закон термодинамики: состояние системы, предоставленной самой себе, изменяется в направлении состояния, обладающего максимальной термодинамической вероятностью, то есть в сторону увеличения энтропии.
Вторая формулировка: теплота не может сама переходить от холодного тела к горячему. Рисунок.
Энтропия единственная термодинамическая функция, для которой можно измерить ее абсолютное значение. При температуре абсолютного нуля энтропия идеального кристалла равна нулю.
Изменение энтропии в ходе химическое реакции определяется по аналогии с законом Гесса:
аА + bВ = сС + dD;
DS = (сDSС + dDSD) – (aDSA + bDSB)
Энергия Гиббса: G = H – TS или DG = DН – TDS при T = const; P = const.
О направлении химического процесса говорит правило Гиббса: в изолированных закрытых системах принципиально возможно самопроизвольное протекание процессов, для которых значение энергии Гиббса понижается. Для изолированной системы DН = 0, следовательно, DG = –TDS < 0. Чтобы изменение энергии Гиббса было отрицательно, энтропия системы должна увеличиваться, следовательно, самопроизвольно протекают процессы, протекающие с увеличением энтропии.
Как известно, существуют необратимые и обратимые реакции. Тип реакции и ее направление зависит от изменения энтальпии и энтропии процесса. Эту зависимость можно представить в виде таблицы.
| DН | DS | Направление процесса |
| < 0 | > 0 | Необратимо идет прямая реакция |
| > 0 | < 0 | Необратимо идет обратная реакция |
| > 0 | > 0 | Реакция обратима, при повышении Т идет прямая реакция |
| < 0 | < 0 | Реакция обратима, при повышении Т идет обратная реакция |
Стандартные энергии Гиббса образования – это изменение свободной энергии соответствующее синтезу моля вещества из простых веществ при стандартных условиях.
Изменение энергии Гиббса в процессе химической реакции находится по аналогии с правилом Гесса:
аА + bВ = сС + dD;
DG = (сDGС + dDGD) – (aDGA + bDGB)
Изменение энергии Гиббса связано с константой равновесия реакции следующим уравнением: DG = –RTlnK
При вычислении стандартных изменений энтальпии, энтропии и энергии Гиббса обычно используют стандартные энтальпии и Энергии Гиббса образования простых веществ, которые является справочными величинами. Энтальпия образования и энергия Гиббса образования наиболее устойчивых простых веществ равны нулю.
Тема 7. Растворы.
Раствор – это гомогенная система переменного состава, состоящая из двух или более компонентов и продуктов их взаимодействия. Компоненты раствора – растворитель и растворенные вещества.
Вообще все дисперсные системы делятся на три группы: грубодисперсные (с диаметром частиц большим, чем 300 нм), коллоидные растворы (диаметр частиц от 1 до 300 нм) и истинные растворы (диаметр частиц меньше 1 нм).
Так как растворы в данном конкретном объеме не обладают постоянным составом, возникло понятие концентрации раствора – это содержание растворенного вещества в единице массы или объема растворителя или раствора. Существует много способов выражения концентрации раствора.
1. Для выражения концентрации по массе используют массовую долю – это массовая доля вещества в 100 г раствора, выражается в %:
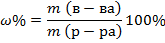
2. Моляльная концентрация – число молей растворенного вещества в 1 кг растворителя, выражается в моль/кг:
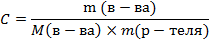
3. Мольная доля раствора – количество данного вещества по отношению к количеству всех веществ, образующих раствор, безразмерная величина:
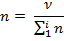
4. Молярная концентрация – количество вещества в 1 л раствора, выражается в моль/л:
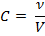
5. Нормальная концентрация – число эквивалентных масс растворенного вещества в 1 л раствора:
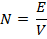
Способность вещества переходить в раствор называется растворимостью вещества. Мера растворимости – концентрация вещества, достигаемая в насыщенном растворе.
Растворимость выражается двумя величинами: к – коэффициент растворимости – количество граммов вещества, растворяющегося в 100 г растворителя. К > 10 – малорастворимые; 10 > к > 1 – умеренно растворимые; 1 > к > 0,01 – малорастворимые; к < 0,01 – практически нерастворимые.
S, моль/л.
Растворимость зависит от следующих факторов.
1. Природы растворенного вещества и природа растворителя: в полярных растворителях хорошо растворяются полярные вещества, в неполярных - неполярные.
2. Температура. Обычно для твердых веществ с повышением температуры растворимость растет. Но есть и исключения: гипс (CaSO4·2H2O). Для растворимости жидкостей в воде нет общих закономерностей.
3. Давление. Влияние давления на растворимость жидкостей и твердых веществ в воде проявляется при давлениях около 10000 атм.
А вот растворимость газов сильно зависит от давления. При постоянной температуре масса газа, растворяющегося в данном объеме жидкости, пропорциональна давлению газа над жидкостью (закон Генри): m = к·Р
По поведению веществ в растворе их разделяют на две большие группы: электролиты – это вещества, диссоциирующие в растворе на ионы; и неэлектролиты, которые на ионы в растворе не диссоциируют.
Наиболее простые растворы образуют неэлектролиты. Растворы неэлектролитов обладают определенным рядом свойств.
1. Давление пара над раствором ниже, чем над растворителем. Количественно данное свойство отражает первый закон Рауля: относительное понижение давления пара раствора равно мольной доле растворенного вещества:
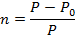
2. Температуры кипения и замерзания растворов. Растворы кипят при температурах более высоких, а замерзают при более низких, чем чистый растворитель. Жидкость кипит только тогда, когда давление пара над жидкостью становится равным внешнему давлению.
Количественно зависимость изменения температур замерзания и кипения от концентрации растворенного вещества выражает 2 закон Рауля: понижение температуры замерзания и повышение температуры кипения раствора прямо пропорционально моляльной концентрации растворенного вещества.
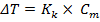
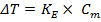
Где КК – криоскопическая константа (1,86 для воды); КЕ - эбулиоскопическая константа (0,52 для воды).
3. Осмос – односторонняя диффузия через полунепроницаемую мембрану. Сила, обуславливающая осмос, называется осмотическим давлением. По закону Вант-Гоффа осмотическое давление раствора равно тому газовому давлению, которое производило бы растворенное вещество, находясь в газообразном состоянии и занимая объем, равный объему раствора: Росм = СRT.
Растворы электролитов сильно отклоняются от законов Рауля и Вант-Гоффа. Поэтому Вант-Гофф предложил ввести изотонический коэффициент i для объяснения этих отклонений.
Поскольку осмотическое давление зависит от числа частиц растворенного вещества, находящихся в единице объема раствора, то шведский ученый Аррениус в 1887 году предположил, что некоторые вещества распадаются в растворе на ионы, что вызывает увеличение числа частиц в растворе.
Для объяснения свойств электролитов Аррениус предложил теорию электролитической диссоциации. Согласно данной теории вещества делятся на две группы: 1) вещества с ионной связью – в узлах кристаллической решетки уже ионы и в растворе разрушается кристаллическая решетка; 2) вещества с полярной ковалентной связью – под действием растворителя происходит ионизация молекул таких веществ.
Для характеристики свойств электролитов используют следующие понятия: степень ионизации и константа ионизации. Степенью ионизации называется отношение распавшихся на ионы формульных единиц вещества к их общему числу в растворе:
На степень ионизации влияет ряд факторов:
1) Природа растворенного вещества. Все электролиты делят на три группы: сильные электролиты (со степенью ионизации больше 0,3 – HCl, NaCl, NaOH); средние электролиты (0,03 < a < 0,3 – HF, H3PO4) и слабые электролиты (a < 0,03 – NH3, CH3COOH).
2) Природа растворителя – чем растворитель менее полярен, тем выше степень ионизации.
HA 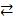 H+ + A-
H+ + A-
Константа ионизации представляет собой константу равновесия процесса ионизации электролита:
Константа ионизации связана со степенью ионизации законом разбавления Оствальда.
Данное уравнение показывает связь между концентрацией электролита и степенью его диссоциации: степень диссоциации возрастает при разбавлении раствора. Процесс диссоциации – процесс равновесный, при разбавлении равновесие сдвигается в сторону образования ионов. И, наоборот, при увеличении концентрации степень диссоциации падает. И даже для сильных электролитов реальная (кажущаяся) степень диссоциации меньше единицы и с увеличением концентрации снижается.
Для оценки действительной степени диссоциации ионов пользуются не концентрацией, а активностью: a = f×C, где f – коэффициент активности.
Коэффициент активности зависит от концентраций ионов, присутствующих в растворе, а точнее, от ионной силы раствора:
Согласно современным представлениям, кислотой является донор протона, то есть частица, способная отдавать протон, а основанием – акцептор протона, то есть частица, способная присоединять протон. Соотношение между кислотой и основанием определяется схемой:
Основание + Протон = Кислота
Связанные данным соотношение кислота и основание называются сопряженными. В зависимости от условий любая кислота может выступать также и в роли основания при реакции с более сильной кислотой.
Чистая вода ослабляет электрический ток в 81 раз, но все же обладает определенной электропроводностью, которая объясняется диссоциацией воды на катионы водорода и гидроксид-анионы:
Н+ и ОН– ⇄ Н2О
Концентрация Н+ и ОН– была вычислена по величине электропроводности дистиллированной воды. При 25 0С они равны 10-7 моль/л. константа диссоциации воды выглядит следующим образом:
Концентрация молекул воды равна 55,55 моль/л. Произведение концентраций Н+ и ОН– является величиной постоянной и называется ионным произведением воды (равно 10-14). В чистой воде концентрации равны. Такой раствор называется нейтральным. В кислом растворе концентрация катионов водорода > 10-7, а в щелочном < 10-7 моль/л. Для удобства выражения концентрацию катионов водорода выражают через ее отрицательный десятичный логарифм и называется водородным показателем и обозначается рН = –lg[Н+]. Таким образом, для нейтрального раствора рН = 7, для кислых растворов рН < 7, для щелочных рН > 7.
Процесс диссоциации процесс равновесный, поэтому смещение равновесия процесса диссоциации подчиняется принципу Ле Шателье. Поэтому можно сделать следующий вывод. Обязательным условием завершенности реакции между электролитами является удаление из раствора каких-либо ионов вследствие образования слабодиссоциирующих веществ (слабых электролитов) или веществ, выделяющихся из раствора в виде газа или осадка. Образование таких веществ сдвигает равновесие в сторону образования продуктов реакции.
Примеры реакций.
Одним из условий протекания реакции между электролитами является образование осадка, то есть нерастворимого соединения. Например:
Ag+ + Cl– = AgCl↓
Константу равновесия данного процесса можно выразить уравнением:
К = [Ag+] [Cl–] = ПР
Концентрация хлорида серебра принимается равной единице и не записывается в выражении для константы, поскольку это твердое вещество. Поскольку значение константы равновесия не зависит от концентрации, то в насыщенном растворе слабого электролита произведение концентраций его ионов в растворе величина постоянная при данной температуре и называется произведением растворимости (ПР). ПР количественно характеризует способность электролита растворяться.
В общем виде ПР электролита записывается с учетом степеней стехиометрических коэффициентов ионов, образующих осадок. Например, для реакции Pb2+ + 2Cl– = PbCl2 ПР = [Pb2+] [Cl–]2. Если ПР не очень мало или в растворе есть посторонние ионы, то в выражении для ПР следует использовать не равновесные концентрации, а активности ионов, образующих осадок. Например: ПР = а(Pb2+) а2 (Cl-) = f[Pb2+] f[Cl–]2.
Некоторые из веществ при обычных условиях в водных растворах претерпевают химическое превращение. Данный процесс называется гидролизом. Мы рассмотрим наиболее распространенный в растворах процесс гидролиза – гидролиз солей. При взаимодействии соли с водой образуются слабая кислота или слабое основание: СН3СООК + Н2О = СН3СООН + КОН; FeCl3 + 3H2O = Fe(OH)3↓ + 3HCl. В первом случае рН раствора будет > 7 (щелочная среда), а во втором < 7 (среда кислая).
Итак, растворы солей, образованных слабой кислотой и сильным основанием имеют щелочную реакцию (рН > 7). Растворы солей, образованных слабым основанием и сильной кислотой, имеют кислую реакцию (рН < 7). Чем слабее основание или кислота, тем большему гидролизу подвергается соль. Процесс гидролиза – процесс равновесный и в общем виде записывается так:
МА + Н2О = НА + МОН
Кг = [НА][МОН]/[МА] – константа гидролиза соли.
Равновесная концентрация воды входит в константу Кг, поскольку является величиной постоянной и в выражения для константы гидролиза не записывается. Константа гидролиза связана с константой диссоциации слабой кислоты или слабого основания следующими соотношениями: Кг = КW/Kкисл; Кг = КW/Kосн. Процесс гидролиза протекает ступенчато: суммарный процесс гидролиза хлорида железа – FeCl3 + 3H2O = Fe(OH)3↓ + 3HCl можно выразить тремя последовательными процессами:
FeCl3 + H2O = Fe(OH)Сl2 + HCl
Fe(OH)Сl2 + H2O = Fe(OH)2Cl + HCl
Fe(OH)2Cl + H2O = Fe(OH)3↓ + HCl
Наиболее полно протекает гидролиз солей, образованных слабой кислотой и слабым основанием, например ацетата аммония.
Коллоидные растворы.
Как известно, коллоидные растворы (диаметр частиц от 1 до 300 нм) являются дисперсной системой. В дисперсных системах различают дисперсную фазу и дисперсную среду. Дисперсная фаза – это совокупность частиц, распределенных в непрерывной дисперсной среде.
Необходимым условием образования коллоидных растворов является малая растворимость дисперсной фазы в дисперсной среде и наличие в системе веществ, способных стабилизировать коллоидные частицы. Стабилизаторами коллоидных растворов (или золей) могут быть соединения, образующиеся при взаимодействии дисперсной фазы с дисперсной средой. Адсорбируясь на границе раздела фаз, они образуют в поверхностном слое барьер, который препятствует слипанию коллоидных частиц.
Согласно мицеллярной теории коллоидные растворы состоят из двух частей: мицеллы и интермицеллярной жидкости. Мицелла – это структурная единица дисперсной фазы, окруженная двойным электрическим слоем. Интермицеллярная жидкость – это дисперсная среда, отделяющая мицеллы друг от друга.
Строение мицеллы иодида серебра.
AgNO3 + KI = AgI + KNO3
1) в избытке иодида калия: { [ m AgI ] nI– ... (n-x) K+ } x– x K+
центр потенциалопределяющие ионы
ядро противоионы
коллоидная частица
мицелла
2) в избытке нитрата серебра: {[mAgI] nAg+ ... (n-x)NO3–}x+ xNO3–.
Устойчивость коллоидных растворов зависит от величины заряда коллоидной частицы – чем он выше, тем устойчивее коллоидная система. Прибавление к золю электролитов вызывает понижение заряд коллоидной частицы в результате изменения структурного слоя противоионов, что способствует коагуляции (слипанию) коллоидных частиц. Коагуляция, в свою очередь, приводит к седиментации (осаждению) частиц в виде осадка.
Дата: 2018-12-28, просмотров: 389.