Тема 1. Основные понятия и законы химии.
Химия это наука о веществах и их превращениях. Она относится к естественным наукам и тесно связана, в первую очередь, с физикой и биологией. На сегодняшний день известно около 120 тысяч неорганических веществ и более 10 миллионов органических, причем число последних постоянно растет.
Итак, с чего начинается химия? Химия начинается с элементов, то есть с определенного вида атомов с одинаковым положительным зарядом ядра. Наименьшей частицей химического элемента является атом, входящий в состав молекул простых и сложных веществ. Таким образом, атом это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. В то же время молекула – это наименьшая частица данного вещества, обладающая его химическими свойствами. Их следует отличать, например, атом кислорода и молекула кислорода отличаются по своих химическим и физическим свойствам.
Все вещества делят на простые и сложные. Простые вещества образованы атомами одного элемента. Сложные вещества (или соединения) образованы атомами разных элементов. Не следует путать простое вещество и химический элемент. Один и тот же химический элемент может образовывать несколько простых веществ. Например, элемент углерод образует три простых вещества: уголь, графит и алмаз, которые отличаются строением кристаллической решетки.
Сами атомы очень малы, но еще в 70-х годах определили их массы с большой точностью. Масса атома водорода составила порядка 10-27 кг, а других атомов еще больше. Поэтому, для удобства, при химических расчетах пользуются понятиями относительной атомной и относительной молекулярной массы. Относительной атомной массой Аr химического элемента называется величина, равная отношению массы атома элемента к 1/12 массы атома изотопа углерода С-12. Относительной молекулярной массой Мr вещества называется величина, равная отношению массы молекулы вещества к 1/12 массы атома изотопа углерода С-12. Относительная атомная и относительная молекулярная масса из-меряются в атомных единицах массы (а.е.м.). А как же количественно характеризовать вещество?
За единицу количества вещества в международной системе единиц принят моль. Моль – это количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов и других), сколько атомов содержится в 0,012 кг изотопа углерода С-12. Точное значение числа атомов в 0,012 кг углерода равно 6,02 10 23 моль-1. Это число называется постоянной Авогадро NA, которое показывает число структурных единиц в моле любого вещества.
Величина, равная отношению массы вещества к количеству вещества называется молярной массой. Обычно она имеет размерность г/моль и численно равна относительной атомной или относительной молекулярной массе данного вещества. Например, Аr(C) = 12, а М(С) = 12 г/моль.
Химические элементы обозначают химическими символами. Сложные вещества обозначают химическими формулами. Химическую формулу устанавливают путем анализа состава веществ. Процессы взаимодействия веществ записывают с помощью химических уравнений, в которых используются соответствующие обозначения элементов и сложных веществ. В левой части записывают формулы веществ, вступающих в реакцию, в правой – формулы продуктов реакции.
Все химические взаимодействия подчиняются закону сохранения массы веществ, который гласит следующее: масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции. При этом общее число атомов каждого элемента всегда остается постоянным. Таким образом, при составлении уравнения реакции типа
H2SO4 + 2NaOH = Na2SO4 + 2H2O
Нужно расставить так называемые стехиометрические коэффициенты таким образом, чтобы число атомов каждого элемента в левой части уравнения и в правой было одно и то же, согласно закону сохранения массы веществ. Если коэффициент равен единице, он обычно не пишется.
Закон сохранения массы основан на том явлении, что при химическом взаимодействии массы атомов не изменяются. На данном явлении основан еще один из основных законов химии – закон постоянства состава, который гласит: любое чистое молекулярное вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав. Следует отметить, что состав соединений с немолекулярной (надмолекулярной или полимерной структурой) не является постоянным и зависит от условий получения.
Поскольку газы являются наиболее простым объектом для исследования, то их свойства изучены наиболее полно. Экспериментальным путем был установлен закон объемных отношений (французским ученым Ж.Л. Гей-Люссаком): объемы вступающих в реакцию газов при одинаковых условиях (температуре и давлении) относятся друг к другу как простые целые числа.
Этот экспериментальный закон позволил сформулировать закон Авогадро: в равных объемах одинаковых газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Таким образом, из закона Авогадро следует, что при одних и тех же условиях 1 моль любого газа занимает одинаковый объем.
Этот объем был вычислен количественно при нормальных условиях (при температуре 273 К – 0 С и давлении 101325 Па) и составил 22,4 л. Итак, при нормальных условиях 1 моль любого газа занимает объем, равный 22,4 л, который называется молярным объемом газа. С другой стороны, молярный объем газа – это отношение объема вещества к количеству данного вещества.
Vm = V/n, где V – объем газа, л; n - количество вещества, моль.
На основании закона Авогадро определяют молярные массы газообразных веществ. В равных объемах газов при одинаковых условиях содержится одинаковое количество молекул, а, следовательно, и молей газов. Отношение масс равных объемов газов равно отношению их молярных масс:
m1/m2 = M1/M2
Отношение массы объема газа к массе такого же объема другого газа (при одинаковых условиях) называется плотностью первого газа по второму:
D = M1/M2.
Из закона постоянства состава следует, что элементы соединяются друг с другом в строго определенных количественных соотношениях. Или эквивалентных соотношениях. Поэтому в химию были введены понятия эквивалента или эквивалентной массы.
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях соединяется или замещает один катион водорода (один протон) или гидроксид-анион, а в окислительно-восстановительных один электрон.
Масса 1 эквивалента элемента называют его эквивалентной массой. Вычисляется в г/моль.
Закон эквивалентов: вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам.
Валентность. Менделеевым была установлена связь между валентностью элемента и его положением в периодической системе. Пример. Он же ввел понятие переменной валентности. Примеры.
Валентность – это способность атомов образовывать связи с другими атомами. Пример.
Между валентностью элемента в данном соединении, его молярной массой и его эквивалентной массой существует простое соотношение: Е = М/n, где Е – эквивалентная масса, г/моль, М – молярная масса, г/моль, n – валентность (простое целое число).
Тема 7. Растворы.
Раствор – это гомогенная система переменного состава, состоящая из двух или более компонентов и продуктов их взаимодействия. Компоненты раствора – растворитель и растворенные вещества.
Вообще все дисперсные системы делятся на три группы: грубодисперсные (с диаметром частиц большим, чем 300 нм), коллоидные растворы (диаметр частиц от 1 до 300 нм) и истинные растворы (диаметр частиц меньше 1 нм).
Так как растворы в данном конкретном объеме не обладают постоянным составом, возникло понятие концентрации раствора – это содержание растворенного вещества в единице массы или объема растворителя или раствора. Существует много способов выражения концентрации раствора.
1. Для выражения концентрации по массе используют массовую долю – это массовая доля вещества в 100 г раствора, выражается в %:
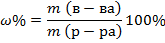
2. Моляльная концентрация – число молей растворенного вещества в 1 кг растворителя, выражается в моль/кг:
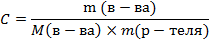
3. Мольная доля раствора – количество данного вещества по отношению к количеству всех веществ, образующих раствор, безразмерная величина:
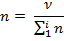
4. Молярная концентрация – количество вещества в 1 л раствора, выражается в моль/л:
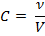
5. Нормальная концентрация – число эквивалентных масс растворенного вещества в 1 л раствора:
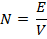
Способность вещества переходить в раствор называется растворимостью вещества. Мера растворимости – концентрация вещества, достигаемая в насыщенном растворе.
Растворимость выражается двумя величинами: к – коэффициент растворимости – количество граммов вещества, растворяющегося в 100 г растворителя. К > 10 – малорастворимые; 10 > к > 1 – умеренно растворимые; 1 > к > 0,01 – малорастворимые; к < 0,01 – практически нерастворимые.
S, моль/л.
Растворимость зависит от следующих факторов.
1. Природы растворенного вещества и природа растворителя: в полярных растворителях хорошо растворяются полярные вещества, в неполярных - неполярные.
2. Температура. Обычно для твердых веществ с повышением температуры растворимость растет. Но есть и исключения: гипс (CaSO4·2H2O). Для растворимости жидкостей в воде нет общих закономерностей.
3. Давление. Влияние давления на растворимость жидкостей и твердых веществ в воде проявляется при давлениях около 10000 атм.
А вот растворимость газов сильно зависит от давления. При постоянной температуре масса газа, растворяющегося в данном объеме жидкости, пропорциональна давлению газа над жидкостью (закон Генри): m = к·Р
По поведению веществ в растворе их разделяют на две большие группы: электролиты – это вещества, диссоциирующие в растворе на ионы; и неэлектролиты, которые на ионы в растворе не диссоциируют.
Наиболее простые растворы образуют неэлектролиты. Растворы неэлектролитов обладают определенным рядом свойств.
1. Давление пара над раствором ниже, чем над растворителем. Количественно данное свойство отражает первый закон Рауля: относительное понижение давления пара раствора равно мольной доле растворенного вещества:
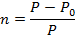
2. Температуры кипения и замерзания растворов. Растворы кипят при температурах более высоких, а замерзают при более низких, чем чистый растворитель. Жидкость кипит только тогда, когда давление пара над жидкостью становится равным внешнему давлению.
Количественно зависимость изменения температур замерзания и кипения от концентрации растворенного вещества выражает 2 закон Рауля: понижение температуры замерзания и повышение температуры кипения раствора прямо пропорционально моляльной концентрации растворенного вещества.
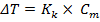
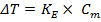
Где КК – криоскопическая константа (1,86 для воды); КЕ - эбулиоскопическая константа (0,52 для воды).
3. Осмос – односторонняя диффузия через полунепроницаемую мембрану. Сила, обуславливающая осмос, называется осмотическим давлением. По закону Вант-Гоффа осмотическое давление раствора равно тому газовому давлению, которое производило бы растворенное вещество, находясь в газообразном состоянии и занимая объем, равный объему раствора: Росм = СRT.
Растворы электролитов сильно отклоняются от законов Рауля и Вант-Гоффа. Поэтому Вант-Гофф предложил ввести изотонический коэффициент i для объяснения этих отклонений.
Поскольку осмотическое давление зависит от числа частиц растворенного вещества, находящихся в единице объема раствора, то шведский ученый Аррениус в 1887 году предположил, что некоторые вещества распадаются в растворе на ионы, что вызывает увеличение числа частиц в растворе.
Для объяснения свойств электролитов Аррениус предложил теорию электролитической диссоциации. Согласно данной теории вещества делятся на две группы: 1) вещества с ионной связью – в узлах кристаллической решетки уже ионы и в растворе разрушается кристаллическая решетка; 2) вещества с полярной ковалентной связью – под действием растворителя происходит ионизация молекул таких веществ.
Для характеристики свойств электролитов используют следующие понятия: степень ионизации и константа ионизации. Степенью ионизации называется отношение распавшихся на ионы формульных единиц вещества к их общему числу в растворе:
На степень ионизации влияет ряд факторов:
1) Природа растворенного вещества. Все электролиты делят на три группы: сильные электролиты (со степенью ионизации больше 0,3 – HCl, NaCl, NaOH); средние электролиты (0,03 < a < 0,3 – HF, H3PO4) и слабые электролиты (a < 0,03 – NH3, CH3COOH).
2) Природа растворителя – чем растворитель менее полярен, тем выше степень ионизации.
HA 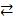 H+ + A-
H+ + A-
Константа ионизации представляет собой константу равновесия процесса ионизации электролита:
Константа ионизации связана со степенью ионизации законом разбавления Оствальда.
Данное уравнение показывает связь между концентрацией электролита и степенью его диссоциации: степень диссоциации возрастает при разбавлении раствора. Процесс диссоциации – процесс равновесный, при разбавлении равновесие сдвигается в сторону образования ионов. И, наоборот, при увеличении концентрации степень диссоциации падает. И даже для сильных электролитов реальная (кажущаяся) степень диссоциации меньше единицы и с увеличением концентрации снижается.
Для оценки действительной степени диссоциации ионов пользуются не концентрацией, а активностью: a = f×C, где f – коэффициент активности.
Коэффициент активности зависит от концентраций ионов, присутствующих в растворе, а точнее, от ионной силы раствора:
Согласно современным представлениям, кислотой является донор протона, то есть частица, способная отдавать протон, а основанием – акцептор протона, то есть частица, способная присоединять протон. Соотношение между кислотой и основанием определяется схемой:
Основание + Протон = Кислота
Связанные данным соотношение кислота и основание называются сопряженными. В зависимости от условий любая кислота может выступать также и в роли основания при реакции с более сильной кислотой.
Чистая вода ослабляет электрический ток в 81 раз, но все же обладает определенной электропроводностью, которая объясняется диссоциацией воды на катионы водорода и гидроксид-анионы:
Н+ и ОН– ⇄ Н2О
Концентрация Н+ и ОН– была вычислена по величине электропроводности дистиллированной воды. При 25 0С они равны 10-7 моль/л. константа диссоциации воды выглядит следующим образом:
Концентрация молекул воды равна 55,55 моль/л. Произведение концентраций Н+ и ОН– является величиной постоянной и называется ионным произведением воды (равно 10-14). В чистой воде концентрации равны. Такой раствор называется нейтральным. В кислом растворе концентрация катионов водорода > 10-7, а в щелочном < 10-7 моль/л. Для удобства выражения концентрацию катионов водорода выражают через ее отрицательный десятичный логарифм и называется водородным показателем и обозначается рН = –lg[Н+]. Таким образом, для нейтрального раствора рН = 7, для кислых растворов рН < 7, для щелочных рН > 7.
Процесс диссоциации процесс равновесный, поэтому смещение равновесия процесса диссоциации подчиняется принципу Ле Шателье. Поэтому можно сделать следующий вывод. Обязательным условием завершенности реакции между электролитами является удаление из раствора каких-либо ионов вследствие образования слабодиссоциирующих веществ (слабых электролитов) или веществ, выделяющихся из раствора в виде газа или осадка. Образование таких веществ сдвигает равновесие в сторону образования продуктов реакции.
Примеры реакций.
Одним из условий протекания реакции между электролитами является образование осадка, то есть нерастворимого соединения. Например:
Ag+ + Cl– = AgCl↓
Константу равновесия данного процесса можно выразить уравнением:
К = [Ag+] [Cl–] = ПР
Концентрация хлорида серебра принимается равной единице и не записывается в выражении для константы, поскольку это твердое вещество. Поскольку значение константы равновесия не зависит от концентрации, то в насыщенном растворе слабого электролита произведение концентраций его ионов в растворе величина постоянная при данной температуре и называется произведением растворимости (ПР). ПР количественно характеризует способность электролита растворяться.
В общем виде ПР электролита записывается с учетом степеней стехиометрических коэффициентов ионов, образующих осадок. Например, для реакции Pb2+ + 2Cl– = PbCl2 ПР = [Pb2+] [Cl–]2. Если ПР не очень мало или в растворе есть посторонние ионы, то в выражении для ПР следует использовать не равновесные концентрации, а активности ионов, образующих осадок. Например: ПР = а(Pb2+) а2 (Cl-) = f[Pb2+] f[Cl–]2.
Некоторые из веществ при обычных условиях в водных растворах претерпевают химическое превращение. Данный процесс называется гидролизом. Мы рассмотрим наиболее распространенный в растворах процесс гидролиза – гидролиз солей. При взаимодействии соли с водой образуются слабая кислота или слабое основание: СН3СООК + Н2О = СН3СООН + КОН; FeCl3 + 3H2O = Fe(OH)3↓ + 3HCl. В первом случае рН раствора будет > 7 (щелочная среда), а во втором < 7 (среда кислая).
Итак, растворы солей, образованных слабой кислотой и сильным основанием имеют щелочную реакцию (рН > 7). Растворы солей, образованных слабым основанием и сильной кислотой, имеют кислую реакцию (рН < 7). Чем слабее основание или кислота, тем большему гидролизу подвергается соль. Процесс гидролиза – процесс равновесный и в общем виде записывается так:
МА + Н2О = НА + МОН
Кг = [НА][МОН]/[МА] – константа гидролиза соли.
Равновесная концентрация воды входит в константу Кг, поскольку является величиной постоянной и в выражения для константы гидролиза не записывается. Константа гидролиза связана с константой диссоциации слабой кислоты или слабого основания следующими соотношениями: Кг = КW/Kкисл; Кг = КW/Kосн. Процесс гидролиза протекает ступенчато: суммарный процесс гидролиза хлорида железа – FeCl3 + 3H2O = Fe(OH)3↓ + 3HCl можно выразить тремя последовательными процессами:
FeCl3 + H2O = Fe(OH)Сl2 + HCl
Fe(OH)Сl2 + H2O = Fe(OH)2Cl + HCl
Fe(OH)2Cl + H2O = Fe(OH)3↓ + HCl
Наиболее полно протекает гидролиз солей, образованных слабой кислотой и слабым основанием, например ацетата аммония.
Коллоидные растворы.
Как известно, коллоидные растворы (диаметр частиц от 1 до 300 нм) являются дисперсной системой. В дисперсных системах различают дисперсную фазу и дисперсную среду. Дисперсная фаза – это совокупность частиц, распределенных в непрерывной дисперсной среде.
Необходимым условием образования коллоидных растворов является малая растворимость дисперсной фазы в дисперсной среде и наличие в системе веществ, способных стабилизировать коллоидные частицы. Стабилизаторами коллоидных растворов (или золей) могут быть соединения, образующиеся при взаимодействии дисперсной фазы с дисперсной средой. Адсорбируясь на границе раздела фаз, они образуют в поверхностном слое барьер, который препятствует слипанию коллоидных частиц.
Согласно мицеллярной теории коллоидные растворы состоят из двух частей: мицеллы и интермицеллярной жидкости. Мицелла – это структурная единица дисперсной фазы, окруженная двойным электрическим слоем. Интермицеллярная жидкость – это дисперсная среда, отделяющая мицеллы друг от друга.
Строение мицеллы иодида серебра.
AgNO3 + KI = AgI + KNO3
1) в избытке иодида калия: { [ m AgI ] nI– ... (n-x) K+ } x– x K+
центр потенциалопределяющие ионы
ядро противоионы
коллоидная частица
мицелла
2) в избытке нитрата серебра: {[mAgI] nAg+ ... (n-x)NO3–}x+ xNO3–.
Устойчивость коллоидных растворов зависит от величины заряда коллоидной частицы – чем он выше, тем устойчивее коллоидная система. Прибавление к золю электролитов вызывает понижение заряд коллоидной частицы в результате изменения структурного слоя противоионов, что способствует коагуляции (слипанию) коллоидных частиц. Коагуляция, в свою очередь, приводит к седиментации (осаждению) частиц в виде осадка.
Тема 11. Электролиз.
В растворах и расплавах электролитов находятся противоположно заряженные ионы (катионы и анионы), которые находятся в постоянном движении. Если в такого рода жидкость, например в расплав хлорида натрия (плавится при 801 0С) погрузить инертные (графитовые) электроды и пропустить постоянный электрический ток, то ионы под действием внешнего электрического поля будут двигаться к электродам катионы – к катоду, а анионы – к аноду. Катионы натрия, достигнув катода, принимают от него электроны и восстанавливаются до металлического натрия:
Na+ + e = Na0
Хлорид-ионы окисляются на аноде:
2Сl– – 2e = Cl20
В итоге на катоде выделяется металлический натрий, а аноде молекулярный хлор. Суммарное уравнение электролиза расплава хлорида натрия выглядит следующим образом.
К: Na+ + e = Na0 2
А: 2Сl– – 2e = Cl20 1
2Na+ + 2Сl– электролиз® 2Na0 + Cl20
2NaСl = 2Na + Cl2
Эта реакция является окислительно-восстановительной: на аноде протекает процесс окисления, а на катоде – процесс восстановления.
Окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита, называется электролизом.
Следует различать электролиз расплавленных электролитов и их растворов. В последнем случае в процессах могут участвовать молекулы воды. Например, при электролизе водного раствора хлорида натрия на инертных (графитовых) электродах на катоде вместо катионов натрия восстанавливаются молекулы воды.
2Н2О + 2е = Н2 + 2ОН–
а на аноде окисляются хлорид-ионы:
2Сl– – 2e = Cl20
В итоге на катоде выделяется водород, на аноде – хлор, а в растворе накапливаются молекулы гидроксида натрия. Общее уравнение электролиза водного раствора хлорида натрия имеет вид:
К: 2Н2О + 2е = Н2 + 2ОН–
А: 2Сl– – 2e = Cl20
2Н2О + 2Сl– = Н2 + Cl2 + 2ОН–
В чем же отличие электролиза расплавов и водных растворов электролитов? Восстановительные процессы на катоде водных растворов электролитов зависят от величины стандартных электродных потенциалов металлов, а именно они чаще всего выступают в качестве катионов, восстанавливающихся на катоде. Здесь возможны три варианта:
1. Катионы металлов, которые имеют стандартный электродный потенциал, выше, чем у водорода, то есть больше нуля при электролизе полностью восстанавливаются на катоде (медь, серебро, золото и другие).
2. Катионы металлов, имеющих очень маленькое значение стандартного электродного потенциала (от лития до алюминия включительно), не восстанавливаются на катоде, а восстанавливаются молекулы воды.
3. Катионы металлов, у которых значение стандартного электродного потенциала, меньше, чем у водорода, но больше, чем у алюминия, при электролизе восстанавливаются на катоде вместе с молекулами воды.
Все электроды делят на нерастворимые (инертные) – угольные, графитовые, платиновые, иридиевые. Растворимые – медь, серебро, цинк, кадмий, никель и другие. Понятие растворимого электрода имеет значение для анода, поскольку именно он способен растворяться при электролизе. На нерастворимом аноде в процессе электролиза происходит окисление анионов или молекул воды. При этом анионы бескислородных кислот достаточно легко окисляются. Если же в растворе присутствуют анионы кислородсодержащих кислот, то на аноде окисляются молекулы воды с выделением кислорода по реакции:
2Н2О – 4е = О2 + 4Н+
Растворимый анод при электролизе сам окисляется, отдавая электроны во внешнюю электрическую цепь и переходя в раствор:
А: Ме Û Меn+ + nе–
Рассмотрим примеры электролиза расплавов и растворов электролитов.
Схема электролиза расплава гидроксида калия выглядит следующим образом: К: К+ + е = К 4
А: 4ОН– – 4е = О2 + 2Н2О 1
4К+ + 4ОН– электролиз® 4К + О2 + 2Н2О или
4КОН электролиз® 4К + О2 + 2Н2О
Рассмотрим электролиз расплава соли кислородсодержащей кислоты, например, сульфата натрия:
К: Na+ + e = Na 4
А: 2SO42– – 4e = 2SO3 + O2 1
4Na+ + 2SO42– электролиз® 4Na + 2SO3 + O2 или
2Na2SO4 электролиз® 4Na + 2SO3 + O2
Теперь рассмотрим электролиз водных растворов некоторых солей. Начнем с хлорида магния. В водном растворе на катоде восстанавливаются не катионы магния, а молекулы воды. А на аноде хлорид-ионы:
К: 2Н2О + 2е = Н2 + 2ОН– 1
А: 2Сl– – 2e = Cl20 1
2Н2О + 2Сl– = Н2 + Cl2 + 2ОН– или
2Н2О + MgСl2 = Н2 + Cl2 + Mg(ОН)2
А сейчас рассмотрим электролиз соли кислородсодержащей кислоты, например, сульфата меди. Сульфат-ионы на аноде не окисляются, поэтому окисляются молекулы воды: К: Cu2+ + 2e = Cu0 2
А: 2Н2О – 4е = О2 + 2Н+ 1
2Cu2+ + 2Н2О электролиз® Cu0 + О2 + 4Н+ или
2CuSO4 + 2Н2О электролиз® Cu0 + О2 + 2Н2SO4
Применение электролиза. Электролиз используется для получения многих металлов – щелочных и щелочноземельных, алюминия, лантаноидов и металлов с положительным электродным потенциалом – меди, серебра, золота высокой чистоты. И, наконец, электролиз применяется, в первую очередь, для защиты металлов и сплавов от коррозии. На поверхность металла наносится тонкий слой инертного металла – хрома, серебра, золота, меди и некоторых других. Иногда применяют многослойное покрытие. Например, внешние детали автомобиля покрывают тонким слоем меди, на медь наносят никель, а на никель – хром (хромирование). Другой пример, на коллектора двигателей радаров, используемых в открытом космосе, наносят слой серебра, а на него – слой родия.
Методы защиты от коррозии.
Существуют 4 группы методов защиты от коррозии:
1) применение коррозионностойких сплавов;
2) защита поверхности металла покрытиями;
3) обработка коррозионной среды;
4) электрохимические методы.
Рассмотрим их по порядку.
1. Применение коррозионностойких сплавов.
Металлические конструкционные коррозионостойкие материалы разделяют на две основные группы.
Черные металлы (сплавы на основе железа) – это обычные углеродистые стали (содержащие до 1% С), высоколегированные стали (содержащие, Cr, Ni, Mo, V и другие металлы), чугуны (содержащие С до 2,5% и более).
Углеродистые стали.
Антикоррозионные свойства углеродистых сталей обыкновенного качества определяются содержанием углерода, а также способом ее механической обработки. Так, в отожженных сталях влияние углерода сказывается при содержании 0,3-0,4%. Коррозионную стойкость ухудшает в основном сера. Она вызывает межкристаллитную коррозию стали, образуя с железом и марганцем сульфиды. В целом данные стали не обладают большой коррозионной стойкостью.
Легированные стали.
В качестве специальных легирующих элементов, повышающих коррозионную стойкость сталей, используют металлы с более высоким, чем у железа, потенциалом или легко пассивирующиеся металлы, например, хром.
Коррозионная стойкость и величина потенциала сплава в результате легирования увеличивается скачкообразно по правилу Таммана. Концентрация более стойкого компонента, при которой скачкообразно повышается коррозионная стойкость сплава, пропорциональна n/8 атомной доли легирующего компонента, где n – целое число от 1 до 7. Такая концентрация получила название границы или порога химической устойчивости сплава.
Скомп = ХА×n/8 (где n = 1-7; ХА – атомная доля более стойкого компонента)
Один и тот же сплав может иметь несколько порогов устойчивости. Например, для хромистых сталей первый порог устойчивости, соответствует содержанию хрома 12,5% и обеспечивает стойкость их в холодной разбавленной азотной кислоте. Второй порог устойчивости соответствует содержанию 25% хрома и обеспечивает устойчивость сталей к кипящей азотной кислоте.
Все высоколегированные стали классифицируются по свойствам на три группы:
I группа – коррозионно-стойкие (нержавеющие) стали, стойкие к атмосферной, почвенной, щелочной, кислотной, солевой и другим видам электрохимической коррозии.
II группа – жаростойкие стали, эксплуатируемые в ненагруженном или слабонагруженном состоянии; стойки в газовых средах при температуре выше 550 0С.
III группа – жаропрочные стали, эксплуатируемые в нагруженном состоянии в течение длительного времени при высоких температурах.
Чугуны.
Как известно, чугуны подразделяются на два класса: белые (без графита) и серые (с графитом). По действующим стандартам различают три группы серых чугунов: обыкновенный литейный, модифицированный и высокопрочный чугун.
Чугуны также легируют, как и стали. Легированные чугуны делятся на: никелевые (2-5% никеля), хромистые (26-36% хрома), алюминиевые, высококремнистые, кремнемолибденовые (антихлоры) и другие.
Сплавы цветных металлов: никель, медь, алюминий, титан, цинк, олово, свинец, серебро, тантал, золото и другие металлы.
2. Защита поверхности металла покрытиями.
Металлические покрытия подразделяют по назначению на: защитные; защитно-декоративные; покрытия, повышающие поверхностную твердость металла и его сопротивление механическому износу; покрытия, служащие для восстановления размеров деталей. Главный недостаток металлических покрытий – пористость. По способу получения покрытий они делятся на электрохимические и механические.
Гальванические покрытия. Образуются благодаря электролитическому осаждению металла из раствора его соли на поверхность защищаемых изделий (катод). Они бывают: цинковые (защищают от коррозии на воздухе и воде до 70 0С); свинцовые (от воздействия сернистых газов); никелевые (от щелочей); кадмиевые (от морской воды).
Химическое осаждение металла из раствора его соли на защищаемое изделие. Данный способ основан на восстановлении соли металла при действии восстановителей. Обычно таким способом наносят никель или хром.
Контактный способ. Защищаемый металл сам восстанавливает на свою поверхность более электроположительный металл из раствора его соли. Например, если на поверхность алюминия нанести раствор сульфата меди, то часть алюминия с поверхности перейдет в раствор, а на поверхности появится слой меди.
Покрытие расплавленным металлом – металлизация. В зависимости от способа расплавления наносимого металла различают три вида металлизации: электродуговую, газовую и высокочастотную. Струей сжатого воздуха распыляют расплавленный металл на поверхность защищаемого изделия.
Термодиффузионные металлические покрытия образуются в результате проникновения на определенную глубину наносимого металла в защищаемый металл. Виды термодиффузионных процессов – алитирование (Al), силицирование и термохромирование.
Покрытия, получаемые погружением в расплавленный металл. Их недостаток – неравномерность и большая толщина. В основном используют легкоплавкие металлы – свинец, олово, висмут и другие.
Покрытия, получаемые плакированием – совместной прокаткой или горячей прессовкой двух металлов. Полученные металлы называются биметаллами. Это наиболее совершенный способ защиты малостойких металлов, поскольку покрытие имеет минимальную пористость.
3. Обработка коррозионной среды.
Под обработкой коррозионной среды используется при эксплуатации изделия в ограниченном объеме жидкости. В первую очередь из раствора удаляют кислород. Затем к раствору добавляют ингибиторы коррозии. Их действие может быть различным. Например, фосфат натрия, образует на поверхности металлов очень прочную, нерастворимую пленку фосфата металла, хроматы (или дихроматы) переводят металл в пассивное состояние. В последнее время наибольшее распространение получили высокомолекулярные органические соединения, такие как смазки и присадки.
4. Электрохимические методы.
К электрохимическим методам защиты металлов относят катодную защиту и протекторный метод. При катодной защите защищаемый металл присоединяют к отрицательному полюсу источника электрической энергии (катоду) и сам становится катодом. В качестве анодов обычно используются куски железа. При достаточной силе тока в цепи процесс окисления претерпевает материал анода, то есть железо, а на защищаемом металле происходит восстановление окислителя.
При протекторном методе к защищаемому металлу присоединяют лист другого, более активного, металла. При защите стальных изделий обычно используют цинк или магний. При хорошем контакте между металлами железо приобретает отрицательный заряд (становится катодом), а металл протектора приобретает положительный заряд (становится анодом). В результате более активный металл окисляется.
Электрохимические методы защиты от коррозии применимы, в первую очередь, в тех средах, которые хорошо проводят электрический ток, например, в морской воде. Протекторы широко применяются для защиты подводных частей морских судов. Данный метод применяют также для защиты подводных частей расположенных в море буровых, нефтяных вышек. Убытки, которые может вызвать коррозия таких ценных сооружений, намного превышают стоимость металла протекторов.
Тема 1. Основные понятия и законы химии.
Химия это наука о веществах и их превращениях. Она относится к естественным наукам и тесно связана, в первую очередь, с физикой и биологией. На сегодняшний день известно около 120 тысяч неорганических веществ и более 10 миллионов органических, причем число последних постоянно растет.
Итак, с чего начинается химия? Химия начинается с элементов, то есть с определенного вида атомов с одинаковым положительным зарядом ядра. Наименьшей частицей химического элемента является атом, входящий в состав молекул простых и сложных веществ. Таким образом, атом это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. В то же время молекула – это наименьшая частица данного вещества, обладающая его химическими свойствами. Их следует отличать, например, атом кислорода и молекула кислорода отличаются по своих химическим и физическим свойствам.
Все вещества делят на простые и сложные. Простые вещества образованы атомами одного элемента. Сложные вещества (или соединения) образованы атомами разных элементов. Не следует путать простое вещество и химический элемент. Один и тот же химический элемент может образовывать несколько простых веществ. Например, элемент углерод образует три простых вещества: уголь, графит и алмаз, которые отличаются строением кристаллической решетки.
Сами атомы очень малы, но еще в 70-х годах определили их массы с большой точностью. Масса атома водорода составила порядка 10-27 кг, а других атомов еще больше. Поэтому, для удобства, при химических расчетах пользуются понятиями относительной атомной и относительной молекулярной массы. Относительной атомной массой Аr химического элемента называется величина, равная отношению массы атома элемента к 1/12 массы атома изотопа углерода С-12. Относительной молекулярной массой Мr вещества называется величина, равная отношению массы молекулы вещества к 1/12 массы атома изотопа углерода С-12. Относительная атомная и относительная молекулярная масса из-меряются в атомных единицах массы (а.е.м.). А как же количественно характеризовать вещество?
За единицу количества вещества в международной системе единиц принят моль. Моль – это количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов и других), сколько атомов содержится в 0,012 кг изотопа углерода С-12. Точное значение числа атомов в 0,012 кг углерода равно 6,02 10 23 моль-1. Это число называется постоянной Авогадро NA, которое показывает число структурных единиц в моле любого вещества.
Величина, равная отношению массы вещества к количеству вещества называется молярной массой. Обычно она имеет размерность г/моль и численно равна относительной атомной или относительной молекулярной массе данного вещества. Например, Аr(C) = 12, а М(С) = 12 г/моль.
Химические элементы обозначают химическими символами. Сложные вещества обозначают химическими формулами. Химическую формулу устанавливают путем анализа состава веществ. Процессы взаимодействия веществ записывают с помощью химических уравнений, в которых используются соответствующие обозначения элементов и сложных веществ. В левой части записывают формулы веществ, вступающих в реакцию, в правой – формулы продуктов реакции.
Все химические взаимодействия подчиняются закону сохранения массы веществ, который гласит следующее: масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции. При этом общее число атомов каждого элемента всегда остается постоянным. Таким образом, при составлении уравнения реакции типа
H2SO4 + 2NaOH = Na2SO4 + 2H2O
Нужно расставить так называемые стехиометрические коэффициенты таким образом, чтобы число атомов каждого элемента в левой части уравнения и в правой было одно и то же, согласно закону сохранения массы веществ. Если коэффициент равен единице, он обычно не пишется.
Закон сохранения массы основан на том явлении, что при химическом взаимодействии массы атомов не изменяются. На данном явлении основан еще один из основных законов химии – закон постоянства состава, который гласит: любое чистое молекулярное вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав. Следует отметить, что состав соединений с немолекулярной (надмолекулярной или полимерной структурой) не является постоянным и зависит от условий получения.
Поскольку газы являются наиболее простым объектом для исследования, то их свойства изучены наиболее полно. Экспериментальным путем был установлен закон объемных отношений (французским ученым Ж.Л. Гей-Люссаком): объемы вступающих в реакцию газов при одинаковых условиях (температуре и давлении) относятся друг к другу как простые целые числа.
Этот экспериментальный закон позволил сформулировать закон Авогадро: в равных объемах одинаковых газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Таким образом, из закона Авогадро следует, что при одних и тех же условиях 1 моль любого газа занимает одинаковый объем.
Этот объем был вычислен количественно при нормальных условиях (при температуре 273 К – 0 С и давлении 101325 Па) и составил 22,4 л. Итак, при нормальных условиях 1 моль любого газа занимает объем, равный 22,4 л, который называется молярным объемом газа. С другой стороны, молярный объем газа – это отношение объема вещества к количеству данного вещества.
Vm = V/n, где V – объем газа, л; n - количество вещества, моль.
На основании закона Авогадро определяют молярные массы газообразных веществ. В равных объемах газов при одинаковых условиях содержится одинаковое количество молекул, а, следовательно, и молей газов. Отношение масс равных объемов газов равно отношению их молярных масс:
m1/m2 = M1/M2
Отношение массы объема газа к массе такого же объема другого газа (при одинаковых условиях) называется плотностью первого газа по второму:
D = M1/M2.
Из закона постоянства состава следует, что элементы соединяются друг с другом в строго определенных количественных соотношениях. Или эквивалентных соотношениях. Поэтому в химию были введены понятия эквивалента или эквивалентной массы.
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях соединяется или замещает один катион водорода (один протон) или гидроксид-анион, а в окислительно-восстановительных один электрон.
Масса 1 эквивалента элемента называют его эквивалентной массой. Вычисляется в г/моль.
Закон эквивалентов: вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам.
Валентность. Менделеевым была установлена связь между валентностью элемента и его положением в периодической системе. Пример. Он же ввел понятие переменной валентности. Примеры.
Валентность – это способность атомов образовывать связи с другими атомами. Пример.
Между валентностью элемента в данном соединении, его молярной массой и его эквивалентной массой существует простое соотношение: Е = М/n, где Е – эквивалентная масса, г/моль, М – молярная масса, г/моль, n – валентность (простое целое число).
Тема 2. Строение атома. Периодический закон.
Атом – в переводе с греческого означает "неделимый". Атом считался самой маленькой частицей вплоть до конца 19 века. Но в 1897 году англичанин Томсон открыл электрон, элементарную частицу, масса которой в 2000 раз меньше массы атома водорода.
В результате опытов Э. Резерфорд показал, что атом состоит из положительно заряженного ядра, вокруг которого на некотором удалении движутся отрицательно заряженные электроны. Найденные значения зарядов ядер показали, что они численно равны порядковому номеру элемента в периодической системе.
Поэтому периодический закон Менделеева можно сформулировать следующим образом: свойства элементов и образуемых ими простых и сложных соединений находятся в периодической зависимости от заряда ядра атомов элементов, и, следовательно, от количества электронов в них.
Оставалось непонятным, как положительно заряженные ядра и отрицательно заряженные электроны существуют в атоме одновременно, не разрушая сам атом, ведь по закону Кулона одноименные заряды отталкиваются. Было предположено, что электроны в атоме находятся на определенных орбитах, каждя из которых индивидуальна в своем вращении около ядра и не мешает вращению других электронов.
Первый шаг в этом направлении сделал Макс Планк (немецкий физик). Он в 1900 году показал, что световая энергия поглощается и испускается телами не непрерывно, а отдельными порциями – квантами. Энергия каждого кванта зависит от частоты излучения. E = hn, где h = 6,626 10-34 (постоянная Планка).
В дальнейшем Эйнштейн показал, что фотон света неспособен дробиться, и, взаимодействуя с веществом, он проявляет себя как материальная частица. В то же время при интерференции и дифракции света пучок фотонов ведет себя как волна. Такая двойственность свойств получила название корпускулярно-волнового дуализма (двойственности).
Корпускулярные свойства фотона выражаются уравнением Планка E = hn, а волновые ln = с или n = l/с. отсюда Е = hс/l. По уравнению Эйнштейна Е = mс2. Преобразуя два последних уравнения, получим l = h/mc = h/mv. Последнее уравнение называется уравнением де Бройля. Этот французский физик в 1924 году предположил, что волновыми свойствами обладает не только фотон, но и любой другой движущийся объект, например, электрон.
Исходя из волновых свойств электронов, Шредингер в 1926 году предположил, что движение электрона внутри атома должно описываться с помощью некой волновой функции, то есть математическим выражением, связывающим движение электрона с его пространственным расположением в атоме. Волновая функция обозначается буквой y, а ее квадрат характеризует вероятность нахождения электрона в данном объеме.
Для расчета количественных значений энергии электронов в атоме Шредингер вывел уравнение (оно так и названо его именем), согласно которому для электрона, находящегося под действием сил притяжения к ядру, решение находится не для любых, а только для определенных значений энергии. Эти значения энергии соответствуют строго определенным орбитам и электроны в атоме располагаются таким образом, что в одном атоме не существуют двух электронов с одинаковыми значениями энергии.
Покажем математически, что энергия электронов принимает строго определенные значения. Мы уже знаем, что движение электрона вокруг ядра описывается волной де Бройля.
Если длина атома равна l, то длина волны де Бройля будет выражаться выражением l = 2l/n, где n – целое число, то есть 1, 2, 3 и т.д. с другой стороны уравнение де Бройля: l = h/mv. Приравнивая правые части уравнений, получаем:
v = nh/2ml
Так как Е = mv2/2 = n2h2/8ml2 – общий вид уравнения Шредингера.
Таким образом, уровни энергии определяются значением целого числа n, которое называется главным квантовым числом. Наименьшее значение энергии электрона достигается при n = 1. Энергетическое состояние электрона, определяющееся значением главного квантового числа, называется энергетическим уровнем.
Форма электронного облака также не может быть произвольной. Она определяется орбитальным квантовым числом l, которое принимает значения от 0 до n-1. Так, при n = 1, l = 0; а при n = 2, l = 0 или 1 и т.д. Состояния электрона, характеризующиеся различными значениями l, называют энергетическими подуровнями, которым присвоены следующие обозначения:
l = 0 1 2 3
обозначение – s p d f
Отсюда название s- и р-электроны, s- или р-элементы, то есть элементы, внешние электроны которых относятся к определенному виду электронов с данным значением l. При l = 0 (s-электроны) электронное облако имеет сферическую форму. Распределение вероятности нахождения р-электронов указывает на электронное облако в форме гантели. Электронные облака d-электронов имеют еще более сложную форму.
Кроме формы электронного облака уравнение Шредингера позволяет определить и ориентацию электронного облака в пространстве, которая определяется значениями магнитного квантового числа m, принимающего целочисленные значения от –l до +l. то есть некоторому значению l соответствует 2l+1 возможных расположений электронного облака в пространстве.
Состояние электрона в атоме, характеризующееся значениями трех квантовых числе n, l и m, получило название электронной орбитали. Существует и четвертое квантовое число, которое характеризует не положение электрона в пространстве, а его собственное состояние. Оно получило название спинового квантового числа или просто спина: s = ±1/2.
Все четыре квантовых числа полностью определяют энергетическое состояние любого из электронов в атоме. Для определения данного состояния существует так называемый принцип Паули, который гласит, что в атоме не может существовать одновременно двух электронов с одинаковым значением всех 4 квантовых чисел. Из этого следует, что каждая электронная орбиталь может быть занята не более чем двумя электронами с противоположными спинами. Если на орбитали находятся два электрона, то они называются спаренными, а один электрон – неспаренным.
Следует отметить, что в многоэлектронном атоме энергетическое состояние электрона определяется не только его притяжением к ядру, но и взаимодействием с другими электронами. Электроны друг от друга отталкиваются. Таким образом внутренние электронные слои экранируют внешние электроны от положительно заряженного ядра (эффект экранирования). В то же время, электроны внешних слоев некоторое время могут пребывать на расстояниях, более близких к ядру, чем обычно. Они как бы проникают к ядру ближе чем электроны внутренних слоев (эффект проникновения). Эффект проникновения наиболее силен для s-электронов, в меньшей степени для р-электронов и для d-электронов еще меньше.
Последовательность заполнения электронами энергетических подуровней в зависимости от значений n и l определяется двумя правилами Клечковского. Первое правило гласит: при увеличении заряда ядра последовательное заполнение электронных орбиталей происходит с возрастанием суммы n+l. Второе правило регулирует порядок заполнения электронами орбиталей, если суммы n+l равны: тогда заполнение орбиталей происходит в направлении возрастания главного квантового числа n.
Порядок заполнения электронами данного энергетического подуровня определяется правилом Хунда: в пределах одного энергетического подуровня электроны располагаются таким образом, чтобы суммарное значение спина (спинового квантового числа) было максимальным.
Необходимо отметить, что некоторые из электронных конфигураций являются энергетическими более выгодными. Дело в том, что при заполнении очередного электронного подуровня он начинает сильнее притягиваться к ядру, то есть электроны данного уровня (подуровня, орбитали) движутся по орбите, более близкой к ядру. Это приводит к следующему явлению. Электронная конфигурация атома меди (согласно правилам Хунда и Клечковского): 1s22s22p63s23p63d94s2. Но, вследствие того, что заполнение d-подуровня, более выгодно, чем заполнение s-подуровня (10 электронов приближаются к ядру, что выгоднее, чем приближение 2 электронов), происходит так называемый провал электрона и конфигурация меди становится 3d104s1.
Согласно периодическому закону положение элемента в периодической системе зависит от заряда ядра атома. А химические свойства элементов зависят от распределения электронов по энергетическим подуровням, в особенности по внешнему слою. Фактически, зная только электронную конфигурацию атома, можно предположить его характерные химические свойства, достоверно предположить ряд его характерных соединений, а также некоторые его особенности, отличающие его от электронных аналогов.
Дата: 2018-12-28, просмотров: 333.