| Восстановители Металлы, водород, уголь | Окислители Галогены |
Биологическая роль: Окислительно-восстановительные реакции играют огромную роль в природе. Без этих реакций невозможна жизнь. Дыхание, обмен веществ, синтез растениями клетчатки из углекислого газа и воды - все это окислительно-восстановительные процессы. Большинство химических реакций, происходящих в природе - окислительно-восстановительные.
ОВР лежат в основе методов оксидиметрии, которые применяют в клиническом анализе для определения в крови ионов кальция, мочевой кислоты, сахара и др.
Окислительно-восстановительные реакции обычно разделяют на три типа: межмолекулярные, внутримолекулярные и реакции диспропорционирования (самоокисления-самовосстановления).
Межмолекулярные реакции протекают с изменением степени окисления атомов, которые находятся в различных молекулах. Например:
2 Al + Fe2O3  Al2O3 + 2 Fe,
Al2O3 + 2 Fe,
C + 4 HNO3(конц) = CO2  + 4 NO2
+ 4 NO2  + 2 H2O.
+ 2 H2O.
К внутримолекулярным реакциям относятся такие реакции, в которых окислитель и восстановитель входят в состав одной и той же молекулы, например:
(NH4)2Cr2O7  N2
N2 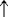 + Cr2O3 + 4 H2O,
+ Cr2O3 + 4 H2O,
2 KNO3 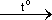 2 KNO2 + O2
2 KNO2 + O2 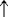 .
.
В реакциях диспропорционирования (самоокисления-самовосстановления) атом (ион) одного и того же элемента является и окислителем, и восстановителем:
Cl2 + 2 KOH  KCl + KClO + H2O,
KCl + KClO + H2O,
2 NO2 + 2 NaOH = NaNO2 + NaNO3 + H2O.
7.
Комплексные соединения- вещества, молекулы которых состоят из центрального атома (или иона), непосредственно связанного с определенным числом других молекул (или ионов), называемых лигандами.
Центральный атом с окружающими его лигандами образуют внутреннюю сферу комплекса.
Также имеется внешняя сфера.
Теория Вернера: Любое КС состоит из:
- центрального атома (центрального иона)
- атома, который образует связи с координированными вокруг него группами атомов (лигандами)
- внутренней и внешней координационной сферы
Координатное число – количество донорных остатков, с помощью которых лиганды связаны с центральным атомом.
Образование КС осуществляется за счёт донорно-акцепторного взаимодействия между комплексообразователем и лигандами. Внешняя сфера удерживается силами электростатического взаимодействия, а возникшая связь по характеру приближается к ионной связи.
Хелатные КС – это циклические соединения, образуемые би- и полидентантными лигандами. (гемоглобин)
Классификация:
1. По заряду комплексообразующего иона
2. По виду лигандов
3. По составу внешней среды
4. По заряду : катионные, анионные, нейтральные
5. По природе лигандов : аквакомплексы, разнолигандные, аммианаты, карбонатные, карбонилы, гидроксокомплексы, цианидные.
Пример: [Ag(N𝐻3)2]Cl хлорид диаминсеребра ( Люба, формулу тоже сказать!)
Поведение в растворах: диссоциируют
Первая стадия – распад на комплекс.ион внутренней сферы и ион внешней сферы
Вторая стадия – распад внутренней сферы
Общая константа нестойкости суммарного процесса диссоциации равна произведению констант всех ступеней диссоциации. Чем меньше константа нестойкости комплекса, тем прочнее комплекс.
Биологическая роль:
- накопление и перемещение различных веществ и энергии
- обмен и блокирование функциональных групп
- участие в ОВР
- образование и расщепление химических связей


Комплексонометрия-
8.
В любом живом организме осуществляются процессы обмена веществ, которые включают огромное количество непрерывно протекающих и взаимодействующих между собой реакций, в ходе которых выделяется или поглощается энергия. Этот процесс обмена веществ и энергии является самым характерным признаком жизни, т.к. с его прекращением прекращается и жизнь.
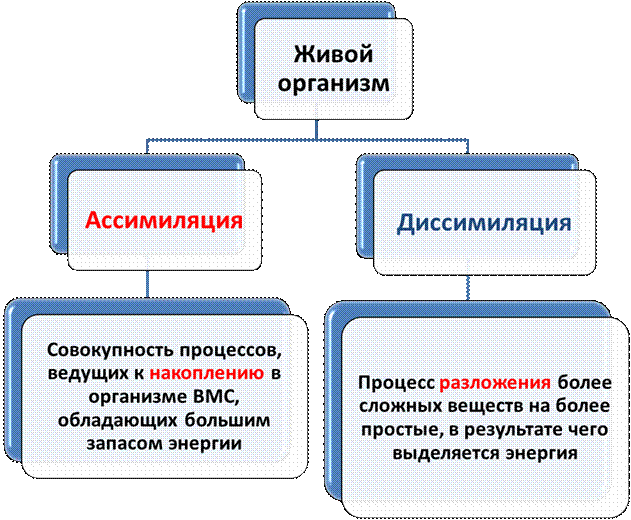
С открытием закона сохранения и превращения энергии учение о взаимных переходах различных форм энергии выделилось из физики в самостоятельную науку термодинамику-науку о превращениях различных форм энергий и законах их превращений.
Термодинамика изучает состояние и превращения, происходящие с макросистемами.
Дата: 2019-02-02, просмотров: 372.