π – связь возникает при перекрывании электронных облаков по обе стороны от линии, соединяющей центры взаимодействующих атомов( ру- ру , рz – pz).
Представления о направленности ковалентной связи позволяет объяснить формы молекул.
Например, при образовании молекулы HCl , область перекрывания электронных облаков находится на линии, соединяющей центры взаимодействующих атомов, поэтому молекула имеет линейное строение.
При образовании молекулы воды 2 неспаренных р-электрона атома кислорода , расположенных по оси x и у, перекрываются с s-электронными облаками 2х атомов водорода, поэтому молекула имеет угловое строение ( 1050 ).
Молекула NH3 имеет
пирамидальное строение,
т.к. атом азота использует
три р – орбитали, расположенные
по оси х, у, z. ( 1070)
Форма молекулы зависит и от гибридизации атомных орбиталей, участвующих в образовании связи.
S и Р орбитали энергетически неравноценны, поэтому 2 ковалентные связи, которые может образовать атом Ве, должны быть не одинаковы.
Однако установлено, что обе связи одинаковы, т.к. происходит гибридизация атомных орбиталей – перераспределение электронной плотности. В итоге образуются новые по форме , но одинаковые для всех, валентные (гибридные) электронные орбитали.
Тип гибридизации – SP.
Две гибридные орбитали атома Ве располагаются под углом 1800, поэтому форма молекулы
ВеН2 – линейная.
Тип гибридизации атомных орбиталей бора – SP2
В результате образуется три гибридные орбитали, расположенные под углом 120 0.
Форма молекулы –
плоский треугольник.
Тип гибридизации атомных орбиталей атома углерода – SP3.
Гибридные орбитали располагаются под углом
109028,
Форма молекулы тетраэдрическая.
Насыщаемость ковалентной связи – понимают наиболее полное использование атомом валентных орбиталей. Насыщаемость связи зависит от количества неспаренных электронов в атоме, которое может увеличиваться за счёт перехода атома в возбуждённое состояние, например:
Валентность- это способность атома присоединять определенное число других атомов с образованием молекулы.
Валентность обозначают черточками у символа элемента.
Водород одновалентный, кислород двухвалентный.
Число валенных черточек определяет число химических связей, которые данный атом может образовать с другими атомами.
Химическая связь- это совокупность взаимодействий между электронами и ядрами, приводящих к соединению атомов в молекулу.
Полярность хим.связи- это величина, измеряемая электрическим моментом данной связи.
Степень окисления- это формальный заряд атома элемента. Вычисляется из предположения, что валентные электроны переходят к атомам с большей относительной электроотрицательностью и все связи в молекуле соединения являются ионными.
Донорно-акцепторная связь:
Донорно-акцепторная связь осуществляется за счёт пары электронов одного атома (донора) и свободной (незаполненной) орбитали другого (акцептора). В обоих случаях электроны становятся общими для двух атомов. Типичным примером является образование иона аммония при реакции аммиака с ионом водорода (протоном).
Условия образования донорно-акцепторной связи:
1. Наличие не поделённой электронной пары у одного атома(молекулы)
2. Наличие свободной орбитали у другого атома(молекулы)
Ионная связь
-это крайний случай ковалентной полярной связи: разница электроотрицательностей элементов настолько велика (>2), что один из них полностью "забирает" электрон у второго и превращается в отрицательно заряженный ион (анион), а второй, отдав электроны, превращается в положительно заряженный ион (катион).
Как правило, связь образуется между атомами металлов и неметаллов.
Например: NaF: натрий-катион, фтор-анион.
5.
Гибридизация орбиталей – это выравнивание формы и энергии некоторых орбиталей при образовании ковалентной связи. Гибридные орбитали представляют собой линейную комбинацию АО и обладают определенной ориентацией в пространстве (симметрией).
Таким образом, когда один атом образует несколько связей, а его валентные электроны принадлежат разным орбиталям (s и p; s, p и d), для объяснения геометрии молекул в МВС необходимо привлекать теорию гибридизации атомных орбиталей. Основные положения теории следующие:
1) гибридные орбитали обладают более высокой энергией, чем исходные атомные, зато они обеспечивают максимальное перекрывание АО в направлении локализованных σ-связей и, соответственно, дают больший выигрыш в энергии при образовании связи;
2) число гибридных орбиталей равно числу АО, участвующих в гибридизации;
3) гибридизуются близкие по энергии валентные АО независимо от того, заполнены они в атоме полностью, наполовину или пусты;
4) химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга.
Если валентная оболочка атома включает электроны на одной s-орбитали и одной p-орбитали, имеет место sp-гибридизация.Рассмотрим её на примере молекулы BeCl2.
Э  лектронная конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние.
лектронная конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние.
Если бы один атом хлора связывался с бериллием за счет 2s-электрона бериллия, а другой - за счет 2px-электрона бериллия, то связи Be-Cl не были бы равноценными. Однако на самом деле обе связи имеют одинаковую длину, прочность и расположены под углом 180° за счёт того, что одна s– орбиталь и одна p– орбиталь “смешиваются” и выравниваются по форме и энергии, давая две одинаковые sp– гибридные орбитали (рисунок 13).
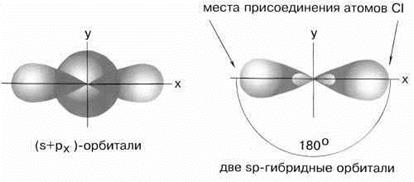 Рисунок 13 - sp-гибридизация валентных орбиталей бериллия
Рисунок 13 - sp-гибридизация валентных орбиталей бериллия
Каждая гибридная орбиталь несимметрична (вытянута в сторону от ядра). Обе гибридные орбитали бериллия отталкиваются и лежат на одной прямой и благодаря этому молекула BeCl2 имеет линейную форму, а обе связи Be-Cl совершенно одинаковы. Такова геометрия и у всех других sp-гибридизованных молекул - независимо от элементов, которые входят в эти молекулы: HC≡CH, MgН2 и т. д.
Е 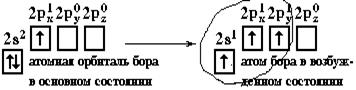
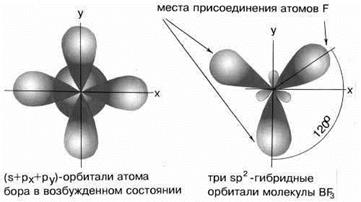 сли валентная оболочка атома включает электроны на однойs-орбиталии двух p-орбиталях, то наблюдается sp2-гибридизация, которая даёт несколько иную геометрию молекулы. Примером может служить sp2-гибридизация бора при образовании молекулы BF3 (рисунок 14). Три sp2-гибридные орбитали лежат в одной плоскости под углом 120°. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника.
сли валентная оболочка атома включает электроны на однойs-орбиталии двух p-орбиталях, то наблюдается sp2-гибридизация, которая даёт несколько иную геометрию молекулы. Примером может служить sp2-гибридизация бора при образовании молекулы BF3 (рисунок 14). Три sp2-гибридные орбитали лежат в одной плоскости под углом 120°. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника.
Рисунок 14 - sp2-гибридизация валентных орбиталей бора
Такую же форму будут иметь и молекулы BH3, H2C=CH2, C6H6 и т. д.
Н 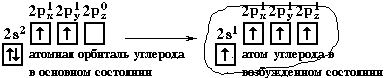 аконец, когда смешиваютсяодна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра (рисунок 15).
аконец, когда смешиваютсяодна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра (рисунок 15).
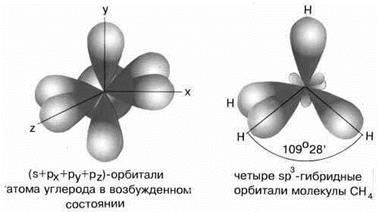 Рисунок 15 - sp3-гибридизация валентных орбиталей углерода
Рисунок 15 - sp3-гибридизация валентных орбиталей углерода
Примером может служить соединение углерода с водородом СН4 (метан). В стационарном состоянии углерод двухвалентен, а для образования связи с водородом необходимо четыре свободных электрона. Они появляются при распаривании s-электронов. В результате образуется четыре гибридных орбитали, которые расположатся максимально далеко друг от друга только тогда, когда молекула примет форму правильного тетраэдра, у которого в центре находится атом C, а в вершинах – атомы H. Углы между всеми связями равны и составляют 109°28'.
Такой же тип гибридизации будет характерен для молекул CCl4, H3C–CH3.
Все вышеописанные молекулы образуются, когда все периферические атомы в многоэлектронной молекуле (или ионе) одинаковы и их число совпадает с числом гибридных орбиталей. Однако, если число гибридных орбиталей больше числа связанных атомов, то часть гибридных орбиталей заселена электронными парами, не участвующими в образовании связи, – несвязывающимиили неподеленными электронными парами.
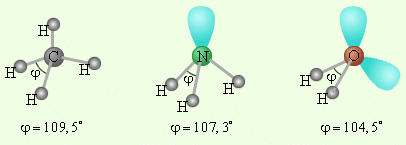
|
| Рисунок 16 - Несвязывающие электронные пары и углы связи в молекулах NH3 и H2O в сравнении с молекулой CH4 |
В качестве примера рассмотрим молекулы NH3 и H2O. Атомы азота и кислорода склонны к sp3-гибридизации. У азота на sp3-ГО, помимо трех связывающих пар электронов, образующих связь с тремя атомами водорода, остается одна неподелённая пара. Именно она, занимая одну sp3-ГО, искажает угол связи H–N–H до 107,3°. В молекуле H2O таких неподелённых пар две, и угол H–O–H равен 104,5° (рисунок 16).
Объясняется это тем, что электроны связывающих и несвязывающих пар по-разному взаимодействуют между собой. Обычно считается, что несвязывающие пары занимают больший объем, чем связывающие, а объем связывающих пар тем меньше, чем больше электроотрицательность периферийных атомов, то есть неподеленные пары отталкиваются между собой несколько сильнее, чем от поделенных пар, и чем поделенные пары отталкиваются друг от друга.
Поэтому реально этот тетраэдр в молекулах NH3 и H2O слегка искажен, потому что реальный угол составляет не 109о, а 107,3о и 104,5о соответственно.
При образовании иона аммония NH4+ по донорно-акцепторному механизму неподелённая электронная пара азота занимает свободную атомную орбиталь протона водорода и угол в ионе увеличивается до 109°28'.
Аналогичное явление наблюдается при образовании иона аксония Н3О+, но угол увеличивается до 107,3о, поскольку только одна из двух неподелённых пар находит себе свободную орбиталь. А вот в ледяной воде угол увеличивается до109°28', поскольку ещё одна неподелённая пара электронов оказывается вовлечённой в водородную связь.
6.
ОВР- это реакции, протекающие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ.
Пример, H2+2Na=2NaH (1)
1) восстановитель 2Nao–2ē=2Na+ окисление
2) окислитель Н2+2ē=2Н¯ восстановление
Н2 – окислитель, восстанавливается до гидрид-иона Н¯.
В реакции Н2+Br2=2HBr (2)
бром является окислителем, он приобретает электрон и восстанавливается, а водород – восстановитель.
1) окислитель Br2+2ē=2Br ¯ восстановление
2) восстановитель Н2 – 2ē=2Н+ окисление
Дата: 2019-02-02, просмотров: 410.