Корпускулярные свойства электрона: характерными свойствами электрона, как и любой материальной частицы, являются масса покоя, энергия и импульс.
Основные характеристики ковалентной связи
Энергия связи – энергия, которая выделяется при образовании химической связи ( кДж/моль);
Длина связи – расстояние между ядрами связанных атомов. Чем больше длина связи, тем меньше энергия связи.
Кратность ковалентной связи;
Направленность ковалентной связи – обуславливает пространственное строение молекул, т.е. их геометрическую форму.
Ковалентная связь образуется за счёт перекрывания валентных электронных облаков, имеющих различную форму, поэтому их взаимное перекрывание может осуществляться различными способами.
В зависимости от способа перекрывания и симметрии образующегося облака различают σ и π связь.
Ионная связь
-это крайний случай ковалентной полярной связи: разница электроотрицательностей элементов настолько велика (>2), что один из них полностью "забирает" электрон у второго и превращается в отрицательно заряженный ион (анион), а второй, отдав электроны, превращается в положительно заряженный ион (катион).
Как правило, связь образуется между атомами металлов и неметаллов.
Например: NaF: натрий-катион, фтор-анион.
5.
Гибридизация орбиталей – это выравнивание формы и энергии некоторых орбиталей при образовании ковалентной связи. Гибридные орбитали представляют собой линейную комбинацию АО и обладают определенной ориентацией в пространстве (симметрией).
Таким образом, когда один атом образует несколько связей, а его валентные электроны принадлежат разным орбиталям (s и p; s, p и d), для объяснения геометрии молекул в МВС необходимо привлекать теорию гибридизации атомных орбиталей. Основные положения теории следующие:
1) гибридные орбитали обладают более высокой энергией, чем исходные атомные, зато они обеспечивают максимальное перекрывание АО в направлении локализованных σ-связей и, соответственно, дают больший выигрыш в энергии при образовании связи;
2) число гибридных орбиталей равно числу АО, участвующих в гибридизации;
3) гибридизуются близкие по энергии валентные АО независимо от того, заполнены они в атоме полностью, наполовину или пусты;
4) химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга.
Если валентная оболочка атома включает электроны на одной s-орбитали и одной p-орбитали, имеет место sp-гибридизация.Рассмотрим её на примере молекулы BeCl2.
Э  лектронная конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние.
лектронная конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние.
Если бы один атом хлора связывался с бериллием за счет 2s-электрона бериллия, а другой - за счет 2px-электрона бериллия, то связи Be-Cl не были бы равноценными. Однако на самом деле обе связи имеют одинаковую длину, прочность и расположены под углом 180° за счёт того, что одна s– орбиталь и одна p– орбиталь “смешиваются” и выравниваются по форме и энергии, давая две одинаковые sp– гибридные орбитали (рисунок 13).
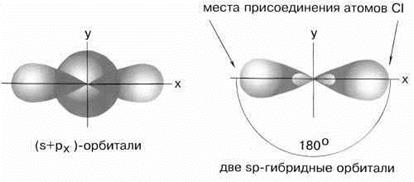 Рисунок 13 - sp-гибридизация валентных орбиталей бериллия
Рисунок 13 - sp-гибридизация валентных орбиталей бериллия
Каждая гибридная орбиталь несимметрична (вытянута в сторону от ядра). Обе гибридные орбитали бериллия отталкиваются и лежат на одной прямой и благодаря этому молекула BeCl2 имеет линейную форму, а обе связи Be-Cl совершенно одинаковы. Такова геометрия и у всех других sp-гибридизованных молекул - независимо от элементов, которые входят в эти молекулы: HC≡CH, MgН2 и т. д.
Е 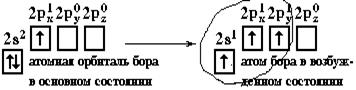
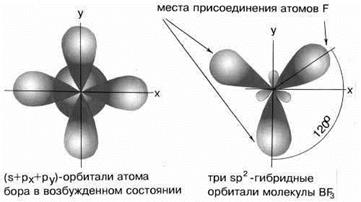 сли валентная оболочка атома включает электроны на однойs-орбиталии двух p-орбиталях, то наблюдается sp2-гибридизация, которая даёт несколько иную геометрию молекулы. Примером может служить sp2-гибридизация бора при образовании молекулы BF3 (рисунок 14). Три sp2-гибридные орбитали лежат в одной плоскости под углом 120°. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника.
сли валентная оболочка атома включает электроны на однойs-орбиталии двух p-орбиталях, то наблюдается sp2-гибридизация, которая даёт несколько иную геометрию молекулы. Примером может служить sp2-гибридизация бора при образовании молекулы BF3 (рисунок 14). Три sp2-гибридные орбитали лежат в одной плоскости под углом 120°. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника.
Рисунок 14 - sp2-гибридизация валентных орбиталей бора
Такую же форму будут иметь и молекулы BH3, H2C=CH2, C6H6 и т. д.
Н 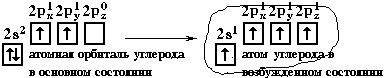 аконец, когда смешиваютсяодна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра (рисунок 15).
аконец, когда смешиваютсяодна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра (рисунок 15).
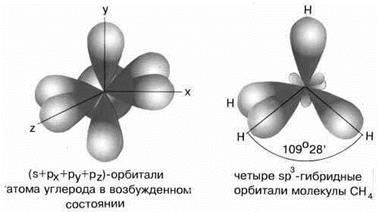 Рисунок 15 - sp3-гибридизация валентных орбиталей углерода
Рисунок 15 - sp3-гибридизация валентных орбиталей углерода
Примером может служить соединение углерода с водородом СН4 (метан). В стационарном состоянии углерод двухвалентен, а для образования связи с водородом необходимо четыре свободных электрона. Они появляются при распаривании s-электронов. В результате образуется четыре гибридных орбитали, которые расположатся максимально далеко друг от друга только тогда, когда молекула примет форму правильного тетраэдра, у которого в центре находится атом C, а в вершинах – атомы H. Углы между всеми связями равны и составляют 109°28'.
Такой же тип гибридизации будет характерен для молекул CCl4, H3C–CH3.
Все вышеописанные молекулы образуются, когда все периферические атомы в многоэлектронной молекуле (или ионе) одинаковы и их число совпадает с числом гибридных орбиталей. Однако, если число гибридных орбиталей больше числа связанных атомов, то часть гибридных орбиталей заселена электронными парами, не участвующими в образовании связи, – несвязывающимиили неподеленными электронными парами.
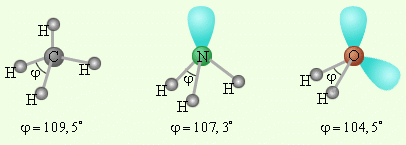
|
| Рисунок 16 - Несвязывающие электронные пары и углы связи в молекулах NH3 и H2O в сравнении с молекулой CH4 |
В качестве примера рассмотрим молекулы NH3 и H2O. Атомы азота и кислорода склонны к sp3-гибридизации. У азота на sp3-ГО, помимо трех связывающих пар электронов, образующих связь с тремя атомами водорода, остается одна неподелённая пара. Именно она, занимая одну sp3-ГО, искажает угол связи H–N–H до 107,3°. В молекуле H2O таких неподелённых пар две, и угол H–O–H равен 104,5° (рисунок 16).
Объясняется это тем, что электроны связывающих и несвязывающих пар по-разному взаимодействуют между собой. Обычно считается, что несвязывающие пары занимают больший объем, чем связывающие, а объем связывающих пар тем меньше, чем больше электроотрицательность периферийных атомов, то есть неподеленные пары отталкиваются между собой несколько сильнее, чем от поделенных пар, и чем поделенные пары отталкиваются друг от друга.
Поэтому реально этот тетраэдр в молекулах NH3 и H2O слегка искажен, потому что реальный угол составляет не 109о, а 107,3о и 104,5о соответственно.
При образовании иона аммония NH4+ по донорно-акцепторному механизму неподелённая электронная пара азота занимает свободную атомную орбиталь протона водорода и угол в ионе увеличивается до 109°28'.
Аналогичное явление наблюдается при образовании иона аксония Н3О+, но угол увеличивается до 107,3о, поскольку только одна из двух неподелённых пар находит себе свободную орбиталь. А вот в ледяной воде угол увеличивается до109°28', поскольку ещё одна неподелённая пара электронов оказывается вовлечённой в водородную связь.
6.
ОВР- это реакции, протекающие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ.
Пример, H2+2Na=2NaH (1)
1) восстановитель 2Nao–2ē=2Na+ окисление
2) окислитель Н2+2ē=2Н¯ восстановление
Н2 – окислитель, восстанавливается до гидрид-иона Н¯.
В реакции Н2+Br2=2HBr (2)
бром является окислителем, он приобретает электрон и восстанавливается, а водород – восстановитель.
1) окислитель Br2+2ē=2Br ¯ восстановление
2) восстановитель Н2 – 2ē=2Н+ окисление
Комплексонометрия-
8.
В любом живом организме осуществляются процессы обмена веществ, которые включают огромное количество непрерывно протекающих и взаимодействующих между собой реакций, в ходе которых выделяется или поглощается энергия. Этот процесс обмена веществ и энергии является самым характерным признаком жизни, т.к. с его прекращением прекращается и жизнь.
С открытием закона сохранения и превращения энергии учение о взаимных переходах различных форм энергии выделилось из физики в самостоятельную науку термодинамику-науку о превращениях различных форм энергий и законах их превращений.
Термодинамика изучает состояние и превращения, происходящие с макросистемами.
Термодинамические системы
1. Изолированные-(Δ m=0; Δ Е=0)
2. Закрытые-(Δ m=0; Δ Е≠0)
3. Открытые-(Δ m≠0; Δ Е≠0).
1. Гомогенные - отсутствуют резкие изменения физических и химических свойств при переходе от одних областей системы к другим, следовательно, не существует поверхности раздела между отдельными частями системы.
2. Гетерогенные - состоят из двух или более гомогенных систем. Такие системы состоят из отдельных частей (фаз),имеющих поверхность раздела.
Фаза-совокупность частей системы, схожих по химическому составу и термодинамическим свойствам и находящимся между собой в термодинамическом равновесии.
Гомогенная система- однофазна;
Гетерогенная система состоит из двух или более фаз.
Компонентами равновесной системы называются её независимые составные части, минимальным числом которых может быть выражен состав любой из фаз.
Каждый компонент- индивидуальное химическое вещество, которое может быть выделено из системы и существовать в изолированном виде.
Пример: раствор NaCl содержит частицы:
Молекулы NaCl
Молекулы воды
Ионы Na+,ионы Cl-,в небольшом количестве ионы Н+ и ОН-
Какой тип системы представлен?
Раствор NaCl- система:
• Гомогенная
• Однофазная
• Двухкомпонентная( Н2О и NaCl).
Состояние системы можно описать с помощью термодинамических переменных-параметров системы.
9.
Начало термодинамики
Первое начало термодинамики устанавливает соотношение между теплотой Q, работой А и изменением внутренней энергии системы ΔU:
Изменение внутренней энергии системы равно количеству сообщенной системе теплоты минус количество работы, совершенной системой против внешних сил.
ΔU = Q - А (I.1)
dU=dQ-A (I.2)
Уравнение (I.1) является математической записью 1-го начала термодинамики для конечного, уравнение (I.2) – для бесконечно малого изменения состояния системы.
Внутренняя энергия является функцией состояния; это означает, что изменение внутренней энергии ΔU не зависит от пути перехода системы из состояния 1 в состояние 2 и равно разности величин внутренней энергии U2 и U1 в этих состояниях:
ΔU = U2 - U1
Следует отметить, что определить абсолютное значение внутренней энергии системы невозможно; термодинамику интересует лишь изменение внутренней энергии в ходе какого-либо процесса.
Энергия – мера способности системы совершать работу; общая качественная мера движения и взаимодействия материи. Энергия является неотъемлемым свойством материи. Различают потенциальную энергию, обусловленную положением тела в поле некоторых сил, и кинетическую энергию, обусловленную изменением положения тела в пространстве.
Внутренняя энергия системы – сумма кинетической и потенциальной энергии всех частиц, составляющих систему. Можно также определить внутреннюю энергию системы как её полную энергию за вычетом кинетической и потенциальной энергии системы как целого.
Формы перехода энергии от одной системы к другой могут быть разбиты на две группы. В первую группу входит только одна форма перехода движения путем хаотических столкновений молекул двух соприкасающихся тел, т.е. путём теплопроводности (и одновременно путём излучения). Мерой передаваемого таким способом движения является теплота.
Теплота- есть форма передачи энергии путём неупорядоченного движения молекул.
Во вторую группу включаются различные формы перехода движения, общей чертой которых является перемещение масс, охватывающих очень большие числа молекул (т.е. макроскопических масс), под действием каких-либо сил. Таковы поднятие тел в поле тяготения, переход некоторого количества электричества от большего электростатического потенциала к меньшему, расширение газа, находящегося под давлением и др. Общей мерой передаваемого такими способами движения является работа – форма передачи энергии путём упорядоченного движения частиц.
В биологических системах теплота обычно отдаётся системой во внешнюю среду, а работа совершается системой за счёт убыли внутренней энергии.
В условиях живого организма выделяют несколько видов работ:
• Химическая - работа, совершаемая при синтезе различных ВМС из НМС в результате химических реакций;
• Механическая - работа по перемещению частей и органов тела против механических сил (совершается мышцами при сокращении);
• Осмотическая - работа по переносу различных веществ через мембраны из области с более низкой концентрацией веществ в область с более высокой их концентрацией;
• Электрическая - работа по переносу заряженных частиц в электрическом поле(совершается при передаче нервного возбуждения по клеткам);
• Работа по высвечиванию - излучение органами животных сверхслабого электромагнитного излучения
10.
Термодинамические процессы
ž Изотермические (Δ Т=0)
ž Изобарные (Δ Р=0)
ž Изохорные (Δ V=0)
ž Адиабатные ( Q=0).
11.
Химические реакции, при протекании которых происходит уменьшение энтальпии системы и во внешнюю среду выделяется теплота, назыаются экзотермическими.
Реакции, в результате которых энтальпия возрастает и система поглощает теплоту извне, называются эндотермическими.
В термодинамике принято считать тепло, поглощённое системой(эндотермические реакции),положительным, а тепло, отданное системой(экзотермические реакции) - отрицательным.
12.
Термохимические уравнения:
Указан тепловой эффект реакции(Δ Н);
Указано агрегатное состояние исходных веществ и продуктов реакции:
Н 2(Г) + 1/2 О 2(Г) = Н 2 О(ж);
ΔН=-286кдж/моль
Закон Гесса(1840 г.):тепловой эффект реакции зависит от вида и состояния исходных веществ и продуктов реакции и не зависит от пути перехода( V- const, P-const, t-const)
• Г.И. Гесс известен как один из основоположников термохимии. В 1840 открыл закон постоянства сумм тепла (Закон Гесса).
Δ Н1
А В
Δ Н2 + Δ Н4
D C
Δ Н3
• Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
Δ Н1 = Δ Н2 + Δ Н3 + Δ Н4
Например:
С + О2 = СО2 ; Δ Н1 = - 394 кдж/моль
С + 1/2 О2 = СО; Δ Н2 = -110 кдж/моль
СО +1/2 О2 = СО2 ; Δ Н3 = -284 кдж/моль
Δ Н1 = Δ Н2 + Δ Н3 = - 394 кдж/моль
ž 1 следствие: тепловой эффект реакции (стандартная энтальпия) равен сумме теплот образования(стандартных энтальпий образования) стехиометрического количества продуктов реакции за вычетом суммы теплот образования(стандартных энтальпий образования) стехиометрического количества исходных веществ.
Δ Н(х.р.) = ∑Δ Н обр. (прод.р.) - ∑ ΔН обр.(исх.в.)
ž 2 следствие: тепловой эффект реакции (стандартная энтальпия) равен сумме теплот сгорания(стандартных энтальпий сгорания) стехиометрического количества исходных веществ за вычетом суммы теплот сгорания(стандартных энтальпий сгорания) стехиометрического количества продуктов реакции.
Δ Н(х.р.) = ∑ ΔН сгор. (исх.в.) - ∑ ΔН –сгор.(прод.р.)
Энтальпия образования – тепловой эффект реакции образования 1 моль сложного вещества из простых веществ.
Энтальпия сгорания - тепловой эффект сгорания 1 моль сложного вещества до простейших оксидов.
Величины тепловых эффектов химических реакций зависят от условий, в которых проводятся реакции. Поэтому табличные значения теплот различных процессов принято относить к стандартному состоянию – температуре 298 К и давлению 101325 Па (760 мм. рт. ст.; 1 атм.);
Величины тепловых эффектов при данных условиях называют стандартными тепловыми эффектами и обозначают ΔН°298 и ΔU°298 соответственно.
Значения стандартных энтальпий образования и сгорания различных веществ имеются в справочниках. Эти значения используются для расчета тепловых эффектов различных процессов, в том числе и биохимических реакций.
13.
Начало термодинамики
ž Первое начало термодинамики утверждает, что при превращении одной формы энергии в другую полная энергия системы не изменяется, однако не указывает никаких ограничений относительно возможности этого процесса. Поэтому первое начало термодинамики позволяет рассчитать энергетический эффект процесса, однако не дает ответа на вопросы о том, будет ли процесс протекать самопроизвольно, о направлении и глубине протекания процесса.
Самопроизвольный процесс-–такой процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве, пропорциональном произошедшему изменению состояния системы.
Второе начало термодинамики дает возможность определить, какой из процессов будет протекать самопроизвольно, какое количество работы может быть при этом получено, каков предел самопроизвольного течения процесса
• второе начало термодинамики дает возможность определить, какими должны быть условия, чтобы нужный процесс протекал в необходимом направлении и в требуемой степени, что особенно важно для решения различных задач прикладного характера.
Попыткой воспользоваться 1 началом термодинамики для оценки направления химической реакции явился принцип Бертло-Томсена , согласно которому, самопроизвольно протекают лишь те процессы, которые сопровождаются выделением теплоты (уменьшением энтальпии).
Однако известны процессы, в результате протекания которых энтальпия системы либо не изменяется, либо возрастает(например, растворение в воде солей аммония)
Для прогнозирования возможности и направленности самопроизвольного процесса, необходимо ввести ещё одну функцию состояния системы, которая не зависит от пути реализации процесса и изменение этой функции должно иметь один и тот же знак;
Если рассмотреть любой самопроизвольный процесс, то можно отметить, что в ходе его реализации всегда происходит увеличение беспорядка в системе.
Все параметры системы остались постоянными, кроме степени беспорядка в системе. Мерой этой неупорядоченности является функция состояния системы, называемая энтропией ( S )
Исходя из понятия энтропии, можно дать одну из формулировок 2 начала термодинамики, согласно которому всякий самопроизвольный процесс в изолированной системе идёт с возрастанием энтропии
В состоянии равновесия- наиболее вероятного состояния величина энтропии максимальна.
Классическая термодинамика рассматривает происходящие процессы безотносительно к внутреннему строению системы; поэтому в рамках классической термодинамики показать физический смысл энтропии невозможно. Для решения этой проблемы Больцманом в теорию теплоты были введены статистические представления
Каждому состоянию системы приписывается термодинамическая вероятность (определяемая как число микросостояний, составляющих данное макросостояние системы), тем большая, чем более неупорядоченным или неопределенным является это состояние.
Количественная связь между энтропией S и термодинамической вероятностью W выражается формулой Больцмана:
S= klgW,
k-постоянная Больцмана
С точки зрения статистической термодинамики второе начало термодинамики можно сформулировать следующим образом:
система стремится самопроизвольно перейти в состояние с максимальной термодинамической вероятностью.
Термодинамическая вероятность – число способов, которыми может быть реализовано состояние физической системы, которое характеризуется определёнными значениями плотности, температуры и т.д.
Эти величины определяют состояние системы в целом, однако, при одной и той же плотности, температуре и т.д. частицы системы могут различными способами распределяться в пространстве и иметь различные импульсы.
Каждое данное распределение частиц называется макросостоянием системы.
Термодинамическая вероятность – W равна числу микросостояний, реализующих данное макросостояние. Термодинамическая вероятность не является вероятностью в математическом смысле. Она применяется в статистической физике для определения свойств системы, находящейся в термодинамическом равновесии.
Т.К. реальные процессы необратимы, то можно утверждать, что все процессы в замкнутой системе ведут к увеличению энтропии – принцип возрастания энтропии
• Это означает, что процессы в замкнутой системе идут в направлении увеличения числа микросостояний, т.е. от меньшей вероятности к большей вероятности состояния до тех пор, пока вероятность состояния не станет максимальной.
Закономерности изменения энтропии:
– энтропия возрастает :
• при переходе от твёрдых веществ к жидкостям и газам;
• при переходе из более твёрдого состояния в менее твёрдое;
• при увеличении числа атомов в молекуле(О2 и О3);
• в гомологическом ряду с увеличением числа атомов углерода;
• в химических реакциях, сопровождающихся увеличением количества(моль) газообразных веществ.
Энтропия уменьшается при :
• Отвердевании
• Охлаждении
• Кристаллизации
• Уменьшении количества(моль) газообразных веществ в химических реакциях.
В то время как абсолютное значение энтальпии определить невозможно и вычисляется только её изменение, вычисление абсолютного значения энтропии- вполне возможная задача. Абсолютное значение энтропии используют для вычисления стандартных энтропий веществ, которая равна разности между суммами абсолютных энтропий продуктов реакции и абсолютных энтропий исходных веществ:
Δ S = ∑ S ( прод . р .) - ∑ S ( исх . в .)
Итак, имеется два стимула для самопроизвольно протекающих процессов:
снижение суммарной энергии системы (уменьшение энтальпии);
более равномерное распределение энергии по компонентам и пространству системы ( увеличение энтропии).
Для изолированных и закрытых систем Δ S и Δ H могут являться критериями направленности самопроизвольных процессов.
14.
ž Для открытых систем показателем возможности самопроизвольного процесса является функция состояния системы- свободная энергия Гиббса, изменение которой может быть рассчитано по формуле:
ΔG = Δ H – T ΔS
По знаку Δ G судят о возможности протекания самопроизвольных процессов:
1. ΔG< 0-процесс возможен;
2. ΔG > 0- процесс невозможен;
3. ΔG=0-система находится в состоянии равновесия
Знак Δ G зависит от соотношения Δ H и T Δ S :
ž Если реакция экзотермическая (Δ H<0), а ΔS положительна, то при любой температуре процесс будет идти самопроизвольно;
Т.к. ΔG-функция состояния системы, для её вычисления можно использовать первое следствие из закона Гесса:
ΔG(хим.р.)= ∑ ΔG(прод.р)- ∑ ΔG (исх.в.)
Возникает вопрос: можно ли обратить самопроизвольный процесс? Второй закон термодинамики отвечает, что это возможно, но при условии создания эквивалентной или ещё большей микроскопической неупорядоченности где-то в другом месте.
Примером может служить процесс фотосинтеза, при котором СО2 , Н2 О и др.питательные вещества поглощаются растениями и за их счёт синтезируются ВМС(углеводы). Этот процесс сопровождается понижением энтропии.
Чтобы происходил процесс фотосинтеза, растениям необходима солнечная энергия.
Поэтому уменьшение энтропии при переходе от СО2 и Н2 О к углеводам компенсируется возрастанием энтропии на солнце.
Многие другие фундаментальные биохимические процессы осуществляются с уменьшением энтропии, например, активный транспорт ионов через клеточную мембрану и др., что, на первый взгляд, противоречит термодинамическим закономерностям.
Живой организм- открытая система, в которой энтропия может возрастать, оставаться постоянной или даже уменьшаться
В целом уменьшение энтропии живых систем в процессе их роста происходит за счёт свободной энергии, освобождающейся при распаде поглощаемых извне питательных веществ или за счёт энергии солнца (фотосинтез).
Одновременно это приводит к увеличению их свободной энергии.
Таким образом, поток отрицательной энтропии необходим для компенсации процесса возникновения положительной энтропии и убыли свободной энергии в клетке в результате самопроизвольных реакций метаболизма, т. е. происходит круговорот и превращения свободной энергии, за счёт которой поддерживается функционирование живых структур.
Итак, законы классической термодинамики могут быть использованы только для изолированных равновесных систем, а в живой природе таких систем нет.
По этим причинам при термодинамическом подходе к биохимическим системам следует соблюдать осторожность в окончательных выводах.
В то же время этот подход плодотворен при изучении химических процессов в неживой природе.
15.
Состояние системы называется равновесным, если все свойства остаются постоянными в течение как угодно большего промежутка времени и в системе отсутствуют потоки вещества и энергии.
Если свойства системы постоянны, но имеются потоки вещества и энергии, состояние называется стационарным.
Процесс называется обратимым, если при переходе из начального состояния 1 в конечное состояние 2 все промежуточные состояния оказываются равновесными.
Процесс называется необратимым, если хоть одно из промежуточных состояний неравновесно.
Самопроизвольный процесс – такой процесс, который может протекать без затраты работы извне, причём в результате может быть получена работа в количестве, пропорциональном произошедшему изменению состояния системы. В естественных условиях подавляющее большинство процессов протекает в неизолированных системах. Направление процессов при этом можно характеризовать работой, которую они могут совершать при определенных условиях. Знак изменения энтропии является критерием направления самопроизвольных процессов
Корпускулярные свойства электрона: характерными свойствами электрона, как и любой материальной частицы, являются масса покоя, энергия и импульс.
Дата: 2019-02-02, просмотров: 353.