ПР = 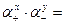 (g+·[Ktz +]) x × (g– ·[Аnz –]) y, (46)
(g+·[Ktz +]) x × (g– ·[Аnz –]) y, (46)
где а+, а– – активности катиона и аниона; g+ , g– – коэффициенты активностей катиона и аниона; [Ktz +], [Аnz –] – равновесные молярные концентрации ионов, моль/дм3.
Поскольку насыщенный раствор труднорастворимого вещества содержит небольшие количества ионов, то есть является достаточно разбавленным, то при расчете ПР активности ионов можно заменить равновесными концентрациями. Тогда уравнение (46) примет вид
ПР = [ Ktz +] x × [Аnz –] y. (47)
ПР электролита при данной температуре есть величина постоянная. Численные значения произведения растворимости большинства труднорастворимых электролитов приведены в справочной литературе.
По величине ПР судят о растворимости электролита: из двух однотипных соединений большей растворимостью обладает то, произведение растворимости которого больше.
Если произведение концентраций ионов (ПРрасч) в каком-либо растворе соли больше, чем табличное значение ПРтабл, то в растворе будет присутствовать осадок данного вещества. И наоборот, если ПРрасч < ПРтабл, то осадок данного вещества растворится.
Равновесные молярные концентрации ионов [Ktz +] и [Аnz –] пропорциональны растворимости вещества L (моль/дм3)
[Ktz +] = x × L ; [Аnz –] = y × L . (48)
Отсюда ПР[(Kt)х(Аn)у] = (x × L)x × ( y × L)y ; (49)
L = 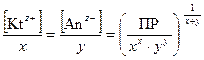 . (50)
. (50)
Примеры решения задач
Пример 1. Вычислите произведение растворимости фторида кальция, если его растворимость в воде равна 0,024 моль/дм3.
Р е ш е н и е
Уравнение диссоциации имеет вид СаF2↓Û Са2+ + 2F –. Тогда по уравнению (48) равновесные концентрации ионов равны
[Са2+]= L; [ F –]= 2× L .
По формуле (47)
ПР(СаF2) = [Са2+]∙[ F –]2 = L × (2 L)2 = 4× L 3 = 4 × (0,024)3 = 5,53 × 10-5.
Пример 2. Выпадет ли осадок йодида серебра при 25 °С после сливания 0,1 дм3 0,005 М раствора нитрата серебра и 0,3 дм3 0,002 М раствора иодида калия, если ПР(AgI)табл = 1,1×10-16?
Решение
При сливании указанных реактивов идет реакция
AgNO3 + KI = AgI↓ + KNO3 ,
Ag+ + I– = AgI↓ .
Молярные концентрации ионов в растворах до смешивания равны
[Ag+] = 0,005 моль/дм3 ; [I–] =0,002 моль/дм3.
Концентрации ионов в растворах после смешивания
[Ag+] = 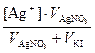 =
= 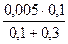 = 1,25∙10-3 моль/дм3;
= 1,25∙10-3 моль/дм3;
[I–] = 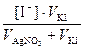 =
= 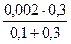 = 1,5∙10-3 моль/дм3 .
= 1,5∙10-3 моль/дм3 .
По формуле (47) находим произведение концентраций ионов (ПРрасч)
ПР(AgI)расч = [Ag+]×[I–]= 1,25∙10-3 ∙1,5∙10-3 = 1,88×10-6.
AgI осаждается, так как соблюдается условие выпадения осадка
ПР(AgI)расч > ПР(AgI)табл .
Пример 3. Вычислите (не учитывая гидролиза) растворимость фосфата бария в моль/л и г/л, а также молярные концентрации ионов в насыщенном растворе данной соли, если ПР [Ва3(РО4)2] = 6,3 · 10-39.
Р е ш е н и е
Фосфат бария диссоциирует по схеме Ва3(РО4)2↓↔ 3Ва2+ + 2РО 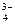 , тогда по формуле (47)
, тогда по формуле (47)
ПР [Ва3(РО4)2] = [Ва2+]3 · [РО 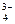 ]2.
]2.
По уравнению (48) равновесные концентрации ионов равны
[Ва2+] = 3×L; [РО 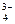 ] = 2×L .
] = 2×L .
Тогда по по формуле (50) L = 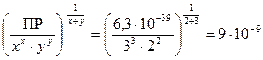 моль/л.
моль/л.
Молярная масса фосфата бария М2(Ва3(РО4)2) = 602 г/моль, тогда растворимость, выраженная в г/л
L = 602 · 9 · 10-9 = 5,42 · 10-6 г/л.
Концентрации ионов [Ва2+] = 3×L = 3 · 9 · 10-9 = 2,7 · 10-8 моль/л;
[РО 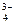 ] = 2×L = 9 · 10-9 · 2 = 1,8 · 10-8 моль/л.
] = 2×L = 9 · 10-9 · 2 = 1,8 · 10-8 моль/л.
Пример 4. Выпадет ли осадок галогенида серебра, если к 1 л 0,1 М раствора [Ag(NH3)2]NO3, содержащему 1 моль аммиака добавить:
а) 1×10–5 моль КВr; б) 1×10–5 моль КI.
Р е ш е н и е
Для решения вопроса о возможности разрушения комплексного иона за счет связывания комплексообразователя в малорастворимую соль необходимо оценить значения равновесных концентраций ионов в рассматриваемой системе. Для этого из справочника [8] выбираем значение константы нестойкости комплекса и произведения растворимости соответствующих солей
КН([Ag(NH3)2]+) = 5,9 · 10–8; ПР(AgBr) = 5,3 · 10–13; ПР(AgI) = 8,3 · 10–17.
Данная комплексная соль диссоциирует по схеме
[Ag(NH3)2]NO3 ® [Ag(NH3)2]+ + NO 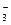 .
.
По определению для комплексного иона [Ag(NH3)2]+
КН([Ag(NH3)2]+) = 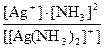 .
.
[NH3] ≈ С2(NH3) = 1 моль/л, так как концентрация молекул аммиака, образовавшихся вследствие вторичной диссоциации комплексного иона мала.
Из схемы первичной диссоциации следует, что
[[Ag(NH3)2]+] ≈ С2([Ag(NH3)2]NO3) = 0,1 моль/л.
Тогда концентрация ионов Ag+ равна
[Ag+] = 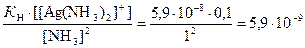 моль/л.
моль/л.
Концентрацию ионов Br –, достаточную для осаждения AgBr найдем из выражения для ПР (AgBr)
[Br –] = 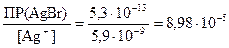 моль/л.
моль/л.
Так как необходимая для осаждения бромида серебра концентрация ионов брома ([Br –] = 8,98×10–5 моль/дм3) больше добавляемой в составе бромида калия ([Br –] = 1×10–5 моль/дм3), то осадок бромида серебра не выпадает.
Концентрацию ионов I–, достаточную для осаждения AgI найдем по аналогии
[I–] = 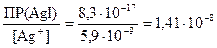 моль/л.
моль/л.
Так как необходимая для осаждения йодида серебра концентрация ионов йода ([I –] = 1,41×10–8 моль/дм3) меньше добавляемой в составе йодида калия ([I –] = 1×10–5 моль/дм3), то реакция разрушения комплексного иона в данном случае будет протекать
[Ag(NH3)2]NO3 + 2КI = AgI↓ + КNO3 + 2NH3 .
ГИДРОЛИЗ СОЛЕЙ
Краткие теоретические сведения
Гидролизом соли называется взаимодействие ионов соли с молекулами воды, сопровождающееся изменением рН раствора. Гидролиз протекает только тогда, когда при взаимодействии ионов и воды образуются малодиссоциированные вещества. Известны следующие виды гидролиза солей.
1. Гидролиз по аниону.
В этом случае гидролизуются соли сильного основания и слабой кислоты, при этом реакция среды становится щелочной (рН > 7). Например
СН3СООNa ® СН3СОО – + Na+;
Na+ + HOH ® реакция практически не идет;
СН3СОО – + HOH Û СН3СООН + ОН –, рН > 7.
Молекулярное уравнение гидролиза
СН3СООNa + HOH Û СН3СООН + NaОН .
Если анион многозарядный, то гидролиз протекает ступенчато, например
Na2CO3 + HOH Û NaHCO3 + NaOH;
I ступень гидролиза: CO 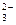 + HOH Û HCO
+ HOH Û HCO 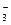 + OH –;
+ OH –;
II ступень гидролиза: НCO 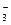 + HOH Û H2CO3 + NaOH .
+ HOH Û H2CO3 + NaOH .
Накапливающиеся в растворе ионы ОН – препятствуют протеканию II ступени гидролиза, поэтому практически гидролиз идет только по I ступени.
2.Гидролиз по катиону.
В этом случае гидролизуются соли слабого основания и сильной кислоты, при этом реакция среды становится кислой (рН < 7). Например
(NH4)2SO4 ® 2NH4+ + SO 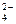 ;
;
SO 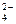 + HOH ® реакция практически не идет;
+ HOH ® реакция практически не идет;
NH4+ + HOH Û NH4OH + H+, рН < 7.
Молекулярное уравнение гидролиза
(NH4)2SO4 + HOH Û NH4OH + NH4HSO4 .
Гидролиз не доходит до конца, так как накопление в растворе ионов водорода препятствует образованию свободной кислоты.
3. Гидролиз по катиону и аниону одновременно.
Такому виду гидролиза подвергаются соли слабого основания и слабой кислоты. В реакции участвуют и катион, и анион соли. Реакция среды определяется относительной силой образующихся слабой кислоты и слабого основания. Если KД (кислоты) > KД (основания), то рН < 7; если KД (кислоты)) < KД (основания), то рН > 7, а когда KД (кислоты) = KД (основания), то рН » 7. Например
NH4COOH + HOH Û NH4OH + HCOOH, рН = 7,
так как KД(HCOOH) = KД(NH4OH) = 1,76 × 10-5.
4. Необратимый полный гидролиз.
Если кислота и основание, образующие соль, являются не только слабыми электролитами, но и малорастворимы или неустойчивы и разлагаются с образованием газообразных продуктов, то гидролиз, как правило, протекает практически необратимо, например
Al2S3 + 6HOH ® 2Al(OH)3¯ + 3H2S ;
2Al3+ + 3S2– + 6HOH ® 2Al(OH)3¯ + 3H2S .
Количественно гидролиз соли характеризуется степенью гидролиза h и константой гидролиза Kг.
Степень гидролиза h показывает, какая часть соли находится в гидролизованном состоянии и выражается в долях единицы или в процентах
h = Сг / С2 , (51)
где Сг – концентрация гидролизованной части соли; С2 – общая концентрация растворенной соли.
Расчет константы гидролиза Kг и степени гидролиза h следует вести по формулам:
1) гидролиз по аниону
Kг = 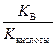 , h =
, h = 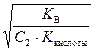 =
= 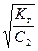 , (52)
, (52)
где Kкислоты – константа диссоциации слабой кислоты.
Если гидролиз протекает ступенчато, то в выражение для расчета константы гидролиза по первой ступени входит константа диссоциации слабого электролита по последней ступени.
Концентрация ионов ОН– и рН раствора соли могут быть вычислены по формулам
[ОН–] = 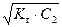 = h × С2 , (53)
= h × С2 , (53)
рН = 14 – рОН = 14 + lg 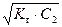 . (54)
. (54)
2) гидролиз по катиону
Kг = 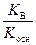 , h =
, h = 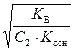 =
= 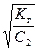 , (55)
, (55)
где Kосн – константа диссоциации слабого основания.
[H+] = 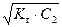 = h × С2 , (56)
= h × С2 , (56)
рН = –lg[H+] = –lg 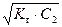 . (57)
. (57)
3) гидролиз по катиону и аниону одновременно:
Kг = 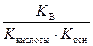 . (58)
. (58)
Для этого случая концентрация раствора соли практически не влияет на степень гидролиза
h = 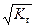 . (59)
. (59)
[H+] = 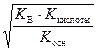 , (60)
, (60)
рН = –lg 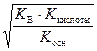 . (61)
. (61)
Примеры решения задач
Пример 1. Определите характер среды водного раствора бората натрия.
Р е ш е н и е
Гидролиз соли, образованной сильным основанием NaOH и слабой многоосновной кислотой H3BO3 определяется ступенчатым характером диссоциации борной кислоты и обратного процесса – соединения ионов BO 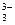 с ионами Н+.
с ионами Н+.
Процесс гидролиза бората натрия можно выразить уравнениями:
I ступень: ВO 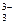 + HOH Û HВO
+ HOH Û HВO 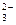 + OH– ;
+ OH– ;
II ступень: НВO 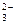 + HOH Û H2ВO
+ HOH Û H2ВO 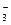 + OH– ;
+ OH– ;
III ступень: H2ВO 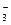 + НOH Û H3BO3 + OH– .
+ НOH Û H3BO3 + OH– .
Как правило, гидролиз заканчивается на I ступени. Тогда молекулярное уравнение гидролиза имеет вид:
Na3BO3 + HOH Û Na2НBO3 + NaOH, рН > 7(среда щелочная).
Пример 2. В какую сторону сместится гидролитическое равновесие при смешивании растворов карбоната натрия и сульфата алюминия?
Р е ш е н и е
Al2(SO4)3 + 3Na2CO3 + 6HOH ® 2Al(OH)3¯ + 3H2O + 3CO2 + 3Na2SO4 .
В результате смешивания растворов катионы Н+, образующиеся при гидролизе Al2(SO4)3, соединяются с анионами ОН–, образующимися при гидролизе Na2CO3, что приводит к смещению равновесия реакции в сторону образования продуктов гидролиза. Смещение усиливается за счет разложения образующихся молекул Н2CO3 и выделения малорастворимого основания Al(OH)3, поэтому реакция идет практически до конца. В ионной форме уравнение реакции имеет вид
2Al3+ + 3CO + 6HOH ® 2Al(OH)3¯ + 3H2O + 3CO2
Пример 3. Вычислите константу гидролиза, степень гидролиза и рН 0,02 М раствора СН3СООK. КД(СН3СООН) = 1,8 · 10–5.
Р е ш е н и е
Соль СН3СООK образована сильным основанием КОН и слабой кислотой СН3СООН. Ионное уравнение гидролиза имеет вид
СН3СОО– + НОН Û СН3СООН + ОН– .
Для расчета константы и степени гидролиза используем формулу (52)
Kг = 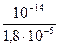 = 5,56×10-10;
= 5,56×10-10;
h = 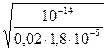 = 1,67×10-4.
= 1,67×10-4.
Пример 4. Вычислите константу гидролиза, степень гидролиза и рН 0,2 М раствора K3PO4, если константы диссоциации ортофосфорной кислоты по первой, второй и третьей ступеням соответственно равны
КI = 7,5∙10–3; КII = 6,25∙10–8; КIII = 2,2∙10–13 .
Р е ш е н и е
Соль K3PO4 образована сильным основанием КОН и слабой кислотой H3PO4. Так как гидролиз преимущественно протекает по первой ступени, тогда молекулярное и ионное уравнение гидролиза имеют вид
K3PO4 + Н2O Û K2HPO4 + KОН
PO43– + Н2O Û HPO42– + ОН–
Для расчета константы гидролиза берем константу диссоциации ортофосфорной кислоты по третьей ступени
Kг = 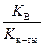 =
= 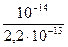 = 4,55×10–2.
= 4,55×10–2.
Степень гидролиза рассчитываем по формуле (52)
h = 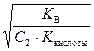 =
= 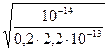 = 0,477.
= 0,477.
Концентрацию гидроксид ионов оценим по уравнению (53)
[ОН–] = h × С2 = 0,477×0,2 = 9,53×10–2.
рН раствора вычислим по формуле (54)
рН = 14 + lg 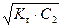 = 14 + lg
= 14 + lg 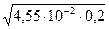 = 12,98.
= 12,98.
Список литературы
1. Павлов Н.Н. Общая и неорганическая химия: Учеб. для вузов. – М.: ООО «Дрофа», 2002.
2. Общая химия в формулах, определениях, схемах / И.Е. Шиманович, М.Л. Павлович, В.Ф. Тикавый, П.М. Малашко; Под ред. В.Ф. Тикавого. – Мн.: Унiверсiтэцкае, 1996.
3. Задачи по общей и неорганической химии: Учеб. пособие для студентов высш. учеб. заведений / Р.А. Лидин, В.А. Молочко, Л.Л. Андреева; Под ред.
Р.А. Лидина. – М.: Гуманитар. изд. центр ВЛАДОС, 2004.
4. Задачи и упражнения по общей химии: Учеб. пособие / Б.И. Адамсон, О.Н. Гончарук, В.Н. Камышова и др.; Под ред. Н.В. Коровина. – М.: Высш. шк., 2003.
5. Сборник задач и упражнений по общей химии: Учеб. пособие / С.А. Пузаков, В.А. Попоков, А.А. Филиппова. – М.: Высш. шк., 2004.
6. Сборник задач и упражнений по общей химии: Учеб. пособие для нехим. спец. вузов / Л.М. Романцева, З.И. Лещинская, В.А. Суханова. – 2-е изд., перераб. и доп. – М.: Высш. шк., 1991.
7. Глинка Н.Л. Задачи и упражнения по общей химии: Учеб. пособие для вузов. – М.: Интеграл-Пресс, 2001.
8. Рабинович В.А., Хавин З.Я. Краткий химический справочник. – Л.: Высш. шк., 1991.
9. Литвинова Т. Н., Сборник задач по общей химии: Учеб. пособие для вузов. – 3-е изд., перераб. - М.: ООО «Издательство Оникс»: ООО «Издательство «Мир и Образование», 2007. – 224 с.
Содержание
Введение .................................................................................................... 3
Растворимость. Способы выражения состава растворов ...................... 3
Краткие теоретические сведения ........................................................... 3
Примеры решения задач ....................................................................... 6
Разбавленные растворы неэлектролитов ................................................. 11
Краткие теоретические сведения ........................................................... 11
Примеры решения задач ....................................................................... 13
Растворы электролитов ............................................................................ 15
Краткие теоретические сведения ........................................................... 15
Примеры решения задач ....................................................................... 18
Ионное произведение воды. Буферные растворы ................................... 21
Краткие теоретические сведения ........................................................... 21
Примеры решения задач ....................................................................... 22
Произведение растворимости .................................................................. 26
Краткие теоретические сведения ........................................................... 26
Примеры решения задач ....................................................................... 27
Гидролиз солей ......................................................................................... 30
Краткие теоретические сведения ........................................................... 30
Примеры решения задач ....................................................................... 32
Литература ................................................................................................ 34
Дата: 2018-12-28, просмотров: 344.