Вещества, которые в растворе не распадаются на ионы, а существуют в виде сольватированных молекул, называются неэлектролитами.
Разбавленные растворы неэлектролитов, относящихся к нелетучим веществам, обладают рядом коллигативных свойств. Коллигативными свойствами растворов называются такие свойства, которые зависят только от количества растворённых частиц, то есть от концентрации. К таким свойствам относятся:
Понижение давления пара (первый закон Рауля).
Относительное понижение давления насыщенного пара растворителя при образовании раствора равно мольной доле растворенного вещества. Или математически
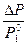 =
= 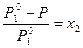 , (13)
, (13)
где Р – давление насыщенного пара над раствором; Р 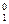 – давление насыщенного пара чистого растворителя; х2 – мольная доля растворенного вещества.
– давление насыщенного пара чистого растворителя; х2 – мольная доля растворенного вещества.
Повышение температуры кипения раствора (второй закон Рауля).
Повышение температуры кипения раствора DTкип прямо пропорционально моляльной концентрации растворенного вещества.
DTкип = Tкип– Т  = КЭ × С m, (14)
= КЭ × С m, (14)
где КЭ – эбуллиоскопическая константа, 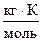 ; Сm - моляльная концентрация, моль/кг; Т
; Сm - моляльная концентрация, моль/кг; Т 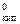 - температура кипения чистого растворителя, К или °С; Tкип – температура кипения раствора, К или °С.
- температура кипения чистого растворителя, К или °С; Tкип – температура кипения раствора, К или °С.
Понижение температуры замерзания (кристаллизации) раствора.
Понижение температуры замерзания раствора DTзам прямо пропорционально моляльной концентрации растворенного вещества.
DTзам = Т 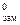 – Tзам = КК × С m, (15)
– Tзам = КК × С m, (15)
где КК – криоскопическая константа, 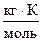 ; Т
; Т 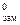 - температура замерзания чистого растворителя, К или °С; Tзам – температура замерзания раствора, К или °С.
- температура замерзания чистого растворителя, К или °С; Tзам – температура замерзания раствора, К или °С.
Таким образом, раствор кипит при более высокой температуре, чем чистый растворитель, а замерзает при более низкой температуре. Значение эбуллиоскопической и криоскопической константы зависит только от природы растворителя и приведено в справочной литературе.
По повышению температуры кипения или понижению температуры замерзания раствора можно вычислить молярную массу растворенного вещества
M2 = КЭ × 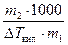 . (16)
. (16)
M2 = KК × 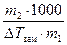 . (17)
. (17)
Осмотическое давление (закон Вант-Гоффа).
Давление, которое нужно приложить к раствору, чтобы остановить одностороннюю диффузию растворителя через полупроницаемую перегородку, называют осмотическим (Росм). Закон Вант-Гоффа гласит, что осмотическое давление численно равно тому давлению, которое оказывало бы растворенное вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объем, равный объему раствора
Росм = С2 × R × T , (18)
где Pосм – осмотическое давление, кПа; С2 – молярная концентрация вещества, моль/дм3; R = 8,314 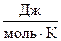 – универсальная газовая постоянная; Т – абсолютная температура, К.
– универсальная газовая постоянная; Т – абсолютная температура, К.
Растворы, обладающие одинаковым осмотическим давлением, называются изотоническими. Раствор, имеющий большее осмотическое давление, является гипертоническим, по отношению к раствору с меньшим значением Росм, который называют гипотоническим.
Примеры решения задач
Пример 1. Вычислите давление насыщенного пара над раствором, содержащим 6,4 г нафталина (С10Н8) в 90 г бензола (С6Н6) при 20 °С. Давление насыщенного пара над чистым бензолом при данной температуре возьмите в справочнике.
Р е ш е н и е
Определим молярные массы нафталина (растворенное вещество) и бензола (растворитель)
М2(С10Н8) = 128 г/моль; М1(С6Н6) = 78 г/моль.
По формуле (8) определяем мольную долю нафталина в растворе
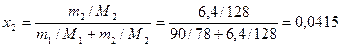 .
.
Из справочника [8] при 20 °С для чистого бензола Р 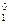 = 9953,82 Па. Тогда, из формулы (13) выразим давление насыщенного пара над раствором
= 9953,82 Па. Тогда, из формулы (13) выразим давление насыщенного пара над раствором
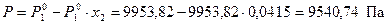 .
.
Пример 2. Вычислите температуру кипения и температуру замерзания водного раствора фруктозы с массовой долей 5 % масс.
Р е ш е н и е
Поскольку массовая доля фруктозы равна 5 % масс., это значит, что в 100 г раствора содержится 5 г растворенного вещества и 95 г воды. Молярная масса фруктозы С6Н12О6 равна М2 = 180 г/моль. Тогда, по уравнению (3) моляльная концентрация раствора равна
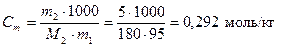 .
.
Из справочника для растворителя выбираем
КЭ(Н2О) = 0,52 (К·кг/моль); а КК(Н2О) = 1,86 (К·кг/моль).
По формуле (14) определяем изменение температуры кипения
DTкип = КЭ × С m = 0,52 ×0,292 = 0,152 °С.
По формуле (15) определяем изменение температуры замерзания
DTзам = КК × С m = 1,86 ×0,292 = 0,543 °С.
Чистая вода кипит при 100°С и замерзает при 0 °С,а раствор глюкозы кипит при более высокой температуре, замерзает при более низкой
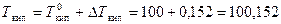 °С;
°С;
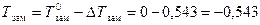 °С.
°С.
Пример 3. Рассчитайте осмотическое давление 20 %-ного водного раствора глюкозы (плотность раствора ρ = 1,08 г/мл = 1080 г/л) при 310 К, применяемого для внутривенного введения при отеке легкого. Каким будет этот раствор гипо-, гипер- или изотоническим по отношению к крови, если учесть, что Росм крови лежит в пределах 740 – 780 кПа?
Р е ш е н и е
Для определения осмотического давления необходимо перейти от процентной концентрации к молярной. Молярная масса глюкозы С6Н12О6 равна М2 = 180 г/моль. Тогда, по уравнению (4) молярная концентрация раствора равна
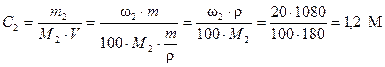 .
.
По закону Вант-Гоффа (уравнение (18))
Росм = 1,2 × 8,314 × 310 = 3092,81 кПа.
Поскольку 3092,81 кПа > Росм(крови), то 20 %-ный раствор глюкозы является гипертоническим по отношению к крови.
Пример 4. Определить массу глюкозы С6Н12О6 , которую должен содержать 1 дм3 раствора, чтобы быть изотоничным раствору, содержащему в 1 дм3 9,2 г глицерина С3Н8О3.
Р е ш е н и е
Определим молярную концентрацию глицерина по формуле (4)
С2(С3Н8О3) = 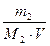 =
= 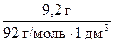 = 0,1 моль/дм3.
= 0,1 моль/дм3.
При одинаковой температуре изотоничными будут растворы с одинаковой молярной концентрацией неэлектролита. Следовательно, масса глюкозы будет равна
m2(С6Н12О6) = С2(С3Н8О3) × M2(С6Н12О6) × V;
m2(С6Н12О6) = 0,1 моль/дм3 × 180 г/моль × 1 дм3 = 18 г.
Пример 5. При растворении 0,4 г некоторого вещества в 10 г воды температура замерзания раствора понижается на 1,24°. Вычислить молекулярную массу растворенного вещества.
Р е ш е н и е
По формуле (17)
M2 = KК × 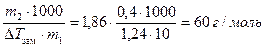 .
.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Дата: 2018-12-28, просмотров: 426.