ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОУ ВПО ЧЕРЕПОВЕЦКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет общих математических и естественнонаучных дисциплин

Кафедра химии
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
ПО ДИСЦИПЛИНЕ
«ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ»
(Для студентов заочной формы обучения)
Часть 3
Учебно-методическое пособие
Специальности: 240301 Химическая технология
неорганических веществ; 280201 Охрана окру-
жающей среды и рациональное использование
природных ресурсов; 240801 Машины и аппара-
ты химических производств
Череповец
2007
Примеры решения задач по дисциплине «Общая и неорганическая химия» для студентов заочной формы обучения: В 3 ч. Ч. 3: Учеб.-метод. пособие. – Череповец: ГОУ ВПО ЧГУ, 2007. – 35 с.
Рассмотрено на заседании кафедры химии, протокол № 9 от 14.05. 07.
Одобрено редакционно-издательской комиссией факультета общих математических и естественнонаучных дисциплин ГОУ ВПО ЧГУ, протокол № 8 от 15.05. 07.
Составители: О.А. Калько – канд. техн. наук, доцент;
Ю.С. Кузнецова;
Н.В. Кунина
Рецензенты: С. Н. Балицкий – канд. хим. наук, доцент (ГОУ ВПО ЧГУ);
Л.Ю. Кудрявцева – канд. техн. наук, доцент (ГОУ ВПО ЧГУ)
Научный редактор: Г.А. Котенко – канд. хим. наук, профессор
© Калько О.А., Кунина Н.В.,
Кузнецова Ю.С., 2007
©ГОУ ВПО Череповецкий государст-
 венный университет, 2007
венный университет, 2007
ВВЕДЕНИЕ
Данное учебно-методическое пособие содержит краткие теоретические сведения и примеры решения задач по теме «Растворы» курса «Общая и неорганическая химия». Пособие предназначено для студентов заочной формы обучения в качестве вспомогательного руководства для самостоятельной работы при выполнении домашних контрольных работ. Содержание учебно-методического пособия соответствует государственному стандарту дисциплины «Общая и неорганическая химия» для химических специальностей.
РАСТВОРИМОСТЬ. СПОСОБЫ ВЫРАЖЕНИЯ
СОСТАВА РАСТВОРОВ
Примеры решения задач
Пример 1. Растворимость KClO3 при 20 °С равна 7,3 г/100 г воды, а при 100 °C – 56,2 г/100 г воды. Какая масса хлората калия выкристаллизуется из 50,0 г раствора данной соли насыщенного при 100 °C, если раствор охладить до 20 °C?
Р е ш е н и е
При охлаждении раствора масса воды, остается постоянной, а масса растворенного вещества, а значит, и масса раствора в целом, меняются. Из определения растворимости следует, что при 100 °C раствор содержит 100,0 г воды и 56,2 г KClO3. Масса такого раствора составляет (100 + 56,2) = 156,2 г. По пропорции определяем массу воды в 50 г раствора
156, 2 г раствора — 100,0 г Н2О;
50,0 г раствора — m1 г Н2О;
Откуда m1 = 32,0 г Н2О.
Тогда масса соли в 50,0 г горячего раствора равна: (50,0 – 32,0) = 18,0 г.
По значению растворимости при 20 °C определяем, сколько соли будет растворено в 32 г воды
в 100 г Н2О — 7,3 г KClO3;
в 32,0 г Н2О — х1 г KClO3;
Откуда m2 = 2,3 г KClO3.
Тогда масса KClO3, выкристаллизовавшаяся после охлаждения раствора, равна (18,0 – 2,3) = 15,7 г.
Пример 2. Рассчитайте массовую долю и моляльную концентрацию глюкозы в растворе, полученном путем растворения 25 г глюкозы (С6Н12О6) в 100 см3 воды.
Р е ш е н и е
Находим массу раствора, считая плотность воды равной 1 г/см3
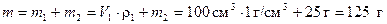 .
.
Тогда по формуле (1) 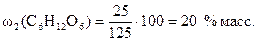 .
.
Для определения моляльной концентрации раствора найдем молярную массу глюкозы
М2(С6Н12О6) = 12·6 + 1·12 + 6·16 = 180 г/моль.
Тогда по формуле (3) 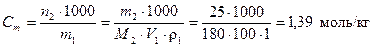 .
.
Пример 3. В дистиллированной воде объёмом 250 мл растворили кристаллогидрат FeSO4 ·7H2О массой 50 г. Определите массовую долю кристаллогидрата и безводного сульфата железа (II) в растворе.
Р е ш е н и е
Найдем массу раствора, считая плотность воды равной 1 г/мл
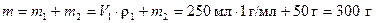 .
.
Тогда по формуле (1) массовая доля кристаллогидрата FeSO4 ·7H2О
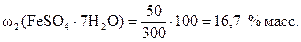 .
.
Определяем молярную массу безводного сульфата железа (II) и молярную массу кристаллогидрата
М2(FeSO4) = 56 + 32 + 16·4= 152 г/моль;
М2(FeSO4 ·7H2О) = 152 + 7·18 = 278 г/моль.
Массу безводной соли в 50 г FeSO4 ·7H2О определяем по пропорции
1 моль (278 г) FeSO4 ·7H2О содержит 1 моль (152 г) FeSO4 ;
50 г FeSO4 ·7H2О содержит m2 г FeSO4 ;
Откуда 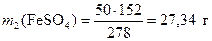 .
.
Массовая доля безводной соли FeSO4 в 300 г раствора равна
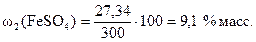
Пример 4. Вычислите массовую долю (% масс.), молярную и молярную эквивалентную концентрации растворенного вещества, а также определите моляльность и титр раствора, полученного при растворении 18 г фосфата калия в 250 см3 воды, если плотность раствора r = 1,31 г/см3 = = 1310 г/дм3.
Р е ш е н и е
Находим массу раствора, считая плотность воды равной 1 г/см3
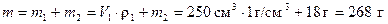 .
.
Тогда по формуле (1) 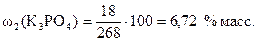 .
.
Определяем молярную массу растворенного вещества
М2(К3РO4) = 3∙39 + 31 + 4∙16 = 212 г/моль.
Молярную концентрацию находим по формуле (4)
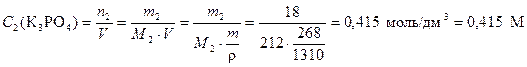 .
.
Для расчета молярной концентрации эквивалента вещества используем формулу (6)
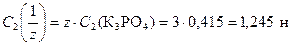 ,
,
где 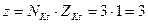 ; NKt – число катионов в 1 молекуле соли; ZKt – заряд катиона соли.
; NKt – число катионов в 1 молекуле соли; ZKt – заряд катиона соли.
Рассчитываем моляльную концентрацию раствора по формуле (3)
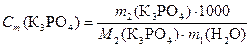
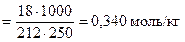 .
.
Вычисляем титр раствора по формуле (7)
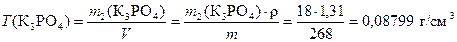 .
.
Пример 5. Определите мольную долю сульфата алюминия в растворе с концентрацией 10 % масс.
Р е ш е н и е
Определяем молярные массы компонентов раствора
М2(Al2(SO4)3) = 2∙27 + 3∙(32 + 16·4) = 342 г/моль;
М1(H2О) = 18 г/моль.
По условию w2(Al2(SO4)3) = 10 % масс., значит в 100 г раствора содержится 10 г соли и 90 г воды. Тогда по формуле (8)
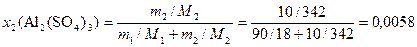 .
.
Пример 6. Рассчитайте массовый процент Al2(SO4)3 в растворе с мольной долей соли х2 = 0,25.
Р е ш е н и е
Пусть общее количество раствора n = 1 моль, тогда мольная доля растворенного вещества будет равна числу моль данного компонента в растворе
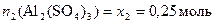 .
.
Число моль растворителя определяем по формуле
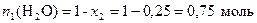 .
.
Рассчитаем массы веществ, которые содержатся в 1 моль раствора
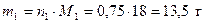 ;
; 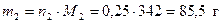 .
.
Массовый процент Al2(SO4)3 в растворе равен
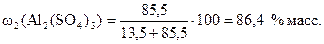
Пример 7. Рассчитайте, какой объём 2,5 %-ного раствора КMnO4 и воды нужно взять для приготовления 40 мл 0,05 %-ного раствора. Плотность 0,05 %-ного раствора равна 1,003 г/мл, а 2,5 %-ного – 1,017 г/мл.
Р е ш е н и е
Примем обозначения для величин, указанных в условии задачи:
Исходный раствор: w1 = 2,5 % масс.; r1 = 1,0175 г/мл; V1 – ?;
Конечный раствор: w2 = 0,05 % масс.; r2 = 1,003 г/мл; V2 = 40 мл.
Приготовление раствора с концентрацией 0,05 % масс. из раствора с концентрацией 2,5 % масс. происходит путем разбавления последнего чистым растворителем, то есть водой, поэтому используем формулу (10). Из которой выражаем V1
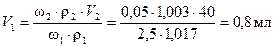
Объем воды найдем по формуле, считая плотность воды r(Н2О) = 1 г/мл
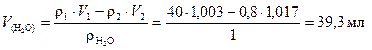 .
.
Пример 8. Сколько граммов 90 %-ного и 10 %-ного раствора серной кислоты необходимо взять для приготовления 800 г 40 %-ного раствора?
Р е ш е н и е
Пользуясь правилом смешивания (иначе правилом креста), определяем соотношение весовых частей, в которых необходимо смешать 90 %-ный. и 10 %-ный растворы серной кислоты, чтобы получить 40 %-ный раствор по формуле (11)
m1 / m2 = (w3 – w2) / (w1 – w3) = (40 – 10) / (90 – 40) = 3/5.
Таким образом, исходные растворы серной кислоты необходимо смешать в соотношении 3 : 5.
По условию задачи необходимо получить 800 г 40 %-ного раствора серной кислоты. Поэтому 800 г делим на две части пропорциональные полученному отношению
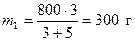 ;
; 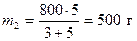 .
.
Следовательно, необходимо взять 300 г 90 %-ного и 500 г 10 %-ного раствора серной кислоты.
Пример 9. Какой объем 0,52 М раствора гидроксида натрия потребуется для нейтрализации 15,45 см3 раствора серной кислоты с массовой долей 3 % масс. и плотностью 1,018 г/см3.
Р е ш е н и е
Объем гидроксида натрия следует находить по закону эквивалентов. Для этого необходимо пересчитать концентрацию раствора серной кислоты из % масс. в нормальность.
Находим массу раствора кислоты, используя объем и плотность
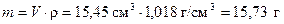 .
.
Тогда из формулы (1) найдем массу серной кислоты
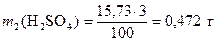 .
.
Определяем молярную массу эквивалента серной кислоты
М2( 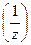 Н2SO4) =
Н2SO4) = 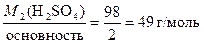 .
.
По формуле (5) определяем нормальность раствора Н2SO4
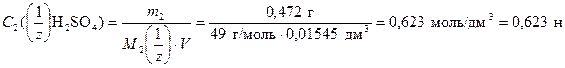 .
.
По формуле (6) определяем нормальность раствора гидроксида натрия
 .
.
Объем NaOH найдем по формуле (12)
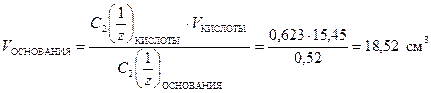 .
.
Пример 10. Какое количество (см3) потребуется для приготовления 0,1 дм3 раствора серной кислоты с концентрацией 3,55 н из 96 %-ного Н2SO4 плотностью r = 1,836 г/см3.
Р е ш е н и е
Массу Н2SO4, содержащуюся в растворе найдем из формулы (5)
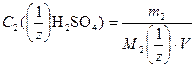 ;
;
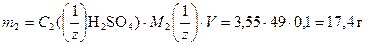 .
.
Объем 96 %-ного раствора серной кислоты, необходимый для приготовления 0,1 дм3 3,55 н раствора найдем из формулы (1)
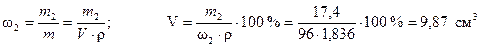 .
.
Примеры решения задач
Пример 1. Вычислите давление насыщенного пара над раствором, содержащим 6,4 г нафталина (С10Н8) в 90 г бензола (С6Н6) при 20 °С. Давление насыщенного пара над чистым бензолом при данной температуре возьмите в справочнике.
Р е ш е н и е
Определим молярные массы нафталина (растворенное вещество) и бензола (растворитель)
М2(С10Н8) = 128 г/моль; М1(С6Н6) = 78 г/моль.
По формуле (8) определяем мольную долю нафталина в растворе
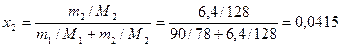 .
.
Из справочника [8] при 20 °С для чистого бензола Р 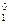 = 9953,82 Па. Тогда, из формулы (13) выразим давление насыщенного пара над раствором
= 9953,82 Па. Тогда, из формулы (13) выразим давление насыщенного пара над раствором
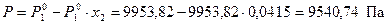 .
.
Пример 2. Вычислите температуру кипения и температуру замерзания водного раствора фруктозы с массовой долей 5 % масс.
Р е ш е н и е
Поскольку массовая доля фруктозы равна 5 % масс., это значит, что в 100 г раствора содержится 5 г растворенного вещества и 95 г воды. Молярная масса фруктозы С6Н12О6 равна М2 = 180 г/моль. Тогда, по уравнению (3) моляльная концентрация раствора равна
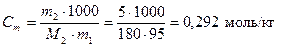 .
.
Из справочника для растворителя выбираем
КЭ(Н2О) = 0,52 (К·кг/моль); а КК(Н2О) = 1,86 (К·кг/моль).
По формуле (14) определяем изменение температуры кипения
DTкип = КЭ × С m = 0,52 ×0,292 = 0,152 °С.
По формуле (15) определяем изменение температуры замерзания
DTзам = КК × С m = 1,86 ×0,292 = 0,543 °С.
Чистая вода кипит при 100°С и замерзает при 0 °С,а раствор глюкозы кипит при более высокой температуре, замерзает при более низкой
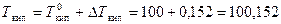 °С;
°С;
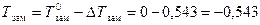 °С.
°С.
Пример 3. Рассчитайте осмотическое давление 20 %-ного водного раствора глюкозы (плотность раствора ρ = 1,08 г/мл = 1080 г/л) при 310 К, применяемого для внутривенного введения при отеке легкого. Каким будет этот раствор гипо-, гипер- или изотоническим по отношению к крови, если учесть, что Росм крови лежит в пределах 740 – 780 кПа?
Р е ш е н и е
Для определения осмотического давления необходимо перейти от процентной концентрации к молярной. Молярная масса глюкозы С6Н12О6 равна М2 = 180 г/моль. Тогда, по уравнению (4) молярная концентрация раствора равна
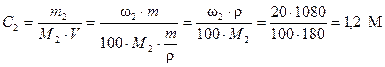 .
.
По закону Вант-Гоффа (уравнение (18))
Росм = 1,2 × 8,314 × 310 = 3092,81 кПа.
Поскольку 3092,81 кПа > Росм(крови), то 20 %-ный раствор глюкозы является гипертоническим по отношению к крови.
Пример 4. Определить массу глюкозы С6Н12О6 , которую должен содержать 1 дм3 раствора, чтобы быть изотоничным раствору, содержащему в 1 дм3 9,2 г глицерина С3Н8О3.
Р е ш е н и е
Определим молярную концентрацию глицерина по формуле (4)
С2(С3Н8О3) = 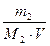 =
= 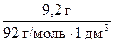 = 0,1 моль/дм3.
= 0,1 моль/дм3.
При одинаковой температуре изотоничными будут растворы с одинаковой молярной концентрацией неэлектролита. Следовательно, масса глюкозы будет равна
m2(С6Н12О6) = С2(С3Н8О3) × M2(С6Н12О6) × V;
m2(С6Н12О6) = 0,1 моль/дм3 × 180 г/моль × 1 дм3 = 18 г.
Пример 5. При растворении 0,4 г некоторого вещества в 10 г воды температура замерзания раствора понижается на 1,24°. Вычислить молекулярную массу растворенного вещества.
Р е ш е н и е
По формуле (17)
M2 = KК × 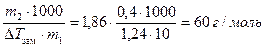 .
.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Примеры решения задач
Пример 1. Раствор содержит 0,85 г хлорида цинка и 125 г воды, которая кристаллизуется при температуре –0,23 °С. Рассчитайте кажущуюся степень диссоциации хлорида цинка в данном растворе.
Р е ш е н и е
Температура замерзания чистой воды равна Т 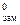 = 0 °С, тогда
= 0 °С, тогда
DTзам = Т 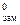 – Tзам = 0 – (–0,23) = 0,23 °С.
– Tзам = 0 – (–0,23) = 0,23 °С.
Моляльность раствора рассчитаем по формуле (3)
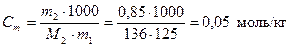 .
.
Изотонический коэффициент для данного раствора определяем из формулы (36)
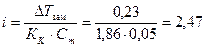 .
.
Для соли CaCl2 n = 3, тогда по уравнению (33) кажущаяся степень диссоциации равна
a = 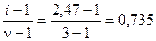 .
.
Пример 2.Определите концентрацию ионов ОН– в 0,01 М растворе гидроксида аммония, если КД(NH4OH) = 1,77 · 10-5.
Р е ш е н и е
Данный электролит в водном растворе диссоциирует обратимо по схеме NH4OH Û NH 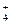 + ОН–. Поскольку КД(NH4OH) << 1, значит гидроксид аммония очень слабый электролит. Тогда для определения степени диссоциации NH4ОН можно использовать формулу (25)
+ ОН–. Поскольку КД(NH4OH) << 1, значит гидроксид аммония очень слабый электролит. Тогда для определения степени диссоциации NH4ОН можно использовать формулу (25)
a = 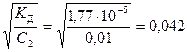 .
.
Концентрацию ионов ОН– найдем по уравнению (20)
[ОН–] = n× a ×C2 = 1× 0,042× 0,01 = 4,2 · 10-4.
Пример 3. Вычислите концентрацию ионов ОН ˉ в растворе, содержащем смесь NH4OH (С2 = 0,2 M) и NH4Сl (С 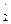 = 1 M), КД(NH4OH) = = 1,77 · 10-5.
= 1 M), КД(NH4OH) = = 1,77 · 10-5.
Р е ш е н и е
Концентрация ионов ОН ˉ определяется уравнением диссоциации слабого электролита по схеме NH4OH Û NH4+ + OH ˉ .
Выражение для константы диссоциации имеет вид KД = 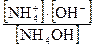 .
.
Тогда [ОН ˉ] = 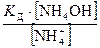 .
.
NH4Сl – сильный электролит, диссоциирует на ионы полностью по схеме NH4Cl Û NH  + Cl–. Тогда [NH4+] = С
+ Cl–. Тогда [NH4+] = С  = 1 моль/л, поскольку концентрацией ионов NH
= 1 моль/л, поскольку концентрацией ионов NH 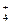 , полученной за счет диссоциации слабого электролита NH4OH, можно пренебречь. Отсюда
, полученной за счет диссоциации слабого электролита NH4OH, можно пренебречь. Отсюда
[ОН –] = 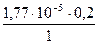 = 3,6×10-6 моль/дм3.
= 3,6×10-6 моль/дм3.
Пример 4. Рассчитайте концентрации ионов в 0,01 М растворе K2SO4.
Р е ш е н и е
K2SO4 – сильный электролит, диссоциирует по уравнению K2SO4 ® 2K+ + SO 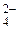 . Следовательно, концентрации ионов определяем по формуле (21)
. Следовательно, концентрации ионов определяем по формуле (21)
[K+] = 2× С2 = 2 × 0,01 = 0,02 моль/дм3; [ SO 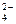 ] = С2 = 0,01 моль/дм3.
] = С2 = 0,01 моль/дм3.
Пример 5. Рассчитайте активность ионов водорода в 0,03 М растворе серной кислоты.
Р е ш е н и е
Н2SO4 − сильная двухосновная кислота, которая полностью распадается на ионы по уравнению Н2SO4 → 2H+ + SO 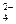 . Тогда концентрации ионов из формулы (21) равны [Н+] = 2× 0,03 = 0,06 М; [SO
. Тогда концентрации ионов из формулы (21) равны [Н+] = 2× 0,03 = 0,06 М; [SO 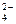 ] = 0,03 М. Ионную силу раствора рассчитаем по формуле (32)
] = 0,03 М. Ионную силу раствора рассчитаем по формуле (32)
I = ½ × (0,06·12 + 0,03 · 22) = 0,09.
Коэффициент активности γ(Н+) найдем из справочника [8]. Для ионной силы I = 0,09 коэффициент активности однозарядного иона γ+ = 0,847. Тогда по формуле (26)
а 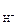 = [Н+] × g+ = 0,06 ×0,847 = 0,051 М.
= [Н+] × g+ = 0,06 ×0,847 = 0,051 М.
Пример 6. Определите активность нитрата стронция в растворе с концентрацией 0,06 моль/кг?
Р е ш е н и е
Sr(NO3)2 диссоциирует по уравнению Sr(NO3)2 Û Sr2+ + 2 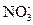 . Так как С m = 0,06 моль/кг, то равновесные концентрации ионов равны
. Так как С m = 0,06 моль/кг, то равновесные концентрации ионов равны
[Sr2+] = 0,06 моль/кг; [ 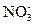 ] = 2 × 0,06 = 0,12 моль/кг.
] = 2 × 0,06 = 0,12 моль/кг.
По уравнению (32) находим ионную силу раствора
I = 1/2 × ([Sr2+] × z 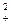 + [
+ [ 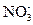 ] × z
] × z  ) = 1/2×(0,06×22 + 0,12×12) = 0,18.
) = 1/2×(0,06×22 + 0,12×12) = 0,18.
По формуле (31) вычисляем средний ионный коэффициент активности электролита
lg g± = – 0,5×½ 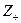 ×
× 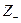 ½×
½× 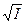 = – 0,5×½2 × 1½×
= – 0,5×½2 × 1½× 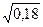 = –0,424.
= –0,424.
Следовательно, f± = 10–0,424 = 0,376.
Среднюю ионную моляльность электролита найдем по формуле (30)
С± = 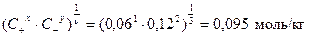 .
.
Активность Sr(NO3)2 оцениваем по уравнению (27)
а2 = 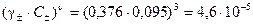 моль/кг.
моль/кг.
Примеры решения задач
Пример 1. Вычислите степень диссоциации, концентрацию ионов водорода и гидроксид ионов, водородный и гидроксильный показатель для 2 М раствора уксусной кислоты, если Kд(СН3СООН) = 1,75×10-5.
Р е ш е н и е 


Уксусная кислота – слабый электролит, диссоциирующий по схеме СН3СООН Û СН3СОО– + Н+. Kд(СН3СООН) << 1, поэтому для расчета степени диссоциации используем формулу (25)
a = 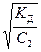 =
= 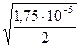 = 2,96×10-3 или 0,296 %
= 2,96×10-3 или 0,296 %
Концентрацию ионов водорода найдем по уравнению (20)
[Н+] = 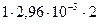 = 5,92×10-3 моль/дм3.
= 5,92×10-3 моль/дм3.
Для определения концентрации ионов ОН– формулу (38) преобразуем к виду
[ОН–] = 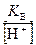 =
= 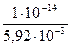 = 1,69∙10-12 моль/дм3.
= 1,69∙10-12 моль/дм3.
Водородный и гидроксильный показатели рассчитываем по формулам (39) и (41)
рН = –lg [Н+] = –lg(5,92×10–3) = 2,23
рОН = 14 – рН = 14 – 2,23 = 11,77
Пример 2. Определите рН 0,017 М раствора муравьиной кислоты, если КД(НСООН) = 2·10–4.
Р е ш е н и е
НСООН – слабая кислота, распадается на ионы по схеме НСООН Û НСОО– + Н+, поэтому расчет концентрации ионов Н+ ведем с использованием формул (25) и (20)
[Н+] = n × α· C2 = n × 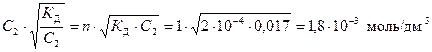 .
.
Водородный показатель рассчитываем по формуле (39)
рН = – lg 1,8 · 10-3 = 2,75.
Пример 3. Определите рН в растворе Са(ОН)2 с концентрацией 0,001 М.
Р е ш е н и е
Са(ОН)2 – щелочь, по первой ступени степень диссоциации α = 1, а по второй ступени степень диссоциации незначительная, поэтому ею можно пренебречь. Тогда схему диссоциации данного сильного электролита следует представить таким образом
Са(ОН)2 ® СаОН+ + ОН–.
Тогда [ОН–] = [Са(ОН)2] = 1×10-3. Данный раствор является сильно разбавленным, поэтому при расчете рОН можно использовать не активность, а концентрацию гидроксид-ионов. По уравнению (40)
рОН = – lg [ОН–] = – lg(1×10–3) = 3.
Из формулы (41) рН = 14 – рОН = 14 – 3 = 11.
Пример 4. Вычислите рН 0,1 М раствора азотной кислоты.
Р е ш е н и е
Азотная кислота – сильная, в растворе практически полностью диссоциирует на ионы по схеме HNO3 ® H+ + NO 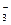 . Степень диссоциации α ≈ 1, следовательно, [Н+] =[NO
. Степень диссоциации α ≈ 1, следовательно, [Н+] =[NO 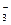 ] = С2(НNO3) = 0,1 моль/дм3. Поскольку концентрация кислоты достаточно велика, при расчете рН следует пользоваться активностью ионов водорода. Тогда по формуле (32)
] = С2(НNO3) = 0,1 моль/дм3. Поскольку концентрация кислоты достаточно велика, при расчете рН следует пользоваться активностью ионов водорода. Тогда по формуле (32)
I = ½ × (0,1·12 + 0,1 · 12) = 0,1.
По уравнению (31 а) вычисляем коэффициент активности Н+
lg g+ = – 0,5×½(+1)2½× 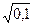 = –0,158; g+ = 10–0,158 = 0,695.
= –0,158; g+ = 10–0,158 = 0,695.
По формулам (26) и (39)
а 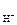 = [Н+] × g+ = 0,1 ×0,695 = 0,0695 М.
= [Н+] × g+ = 0,1 ×0,695 = 0,0695 М.
рН = –lg а 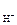 = – lg 0,0695 = 1,16.
= – lg 0,0695 = 1,16.
Пример 5. Рассчитайте молярную концентрацию раствора азотистой кислоты НNO2, если рН = 2,7.
Р е ш е н и е
Азотистая кислота – слабый электролит, диссоциирует по схеме
НNO2 Û Н+ + NO 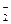
Из уравнения видно, что [Н+] = [NO 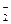 ]. Концентрации ионов найдем из формулы (39)
]. Концентрации ионов найдем из формулы (39)
[Н+] = [NO 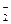 ] = 10–рН = 10–2,7 = 2×10–3 моль/дм3.
] = 10–рН = 10–2,7 = 2×10–3 моль/дм3.
Концентрация молекул кислоты, распавшихся на ионы, также составляет 2×10–3 моль/дм3. Обозначив исходную концентрацию кислоты через С2 и учитывая, что в начальный момент продуктов диссоциации не было, находим, что в состоянии равновесия концентрация недиссоциированных молекул кислоты равна [НNO2] = (С2 − 2×10–3) М.
По формуле (22) константа диссоциации азотистой кислоты
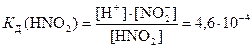 .
.
Значение КД для азотистой кислоты взяли по справочнику [8]. Подставив в последнее выражение все известные концентрации, решаем уравнение относительно С2
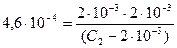 ; С2 = 0,01 М.
; С2 = 0,01 М.
Пример 6. Рассчитайте концентрацию основания Ва(ОН)2 в растворе с рН = 11,3. Коэффициент активности γ (ОН−) = 0,965.
Р е ш е н и е
Ва(ОН)2 – щелочь, сильный электролит, диссоциирует по схеме Ва(ОН)2 → Ва2+ + 2ОН−. Из формулы (41)
рОН = 14 – рН = 14 – 11,3 = 2,7.
Активность ионов ОН− определим из уравнения (40)
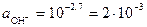 моль/дм3.
моль/дм3.
Из соотношения (26) находим концентрацию ионов ОН−
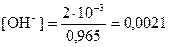 моль/дм3.
моль/дм3.
Из схемы диссоциации следует, что
С2(Ва(ОН)2) = 1/2×[ОН−] = 0,0021/2=0,00105 моль/дм3.
Пример 7. Рассчитайте рН буферного раствора, содержащего в 1 дм3 0,1 моль СН3СООН и 0,2 моль NaСН3СОО. Оцените буферную ёмкость данного раствора по отношению к НСl.
Р е ш е н и е
По справочнику [8] находим значение константы диссоциации уксусной кислоты КД(СН3СООН) = 1,75 · 10–5. Тогда
рКД(СН3СООН) = –lgКД(СН3СООН) = –lg(1,75 · 10–5) = 4,757.
По формуле (43) определяем рН раствора
рН = 4,757 – lg 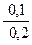 = 5,058.
= 5,058.
При добавлении кислоты рН буферного раствора будет уменьшаться. Обозначим буферную ёмкость раствора по отношению к НСl через х моль. Тогда при добавлении х моль НСl к 1 дм3 раствора пойдет реакция
NaСН3СОО + НСl = NaСl + СН3СООН .
Концентрация СН3СООН увеличится до (0,1 + х) моль/л, а концентрация NaСН3СОО уменьшиться до (0,2 – х) моль/л.
При добавлении НСl в количестве, равном буферной ёмкости раствора, рН понизится на единицу, т. е. будет равным 4,058. В этом случае из (39)
[Н+] = 10–4,058 = 8,75·10–5.
По формуле (42)
[Н+] = 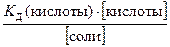 или 8,75 · 10-5 =
или 8,75 · 10-5 = 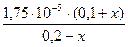 ;
;
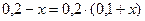 ; х = 6,67 моль/дм3.
; х = 6,67 моль/дм3.
Буферная ёмкость раствора по отношению к НСl равна 6,67 моль/л.
Пример 8. К 100 мл крови для понижения рН от 7,36 до 7,00 необходимо добавить 3,6 мл соляной кислоты с концентрацией 0,1 М. Чему равна буферная ёмкость крови по кислоте?
Р е ш е н и е
По формуле (45) найдем буферную ёмкость раствора по кислоте
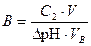 =
= 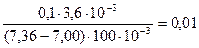 моль/л.
моль/л.
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
Краткие теоретические сведения
Для любого труднорастворимого электролита (Kt)х(Аn)у между его осадком и насыщенным раствором устанавливается равновесие вида
(Kt)х(Аn)у Û x ×Ktz + + y ×Аnz –.
осадок насыщенный раствор
Константа равновесия процесса диссоциации мало растворимого вещества в его насыщенном растворе называется произведением растворимости ПР.
Примеры решения задач
Пример 1. Вычислите произведение растворимости фторида кальция, если его растворимость в воде равна 0,024 моль/дм3.
Р е ш е н и е
Уравнение диссоциации имеет вид СаF2↓Û Са2+ + 2F –. Тогда по уравнению (48) равновесные концентрации ионов равны
[Са2+]= L; [ F –]= 2× L .
По формуле (47)
ПР(СаF2) = [Са2+]∙[ F –]2 = L × (2 L)2 = 4× L 3 = 4 × (0,024)3 = 5,53 × 10-5.
Пример 2. Выпадет ли осадок йодида серебра при 25 °С после сливания 0,1 дм3 0,005 М раствора нитрата серебра и 0,3 дм3 0,002 М раствора иодида калия, если ПР(AgI)табл = 1,1×10-16?
Решение
При сливании указанных реактивов идет реакция
AgNO3 + KI = AgI↓ + KNO3 ,
Ag+ + I– = AgI↓ .
Молярные концентрации ионов в растворах до смешивания равны
[Ag+] = 0,005 моль/дм3 ; [I–] =0,002 моль/дм3.
Концентрации ионов в растворах после смешивания
[Ag+] = 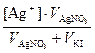 =
= 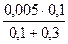 = 1,25∙10-3 моль/дм3;
= 1,25∙10-3 моль/дм3;
[I–] = 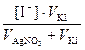 =
= 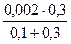 = 1,5∙10-3 моль/дм3 .
= 1,5∙10-3 моль/дм3 .
По формуле (47) находим произведение концентраций ионов (ПРрасч)
ПР(AgI)расч = [Ag+]×[I–]= 1,25∙10-3 ∙1,5∙10-3 = 1,88×10-6.
AgI осаждается, так как соблюдается условие выпадения осадка
ПР(AgI)расч > ПР(AgI)табл .
Пример 3. Вычислите (не учитывая гидролиза) растворимость фосфата бария в моль/л и г/л, а также молярные концентрации ионов в насыщенном растворе данной соли, если ПР [Ва3(РО4)2] = 6,3 · 10-39.
Р е ш е н и е
Фосфат бария диссоциирует по схеме Ва3(РО4)2↓↔ 3Ва2+ + 2РО 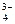 , тогда по формуле (47)
, тогда по формуле (47)
ПР [Ва3(РО4)2] = [Ва2+]3 · [РО 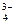 ]2.
]2.
По уравнению (48) равновесные концентрации ионов равны
[Ва2+] = 3×L; [РО 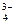 ] = 2×L .
] = 2×L .
Тогда по по формуле (50) L = 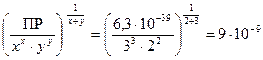 моль/л.
моль/л.
Молярная масса фосфата бария М2(Ва3(РО4)2) = 602 г/моль, тогда растворимость, выраженная в г/л
L = 602 · 9 · 10-9 = 5,42 · 10-6 г/л.
Концентрации ионов [Ва2+] = 3×L = 3 · 9 · 10-9 = 2,7 · 10-8 моль/л;
[РО 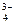 ] = 2×L = 9 · 10-9 · 2 = 1,8 · 10-8 моль/л.
] = 2×L = 9 · 10-9 · 2 = 1,8 · 10-8 моль/л.
Пример 4. Выпадет ли осадок галогенида серебра, если к 1 л 0,1 М раствора [Ag(NH3)2]NO3, содержащему 1 моль аммиака добавить:
а) 1×10–5 моль КВr; б) 1×10–5 моль КI.
Р е ш е н и е
Для решения вопроса о возможности разрушения комплексного иона за счет связывания комплексообразователя в малорастворимую соль необходимо оценить значения равновесных концентраций ионов в рассматриваемой системе. Для этого из справочника [8] выбираем значение константы нестойкости комплекса и произведения растворимости соответствующих солей
КН([Ag(NH3)2]+) = 5,9 · 10–8; ПР(AgBr) = 5,3 · 10–13; ПР(AgI) = 8,3 · 10–17.
Данная комплексная соль диссоциирует по схеме
[Ag(NH3)2]NO3 ® [Ag(NH3)2]+ + NO 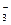 .
.
По определению для комплексного иона [Ag(NH3)2]+
КН([Ag(NH3)2]+) = 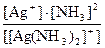 .
.
[NH3] ≈ С2(NH3) = 1 моль/л, так как концентрация молекул аммиака, образовавшихся вследствие вторичной диссоциации комплексного иона мала.
Из схемы первичной диссоциации следует, что
[[Ag(NH3)2]+] ≈ С2([Ag(NH3)2]NO3) = 0,1 моль/л.
Тогда концентрация ионов Ag+ равна
[Ag+] = 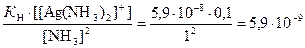 моль/л.
моль/л.
Концентрацию ионов Br –, достаточную для осаждения AgBr найдем из выражения для ПР (AgBr)
[Br –] = 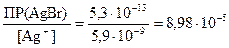 моль/л.
моль/л.
Так как необходимая для осаждения бромида серебра концентрация ионов брома ([Br –] = 8,98×10–5 моль/дм3) больше добавляемой в составе бромида калия ([Br –] = 1×10–5 моль/дм3), то осадок бромида серебра не выпадает.
Концентрацию ионов I–, достаточную для осаждения AgI найдем по аналогии
[I–] = 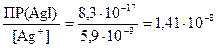 моль/л.
моль/л.
Так как необходимая для осаждения йодида серебра концентрация ионов йода ([I –] = 1,41×10–8 моль/дм3) меньше добавляемой в составе йодида калия ([I –] = 1×10–5 моль/дм3), то реакция разрушения комплексного иона в данном случае будет протекать
[Ag(NH3)2]NO3 + 2КI = AgI↓ + КNO3 + 2NH3 .
ГИДРОЛИЗ СОЛЕЙ
Краткие теоретические сведения
Гидролизом соли называется взаимодействие ионов соли с молекулами воды, сопровождающееся изменением рН раствора. Гидролиз протекает только тогда, когда при взаимодействии ионов и воды образуются малодиссоциированные вещества. Известны следующие виды гидролиза солей.
1. Гидролиз по аниону.
В этом случае гидролизуются соли сильного основания и слабой кислоты, при этом реакция среды становится щелочной (рН > 7). Например
СН3СООNa ® СН3СОО – + Na+;
Na+ + HOH ® реакция практически не идет;
СН3СОО – + HOH Û СН3СООН + ОН –, рН > 7.
Молекулярное уравнение гидролиза
СН3СООNa + HOH Û СН3СООН + NaОН .
Если анион многозарядный, то гидролиз протекает ступенчато, например
Na2CO3 + HOH Û NaHCO3 + NaOH;
I ступень гидролиза: CO  + HOH Û HCO
+ HOH Û HCO 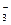 + OH –;
+ OH –;
II ступень гидролиза: НCO 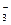 + HOH Û H2CO3 + NaOH .
+ HOH Û H2CO3 + NaOH .
Накапливающиеся в растворе ионы ОН – препятствуют протеканию II ступени гидролиза, поэтому практически гидролиз идет только по I ступени.
2.Гидролиз по катиону.
В этом случае гидролизуются соли слабого основания и сильной кислоты, при этом реакция среды становится кислой (рН < 7). Например
(NH4)2SO4 ® 2NH4+ + SO 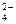 ;
;
SO 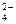 + HOH ® реакция практически не идет;
+ HOH ® реакция практически не идет;
NH4+ + HOH Û NH4OH + H+, рН < 7.
Молекулярное уравнение гидролиза
(NH4)2SO4 + HOH Û NH4OH + NH4HSO4 .
Гидролиз не доходит до конца, так как накопление в растворе ионов водорода препятствует образованию свободной кислоты.
3. Гидролиз по катиону и аниону одновременно.
Такому виду гидролиза подвергаются соли слабого основания и слабой кислоты. В реакции участвуют и катион, и анион соли. Реакция среды определяется относительной силой образующихся слабой кислоты и слабого основания. Если KД (кислоты) > KД (основания), то рН < 7; если KД (кислоты)) < KД (основания), то рН > 7, а когда KД (кислоты) = KД (основания), то рН » 7. Например
NH4COOH + HOH Û NH4OH + HCOOH, рН = 7,
так как KД(HCOOH) = KД(NH4OH) = 1,76 × 10-5.
4. Необратимый полный гидролиз.
Если кислота и основание, образующие соль, являются не только слабыми электролитами, но и малорастворимы или неустойчивы и разлагаются с образованием газообразных продуктов, то гидролиз, как правило, протекает практически необратимо, например
Al2S3 + 6HOH ® 2Al(OH)3¯ + 3H2S ;
2Al3+ + 3S2– + 6HOH ® 2Al(OH)3¯ + 3H2S .
Количественно гидролиз соли характеризуется степенью гидролиза h и константой гидролиза Kг.
Степень гидролиза h показывает, какая часть соли находится в гидролизованном состоянии и выражается в долях единицы или в процентах
h = Сг / С2 , (51)
где Сг – концентрация гидролизованной части соли; С2 – общая концентрация растворенной соли.
Расчет константы гидролиза Kг и степени гидролиза h следует вести по формулам:
1) гидролиз по аниону
Kг = 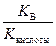 , h =
, h = 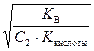 =
= 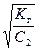 , (52)
, (52)
где Kкислоты – константа диссоциации слабой кислоты.
Если гидролиз протекает ступенчато, то в выражение для расчета константы гидролиза по первой ступени входит константа диссоциации слабого электролита по последней ступени.
Концентрация ионов ОН– и рН раствора соли могут быть вычислены по формулам
[ОН–] = 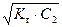 = h × С2 , (53)
= h × С2 , (53)
рН = 14 – рОН = 14 + lg 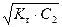 . (54)
. (54)
2) гидролиз по катиону
Kг = 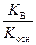 , h =
, h = 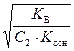 =
= 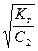 , (55)
, (55)
где Kосн – константа диссоциации слабого основания.
[H+] = 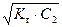 = h × С2 , (56)
= h × С2 , (56)
рН = –lg[H+] = –lg 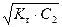 . (57)
. (57)
3) гидролиз по катиону и аниону одновременно:
Kг = 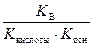 . (58)
. (58)
Для этого случая концентрация раствора соли практически не влияет на степень гидролиза
h = 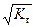 . (59)
. (59)
[H+] = 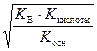 , (60)
, (60)
рН = –lg 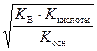 . (61)
. (61)
Примеры решения задач
Пример 1. Определите характер среды водного раствора бората натрия.
Р е ш е н и е
Гидролиз соли, образованной сильным основанием NaOH и слабой многоосновной кислотой H3BO3 определяется ступенчатым характером диссоциации борной кислоты и обратного процесса – соединения ионов BO 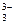 с ионами Н+.
с ионами Н+.
Процесс гидролиза бората натрия можно выразить уравнениями:
I ступень: ВO 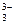 + HOH Û HВO
+ HOH Û HВO 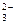 + OH– ;
+ OH– ;
II ступень: НВO 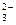 + HOH Û H2ВO
+ HOH Û H2ВO 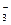 + OH– ;
+ OH– ;
III ступень: H2ВO 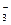 + НOH Û H3BO3 + OH– .
+ НOH Û H3BO3 + OH– .
Как правило, гидролиз заканчивается на I ступени. Тогда молекулярное уравнение гидролиза имеет вид:
Na3BO3 + HOH Û Na2НBO3 + NaOH, рН > 7(среда щелочная).
Пример 2. В какую сторону сместится гидролитическое равновесие при смешивании растворов карбоната натрия и сульфата алюминия?
Р е ш е н и е
Al2(SO4)3 + 3Na2CO3 + 6HOH ® 2Al(OH)3¯ + 3H2O + 3CO2 + 3Na2SO4 .
В результате смешивания растворов катионы Н+, образующиеся при гидролизе Al2(SO4)3, соединяются с анионами ОН–, образующимися при гидролизе Na2CO3, что приводит к смещению равновесия реакции в сторону образования продуктов гидролиза. Смещение усиливается за счет разложения образующихся молекул Н2CO3 и выделения малорастворимого основания Al(OH)3, поэтому реакция идет практически до конца. В ионной форме уравнение реакции имеет вид
2Al3+ + 3CO + 6HOH ® 2Al(OH)3¯ + 3H2O + 3CO2
Пример 3. Вычислите константу гидролиза, степень гидролиза и рН 0,02 М раствора СН3СООK. КД(СН3СООН) = 1,8 · 10–5.
Р е ш е н и е
Соль СН3СООK образована сильным основанием КОН и слабой кислотой СН3СООН. Ионное уравнение гидролиза имеет вид
СН3СОО– + НОН Û СН3СООН + ОН– .
Для расчета константы и степени гидролиза используем формулу (52)
Kг = 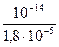 = 5,56×10-10;
= 5,56×10-10;
h = 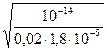 = 1,67×10-4.
= 1,67×10-4.
Пример 4. Вычислите константу гидролиза, степень гидролиза и рН 0,2 М раствора K3PO4, если константы диссоциации ортофосфорной кислоты по первой, второй и третьей ступеням соответственно равны
КI = 7,5∙10–3; КII = 6,25∙10–8; КIII = 2,2∙10–13 .
Р е ш е н и е
Соль K3PO4 образована сильным основанием КОН и слабой кислотой H3PO4. Так как гидролиз преимущественно протекает по первой ступени, тогда молекулярное и ионное уравнение гидролиза имеют вид
K3PO4 + Н2O Û K2HPO4 + KОН
PO43– + Н2O Û HPO42– + ОН–
Для расчета константы гидролиза берем константу диссоциации ортофосфорной кислоты по третьей ступени
Kг = 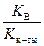 =
= 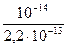 = 4,55×10–2.
= 4,55×10–2.
Степень гидролиза рассчитываем по формуле (52)
h = 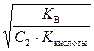 =
= 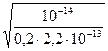 = 0,477.
= 0,477.
Концентрацию гидроксид ионов оценим по уравнению (53)
[ОН–] = h × С2 = 0,477×0,2 = 9,53×10–2.
рН раствора вычислим по формуле (54)
рН = 14 + lg 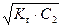 = 14 + lg
= 14 + lg 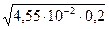 = 12,98.
= 12,98.
Список литературы
1. Павлов Н.Н. Общая и неорганическая химия: Учеб. для вузов. – М.: ООО «Дрофа», 2002.
2. Общая химия в формулах, определениях, схемах / И.Е. Шиманович, М.Л. Павлович, В.Ф. Тикавый, П.М. Малашко; Под ред. В.Ф. Тикавого. – Мн.: Унiверсiтэцкае, 1996.
3. Задачи по общей и неорганической химии: Учеб. пособие для студентов высш. учеб. заведений / Р.А. Лидин, В.А. Молочко, Л.Л. Андреева; Под ред.
Р.А. Лидина. – М.: Гуманитар. изд. центр ВЛАДОС, 2004.
4. Задачи и упражнения по общей химии: Учеб. пособие / Б.И. Адамсон, О.Н. Гончарук, В.Н. Камышова и др.; Под ред. Н.В. Коровина. – М.: Высш. шк., 2003.
5. Сборник задач и упражнений по общей химии: Учеб. пособие / С.А. Пузаков, В.А. Попоков, А.А. Филиппова. – М.: Высш. шк., 2004.
6. Сборник задач и упражнений по общей химии: Учеб. пособие для нехим. спец. вузов / Л.М. Романцева, З.И. Лещинская, В.А. Суханова. – 2-е изд., перераб. и доп. – М.: Высш. шк., 1991.
7. Глинка Н.Л. Задачи и упражнения по общей химии: Учеб. пособие для вузов. – М.: Интеграл-Пресс, 2001.
8. Рабинович В.А., Хавин З.Я. Краткий химический справочник. – Л.: Высш. шк., 1991.
9. Литвинова Т. Н., Сборник задач по общей химии: Учеб. пособие для вузов. – 3-е изд., перераб. - М.: ООО «Издательство Оникс»: ООО «Издательство «Мир и Образование», 2007. – 224 с.
Содержание
Введение .................................................................................................... 3
Растворимость. Способы выражения состава растворов ...................... 3
Краткие теоретические сведения ........................................................... 3
Примеры решения задач ....................................................................... 6
Разбавленные растворы неэлектролитов ................................................. 11
Краткие теоретические сведения ........................................................... 11
Примеры решения задач ....................................................................... 13
Растворы электролитов ............................................................................ 15
Краткие теоретические сведения ........................................................... 15
Примеры решения задач ....................................................................... 18
Ионное произведение воды. Буферные растворы ................................... 21
Краткие теоретические сведения ........................................................... 21
Примеры решения задач ....................................................................... 22
Произведение растворимости .................................................................. 26
Краткие теоретические сведения ........................................................... 26
Примеры решения задач ....................................................................... 27
Гидролиз солей ......................................................................................... 30
Краткие теоретические сведения ........................................................... 30
Примеры решения задач ....................................................................... 32
Литература ................................................................................................ 34
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОУ ВПО ЧЕРЕПОВЕЦКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет общих математических и естественнонаучных дисциплин

Кафедра химии
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
ПО ДИСЦИПЛИНЕ
«ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ»
(Для студентов заочной формы обучения)
Часть 3
Учебно-методическое пособие
Специальности: 240301 Химическая технология
неорганических веществ; 280201 Охрана окру-
жающей среды и рациональное использование
природных ресурсов; 240801 Машины и аппара-
ты химических производств
Череповец
2007
Примеры решения задач по дисциплине «Общая и неорганическая химия» для студентов заочной формы обучения: В 3 ч. Ч. 3: Учеб.-метод. пособие. – Череповец: ГОУ ВПО ЧГУ, 2007. – 35 с.
Рассмотрено на заседании кафедры химии, протокол № 9 от 14.05. 07.
Одобрено редакционно-издательской комиссией факультета общих математических и естественнонаучных дисциплин ГОУ ВПО ЧГУ, протокол № 8 от 15.05. 07.
Составители: О.А. Калько – канд. техн. наук, доцент;
Ю.С. Кузнецова;
Н.В. Кунина
Рецензенты: С. Н. Балицкий – канд. хим. наук, доцент (ГОУ ВПО ЧГУ);
Л.Ю. Кудрявцева – канд. техн. наук, доцент (ГОУ ВПО ЧГУ)
Научный редактор: Г.А. Котенко – канд. хим. наук, профессор
© Калько О.А., Кунина Н.В.,
Кузнецова Ю.С., 2007
©ГОУ ВПО Череповецкий государст-
 венный университет, 2007
венный университет, 2007
ВВЕДЕНИЕ
Данное учебно-методическое пособие содержит краткие теоретические сведения и примеры решения задач по теме «Растворы» курса «Общая и неорганическая химия». Пособие предназначено для студентов заочной формы обучения в качестве вспомогательного руководства для самостоятельной работы при выполнении домашних контрольных работ. Содержание учебно-методического пособия соответствует государственному стандарту дисциплины «Общая и неорганическая химия» для химических специальностей.
РАСТВОРИМОСТЬ. СПОСОБЫ ВЫРАЖЕНИЯ
СОСТАВА РАСТВОРОВ
Дата: 2018-12-28, просмотров: 402.