Полная биологическая очистка сточных вод является эффективным способом предотвращения загрязнения водоемов биохимически разлагаемыми органическими соединениями.
Сущность биохимической очистки – разложение органических веществ, содержащихся в сточных водах в результате жизнедеятельности микроорганизмов.
На очистных сооружениях городской канализации биологической очистке подвергаются бытовые и производственные сточные воды. Разложение органических веществ, в процессе биологической очистки, может происходить в аэробных и анаэробных условиях. Аэробные процессы используются для окисления загрязнений, остающихся в сточной воде после отстаивания:
- растворенных,
- коллоидных,
- тонкодиспергированных органических примесей, не выделившихся при отстаивании.
Окисление осуществляется аэробными микроорганизмами в естественных (биопруды, поля орошения, поля фильтрации) условиях и на искусственных очистных сооружениях (аэротенки, био – и аэрофильтры).
Аэробные биохимические процессы используются для разложения осада сточных вод и иногда в качестве предварительной ступени очистки концентрированных производственных сточных вод.
Окисление органических веществ в аэробных условиях.
1. Окисление целлюлозы и пектиновых веществ протекает в 2 стадии:
- ферментативный гидролиз целлюлозы с образованием глюкозы.
2С6Н10О5 + Н2О = С12Н22О11
целлобиоза
½ С12Н22О11 + ½ Н2О = С6Н12О6,
целлюлоза
- цикл Кребса: С6Н12О6 + 6О2 = 6 СО2 + 6 Н2О.
Разложение целлюлозы в аэробных условиях осуществляется рядом бактерий, актиномицетами и грибами. Чаще всего это:
- бактерии Cytophaga , Cellvibrio
- актиномицеты Micromonospora , Streptomices ;
- грибы Tasarium, Aspergillus и др.
Окисление пектиновых веществ протекает аналогичным образом.
2. Окисление жиров.
Начинается с их гидролиза под влиянием фермента – липазы, содержащегося в пигментных бактериях, актиномицетах, плесневых грибах рода Aspergillus и Penicillium :
СН2 – О – С – R1
| || СН2 –ОН R1 -COOH
| О |
СН – О – С – R2 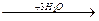 СН - ОН + R2 –COOH
СН - ОН + R2 –COOH
| || |
СН2 – О – С – R1 СН2 –ОН R3 -COOH
|| глицерин жирные кислоты
О
Глицерин легко окисляется до СО2 и Н2О. Жирные кислоты труднее окисляются микроорганизмами до СО2 и Н2О.
СН2-ОН
|
СН- ОН + 3,5 О2 → 3 СО2 + 4Н2О
|
СН2-ОН
глицерин
С17Н35СООН + 26О2 → 18СО2 + 18Н2О
стеариновая кислота
3. Окисление предельных углеводородов (алканов).
Группа метаноокисляющих микроорганизмов Metanomonas под действием ферментов трансформирует метан в СО2 и Н2О.
Основной путь:
R–CH3 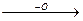 R–CH2OH
R–CH2OH 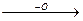 R–CHO
R–CHO 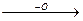 R-OOH
R-OOH 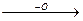 CO2+H2O
CO2+H2O
спирт альдегид карбоновая к-та
Последний этап с образованием СО2 и Н2О протекает в цикле Кребса.
Наиболее энергично окисляют алканы:
- бактериями Pseudomonas ,
- микробактериями,
- актиномицетами.
4. Окисление ароматичных углеводородов и их производных.
Многие соединения ароматического ряда являются токсичными по отношению к микроорганизмам (например, фенол и его гомологи). Но существуют специфические микроорганизмы из групп миксобактерий и бацилл, способные разлагать эти соединения при определенной их концентрации в окружающей среде. Наиболее полно окисление этих соединений протекает в воде при достаточном количестве кислорода. Разложение соединений ароматического ряда в этом случае протекает без образования промежуточных продуктов с образованием СО2 и Н2О.
Постоянными компонентами городских сточных вод являются ПАВ. По отношению к биохимическому окислению они делятся на:
- «мягкие» это анионные ПАВ – алкилсульфаты с нормальной углеводородной цепью;
- «жесткие», имеющие разветвленную углеводородную цепь, содержащую бензольное кольцо и неионогенные ПАВ; они устойчивы к биохимическому окислению.
5. окисление азотсодержащих органических веществ.
Белки непосредственно не могут усваиваться микроорганизмами. Но некоторые группы микроорганизмов могут выделять в среду протеолитические экзоферменты, которые гидролируют белки с образованием соединений с меньшей молекулярной массой (аминокислоты).
Белки 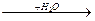 полипептиды
полипептиды 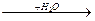 аминокислоты.
аминокислоты.
Аминокислоты под влиянием других микроорганизмов, содержащих фермент трансаминазы, подвергаются дезаминированию, то есть разложению с образованием аммиака. Оно осуществляется различными путями:
1. Прямое дезаминирование
R-CH2-CH- COOH → R-CH=CH-COOH +NH3
| непредельная кислота
NH2
2. Окислительное дезаминирование:
R-CH2-CH- COOH 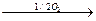 R-CH=CH-COOH +NH3
R-CH=CH-COOH +NH3
| ||
NH2 О
кетокислота
3. Восстановительное дезаминирование:
R-CH- COOH 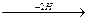 R-CH2 - СOOH +NH3
R-CH2 - СOOH +NH3
| непредельная кислота
NH2
Процесс разложения продуктов гидролиза белковых соединений микроорганизмами с образованием аммиака, называется аммонификацией, а микроорганизмы - аммонификаторами.
Окисление белковых соединений происходит до конца с образованием NH3, CO2 и Н2О.
Аэробные возбудители разложения белков:
- Bacterium Aluorescems;
- Bacillus Subtilis;
- Bacillus mycoides .
Разложение белков может осуществляться актиномицетами и многими грибами.
6. Разложение карбамида.
Карбамид (мочевина) NH2 - СО - NH2 - это продукт белкового обмена у животных и человека. Карбомид гидролизуется уробактериями с образованием аммиака и диоксида углерода:
NH2 - СО - NH2 + 2Н2О →2 NH3 + СО2 + 2Н2О ↔ (NH4)2СО3
||
O
7. Нитрификация
Аммиак, образовавшийся в результате азотосодержащих органических соединений, используется а качестве энергетического материала нитрозобактериями:
2 NH3 + 3О2= 2HNO2 + 2Н2О;
(NH4)2СО3 + 3О2 = 2HNO2 +CO2 + 2Н2О
Наиболее энергичными окислителями аммиака являются бактерии рода Nitromonas, представляющие собой подвижные клетки овальной формы с длинными жгутиками.
Азотистая кислота HNO2 в присутствии достаточного количества кислорода окисляется другой группой микроорганизмов - нитробактериями до азотной кислоты:
2HNO2 + О2 = 2HNO3
Образующиеся кислоты нейтрализуются гидрокарбонатами. Поэтому на первой стадии нитрификации образуются нитриты, а на второй нитраты.
Процесс протекает при энергичной аэрации. Возбудители процесса бактерии рода Nitrobacter .
Процесс окисления аммиака и азотистой кислоты, называются нитрификацией, а бактерии - нитрифицирующими бактериями или нитрификаторами.
8. Разложение серусодержащих соединений.
Сера входит в состав некоторых белков. При гидролитическом распаде белков сера восстанавливается до H2S (токсичен!). Но в водоемах и почве встречаются серобактерии, окисляющие восстановленные соединения серы до свободной серы и сульфатов.
Окисление Н2S протекает в два этапа:
1. 2 Н2S + О2 = 2Н2О + S (при высокой концентрации сероводорода).
2. 2S + 3 О2 + 2Н2О = 2Н2SO4 (при низкой концентрации Н2S).
К серобактериям, окисляющим Н2S через образование свободной серы, относятся:
- бесцветные серобактерии ( Beggiatoa alba),
- пурпурные серобактерии (им. Fhiarodaceas ).
Группа тиобактерий окисляет сероводород непосредственно до Н2SO4 (Fhiobacillus thioparus).
Превращение соединений фосфора
Фосфор входит в состав нуклеиновых кислот, липоидов, АТФ. При разложении этих соединений образуется фосфорная кислота, которая с Са2+ и Mg2+ образует труднорастворимые фосфаты. Перевод их в растворимые соединения (гидро – и дигидрофосфаты), называется мобилизацией фосфатов. Он осуществляется действием кислот (2Н2SO4, HNO3), образующихся в результате жизнедеятельности некоторых серобактерий и нитрификаторов.
Са3 (РО4)2 +2Н2SO4 = Ca(Н2РО4)2 + 2CaSO4
Са (РО4)2 + 4HNO3 = Ca(Н2РО4)2 + 2Ca(NO3)2
Общая направленность аэробных процессов
Может быть условно описана следующими схемами.
1. Окисление органических веществ в процессе энергетического обмена:
СxHyOz + O2 → xCO2 + H2O - ∆H
СxHyOz N + O2 → xCO2 + H2O – NH3 - ∆H
2. Синтез биомассы клеток микроорганизмов в процессе конструктивного обмена.
СxHyOz + NH3 + O2→ С5H7 NO2 + CO2+ H2O - ∆H
(С5H7 NO2 - формула синтезируемого клеткой вещества - среднестатистическая).
3. Окисление органических веществ, входящих в состав клеток микроорганизмов :
С5H7 NO2 + O2 → CO2 + H2O – NH3 - ∆H
Количество кислорода, необходимое для окисления органических примесей в ферментативных реакциях конструктивного и энергетического обменов, характеризует полное БПК. Образующийся аммиак окисляется нитрифицирующими бактериями до ниратов. Первый и третий процессы - экзотермичсекие. Второй - эндотермичсекий.
Микроорганизмы активного ила и биопленки
Действующим началом при очистке сточных вод в аэротенках является активный ил, представляющий собой частицы органических веществ, населенные различными группами микроорганизмов— аэробов и факультативных анаэробов. Аэрация воды способствует созданию оптимальных условий для их жизнедеятельности и интенсификации процессов окисления органических веществ. Кроме того, перемешивание воздухом способствует поддержанию активного ила во взвешенном состоянии.
С физико-химических позиций активный ил представляет собой структурированную коллоидную систему, обладающую высокой сорбционной способностью. Активный ил представляет собой среду обитания многих микроорганизмов воды и почвы, образующих сложный биоценоз. Он получается при длительной аэрации биологической пленки биофильтров или бытовых сточных вод. Состав активного ила определяется природой органических примесей и поэтому может изменяться качественно и количественно. Так, при окислении фенолсодержащих сточных вод в биоценозе активного ила преобладают псевдомонады (Pseudomonas) при общем количестве видов микроорганизмов 48 и плотности бактериального населения 550 млн. клеток в 1 мл. А при окислении сточных вод, содержащих анионные ПАВ (алкилсульфонаты), развиваются только десять видов со значительным преобладанием микобактерий при общем количестве микроорганизмов 500 000 в 1 мл.
Биоценоз активного ила при нормальной работе аэротенка прежде всего представлен различными группами бактерий, среди которых есть гетеротрофы и литотрофы. Численность бактерий в активных илах составляет 108—1012 клеток на 1 мг сухого вещества. В активном иле встречаются все морфологические группы бактерий: порядок Pseudomonadineae и роды: Bacillus, Bacterium, Sarcina, Micrococcus и др. В нормально работающем иле содержится небольшое количество нитчатых бактерий (сферотилюс и кладотрикс).
Бактерии в процессе очистки воды образуют слизистые скопления— зооглеи, которые характерны для хорошо сформированного активного ила. В зооглеях преобладают кокковые и палочковидные формы. В образовании зооглей может участвовать бактерия Zooglea ramigera, образующая разветвленные зооглеи в виде лопастей.
Основными представителями биоценозов активного ила являются бактерии, осуществляющие биохимические процессы разложения органических веществ. Среди них представлены все группы бактерий, разлагающих безазотистые и азотсодержащие органические соединения и недоокисленные неорганические вещества; протеолиты, гидролизующие белковые соединения; аммонификаторы; бактерии, разлагающие углеводы, жиры, органические кислоты; нитрификаторы; серобактерии и др.
Кроме бактерий в активном иле развиваются грибы и актиномицеты. Водоросли обычно встречаются редко и в небольшом количестве.
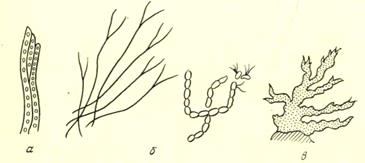
Рис. 20. Нитчатые и зооглейные бактерии:
а — Sphaerotilus natans; 6 — Cladothrix dichotoma; в — Zooglea ramigera
Актиномицеты и близкие к ним микобактерии разлагают углеводороды, жиры, органические кислоты, углеводы. Плесневые грибы участвуют в разложении углеводов, спиртов, органических кислот, некоторые усваивают органические формы азота. Углеводы и органические кислоты потребляются дрожжами.
При затрудненной аэрации или избыточном поступлении в аэротенк органических загрязнений наблюдается смена биоценоза активного ила. При длительности анаэробных условий более 15 мин происходит значительное увеличение количества факультативных анаэробов и подавляется жизнедеятельность аэробных форм. Подобная смена групп микроорганизмов сопровождается образованием неоседающего ила (вспуханием). При этом в активном иле наблюдается массовое развитие нитчатых бактерий и грибов (Fusarium).
Микрофауна активного ила представлена разнообразными группами простейших (жгутиковыми, саркодовыми, инфузориями), коловратками, встречаются малощетинковые черви (олигохеты), реже — водные клещи. Представители микрофауны очень чувствительны к концентрации органических соединений, количеству растворенного кислорода, наличию токсичных соединений. Поэтому в зависимости от изменения степени загрязнения воды в процессе очистки или интенсивности аэрации воды в активном иле наблюдается преобладание различных групп простейших. Так, при сильном загрязнении воды органическими примесями (в начале процесса очистки, при плохой работе аэротенка) в активном иле развиваются в большом количестве из саркодовых мелкие амебы (например, Amoeba limax и др.), бесцветные жгутиковые (p. Bodo, Oicomonas и др.). Инфузории при неблагоприятных условиях из веге тативных форм превращаются в цисты, а при недостатке растворенного кислорода прикрепленные формы переходят в подвижную стадию. Наименее чувствительны к отрицательным воздействиям из равноресничных инфузорий Paramecium caudatum, а из кругоресничных — Vorticella microstoma. При хорошей работе аэротенка в активном иле встречается большое количество видов простейших. Особенно характерны брюхоресничные инфузории: Aspidisca, Stylonichia, Euplotes; кругоресничные: Vorticella convallaria, Opercularia. Если наблюдается дефицит питательных веществ (голодающий ил), происходит уменьшение размеров инфузорий и они начинают инцистироваться. В активном иле, перегруженном органическими примесями, развиваются сосущие инфузории (Suctoria).
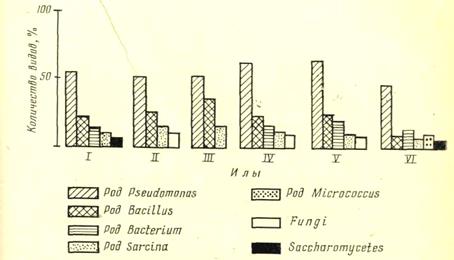
Рис. 21 . Соотношение между различными группами микроорганизмов активного ила
В активном иле в период завершения окисления органических веществ и протекания процесса нитрификации развиваются в большом количестве прикрепленные инфузории (например, Carchesium), раковинные (Arcella) и крупные голые амебы. Довольно часто встречаются коловратки (Philodina, Notommata и др.). Водные клещи и рачки (циклопы) развиваются в голодающем иле. Способность отдельных групп микрофауны развиваться при определенных условиях используется для проведения гидробиологического анализа. При микроскопировании активного ила или биопленки дается характеристика видового и количественного состава микроорганизмов, определяется их жизнеспособность. В сочетании с технологическим анализом это позволяет сделать вывод о работе сооружения.
|
|
По результатам гидробиологического анализа определяется режим работы сооружения, нагрузка по органическим веществам, устанавливается факт попадания производственных сточных вод, содержащих токсичные вещества. При характеристике работы сооружения следует учитывать интенсивность развития индикаторных форм микроорганизмов, а не отдельных видов.
Рис. 22. Коловратки:
а- р. Notommata; б- p. Philodina.
Анализ кривых роста для бактерий и других микроорганизмов показывает, какие микроорганизмы сопутствуют определенной фазе развития бактериальной микрофлоры активного ила. Так, фаза задержки роста бактерий в активном иле сочетается с преобладанием в нем амеб и жгутиковых. В логарифмической фазе из простейших наибольшее развитие получают жгутиковые, увеличивается количество свободно плавающих инфузорий. Эта фаза соответствует интенсивному разложению органических примесей, но скоплений бактерий не образуется. В фазе замедленного роста и стационарной фазе количество бактерий почти не изменяется, но идет образование хлопка активного ила. Этой фазе соответствует максимум развития свободноплавающих инфузорий. Фаза отмирания бактерий (эндогенная) соответствует окончанию разложения органического вещества. Численность бактерий уменьшается в результате отмирания из-за недостатка питательных веществ и потребления их простейшими. В этой фазе из простейших преобладают прикрепленные инфузории, присутствуют свободноплавающие и коловратки. Окисление клеточного материала отмирающих бактерий идет параллельно с процессом нитрификации (нитрифицирующий ил). Роль простейших сводится к поеданию бактерий, а также к потреблению взвешенных веществ.
Процесс минерализации органических веществ может нарушаться в присутствии токсичных соединений, ПАВ, тяжелых металлов и др. Биологическая токсичность примесей производственных сточных вод оценивается по изменению дегидрогеназной активности. Дегидрогеназа — окислительно-восстановительный фермент, участвующий в процессе дыхания. Она очень чувствительна к действию токсичных соединений. По степени подавления активности дегидрогеназы у микроорганизмов активного ила или биопленки можно судить о влиянии этих соединений на их жизнедеятельность. Определение проводится в присутствии индикаторов, изменяющих окраску при переходе из окисленного состояния в восстановленное под действием дегидрогеназы.
Степень развития различных групп простейших при работе
очистных сооружений
Таблица 4
| Организмы | Характеристика работы биологического окислителя | |||
| очень плохая | плохая | удовлетворительная (нитрификация слабая) | хорошая (нитрифи- кация сильная) | |
| Амебы | Преобладают | Преобладают | Единичные экземпляры | Отсутствуют |
| Бесцветные жгутиковые | - | - | То же | - |
| Инфузории | отсутствуют | мало | Преобладают равноресничные | Преобладают круго – и брюхоресничные |
| Коловратки | - | - | Преобладают | Преобладают |
Способность активного ила к осаждению характеризуется иловым индексом. Эта величина определяется по объему ила, образующегося после 30-минутного отстаивания жидкости, содержащей 3 мг/л ила. Соотношение между объемом (мл) ила и массой сухого вещества, содержащегося в 1 г ила, называется иловым индексом. При хорошей работе аэротенка иловый индекс составляет 100— 120 мл/г. Повышение илового индекса до 150—200 мл/г свидетельствует о нарушении работы аэротенка. Биологическая очистка считается полной, если БПК полностью очищенной сточной воды составляет менее 20 мг/л, и неполной, если БПК полный превышает 20 мг/л. Полная биологическая очистка может проводиться в двух режимах: обычная аэрация (до начала нитрификации и минерализации активного ила) и длительная аэрация (полное окисление), при которой частично минерализуется активный ил и идет процесс нитрификации. Понятие «полная биологическая очистка» является условным, так как часть биологически окисляющихся и неокисляющихся в этих условиях органических соединений остается в очищенной воде.
Биохимические процессы разложения органических веществ в биофильтре осуществляются микроорганизмами биологической пленки, формирующейся на зернах загрузки в период его созревания. Население биопленки представлено, в основном, теми же группами микроорганизмов, что и в биоценозе активного ила. Но в ней более широко представлены зеленые, синезеленые и диатомовые водоросли, а также грибы, черви, личинки насекомых. Степень развития различных групп микроорганизмов в биофильтре определяется составом сточных вод, условиями обработки воды. Видовой состав биопленки подвержен также сезонным колебаниям. Водоросли развиваются в верхних слоях, но диатомовые могут встречаться и- в нижних слоях загрузки. Простейшие также развиваются преимущественно в верхних слоях (в неорошаемой зоне) и в нижних. Бактерии населяют все слои загрузки биофильтра. В отличие от биоценоза активного ила в биопленке содержится большое количество анаэробов, иногда до 29%. В нижних слоях загрузки наблюдается развитие большого количества червей (зона червей). Смена биоценозов по высоте загрузки характерна для биофильтров. В них живут микроорганизмы, свойственные α- и β-мезосапробной зонам. Б верхних слоях живут микроорганизмы α-мезосапробной зоны: здесь встречается большое количество нитчатых бактерий, водорослей, грибов, из простейших — бесцветные жгутиковые. В средних слоях количество этих микроорганизмов уменьшается и на смену им приходят брюхо- и кругоресничные инфузории. Нижние слои заселены микроорганизмами β-мезосапробной зоны. Бактериальное население представлено авто- и гетеротрофами.
Почвенные методы очистки сточных вод
Сущность данных методов заключается в фильтрации сточных вод, содержащих органические вещества, через слой почвы. Очистка воды при этом осуществляется под воздействием физических, химических и биологических факторов.
В процессе фильтрации сточной жидкости в течение 1—2 недель на поверхности почвы образуется активный фильтрующий слой. Он возникает в результате задержки взвешенных и коллоидных веществ, содержащихся в сточной жидкости, и заселения этого слоя огромным количеством аэробных микроорганизмов. Толщина активной пленки составляет 20—40 см. В этом слое происходит накопление взвешенных, коллоидных и растворенных веществ, а также микроорганизмов и яиц гельминтов. Благодаря чрезвычайно сильно развитой поверхности почвенных частиц осуществляется адсорбция газов, содержащихся в сточной жидкости, в том числе необходимого для жизнедеятельности микроорганизмов кислорода.
Очистка воды в определенной степени может осуществляться в слое почвы толщиной до 1,5—2 м. В самом верхнем слое почвы задерживаются взвешенные вещества, яйца гельминтов, частично бактерии. В более глубоких слоях происходит адсорбция коллоидных примесей и бактерий почвенными частицами, содержащими огромное количество микроорганизмов, которые участвуют в разложении органических веществ и ликвидации бактериального загрязнения. Основную массу населения активной биологической пленки составляют бактерии-минерализаторы, осуществляющие процесс биохимического окисления органических веществ.
Микроорганизмы сточных вод составляют около 1 % от общего числа почвенных микроорганизмов. Под влиянием неблагоприятных условий и антагонистического воздействия микроорганизмов почвы происходит почти полное отмирание патогенных форм. Задержка патогенных микроорганизмов происходит в результате поглощения их частицами почвы, а отмирание может вызываться антибиотическими веществами, выделяемыми почвенными микроорганизмами. Кроме того, патогенные микроорганизмы используются простейшими, коловратками и другими организмами для питания.
Эффективность задержки бактерий, поступающих со сточными водами, зависит от способности их сорбироваться частицами почвы. Количество адсорбированных бактерий зависит от их видовых особенностей и колеблется в значительных пределах (от 45 до 95%). Степень адсорбции для кишечной палочки составляет около 94% от общего количества, поступившего со стоком. Присутствие ПАВ в сточных водах способствует уменьшению числа задерживаемых почвой бактерий. Так, при концентрации анионного ПАВ (сульфонола) 10 мг/л расстояние, на которое переносится водой Bacteria coli, увеличивается в 2 раза. Энтерококки и кишечные палочки при коли-индексе 105 и 104 соответственно в 1 л воды распространяются на расстоянии от 30 до 200 см. Отмирание микроорганизмов, поступающих со сточными водами, может обусловливаться в определенной степени и действием таких факторов, как солнечная радиация, неблагоприятные условия внешней среды. Прохождение сточной жидкости через почвенный фильтрующий слой сопровождается снижением общего числа микроорганизмов на 90—99,8%.
В активном слое происходит энергичное разложение азотсодержащих соединений, в нем развивается количество бактерий — нитрификаторов, достигающее 1 млн. клеток на 1 г почвы. Содержание азота в форме нитратов в очищенной воде может составлять 20— 25 мг/л. На глубине более 40 см окисление органических соединений осуществляется за счет восстановления нитратов.
В процессе разложения органических веществ активно участвуют и другие растительные и животные организмы биоценоза. Почвенные водоросли, особенно зеленые и синезеленые, являются дополнительным источником кислорода. Грибы используют в качестве питательного материала органические соединения. Роль простейших и коловраток сводится к уничтожению бактерий, переработке иловых частиц. Черви, личинки насекомых, населяющие верхний слой почвы, разрыхляют его и способствуют лучшей аэрации. На полях орошения число личинок комара Chironomus pulmosus может достигать 90 000 на 1м2, количество поглощаемого ими органического вещества достигает примерно 250 г/м2, из которых около 150г минерализуется и около 100 г используется для построения тела личинок.
Степень биохимической очистки при почвенных методах определяется количеством и качеством поступающих сточных вод и свойствами почвы. Определяющими показателями почв служат их проницаемость и адсорбционная способность. Наиболее благоприятными в этом отношении являются супесчаные, черноземные и суглинистые почвы.
При избыточном количестве поступающей сточной жидкости наблюдается возникновение анаэробных условий, что ведет к замене аэробных микроорганизмов анаэробными и накоплению промежуточных продуктов распада органических веществ. Нарушение биохимического окисления может происходить и при высокой концентрации неорганических и биологически неокисляемых органических соединений.
Очищенная фильтрацией через слой почвы сточная вода не содержит яиц гельминтов. Основная масса яиц гельминтов задерживается в 10-сантиметровом слое почвы, отдельные могут проникать на глубину 30 см. Но сама почва, задерживая в значительном количестве яйца гельминтов, может явиться источником заражения выращиваемых на ней овощей, а также обслуживающего персонала. Яйца гельминтов на глубине 2 см могут сохраняться в течение полутора лет. Подпочвенное орошение сточными водами имеет преимущество перед обычными фильтрационными методами в санитарном отношении. При этом не загрязняется поверхность почвы и произрастающие растения, отсутствуют неприятные запахи вследствие поглощения газов почвой. Очищенные сточные воды характеризуются следующими показателями: рН 6,5—8,5; взвешенные вещества 14—70 мг/л; ХПК 20—150 мг/л; БПК5 10—40 мг/л; аммонийный азот 6—70 мг/л; растворенный кислород 4—8 мг/л; сухой остаток 400—700 мг/л. Из приведенных данных следует, что при биологической очистке не всегда удается получить воду, которая бы соответствовала необходимым требованиям. Иногда бывает необходима доочистка сточных вод, прошедших биологическую очистку, физико-химическими и химическими методами.
Разложение органических веществ в анаэробных условиях.
Осадок, образующийся в первичных отстойниках, или избыточный активный ил подвергаются специальной обработке для предотвращения их загнивания, улучшения структуры, уменьшения объема и облегчения обезвоживания.
Обработка заключается в частичном биохимическом разложении органических веществ в анаэробных условиях – это различные виды брожения.
1. Брожение целлюлозы.
Целлюлоза
- устойчива к действию химических соединений,
- не подвергается изменению в пищеварительном тракте,
- накапливается в большом количестве в почве и на дне водоемов,
- составляет значительную часть осадка образующегося в первичных отстойниках.
Брожение целлюлозы включает 2 этапа:
1. Ферментативные реакции образования глюкозы.
2. Сбраживание глюкозы с образованием органических кислот, этилового спирта, диоксидаза углерода, водорода.
Разложение целлюлозы осуществляется облигатными анаэробами бактериями, относящимися к роду Clostridium. Это подвижные палочки, могут образовывать споры.
К ним относятся:
а) мезофиллы (от t -30-35 0C)
б) термофилы (от t ≈ 60 0С).
При мезофильном брожении образуются:
- уксусная кислота
- молочная кислота
- муравьиная кислота
- этиловый спирт
СО2, Н2.
При термофильном брожении образуются:
- уксусная кислота
- молочная кислота
- муравьиная кислота
Со2, Н2.
Термофилы более полно разлагают целлюлозу и процесс брожения идет значительно быстрее.
В качестве азотного питания целлюлозоразлагающие бактерии используют аммонийные соли, органические соединения, а некоторые используют свободный азот.
2. Маслянокислое брожение. При этом образуются :
- масляная кислота
- уксусная кислота
Со2, Н2.
Оно вызывается маслянокислыми бактериями Clostridium butiricum . В качестве побочных продуктов могут получиться: ацетон, бутанол.
Схема маслянокислого брожения
С6Н12О6 → СН3 – СН2 – СН2 – СООН + СН3 СООН + СО2 +Н2
пировиноградная кислота
Источники азота: пептоны, аминокислоты, амлонийные соли, свободный азот.
Источники углерода и энергии: углероды.
Маслянокислые бактерии – это олигатные анаэробы, палочки, образут споры опт t – 35-370 С, предельные значения рН 6-8.
3. Брожение пектиновых веществ осуществляется бактериями и грибами в две стадии:
1) гидролизующими пектиновые вещества с образованием менее сложных соединений.
2) Сбраживание до масляной и уксусной кислот, СО2 и Н2.
Возбудители: облигатные анаэробы клостридии.
4. Разложение жиров в анаэробных условиях проходит через стадии:
1) образование глицерина и жирных кислот:
2) сбраживание с образованием метана и диоксида углерода.
Глицерин через стадию образования пировиноградной кислоты сбраживается с образованием различных продуктов.
Высшие жирные кислоты сбраживаются с образованием низших кислот, которые разлагаются до СН4 и СО2.
5. Метановое брожение – сложный процесс, протекающий при участии нескольких групп организмов. Сущность его заключается в сбраживании органических соединений, спиртов, образующихся на первой стадии брожения, с выделением метана и СО2. Одновременно может происходить восстановление СО2 до метана водородом. Обязательно участвует вода или образуется в процессе биохимических реакций.
Схема метанового брожения:
а) брожение жирных кислот
4НСООН → СН4 + 3СО2 + 2Н2О
муравьиная кислота вода
СН3СООН → СН4 + СО2 ↑
уксусная кислота метан угл. газ
2СН3 – (СН2)2 – СООН + СО2 + 2Н2О → СН4 + 4 СН3СОО4
масляная кислота
б) брожение спиртов
4СН3 – ОН → 3СН4 + СО2 + 2Н2О
метан
2С2Н5ОН + СО2 → СН4 + 2СН3 СООН
этанол
в) восстановление СО2 водородом
СО2 + 4Н2 → СН4 + 2Н2О.
Метановое брожение вызывается:
1. Органотрофными организмами
2. Метотрофными.
Идет в нейтральной или слабощелочной среде.
Дата: 2019-02-02, просмотров: 652.