Ежегодно из-за вредителей, сорняков и болезней в мире теряется до 24% урожая. Суммарный ущерб сельскому хозяйству ежегодно исчисляется в 70 млрд долларов.
Для борьбы с вредителями, сорняками и болезнями в нашей стране ежегодно выпускают более 500 тыс. т пестицидов. Их применение позволяет сберечь до сотни тысяч тонн урожая в год.
По назначению пестициды делят на:
-инсектициды (для борьбы с вредными насекомыми)
-фунгициды ( для излечения растений и почвы от грибковых заболеваний)
-гербициды (для уничтожения сорняков)
-бактерициды (для уничтожения вредных микроорганизмов)
-зооциды (для уничтожения грызунов)
-половые аттрактанты (для приманки вредителей и их уничтожения)
-репелленты (для отпугивания вредных насекомых от растений, которыми они питаются)
-хемостерилянты (для стерилизации вредных насекомых)
Лекция 46
Неорганические материалы
План
1. Производство стекла и керамики.
1. Производство стекла и керамики. Обычное оконное стекло – сплав различных силикатов. Получают его при сплавлении смеси белого песка, кальцинированной соды и мела в специальных печах. Реакции, происходящие при этом, можно записать в виде уравнений:
Na2CO3 + SiO2 = Na2SiO3 + CO2;
CaCO3 + SiO2 = CaSiO3 + Co2
Образующиеся соли растворяются в избытке расплавленного кремния (IV), образуя прозрачный аморфный сплав – стекло. Химический состав стекла может изменяться в широких пределах. Обычно его записывают в виде формулы
Na2O x CaO x 6SiO2.
Для получения тугоплавкого стекла вместо соды берут поташ. Из калиевого стекла изготавливают химическую посуду. Если оксид кальция заменить оксидом свинца PbO,образуется хрустальное стекло примерно такого состава:
K2O x PbO x 6SiO2 . Высокотемператуное стекло содержит в своем составе оксид бора B2O3. Оно стойко к действию химических реагентов, поэтому используется для изготовления химической посуды.
Оксиды некоторых металлов могут окрашивать стекло. Например, оксид хрома CrO3 придает стеклу зеленую окраску, а оксид кобальта СоО – синюю. При этом оксиды, растворяясь в стекле, образуют коллоидно-дисперсную систему.
Новым ценным материалом являются ситаллы – закристаллизованные стекла, получающиеся из аморфных силикатных стекол при термической обработке. Микрометаллическое строение ситаллов обусловливает их высокие механические свойства, устойчивость против тепловых ударов.
Больше значение в народном хозяйстве имеют изделия, полученные при спекании глины с оксидом кремния (IV): кирпич, огнеупорные материалы, гончарные изделия (грубая керамика), фарфор и фаянс (тонкая керамика). Изделия грубой керамики изготовляют из смеси каолина, кварца и полевых шпатов, которую обжигают при высокой температуре.
Фарфоровые и фаянсовые изделия покрывают стеклоподобным слоем – глазурью, защищающей их от действия воды, химических реагентов, а также придающей им красивый вид. Фарфор и фаянс отличаются физическими свойствами черепка: черепок фарфора плотный, фаянс – пористый. Обычный фарфор и фаянс изготовляют при спекании глинистых веществ (50%), кварца (25%) и полевого шпата (25%). Образуется смесь различных силикатов и алюминатов.
Контрольные вопросы
1. Напишите уравнения реакций между оконным стеклом и плавиковой кислотой, свинцовым стеклом и плавиковой кислотой.
2. К каким системам следует отнести окрашенное различными оксидами (например, Cr2O3) стекло?
Лекция 47
ПОЛИМЕРЫ
План
1. Важнейшие полимеры – полиэтилен и полипропилен.
1. Важнейшие полимеры – полиэтилен и полипропилен. Этилен и пропилен полимеризуются, образуя полимеры полиэтилен и полипропилен. Механизм полимеризации весьма сложен. Известны различные типы полимеризации. В самом общем виде процесс полимеризации можно изобразить 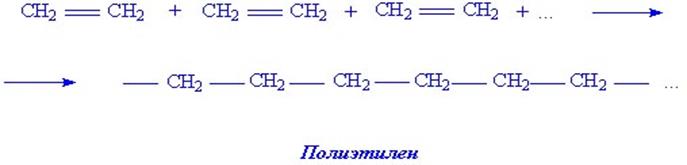
Рассмотрим пример механизма полимеризации этилена под действием свободного радикала 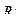 , где
, где 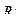 это CH3, C2H5 и т.д. Вещество, вызывающее полимеризацию называют инициатором.
это CH3, C2H5 и т.д. Вещество, вызывающее полимеризацию называют инициатором.
Итак, радикальную полимеризацию этилена под действием свободного радикала 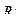 (инициатора) можно представить в виде:
(инициатора) можно представить в виде:
 CH2 = CH2 +
CH2 = CH2 + 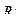 R – CH2 – CH2 –.
R – CH2 – CH2 –.
Под действием активной частицы 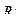 двойная связь разрывается и радикал
двойная связь разрывается и радикал 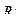 присоединяется по месту двойной связи.
присоединяется по месту двойной связи.
Образовавшаяся новая частица (новый радикал) оказывает на молекулу этилена такое же действие, как и радикал R. Углеродная цепь при этом растет:
 R – CH2 – CH2 – + CH2 = CH2 R – CH2 – CH2 – CH2– CH2–.
R – CH2 – CH2 – + CH2 = CH2 R – CH2 – CH2 – CH2– CH2–.
Подобного рода процесс происходит и дальше, пока не наступи обрыв углеродной цепи. Это может произойти или при присоединении к цепи с углеродом, имеющим свободную связь, частицы инициатора R, или при соединении двух частиц с атомами углерода со свободной связью. В обоих случаях свободные единицы валентности насыщаются:
 R – CH2 – CH2–…– CH2 – CH2–+
R – CH2 – CH2–…– CH2 – CH2–+ 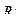
 R – CH2 – CH2 –…– CH2 –CH2– R.
R – CH2 – CH2 –…– CH2 –CH2– R.
или
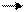 R – CH2 – CH2–… – CH2– CH2– + – CH2– CH2–…–CH2– CH2–R
R – CH2 – CH2–… – CH2– CH2– + – CH2– CH2–…–CH2– CH2–R
 R– CH2– CH2–…– CH2– CH2– CH2–CH2–…– CH2– CH2– R.
R– CH2– CH2–…– CH2– CH2– CH2–CH2–…– CH2– CH2– R.
Три точки (…) показывают, что звено – СН2 – СН2– повторяется и дальше угодно раз.
Сокращенно формулу полиэтилена записывают так: [–СН2–СН2–]n. В квадратные скобки берут элементарное звено полимера, т.е. ту часть, которая повторяется n раз и образуется из молекулы мономера. Радикалы на концах цепи не указываются, поскольку учитывая огромную молекулярную массу полимера, они не оказывают практического влияния на состав макромолекулы.
 СН3
СН3
Формула полипропилена имеет вид [–СН2– СН –]n. Элементарное звено образуется при раскрытии двойной связи в молекуле пропилена:
 СН3
СН3
 СН2 = СН – СН3 – СН2 – СН –.
СН2 = СН – СН3 – СН2 – СН –.
Полиэтилен и полипропилен – представители полимеров, являющихся основой пластмасс (пластических масс) – материалов, способных при нагревании становиться пластичными, т.е. формоваться, приобретая определенную форму, которая сохраняется и после охлаждения пластмассы.
Полиэтилен обладает высокими физико-химическими свойствами и сравнительно недорог. По химическому составу это наиболее простой полимер. В зависимости от условий полимеризации производят полиэтилен высокого и низкого давления. Первый получают под давлением 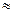 120 – 150 МПа и при температуре 100 –3000С; второй – при давлении
120 – 150 МПа и при температуре 100 –3000С; второй – при давлении 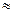 0,4МПа и комнатной температуре с применением специальных катализаторов. Молекулярная масса полиэтилена первого типа 18000 –4000, второго значительно выше – 60000–800000.
0,4МПа и комнатной температуре с применением специальных катализаторов. Молекулярная масса полиэтилена первого типа 18000 –4000, второго значительно выше – 60000–800000.
Полипропилен, сходный с полиэтиленом полимер, имеет большие перспективы применения в народном хозяйстве. Полипропилен легкий, стойкий против действия кислот, щелочей, масел, имеет температуру плавления несколько более высокую, чем полиэтилен. Она колеблется для полипропилена в интервале 160-1300С, в то время как для полиэтилена в интервале 100-1300С. Применяют полипропилен для изоляции высокочастотных кабелей и монтажных проводов, в качестве диэлектрика высокочастотных конденсаторов. Весьма перспективным является применение полипропилена для изготовления тонкостенной твердой тары, выдерживающей стерилизацию в кипящей воде. Один из его недостатков – недостаточная сопротивляемость окислению.
Полиэтилен и полипропилен – обычно ненаполненные пластические массы, состоящие только из синтетического полимера. Такой синтетический полимер часто называют синтетической смолой.
Контрольные вопросы
1. Полиэтиленовые трубы, посуду, полиэтиленовую пленку изготовляют из полимера, для которого степень полимеризации n равна 1500 –2000. Напишите схему полимеризации для полиэтилена, если n =2000.
2. Какой из известных вам полимеров наиболее устойчив против агрессивных сред?
Дата: 2019-02-02, просмотров: 356.