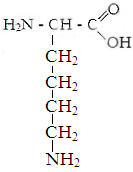
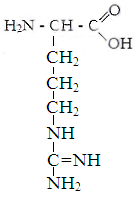
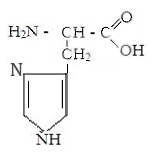
Лизин Аргинин Гистидин
Физико-химические свойства белков.
Находящиеся на поверхности белковой молекулы радикалы аспарагиной, глутаминовой кислот, тирозина и цистина, диссоциируя на ион водорода, придают ей отрицательный заряд. Радикалы лизина, аргинина и гистидина, диссоциирующие на ион гидроксила, наоборот придают молекуле белка положительный заряд. У большинства белков отрицательных зарядов на молекуле больше. Благодаря заряду они отталкиваются друг от друга и не слипаются в конгломераты. Слипанию препятствует также наличие вокруг молекулы белка водной оболочки.
В слабокислой среде тормозится диссоциация части отрицательно заряженных радикалов аминокислот, количество положительных и отрицательных зарядов сравнивается, молекулы белков становятся электронейтральными и слипаются в конгломераты и выпадабт в осадок. Слипанию их способствует и нагревание, приводящее к потере водной оболочки. Значение рН, при котором молекула белка становится электронейтральной, называется изоэлектрической точкой белка.
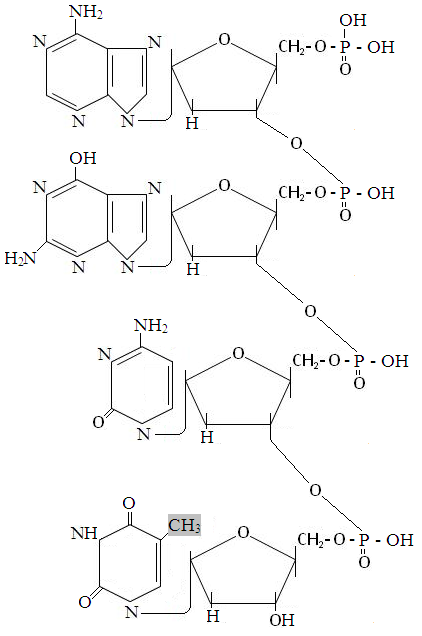
Классификация белков. Белки делятся на простые, состоящие только из аминокислот (альбумины, глобулины, проламины, глютелины, протамины, гистоны и пртеиноиды) и сложные, состоящие из белковой и небелковой части. У хромопротеинов небелковой частью может быть окрашенное вещество (например гем у гемоглобина), у липопротеинов - липидная часть, у гликопротеинов - гетерополисахарид, у фосфопротеинов - фосфорная кислота, у нуклеопротеинов - ДНК или РНК. Нуклеиновые кислоты состоят из нуклеотидов. Последние состоят из азотистого основания, пуринового (аденин и гуанин) или пиримидинового [цитозин, тимин (у ДНК) или урацил (у РНК)], дезоксирибозы (у ДНК) или рибозы (у РНК) и фосфорной кислоты. Сборка нуклеотида из аденина, дезоксирибозы и фосфорной кислоы показана ниже.
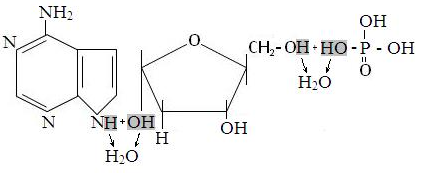
Молекула ДНК состоит из четырех разновидностей нуклеотидов6 дезоксиаденозинмонофосфата (дАМФ), дезоксигуанозинмонофосфата (дГМФ), дезоксицитидинмонофосфата (дЦМФ) и дезокситимидинмонофосфата (дТМФ). Нуклеотиды связаны между собой посредством фосфодиэфирной связи межде вторым углеродным атомом дезоксирибозы и фосфорной кислотой соседнего нуклеотида, как показано в фформуле фрагмента ДНК, состоящего из дАМФ, дГМФ, дЦМФ и дТМФ.
Фрагмент ДНК, состоящий из дАМФ, дГМФ, дУМФ и дТМФ.
Структура и биологическая роль углеводов.
Углеводы – полиоксикарбонильные соединения, являющиеся по своей природе альдо- или кетоспиртами или их производными. По химической структуре различают: 1) моносахариды (рибоза, дезоксирибоза, глюкоза, галактоза, фруктоза и др.); 2) олигосхариды (сахароза, мальтоза, лактоза и др.); 3) гомопосахариды (гликоген, крахмал, клетчатка и др.) и гетероплсахариды (гиалуроновая, хондроитинсерная кислоты, кератансульфат и др.).
1. Моносахариды.
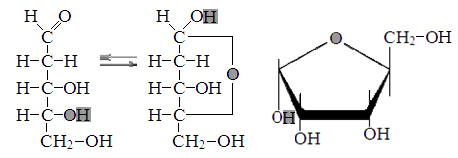
Превращение Д-дезоксирибозы в α-Д-дезоксирибофуранозу.
Превращение Д-глюкозы в α-Д-глюкопиранозу 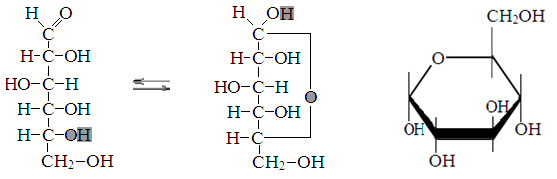
Превращение Д-глюкозы в α-Д-глюкопиранозу
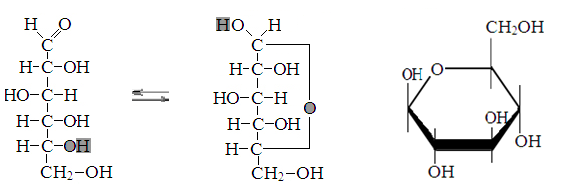
Превращение Д-глюкозы в β-Д-глюкопиранозу
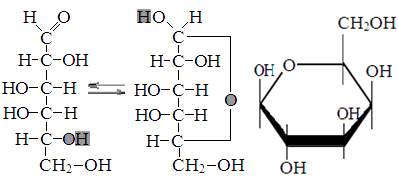
Превращение Д-глюкозы в β-Д-глюкопиранозу
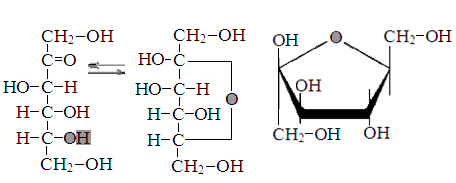
Превращение Д-фруктозыозы в β-Д-фруктофуранозу
2. Олигосахариды
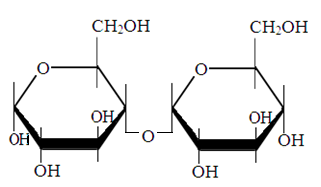
Мальтоза
Лактоза 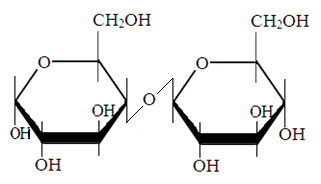
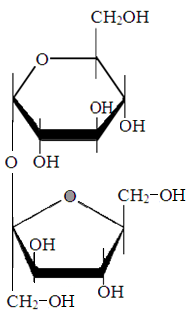
Сахароза.
3. Гомоолисахариды
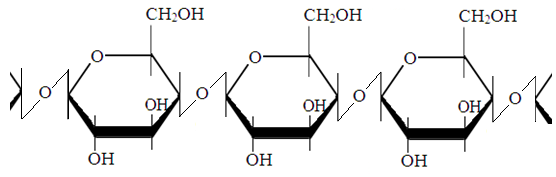
Клетчатка, состоящая из остатков β-Д-глюкопиранозы.
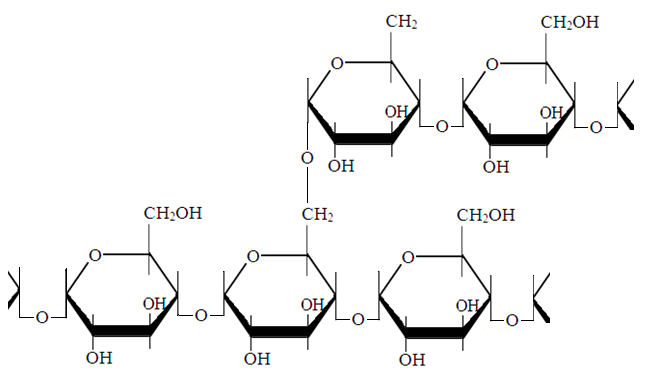
Крахмал, состоящий из остатков α-Д-глюкопиранозы.
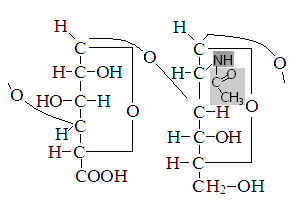
Гиалуроновая и хондроитинсерная кислоты, компоненты гетерополисахаридов.
Биологическая роль углеводов.
Углеводы являются основным энергетическим материалом в организме. При окислении 1 г глюкозы высвобождается 4,1 ккал. Углеводы необходимы для окисления липидов. Гликоген и крахмал являются запасным энергетическим материалом.
Рибоза входит в состав нуклеотидов РНК, АТФ, НАД, ФАД, витамина В12 и других веществ, а дезоксирибоза - в состав ДНК.
Углеводы являются источником пластического материала для биосинтеза триглицеридов, холестерина, заменимых аминокислот и других веществ.
Гетерополисахариды являются небелковой частью гликопротеинов, участвующих в многих процессах: формировании соединительной ткани, развитии иммунной реакции, свертывании крови и др.
Лекция № 2
ФЕРМЕНТЫ
План
1.Структура ферментов
2. Свойства ферментов.
Структура ферментов
Ферменты (энзимы) – белки, являющиеся биологическими катализаторами. По строению могут быть простыми и сложными белками. Последние состоят из белковой части (апофермента) и небелковой части (кофермента). По отдельности каталитической активностью не обладают, активны лишь вместе. Существуют мультиферментные комплексы, состоящие из нескольких ферментов
Некоторые ферменты имеют четвертичную структуру – состоят из двух и более радикалов более мелких белков (субъединиц). Некоторые ферменты могут катализировать одну реакцию, но отличаться по строению субъединиц.
Их называют изоферментами. Например, креатинкиназа-1 мозга состоит из субъединиц ВВ, креатинкиназа-2 миокарда - из субъединиц ВМ, а креатинкиназа-3 скелетных мышц – из субъединиц ММ.
В молекуле фермента различают активный и аллостерический центры. К первому из них присоединяется вещество, на которое действует фермент (субстрат), происходит его превращение, образуется продукт реакции. Этот центр занимает лишь часть молекулы фермента. В его составе выделяют контактный участок, к которому присоединяется субстрат и каталитический центр, где происходит ферментативная реакция. В составе каталитического центра могут быть радикалы аминокислот, содержащие группы –СООН, -ОН, -NH2 и др., а у ферментов-сложных белков – и кофермент.
Аллостерический центр (allos – другой) – участок фермента, к которому присоединяются вещества, отличные от субстрата, способные изменять форму активного центра, ускоряя таким образом ферментативную реакцию (активаторы) или замедляя ее (ингибиторы). Такими веществами могут быть продукты собственной реакции, других реакций, гормоны и др.
Строение коферментов.
Различают коферменты витаминные т невитаминные.
Витаминные коферменты.. К ним относят никотинамидные, флавиновые, тиаминовые, пиридоксалевые, пантотеновые, кобаламиновые и другие коферменты.
Никотинамидные коферменты – производные витамина РР.
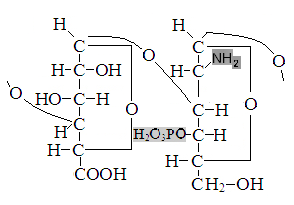
К ним относят никотинамидадениндинуклеотид (НАД) и никотинамидадениндинуклеотид фосфат (НАДФ). НАД из соединенных между собой остатков аденозинмонофосфата (АМФ) и никотинамидрибозилмонофосфата (НМФ). Он входит в состав ферментов дегидрогеназ, отщепляющих ионы водорода от гидроксильных, альдегидных или аминогрупп. Ионы водорода присоединяются к атому углерода никотинамида, находящемуся в четвертом положении. НАД способен переносить ионы водорода в дыхательную цепь митохондрий, где они окисляются с образованием АТФ.
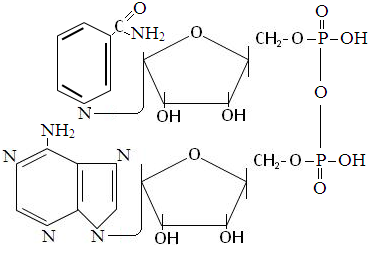
НАДФ отличается по строению тем, что к второму углеродному атому радикала рибозы АМФ присоединяется остаток фосфорной кислоты. Является коферментом дегидрогеназ пентозного цикла, откуда ионы водорода поставляются в реакции биосинтеза различных веществ.
Флавиновые коферменты – производные витамина В2.
К ним относя флавинмононуклеотидд (ФМН) и флавинадениединуклеотид (ФАД). Первый из них входит в состав дыхательной цепи митохондрий. Он принимает ионы водорода и электроны от НАД-Н2 и передает их убихинону.
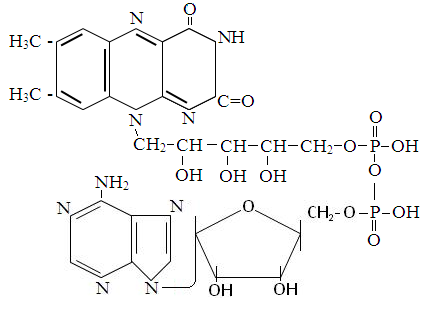
ФАД состоит из остатков АМФ и ФМН. Является коферментом дегидрогеназ, отщепляющих ионы водорода от янтарной кислоты и активированных жирных кислот. Ионы водорода присоединяются к атомам азота изоалаксозинового цикла и переносятся в дыхательную цепь митохондрий.
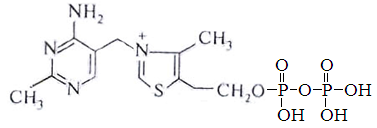
Тиаминовые коферменты – производные витамина В1. К ним относя тиаминдифосфат (ТДФ). Входит в состав транскетолазы пентозного цикла, а также ферментов отщепляющих углекислый газ от пировиноградной и альфа-кетоглутаровой кислот.
Пиридоксальфосфат (ПФ) – производное витамина В6. Входит в состав ферментов обмена аминокислот – декарбоксилаз, трансамназ.
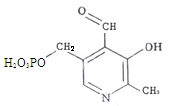
Пантотеновые коферменты – производные витамина В3. К ним относят коэнзим А (КоА), входящий в состав ферментов, переносящих остатки уксусной, янтарной или жирных кислот.
СН3 ОН
! !
АДФ-О - СН2 - С----СН – СО – NH - СН2 -СН2 - COOH
!
СН3
Коэнзим А
Фолатные коферменты - производные витамина Вс (фолиевой кислоты).
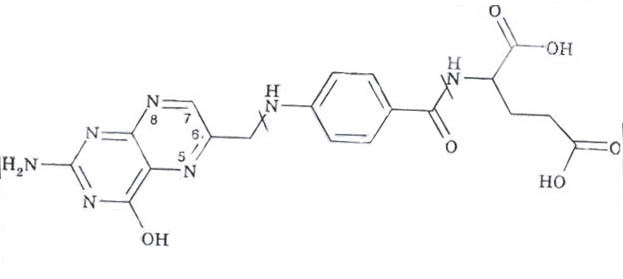
Участвуют в переносе метильных, альдегидных и других одноуглеродных фрагментов
Невитаминными коферментами могут быть гем (у каталазы, цитохромов и др. ферментов), ионы металлов (у глутатионпероксидазы, супероксиддисмутазы, амилазы и др.), глутатион (у глицеральдегид-3-фосфатдегидрогеназы), мононуклеотиды (АМФ, ГМФ, ЦМФ) и др.
Свойства ферментов
1. Высокая каталитическая активность – способность повышать скорость реакций в миллионы-миллиарды раз. Неорганические катализаторы увеличивают ее лишь в тысячи раз.
2. На активность фермента влияет концентрация субстрата. При увеличении последней активность фермента возрастает, но до определенного предела. Концентрация субстрата, при которой активность фермента равна 0,5 от максимальной, называется константой Михаэлиса.
3. На активность фермента влияет концентрация продукта реакции. При постепенном накоплении последнего в среде она снижается. Поэтому активность фермента определяют на начальном этапе реакции, когда субстрат еще не накопился.
4. Активность ферментов зависит от рН среды. В зависимости от рН изменяется диссоциация ионогенных групп в активном центре фермента и в молекуле субстрата, что влияет на скорость реакции. Большинство ферментов наиболее активны в слабощелочной среде. Исключение – пепсин желудочного сока и катепсины лизосом, активные в кислой среде.
5. На активность фермента влияет температура среды. Обычно при повышении ее на 10оС скорость реакции увеличивается в 2 раза (правило Ван Гоффа). Наиболее активны ферменты млекопитающих при 40-50 о. При более низкой температуре активность тормозится из-за снижения диссоциации ионогенных групп, а при более высокой – из-за денатурации белковой молекулы.
6. Ферменты обладают специфичностью, т.е. способность воздействовать лишь на определенный субстрат. Различают различные виды специфичности.
а. Абсолютная специфичность, когда фермент действует лишь на один субстрат. Например, фумаратгидратаза действует только на фумаровую кислоту.
б. Групповая специфичность, когда фермент действует на несколько сходных по структуре субстратов. Например, липаза расщепляет ацилглицеролы, состоящие из различных жирных кислот.
г. Стереоспецифичность, когда фермент действует только на определенный пространственный изомер. Например, фумаратгидратаза не действе на стереоизомер фумаровой кислоты – малеиновую кислоту.
7. На активность ферментов влияют вещества, повышающие скорость реакции (активаторы) и снижающие ее (ингибиторы). Некоторые ферменты вырабатываются неактивными и при помощи активаторов переходят в активные. Например, энтерокиназа отщепляет от трипсиногена часть молекулы и он превращается в активный трипсин. Активаторами могут быть ионы металлов, субстраты, продукты других реакций, гормоны и другие вещества.
Ингибиторы по характеру торможения активности фермента могут быть обратимыми и необратимыми. В первом случае комплекс фермент-ингибитор может расщепляться и активность фермента восстанавливается. При необратимом ингибировании образуется прочная связь между ферментом и ингибитором.
По механизму действия ингибиторы делят на конкурентные, неконкурентные, субстратные и аллостерические.
а. При конкурентном ингибировании структура ингибитора близка к структуре субстрата и он конкурирует за активный центр. Например, малоновая кислота по структуре близка к янтарной кислоте и поэтому способна связывать активный центр сукцинатдегидрогеназы. Ингибирование можно ослабить увеличением концентрации субстрата. На конкурентном ингибировании основано действие сульфаниламидов. Они по строению сходны с п-аминобензойной кислотой, необходимой микроорганизмам. Сульфаниламиды, занимая место последней, тормозят рост микроорганизмов.
б. Неконкурентное ингибирование развивается под действием вещества, структура которого не сходная со структурой субстрата. Оно связывается не с активным центром, а с другими участками молекулы фермента. Последний после этого может образовывать комплекс с субстратом, но внутри этого комплекса реакция не протекает. Например, ионы тяжелых металлов связывают HS-группы ферментов, ингибируя их. Цианиды связываются с ионом железа цитохромоксидазы, прекращая дыхание митохондрий. Неконкурентное ингибирование, в отличие от конкурентного, не снимается избытком субстрата.
в. Субстратное ингибирование развивается иногда при увеличении в среде концентрации субстрата. Его снимают, уменьшая концентрацию последнего.
г. Аллостерическое ингибирование развивается тогда, когда вещество, сзязываясь с аллостерическим центром, изменяет конфигурацию активного центра, блокируя его. Такими ингибиторами могут быть собственный продукт реакции, продукты других реакций, гормоны и другие вещества.
Лекция №3.
ФЕРМЕНТЫ (продолжение)
План.
1. Механизм действия Ф.
2.Номенклатура и классификация ферментов.
3. Ферменты в сельском хозяйстве.
Механизм действия ферментов
Ферменты во много раз увеличивают скорость химических реакций, что с термодинамических позиций связывают со способностью их снижать энергию активации реакции, т. е. то дополнительное количество ее, которое нужно дать молекулам, чтоб они из неактивного состояния перешли в активное. Это снижение происходит через несколько стадий.
Согласно теории Михаэлиса-Ментена ферментативная реакция протекает в три стадии: 1) фермент (Фер) + субстрат (Суб) ------ фермент-субстратный комплекс (Фер-Суб);
2) преобразование субстрата в несколько стадий молекулы внутри фермент-субстратного комплекса с образованием внутри него промежуточных продуктов и в конечном итоге - комплекса фермент-продукт реакции (Фер- Прод); 3) расщепление комплекса фермент-продукт реакции с диффузией фермента и продукта реакции в среду: Фер-Прод ------ Фер + Прод.
На первой стадии реакции субстрат маневрирует, сближаясь с активным центру фермента, концентрируясь в нем. При этом происходит их взаимная пространственная подгонка так, чтоб активный центр расположился напротив «атакуемой» связи в молекуле субстрата. Образуется фермент-субстратный комплекс. Процесс протекает мгновенно, энергия активации снижается незначительно.
Вторая стадия реакции наиболее продолжительная, за счет нее в основном снижается энергия активации. В активном центре фермента и в молекуле субстрата содержатся кислотные и основные радикалы. Поэтому в ходе реакции может изменяться рН среды, что влияет на ее скорость. Во время нее происходит натяжение, деформирование химических связей в молекуле субстрата, их разрыв с возникновением новых связей. Это приводит к ускорению реакции, образования во время нее вначале одного или нескольких промежуточных продуктов, затем - продукта реакции.
Третья стадия реакции протекает также мгновенно и энергия активации изменяется мало.
Номенклатура и классификация ферментов
Вначале ферментам давали название по случайному признаку. Например, название пепсин происходит от слова peptis (пищеварение). Затем рабочее название фермента начали составлять из названия субстрата, типа катализируемой реакции и окончания «аза»: лактатдегидрогеназа. В 1961 году на Международном биохимическом съезде в Москве приняли систематическую классификацию ферментов. Их названия составляют из названия субстрата, класса реакции и окончания «аза». Если происходит перенос химической группы от донора к акцептору, то это включается в название: лактат:НАД-оксидоредуктаза.
Описано более 1900 ферментов, которые по типу катализируемой реакции деля на 6 классов: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы; 5) изомеразы; 6) лигазы (синтетазы). Каждый класс делится на подкласс, подкласс – на подподкласс. В последнем фермент имеет свой порядковый номер. Поэтому каждый фермент имеет свой шифр, состоящий из четырех чисел: номеров класса, подкласса, подподкласса и порядкового номера. Например, у лактат:НАД-оксидоредуктазы шифр 1.1.1.27.
1. Оксидоредуктазы катализируют окислительно-восстановительные реакции. Существует их 17 подклассов. Ферменты первого подкласса окисляют атомы водорода группы = СН - ОН:
СН3 СН3
1 1
СН-ОН + НАД Лактатдегидрогеназа С=О + НАД-Н2
1 1
СООН СООН .
Молочная кислота Пировиноградная килота.
У первого подподкласса акцептором ионов водорода является НАД, у второго – НАДФ, у третьего – цитохромы.
Ферменты второго класса окисляют альдегидную группу, третьего – группу
-СН2-СН2- и т.д. Ферменты, переносящие ионы водорода, называют дегидрогеназами. Если акцептором оксидоредуктазы служит кислород, ее называют оксидазой. Если при окислении кислорода он включается прямо в субстрат, то это – оксигеназы.
2. Трансферазы переносят различные функциональные группы от одного субстрата к другому. Аминотрансферазы перенося аминогруппы, метилтрансферазы – группы –СН3, ацилтрансферазы – радикалы кислот и т.д.
СООН СООН
1 1
СН2 CН3 СН2 СН3
1 1 1 1
СН2 + С=О Аланинамино- СН2 + СН-NH2
1 1 ←трансфераза→ 1 1
СН-NH2 СООН Пиридоксаль- С=О CООН
1 фосфат 1
COOH СООН
Глутамино- Пировиноград- α-кетоглутаро- Аланин
вая кислота ная кислота вая кислота
3. Гидролазы расщепляют вещества с присоединением к месту разрыва молекулы воды. Широко распространены. Гидролазы подкласса 3.1, эстеразы, расщепляют сложноэфирные связи эфиров фосфорной, карбоновых кислот, тиолов и т.д:
СН2 -О-СО-С17Н35 СН2 -ОН
1 1 С17Н35 –CO-О-СН Липаза НО-СН + 3 С17Н35 - СООН
1 1
СН2-О-СО-С17Н35 + 3 Н2О СН2-ОН Стеариновая кислота
Тристеарин Глицерол.
Гидролазы подкласса 3.1, гликозидазы, расщепляют О-, N- и S-гликозильные связи у различных соединений, например, у углеводов:
Гидролазы подкласса 3.4, пептидазы, расщепляют пептидные связи:
H2N-CH-CO-NH-CH-COOH Дипептидаза H2N-CH-COОН + H2N -CH-COOH
1 1 + Н2О 1 1
CH3 CH2 –OH СН3 CH2 –OH
Аланилсерин Аланин серин
4. Лиазы катализируют реакции расщепления веществ без присоединения к месту разрыва молекул воды или обратные им реакции –
соединение двух веществ в одно без затраты энергии в виде АТФ или других макроэргических соединений.
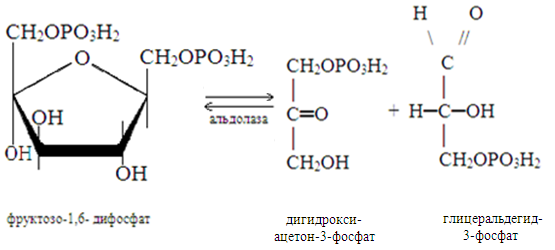
5. Изомеразы катализируют превращения, происходящих в пределах одной молекулы.
6. Лигазы (синтетазы) катализируют реакции соединения молекул двух веществ в одну с использованием энергии АТФ или другого макроэргического соединения. При этом образуются –С-О-, -C-S- и –С-N-cвязи.
СООН
1
СН3 СН2
1 1
СО2 + СН-ОН + АТФ Пируваткарбоксилаза С=О + АДФ + Н3РО4.
1 Биотин 1
СООН СООН
Пировиноградная Щавелевоуксусная
кислота кислота
Ферменты в сельском хозяйстве.
Ферменты широко используются в связанных с сельским хозяйством технологических процессах: производстве молочных продуктов, напитков, переработке пера, костей и др. Все чаще используются ферменты, иммобилизованные на гранулах стекла, полимерах и помещенные в колонки, через которые пропускают перерабатываемое вещество.
Распространены заболевания людей и животных, связанные с нарушением синтеза или повреждением некоторых ферментов (фенилкетонурия, галактоземия, гликогенозы и др.). Своевременная диагностика их позволяет проводить лечебно-профилактические мероприятия, направленные на снижение ущерба, наносимого этой патологией.
При патологии печени, поджелудочной железы, миокарда и других заболеваниях животных из поврежденных органов в кровь поступают ферменты. Определяя их активность, можно не только выявить пораженный орган, но и оценить тяжесть заболевания, эффективность проводимой терапии.
Ферменты широко используются в современных клинических биохимических исследования в качестве реагентов. Применение их позволяет повысить точность и облегчить проведение анализа.
Ферменты применяют для лечения животных с патологией органов пищеварительной системы, хирургическими заболеваниями и др.
Лекция №4
ОБМЕН ВЕЩЕСТВ
План
- Понятие об обмене веществ.
- Биологическое окисление.
- Обмен энергии. АТФ. Митохондрии.
- Цикл трикарбоновых кислот.
Обмен веществ – совокупность химических превращений, которым подвергаются вещества с момента поступления в организм до выделения их в виде конечных продуктов. Включает два взаимосвязанные между собой процессы: ассимиляцию и диссимиляцию. Ассимиляция – образование характерных для организма веществ, сопряженное с потреблением АТФ. Диссимиляция – процесс распада веществ в организме.
Этапы обмена веществ
- Пищеварение – гидролитическое расщепление ферментами веществ,
поступивших с пищей, до простых веществ- мономеров: белки расщепляются до аминокислот, жиры – до глицерина и жирных кислот, олиго- и полисахахариды – до моносахаридов.
- Всасывание мономеров в кровь в стенке кишечника.
- Межуточный (тканевой) обмен – химические превращения веществ в
тканях или метаболизм. Вещества, участвующие в этих превращениях – метаболиты. Одновременно в организме протекают процессы образования (анаболизм) и распада веществ (катаболизм).
4. Образование конечных продуктов - процесс, позволяющий высвободить около 80% энергии. Конечными продуктами метаболизма белков, углеводов и липидов являются углекислый газ и вода. При окислении белков образуется также аммиак, обезвреживающийся в мочевину.
Биологическое окисление – совокупность процессов окисления (отщепления и присоединения электронов), протекающих в клетках. Согласно теории В.И. Палладина оно заключается в отщеплении от окисляемого субстрата ионов водорода и электронов и переносе их на активированный кислород с образованием воды:
S-H2 2Н+ + 2е- ½ О2 → Н2О + энергия (210 кДж).
Реакция 2Н+ + ½ О2 → Н2О + энергия является основным источником энергии в организме. Вне организма она протекает быстро, с выделением большого количества энергии, с взрывом, а в организме – ступенчато. Энергия при этом выделяется порциями, что предотвращает перегревание клетки. Часть ее выделяется в виде тепла, часть запасается в макроэргических связях аденозинтрифосфата (АТФ):
Аденозиндифосфат (АДФ) + Н3РО4 + энергия → АТФ.
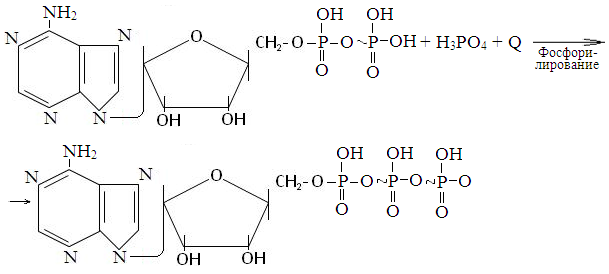
Синтез АТФ из АДФ и Н3РО4 называется фосфорилированием. Различают две разнолвидности его: субстратное и окислительное фосфорилирование. Первое из них (субстратное фосфорилирование) протекает за счет энергии, освобождающейся при расщеплении макроэргических (богатых энергией) химических связей некоторых веществ- субстратов: 1,3-дифосфоглицериновой, фосфоенолпировиноградной кислот (в реакциях окисления глюкозы ) и активной формы янтарной кислоты (в реакциях окисления активной формы уксусной кислоты в цикле Кребса); 2) за счет энергии освобождающейся при окислении кислородом ионов водорода ферментами дыхательной цепи, расположенной на внутренней мембране митохондрий (окислительное фосфорилирование).
Строение дыхательной цепи митохондрий
На внутренней мембране этих органоидов локализовано 8 оксидоредуктаз, коферменты которых располагаются последовательно в следующем порядке:
Ц и т о х р о м ы
S-H2 2е- НАД 2е- ФМН 2е- убихинон 2е- Ц.b 2е- Ц.c1 2е- Ц.c 2е- Ц.a 2е- Ц.a3 2е-
2Н+ 2Н+ 2Н+ 2Н+
Н2О ½ О2
-------------------- ----------------- -----------------
АТФ АТФ АТФ
Первый кофермент – НАД. Он принимает ионы водорода и электроны от субстрата S-H2, находящегося за пределами дыхательной цепи. Акцептором их является атом углерода никотинамида, находящийся в 4-м положении. Образовавшийся НАД-Н2 передает ионы водорода и электроны ФМН, где они присоединяются к атомам азота изоалаксозинового цикла. От ФМН-Н2 ионы водорода и электроны переходят на убихинон. Первые из них временно остаются на убихиноне и в дальнейшем, соединяясь с атомом активированного кислорода, образуют молекулу воды.
От убихинона електроны передаются на цитохром b, присоединяясь к атому железа гема, который меняет свою валентность с 3 на 2.. От цитохром b они перемещаются последовательно на цитохромы с1, с, а и а3. При каждом таком переходе электрона от одного фермента дыхательной цепи митохондрий к другом происходит постепенная потеря энергии и на цитохром а3 (цитохромоксидазу) переходит лишь остаток ее. Последний передается на молекулу кислорода, поступившую в клетку через кровь из легких, активируя ее. Активированный кислород после этого соединяется с ионами водорода, отщепившимися от убихинона и образуется вода, конечный продукт биологического окисления.
Генерации АТФ ферментами дыхательной цепи митохондрий
Каждые два фермента дыхательной цепи митохондрий образуют редокс-пару. Между ними имеются определенный окислительно-восстановительный потенциал (ОВП), э.д.с., выражающаяся в вольтах. В процессе переноса электронов происходит постепенное увеличение ОВП. У НАД он равен -0,32 в, у кислорода - +0,81 в. Генерация АТФ в дыхательной цепи митохондрий происходит на тех участках ее, где различие в ОВП между компонентами редокс-пары составляет не менее 0,2 в. Таких участков 3: 1) между НАД и ФМН; 2) между цитохромами b и c1; 3) между цитохромами а и а3.Поэтому при окислении ферментами дыхательной цепи митохондрий одной молекулы НАД-Н2 генерируется 3 молекулы АТФ. Если же окисляется ФАД-Н2, то ионы водорода и электроны передаются от него на ФМН, минуя первый пункт генерации АТФ, между НАД и ФМН. Поэтому произойдет генерация только двух молекул АТФ.
Согласно теории П. Митчелла, энергия, отдаваемая электронами при прохождении через эти участки дыхательной цепи, используется для перемещения положительно заряженных ионов водорода из внутреннего пространства митохондрий (матрикса) в пространство между внутренней и наружной мембранами их, т.е. на наружную поверхность внутренней мембраны этих органоидов (ВММ). Вследствие этого на последней накапливается избыток ионов водорода. При этом на внутренней поверхности ВММ содержится избыток отрицательно заряженных электронов. Поэтому создается разница потенциалов между наружной и внутренней поверхностями ВММ (мембранный потенциал).
Из-за наличия этого потенциала ионы водорода стремятся вернуться обратно в матрикс. Для этого они использую специальный канал, расположенный внутри фермента протонная АТФ-аза, расположенная на ВММ. Во время прохождения через этот канал ионов водорода выделяется энергия, которая используется для генерации из АДФ и фосфорной кислоты АТФ (окислительного фосфорилирования). Следовательно протонная АТФ-аза функционирует как АТФ- синтетаза.
Креатинкиназная реакция – «челночный» механизм, осуществляющий перенос энергии АТФ от места выработки его (митохондрий, расположенных на поверхности мышечных волокон) до места потребления (саркомеров мышечных волокон). Прямо поступать АТФ в саркомеры не может, т.к. расщепляется по пути ферментами.
Микросомальное окисление, протекающее с участие специальной цепи переноса электронов (ЦПЭ), расположенной на мембранах эндоплазматической цепи печени, надпочечников и других органов, также сопряжено с потреблением кислорода. При этом последний не только превращается в воду, но и используется для гидроксилирования (присоединения НО-группы) ряда веществ: стероидных гормонов, ядов лекарственных и других веществ, происходящее на первой стадии их инактивации. Микросомальная ЦПЭ состоит из четырех ферментов, коферментами которых являются НАДФ, ФАД, ион железа и цитохром Р450:
О R-H
2Н+
НАДФ-Н2 2Н+ флавопртеин---Fe- cодержащий белок--цит. Р450--О R-OH
2е- 2е- 2е- 2е-
Источники ионов водорода в клетках.
Большое количество ионов водорода генерируются в реакциях отщепления их от 3-фосфоглицеринового альдегида, молочной, пировиноградной кислот (окисление глюкозы), активированных жирных кислот (окисление липидов), глутаминовой кислоты (обмен белков). Основная масса их высвобождается при окислении в цикле трикарбоновых кислот, описанном Г. Кребсом, активированной уксусной кислоты (ацетил-КоА). Источником последнего является главным образом окисление пировиногроадной, жирных кислот и некоторых аминокислот.
Лекция №5
Цикл Кребса
План.
1. Реакции цикла трикарбоновых кислот.
2. Биологическая роль цикла Кребса.
Цикл Кребса – 10 последовательно протекающих реакций, начинающихся с вовлечения в процесс шавелевоуксусной кислоты и заканчивающихся высвобождением ее.
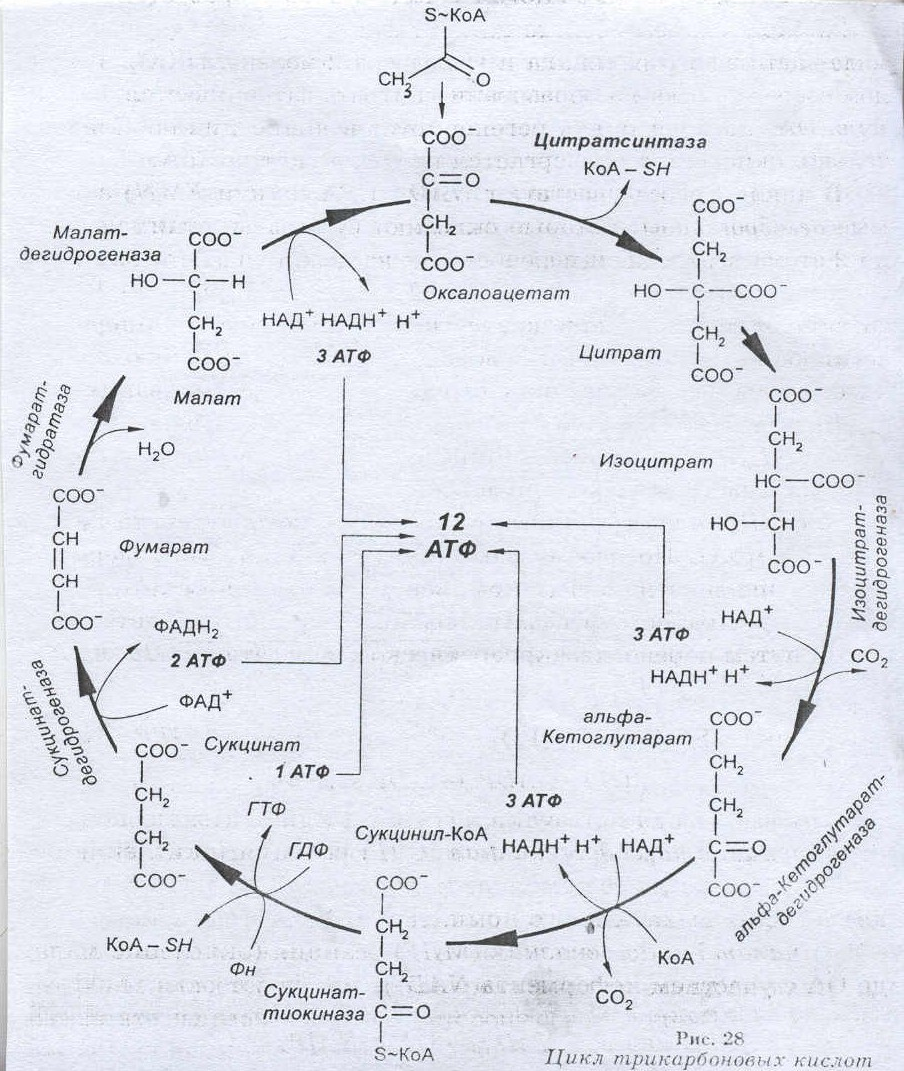
Биологическая роль цикла Кребса
1. При расщеплении одной молекулы ацетил-КоА в цикле Кребса высвобождается 2 молекулы углекислого газа – в результате изоцитатдегидрогеназной и ά-кетоглутаратдегидрогеназной реаций. Первая из них сопряжена с прямым декарбоксилированием, вторая – окислительным. Углекислый газ в основном выделяется легкими, но он может участвовать в функционировании буферных систем крови.
2. В цикле Кребса восстанавливается 3 молекулы НАД и 1 молекула ФАД. Они переносят ионы водорода в дыхательную цепь митохондрий, где из них может генерироваться 11 молекул АТФ. НАД-Н2 генерируется в изоцитатдегидрогеназной, изоцитатдегидрогеназной и ά-кетоглутаратдегидрогеназной реаций атдегидрогеназной и малатдегидрогеназной реациях, ФАД-Н2 – в сукцинатдегидрогеназной реакции. Непосредственно цикле Кребса в результате реакции субстратного фосфорилирования, сукциниотиокиназной реакции, также может генерироваться одна молекула гуанозинтрифосфата (ГТФ), способная передавать энергию для синтеза АТФ.
3. Генерируемые в цикле Кребса ά-кетоглутаровая и щавелевоуксусная кислоты участвуют в реакциях переаминирования аминокислот.
4. В цикле Кребса окисляется сукцинил-КоА, образующийся в преджелудках жвачных животных в процессе расщепления микрофлорой клетчатки.
Лекция №6
ОБМЕН БЕЛКОВ
План
1. Гидролиз белков в органах пищеварительной системы, транспорт аминокислот в клетки.
2. Метаболизм аминокислот: реакции дезаминирования, переаминирования, декарбоксилирования.
3. Образование цистеина, метионина и др.
6. Биосинтез белка: генетический код, репликация ДНК, транскрипция, трансляция. Мутации генов. Генная инженерия.
7. Образование конечных продуктов белкового обмена: мочевины, мочевой кислоты, креатинина и др.
8. Патология белкового обмена.
Гидролиз белков в органах пищеварительной системы
В ротовой полости происходит механическое измельчение пищи. Гидролиз белков начинается в желудке (у жвачных животных в сечуге) под действием пепсина. Вырабатывается он клетками слизистой оболочки в виде неактивного пепсиногена. От последнего под действием хлористоводородной кислоты отщепляется часть молекулы и он переходит в активный пепсин. Хлористоводородная кислота, кроме того, создает для пепсина оптимум рН (1,5-2,5), способствует набуханию белков, убивает микроорганизмы, способствует эвакуации желудочного содержимого, воздействуя на рецепторы пилоруса. Пепсин, гидролизуя в белках пептидные связи, образованные кабоксильными группами циклических аминокислот и аминогруппами аспарагиновой и глутаминовой кислот, расщепляет их до полипептидов (пептонов). У молодняка рН желудка 3-3,5 и белки в нем расщепляются гастроксином.
Из желудка пищевый комок поступает в 12-персную кишку, в которой его содержимое нейтрализуется карбонатами кишечного сока до рН 7,5-8. Сюда из поджелудочной железы поступают ряд проферментов: трипсиноген, химотрипсиноген, проэластаза и прокарбоксипептидаза. В дальнейшем происходит их активация путем отщепления пептидов, закрывающих их активные центры. Трипсиноген превращается в активный трипсин энтерокиназой, вырабатываемой клетками стенки кишечника. Трипсин, гидролизуя пептидные связи полипептидов, образованные кабоксильными группами лизина и аргинина, превращает их в более мелкие пептиды.
Химотрипсиноген, проэластаза и прокарбоксипептидаза активируются трипсином, превращаясь в химотрипсин, эластаза и карбоксипептидаза. Первый из них расщепляет пептидные связи, образованные кабоксильными группами фенилаланина, тирозина и триптофана. Образовавшиеся пептиды гидролизуются в кишечнике карбоксипептидазой и аминопептидазой, вырабатываемой стенкой кишечника. Первая из них отщепляет от пептида одну аминокислоту, где крайняя группа – СООН, вторая – где крайняя аминогруппа. На конечном этапе образовавшиеся дипептиды расщепляются дипептидазами. Эластические волокна соединительной ткани расщепляются эластазой. Описанные реакции ускоряются в присутствии ворсин тонкого кишечника (пристеночное пищеварение).
Дата: 2019-02-02, просмотров: 443.