Структура белков.
Белки - органические соединения, состоящие из аминокислот, связанных между собой пептидной связью. Аминокислоты - кабоновые кислоты, содержащие аминную и карбоксильную групп, находящиеся у одного и того же углеродного атома.В состав белков входят 22 аминокислоты, которые по свойствам боковой цепи делят на 4 группы: гидрофобные,
гидрофильные неионные, гидрофильные с отрицательным зарядом и гидрофильные с положительным зарядом.
I . гидрофобные аминокислоты.
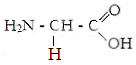
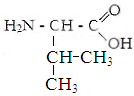

Глицин. Аланин Валин Лейцин
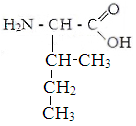
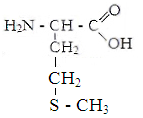
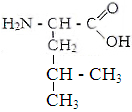
Изолейцин Метионин Цистин Фенилаланин
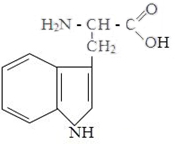
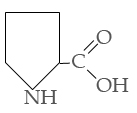
Триптофан Пролин
II . гидрофильные неионные аминокислоты.
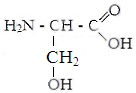
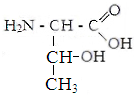
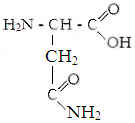

Серин Треонин Аспарагин Глутамин
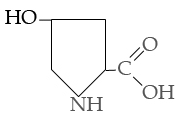
Оксипролин
III . гидрофильные аминокислоты .
.

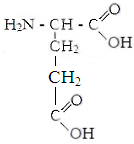
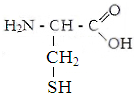

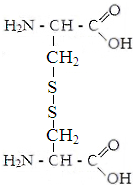
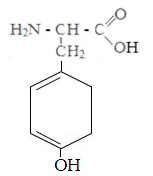
Аспарагиновая Глутаминовая Цистеин Тирозин
кислота кислота
Лекция № 2
ФЕРМЕНТЫ
План
1.Структура ферментов
2. Свойства ферментов.
Структура ферментов
Ферменты (энзимы) – белки, являющиеся биологическими катализаторами. По строению могут быть простыми и сложными белками. Последние состоят из белковой части (апофермента) и небелковой части (кофермента). По отдельности каталитической активностью не обладают, активны лишь вместе. Существуют мультиферментные комплексы, состоящие из нескольких ферментов
Некоторые ферменты имеют четвертичную структуру – состоят из двух и более радикалов более мелких белков (субъединиц). Некоторые ферменты могут катализировать одну реакцию, но отличаться по строению субъединиц.
Их называют изоферментами. Например, креатинкиназа-1 мозга состоит из субъединиц ВВ, креатинкиназа-2 миокарда - из субъединиц ВМ, а креатинкиназа-3 скелетных мышц – из субъединиц ММ.
В молекуле фермента различают активный и аллостерический центры. К первому из них присоединяется вещество, на которое действует фермент (субстрат), происходит его превращение, образуется продукт реакции. Этот центр занимает лишь часть молекулы фермента. В его составе выделяют контактный участок, к которому присоединяется субстрат и каталитический центр, где происходит ферментативная реакция. В составе каталитического центра могут быть радикалы аминокислот, содержащие группы –СООН, -ОН, -NH2 и др., а у ферментов-сложных белков – и кофермент.
Аллостерический центр (allos – другой) – участок фермента, к которому присоединяются вещества, отличные от субстрата, способные изменять форму активного центра, ускоряя таким образом ферментативную реакцию (активаторы) или замедляя ее (ингибиторы). Такими веществами могут быть продукты собственной реакции, других реакций, гормоны и др.
Строение коферментов.
Различают коферменты витаминные т невитаминные.
Витаминные коферменты.. К ним относят никотинамидные, флавиновые, тиаминовые, пиридоксалевые, пантотеновые, кобаламиновые и другие коферменты.
Никотинамидные коферменты – производные витамина РР.
К ним относят никотинамидадениндинуклеотид (НАД) и никотинамидадениндинуклеотид фосфат (НАДФ). НАД из соединенных между собой остатков аденозинмонофосфата (АМФ) и никотинамидрибозилмонофосфата (НМФ). Он входит в состав ферментов дегидрогеназ, отщепляющих ионы водорода от гидроксильных, альдегидных или аминогрупп. Ионы водорода присоединяются к атому углерода никотинамида, находящемуся в четвертом положении. НАД способен переносить ионы водорода в дыхательную цепь митохондрий, где они окисляются с образованием АТФ.
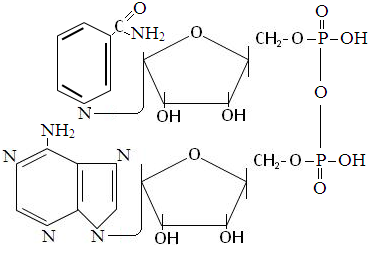
НАДФ отличается по строению тем, что к второму углеродному атому радикала рибозы АМФ присоединяется остаток фосфорной кислоты. Является коферментом дегидрогеназ пентозного цикла, откуда ионы водорода поставляются в реакции биосинтеза различных веществ.
Флавиновые коферменты – производные витамина В2.
К ним относя флавинмононуклеотидд (ФМН) и флавинадениединуклеотид (ФАД). Первый из них входит в состав дыхательной цепи митохондрий. Он принимает ионы водорода и электроны от НАД-Н2 и передает их убихинону.
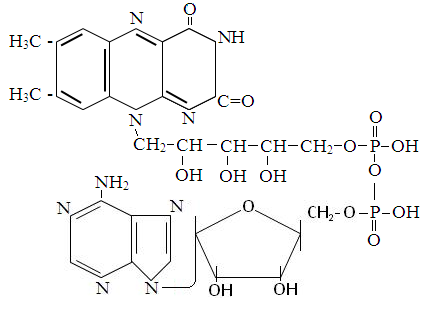
ФАД состоит из остатков АМФ и ФМН. Является коферментом дегидрогеназ, отщепляющих ионы водорода от янтарной кислоты и активированных жирных кислот. Ионы водорода присоединяются к атомам азота изоалаксозинового цикла и переносятся в дыхательную цепь митохондрий.
Тиаминовые коферменты – производные витамина В1. К ним относя тиаминдифосфат (ТДФ). Входит в состав транскетолазы пентозного цикла, а также ферментов отщепляющих углекислый газ от пировиноградной и альфа-кетоглутаровой кислот.
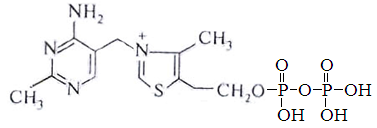
Пиридоксальфосфат (ПФ) – производное витамина В6. Входит в состав ферментов обмена аминокислот – декарбоксилаз, трансамназ.
Пантотеновые коферменты – производные витамина В3. К ним относят коэнзим А (КоА), входящий в состав ферментов, переносящих остатки уксусной, янтарной или жирных кислот.
СН3 ОН
! !
АДФ-О - СН2 - С----СН – СО – NH - СН2 -СН2 - COOH
!
СН3
Коэнзим А
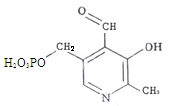
Фолатные коферменты - производные витамина Вс (фолиевой кислоты).
Участвуют в переносе метильных, альдегидных и других одноуглеродных фрагментов
Невитаминными коферментами могут быть гем (у каталазы, цитохромов и др. ферментов), ионы металлов (у глутатионпероксидазы, супероксиддисмутазы, амилазы и др.), глутатион (у глицеральдегид-3-фосфатдегидрогеназы), мононуклеотиды (АМФ, ГМФ, ЦМФ) и др.
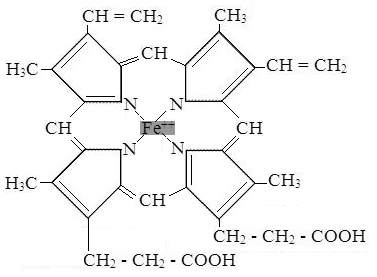
Свойства ферментов
1. Высокая каталитическая активность – способность повышать скорость реакций в миллионы-миллиарды раз. Неорганические катализаторы увеличивают ее лишь в тысячи раз.
2. На активность фермента влияет концентрация субстрата. При увеличении последней активность фермента возрастает, но до определенного предела. Концентрация субстрата, при которой активность фермента равна 0,5 от максимальной, называется константой Михаэлиса.
3. На активность фермента влияет концентрация продукта реакции. При постепенном накоплении последнего в среде она снижается. Поэтому активность фермента определяют на начальном этапе реакции, когда субстрат еще не накопился.
4. Активность ферментов зависит от рН среды. В зависимости от рН изменяется диссоциация ионогенных групп в активном центре фермента и в молекуле субстрата, что влияет на скорость реакции. Большинство ферментов наиболее активны в слабощелочной среде. Исключение – пепсин желудочного сока и катепсины лизосом, активные в кислой среде.
5. На активность фермента влияет температура среды. Обычно при повышении ее на 10оС скорость реакции увеличивается в 2 раза (правило Ван Гоффа). Наиболее активны ферменты млекопитающих при 40-50 о. При более низкой температуре активность тормозится из-за снижения диссоциации ионогенных групп, а при более высокой – из-за денатурации белковой молекулы.
6. Ферменты обладают специфичностью, т.е. способность воздействовать лишь на определенный субстрат. Различают различные виды специфичности.
а. Абсолютная специфичность, когда фермент действует лишь на один субстрат. Например, фумаратгидратаза действует только на фумаровую кислоту.
б. Групповая специфичность, когда фермент действует на несколько сходных по структуре субстратов. Например, липаза расщепляет ацилглицеролы, состоящие из различных жирных кислот.
г. Стереоспецифичность, когда фермент действует только на определенный пространственный изомер. Например, фумаратгидратаза не действе на стереоизомер фумаровой кислоты – малеиновую кислоту.
7. На активность ферментов влияют вещества, повышающие скорость реакции (активаторы) и снижающие ее (ингибиторы). Некоторые ферменты вырабатываются неактивными и при помощи активаторов переходят в активные. Например, энтерокиназа отщепляет от трипсиногена часть молекулы и он превращается в активный трипсин. Активаторами могут быть ионы металлов, субстраты, продукты других реакций, гормоны и другие вещества.
Ингибиторы по характеру торможения активности фермента могут быть обратимыми и необратимыми. В первом случае комплекс фермент-ингибитор может расщепляться и активность фермента восстанавливается. При необратимом ингибировании образуется прочная связь между ферментом и ингибитором.
По механизму действия ингибиторы делят на конкурентные, неконкурентные, субстратные и аллостерические.
а. При конкурентном ингибировании структура ингибитора близка к структуре субстрата и он конкурирует за активный центр. Например, малоновая кислота по структуре близка к янтарной кислоте и поэтому способна связывать активный центр сукцинатдегидрогеназы. Ингибирование можно ослабить увеличением концентрации субстрата. На конкурентном ингибировании основано действие сульфаниламидов. Они по строению сходны с п-аминобензойной кислотой, необходимой микроорганизмам. Сульфаниламиды, занимая место последней, тормозят рост микроорганизмов.
б. Неконкурентное ингибирование развивается под действием вещества, структура которого не сходная со структурой субстрата. Оно связывается не с активным центром, а с другими участками молекулы фермента. Последний после этого может образовывать комплекс с субстратом, но внутри этого комплекса реакция не протекает. Например, ионы тяжелых металлов связывают HS-группы ферментов, ингибируя их. Цианиды связываются с ионом железа цитохромоксидазы, прекращая дыхание митохондрий. Неконкурентное ингибирование, в отличие от конкурентного, не снимается избытком субстрата.
в. Субстратное ингибирование развивается иногда при увеличении в среде концентрации субстрата. Его снимают, уменьшая концентрацию последнего.
г. Аллостерическое ингибирование развивается тогда, когда вещество, сзязываясь с аллостерическим центром, изменяет конфигурацию активного центра, блокируя его. Такими ингибиторами могут быть собственный продукт реакции, продукты других реакций, гормоны и другие вещества.
Лекция №3.
ФЕРМЕНТЫ (продолжение)
План.
1. Механизм действия Ф.
2.Номенклатура и классификация ферментов.
3. Ферменты в сельском хозяйстве.
Механизм действия ферментов
Ферменты во много раз увеличивают скорость химических реакций, что с термодинамических позиций связывают со способностью их снижать энергию активации реакции, т. е. то дополнительное количество ее, которое нужно дать молекулам, чтоб они из неактивного состояния перешли в активное. Это снижение происходит через несколько стадий.
Согласно теории Михаэлиса-Ментена ферментативная реакция протекает в три стадии: 1) фермент (Фер) + субстрат (Суб) ------ фермент-субстратный комплекс (Фер-Суб);
2) преобразование субстрата в несколько стадий молекулы внутри фермент-субстратного комплекса с образованием внутри него промежуточных продуктов и в конечном итоге - комплекса фермент-продукт реакции (Фер- Прод); 3) расщепление комплекса фермент-продукт реакции с диффузией фермента и продукта реакции в среду: Фер-Прод ------ Фер + Прод.
На первой стадии реакции субстрат маневрирует, сближаясь с активным центру фермента, концентрируясь в нем. При этом происходит их взаимная пространственная подгонка так, чтоб активный центр расположился напротив «атакуемой» связи в молекуле субстрата. Образуется фермент-субстратный комплекс. Процесс протекает мгновенно, энергия активации снижается незначительно.
Вторая стадия реакции наиболее продолжительная, за счет нее в основном снижается энергия активации. В активном центре фермента и в молекуле субстрата содержатся кислотные и основные радикалы. Поэтому в ходе реакции может изменяться рН среды, что влияет на ее скорость. Во время нее происходит натяжение, деформирование химических связей в молекуле субстрата, их разрыв с возникновением новых связей. Это приводит к ускорению реакции, образования во время нее вначале одного или нескольких промежуточных продуктов, затем - продукта реакции.
Третья стадия реакции протекает также мгновенно и энергия активации изменяется мало.
Номенклатура и классификация ферментов
Вначале ферментам давали название по случайному признаку. Например, название пепсин происходит от слова peptis (пищеварение). Затем рабочее название фермента начали составлять из названия субстрата, типа катализируемой реакции и окончания «аза»: лактатдегидрогеназа. В 1961 году на Международном биохимическом съезде в Москве приняли систематическую классификацию ферментов. Их названия составляют из названия субстрата, класса реакции и окончания «аза». Если происходит перенос химической группы от донора к акцептору, то это включается в название: лактат:НАД-оксидоредуктаза.
Описано более 1900 ферментов, которые по типу катализируемой реакции деля на 6 классов: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы; 5) изомеразы; 6) лигазы (синтетазы). Каждый класс делится на подкласс, подкласс – на подподкласс. В последнем фермент имеет свой порядковый номер. Поэтому каждый фермент имеет свой шифр, состоящий из четырех чисел: номеров класса, подкласса, подподкласса и порядкового номера. Например, у лактат:НАД-оксидоредуктазы шифр 1.1.1.27.
1. Оксидоредуктазы катализируют окислительно-восстановительные реакции. Существует их 17 подклассов. Ферменты первого подкласса окисляют атомы водорода группы = СН - ОН:
СН3 СН3
1 1
СН-ОН + НАД Лактатдегидрогеназа С=О + НАД-Н2
1 1
СООН СООН .
Молочная кислота Пировиноградная килота.
У первого подподкласса акцептором ионов водорода является НАД, у второго – НАДФ, у третьего – цитохромы.
Ферменты второго класса окисляют альдегидную группу, третьего – группу
-СН2-СН2- и т.д. Ферменты, переносящие ионы водорода, называют дегидрогеназами. Если акцептором оксидоредуктазы служит кислород, ее называют оксидазой. Если при окислении кислорода он включается прямо в субстрат, то это – оксигеназы.
2. Трансферазы переносят различные функциональные группы от одного субстрата к другому. Аминотрансферазы перенося аминогруппы, метилтрансферазы – группы –СН3, ацилтрансферазы – радикалы кислот и т.д.
СООН СООН
1 1
СН2 CН3 СН2 СН3
1 1 1 1
СН2 + С=О Аланинамино- СН2 + СН-NH2
1 1 ←трансфераза→ 1 1
СН-NH2 СООН Пиридоксаль- С=О CООН
1 фосфат 1
COOH СООН
Глутамино- Пировиноград- α-кетоглутаро- Аланин
вая кислота ная кислота вая кислота
3. Гидролазы расщепляют вещества с присоединением к месту разрыва молекулы воды. Широко распространены. Гидролазы подкласса 3.1, эстеразы, расщепляют сложноэфирные связи эфиров фосфорной, карбоновых кислот, тиолов и т.д:
СН2 -О-СО-С17Н35 СН2 -ОН
1 1 С17Н35 –CO-О-СН Липаза НО-СН + 3 С17Н35 - СООН
1 1
СН2-О-СО-С17Н35 + 3 Н2О СН2-ОН Стеариновая кислота
Тристеарин Глицерол.
Гидролазы подкласса 3.1, гликозидазы, расщепляют О-, N- и S-гликозильные связи у различных соединений, например, у углеводов:
Гидролазы подкласса 3.4, пептидазы, расщепляют пептидные связи:
H2N-CH-CO-NH-CH-COOH Дипептидаза H2N-CH-COОН + H2N -CH-COOH
1 1 + Н2О 1 1
CH3 CH2 –OH СН3 CH2 –OH
Аланилсерин Аланин серин
4. Лиазы катализируют реакции расщепления веществ без присоединения к месту разрыва молекул воды или обратные им реакции –
соединение двух веществ в одно без затраты энергии в виде АТФ или других макроэргических соединений.
5. Изомеразы катализируют превращения, происходящих в пределах одной молекулы.
6. Лигазы (синтетазы) катализируют реакции соединения молекул двух веществ в одну с использованием энергии АТФ или другого макроэргического соединения. При этом образуются –С-О-, -C-S- и –С-N-cвязи.
СООН
1
СН3 СН2
1 1
СО2 + СН-ОН + АТФ Пируваткарбоксилаза С=О + АДФ + Н3РО4.
1 Биотин 1
СООН СООН
Пировиноградная Щавелевоуксусная
кислота кислота
Ферменты в сельском хозяйстве.
Ферменты широко используются в связанных с сельским хозяйством технологических процессах: производстве молочных продуктов, напитков, переработке пера, костей и др. Все чаще используются ферменты, иммобилизованные на гранулах стекла, полимерах и помещенные в колонки, через которые пропускают перерабатываемое вещество.
Распространены заболевания людей и животных, связанные с нарушением синтеза или повреждением некоторых ферментов (фенилкетонурия, галактоземия, гликогенозы и др.). Своевременная диагностика их позволяет проводить лечебно-профилактические мероприятия, направленные на снижение ущерба, наносимого этой патологией.
При патологии печени, поджелудочной железы, миокарда и других заболеваниях животных из поврежденных органов в кровь поступают ферменты. Определяя их активность, можно не только выявить пораженный орган, но и оценить тяжесть заболевания, эффективность проводимой терапии.
Ферменты широко используются в современных клинических биохимических исследования в качестве реагентов. Применение их позволяет повысить точность и облегчить проведение анализа.
Ферменты применяют для лечения животных с патологией органов пищеварительной системы, хирургическими заболеваниями и др.
Лекция №4
ОБМЕН ВЕЩЕСТВ
План
- Понятие об обмене веществ.
- Биологическое окисление.
- Обмен энергии. АТФ. Митохондрии.
- Цикл трикарбоновых кислот.
Обмен веществ – совокупность химических превращений, которым подвергаются вещества с момента поступления в организм до выделения их в виде конечных продуктов. Включает два взаимосвязанные между собой процессы: ассимиляцию и диссимиляцию. Ассимиляция – образование характерных для организма веществ, сопряженное с потреблением АТФ. Диссимиляция – процесс распада веществ в организме.
Этапы обмена веществ
- Пищеварение – гидролитическое расщепление ферментами веществ,
поступивших с пищей, до простых веществ- мономеров: белки расщепляются до аминокислот, жиры – до глицерина и жирных кислот, олиго- и полисахахариды – до моносахаридов.
- Всасывание мономеров в кровь в стенке кишечника.
- Межуточный (тканевой) обмен – химические превращения веществ в
тканях или метаболизм. Вещества, участвующие в этих превращениях – метаболиты. Одновременно в организме протекают процессы образования (анаболизм) и распада веществ (катаболизм).
4. Образование конечных продуктов - процесс, позволяющий высвободить около 80% энергии. Конечными продуктами метаболизма белков, углеводов и липидов являются углекислый газ и вода. При окислении белков образуется также аммиак, обезвреживающийся в мочевину.
Биологическое окисление – совокупность процессов окисления (отщепления и присоединения электронов), протекающих в клетках. Согласно теории В.И. Палладина оно заключается в отщеплении от окисляемого субстрата ионов водорода и электронов и переносе их на активированный кислород с образованием воды:
S-H2 2Н+ + 2е- ½ О2 → Н2О + энергия (210 кДж).
Реакция 2Н+ + ½ О2 → Н2О + энергия является основным источником энергии в организме. Вне организма она протекает быстро, с выделением большого количества энергии, с взрывом, а в организме – ступенчато. Энергия при этом выделяется порциями, что предотвращает перегревание клетки. Часть ее выделяется в виде тепла, часть запасается в макроэргических связях аденозинтрифосфата (АТФ):
Аденозиндифосфат (АДФ) + Н3РО4 + энергия → АТФ.
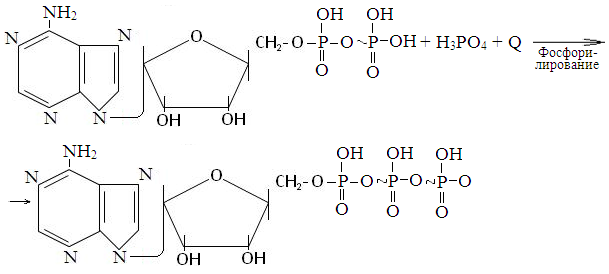
Синтез АТФ из АДФ и Н3РО4 называется фосфорилированием. Различают две разнолвидности его: субстратное и окислительное фосфорилирование. Первое из них (субстратное фосфорилирование) протекает за счет энергии, освобождающейся при расщеплении макроэргических (богатых энергией) химических связей некоторых веществ- субстратов: 1,3-дифосфоглицериновой, фосфоенолпировиноградной кислот (в реакциях окисления глюкозы ) и активной формы янтарной кислоты (в реакциях окисления активной формы уксусной кислоты в цикле Кребса); 2) за счет энергии освобождающейся при окислении кислородом ионов водорода ферментами дыхательной цепи, расположенной на внутренней мембране митохондрий (окислительное фосфорилирование).
Строение дыхательной цепи митохондрий
На внутренней мембране этих органоидов локализовано 8 оксидоредуктаз, коферменты которых располагаются последовательно в следующем порядке:
Ц и т о х р о м ы
S-H2 2е- НАД 2е- ФМН 2е- убихинон 2е- Ц.b 2е- Ц.c1 2е- Ц.c 2е- Ц.a 2е- Ц.a3 2е-
2Н+ 2Н+ 2Н+ 2Н+
Н2О ½ О2
-------------------- ----------------- -----------------
АТФ АТФ АТФ
Первый кофермент – НАД. Он принимает ионы водорода и электроны от субстрата S-H2, находящегося за пределами дыхательной цепи. Акцептором их является атом углерода никотинамида, находящийся в 4-м положении. Образовавшийся НАД-Н2 передает ионы водорода и электроны ФМН, где они присоединяются к атомам азота изоалаксозинового цикла. От ФМН-Н2 ионы водорода и электроны переходят на убихинон. Первые из них временно остаются на убихиноне и в дальнейшем, соединяясь с атомом активированного кислорода, образуют молекулу воды.
От убихинона електроны передаются на цитохром b, присоединяясь к атому железа гема, который меняет свою валентность с 3 на 2.. От цитохром b они перемещаются последовательно на цитохромы с1, с, а и а3. При каждом таком переходе электрона от одного фермента дыхательной цепи митохондрий к другом происходит постепенная потеря энергии и на цитохром а3 (цитохромоксидазу) переходит лишь остаток ее. Последний передается на молекулу кислорода, поступившую в клетку через кровь из легких, активируя ее. Активированный кислород после этого соединяется с ионами водорода, отщепившимися от убихинона и образуется вода, конечный продукт биологического окисления.
Генерации АТФ ферментами дыхательной цепи митохондрий
Каждые два фермента дыхательной цепи митохондрий образуют редокс-пару. Между ними имеются определенный окислительно-восстановительный потенциал (ОВП), э.д.с., выражающаяся в вольтах. В процессе переноса электронов происходит постепенное увеличение ОВП. У НАД он равен -0,32 в, у кислорода - +0,81 в. Генерация АТФ в дыхательной цепи митохондрий происходит на тех участках ее, где различие в ОВП между компонентами редокс-пары составляет не менее 0,2 в. Таких участков 3: 1) между НАД и ФМН; 2) между цитохромами b и c1; 3) между цитохромами а и а3.Поэтому при окислении ферментами дыхательной цепи митохондрий одной молекулы НАД-Н2 генерируется 3 молекулы АТФ. Если же окисляется ФАД-Н2, то ионы водорода и электроны передаются от него на ФМН, минуя первый пункт генерации АТФ, между НАД и ФМН. Поэтому произойдет генерация только двух молекул АТФ.
Согласно теории П. Митчелла, энергия, отдаваемая электронами при прохождении через эти участки дыхательной цепи, используется для перемещения положительно заряженных ионов водорода из внутреннего пространства митохондрий (матрикса) в пространство между внутренней и наружной мембранами их, т.е. на наружную поверхность внутренней мембраны этих органоидов (ВММ). Вследствие этого на последней накапливается избыток ионов водорода. При этом на внутренней поверхности ВММ содержится избыток отрицательно заряженных электронов. Поэтому создается разница потенциалов между наружной и внутренней поверхностями ВММ (мембранный потенциал).
Из-за наличия этого потенциала ионы водорода стремятся вернуться обратно в матрикс. Для этого они использую специальный канал, расположенный внутри фермента протонная АТФ-аза, расположенная на ВММ. Во время прохождения через этот канал ионов водорода выделяется энергия, которая используется для генерации из АДФ и фосфорной кислоты АТФ (окислительного фосфорилирования). Следовательно протонная АТФ-аза функционирует как АТФ- синтетаза.
Креатинкиназная реакция – «челночный» механизм, осуществляющий перенос энергии АТФ от места выработки его (митохондрий, расположенных на поверхности мышечных волокон) до места потребления (саркомеров мышечных волокон). Прямо поступать АТФ в саркомеры не может, т.к. расщепляется по пути ферментами.
Микросомальное окисление, протекающее с участие специальной цепи переноса электронов (ЦПЭ), расположенной на мембранах эндоплазматической цепи печени, надпочечников и других органов, также сопряжено с потреблением кислорода. При этом последний не только превращается в воду, но и используется для гидроксилирования (присоединения НО-группы) ряда веществ: стероидных гормонов, ядов лекарственных и других веществ, происходящее на первой стадии их инактивации. Микросомальная ЦПЭ состоит из четырех ферментов, коферментами которых являются НАДФ, ФАД, ион железа и цитохром Р450:
О R-H
2Н+
НАДФ-Н2 2Н+ флавопртеин---Fe- cодержащий белок--цит. Р450--О R-OH
2е- 2е- 2е- 2е-
Источники ионов водорода в клетках.
Большое количество ионов водорода генерируются в реакциях отщепления их от 3-фосфоглицеринового альдегида, молочной, пировиноградной кислот (окисление глюкозы), активированных жирных кислот (окисление липидов), глутаминовой кислоты (обмен белков). Основная масса их высвобождается при окислении в цикле трикарбоновых кислот, описанном Г. Кребсом, активированной уксусной кислоты (ацетил-КоА). Источником последнего является главным образом окисление пировиногроадной, жирных кислот и некоторых аминокислот.
Лекция №5
Цикл Кребса
План.
1. Реакции цикла трикарбоновых кислот.
2. Биологическая роль цикла Кребса.
Цикл Кребса – 10 последовательно протекающих реакций, начинающихся с вовлечения в процесс шавелевоуксусной кислоты и заканчивающихся высвобождением ее.
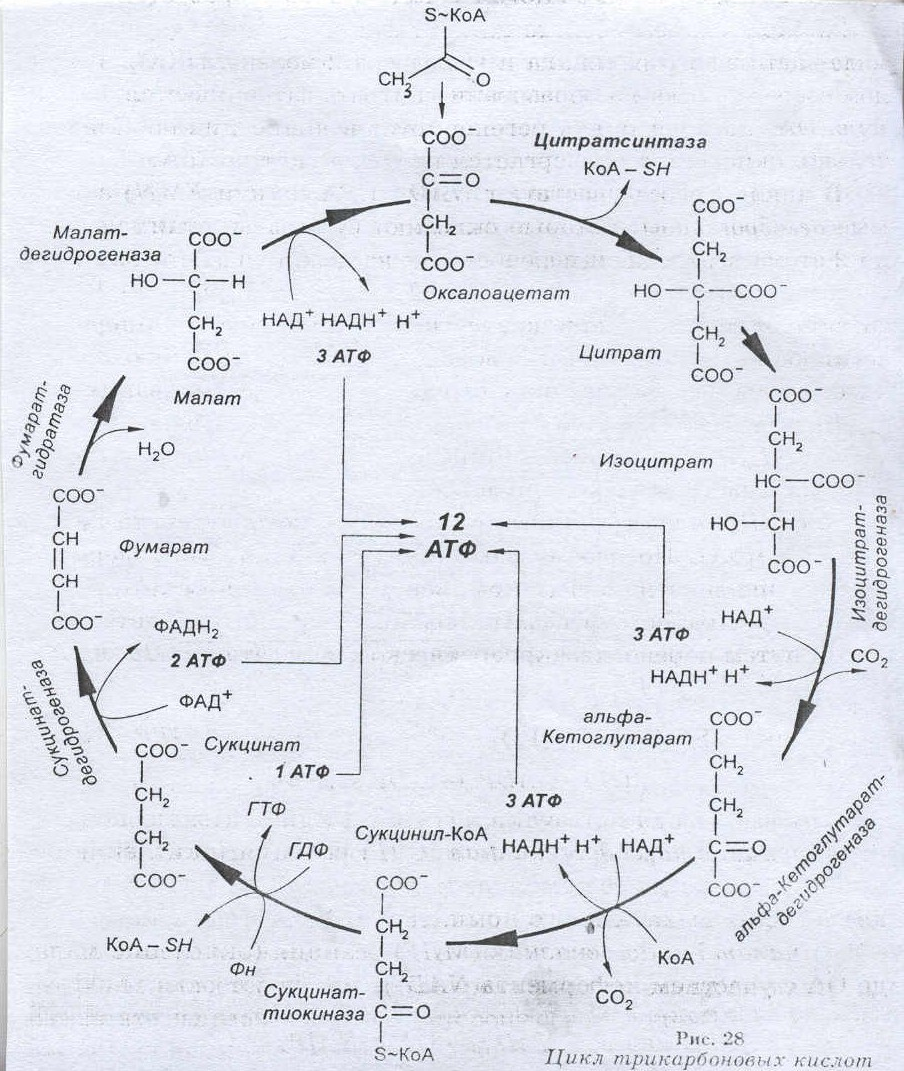
Биологическая роль цикла Кребса
1. При расщеплении одной молекулы ацетил-КоА в цикле Кребса высвобождается 2 молекулы углекислого газа – в результате изоцитатдегидрогеназной и ά-кетоглутаратдегидрогеназной реаций. Первая из них сопряжена с прямым декарбоксилированием, вторая – окислительным. Углекислый газ в основном выделяется легкими, но он может участвовать в функционировании буферных систем крови.
2. В цикле Кребса восстанавливается 3 молекулы НАД и 1 молекула ФАД. Они переносят ионы водорода в дыхательную цепь митохондрий, где из них может генерироваться 11 молекул АТФ. НАД-Н2 генерируется в изоцитатдегидрогеназной, изоцитатдегидрогеназной и ά-кетоглутаратдегидрогеназной реаций атдегидрогеназной и малатдегидрогеназной реациях, ФАД-Н2 – в сукцинатдегидрогеназной реакции. Непосредственно цикле Кребса в результате реакции субстратного фосфорилирования, сукциниотиокиназной реакции, также может генерироваться одна молекула гуанозинтрифосфата (ГТФ), способная передавать энергию для синтеза АТФ.
3. Генерируемые в цикле Кребса ά-кетоглутаровая и щавелевоуксусная кислоты участвуют в реакциях переаминирования аминокислот.
4. В цикле Кребса окисляется сукцинил-КоА, образующийся в преджелудках жвачных животных в процессе расщепления микрофлорой клетчатки.
Лекция №6
ОБМЕН БЕЛКОВ
План
1. Гидролиз белков в органах пищеварительной системы, транспорт аминокислот в клетки.
2. Метаболизм аминокислот: реакции дезаминирования, переаминирования, декарбоксилирования.
3. Образование цистеина, метионина и др.
6. Биосинтез белка: генетический код, репликация ДНК, транскрипция, трансляция. Мутации генов. Генная инженерия.
7. Образование конечных продуктов белкового обмена: мочевины, мочевой кислоты, креатинина и др.
8. Патология белкового обмена.
Гидролиз белков в органах пищеварительной системы
В ротовой полости происходит механическое измельчение пищи. Гидролиз белков начинается в желудке (у жвачных животных в сечуге) под действием пепсина. Вырабатывается он клетками слизистой оболочки в виде неактивного пепсиногена. От последнего под действием хлористоводородной кислоты отщепляется часть молекулы и он переходит в активный пепсин. Хлористоводородная кислота, кроме того, создает для пепсина оптимум рН (1,5-2,5), способствует набуханию белков, убивает микроорганизмы, способствует эвакуации желудочного содержимого, воздействуя на рецепторы пилоруса. Пепсин, гидролизуя в белках пептидные связи, образованные кабоксильными группами циклических аминокислот и аминогруппами аспарагиновой и глутаминовой кислот, расщепляет их до полипептидов (пептонов). У молодняка рН желудка 3-3,5 и белки в нем расщепляются гастроксином.
Из желудка пищевый комок поступает в 12-персную кишку, в которой его содержимое нейтрализуется карбонатами кишечного сока до рН 7,5-8. Сюда из поджелудочной железы поступают ряд проферментов: трипсиноген, химотрипсиноген, проэластаза и прокарбоксипептидаза. В дальнейшем происходит их активация путем отщепления пептидов, закрывающих их активные центры. Трипсиноген превращается в активный трипсин энтерокиназой, вырабатываемой клетками стенки кишечника. Трипсин, гидролизуя пептидные связи полипептидов, образованные кабоксильными группами лизина и аргинина, превращает их в более мелкие пептиды.
Химотрипсиноген, проэластаза и прокарбоксипептидаза активируются трипсином, превращаясь в химотрипсин, эластаза и карбоксипептидаза. Первый из них расщепляет пептидные связи, образованные кабоксильными группами фенилаланина, тирозина и триптофана. Образовавшиеся пептиды гидролизуются в кишечнике карбоксипептидазой и аминопептидазой, вырабатываемой стенкой кишечника. Первая из них отщепляет от пептида одну аминокислоту, где крайняя группа – СООН, вторая – где крайняя аминогруппа. На конечном этапе образовавшиеся дипептиды расщепляются дипептидазами. Эластические волокна соединительной ткани расщепляются эластазой. Описанные реакции ускоряются в присутствии ворсин тонкого кишечника (пристеночное пищеварение).
Метаболизм аминокислот
Реакции переаминирования (трансаминирования)- обмен аминогруппы аминокислоты на карбонильную группу кетокислоты. Образуется новая аминокислота и новая кетокислота. Реакции обратимые. Небелковой частью ферментов их является пиридоксальфосфат (ПФ). Название фермента включает название аминокислоты, донора аминогруппы.
СООН СООН
1 1
СН2 CН3 СН2 СН3
1 1 1 1
СН2 + С=О Аланинамино- СН2 + СН-NH2
1 1 трансфераза 1 1
СН-NH2 СООН Пиридоксаль- С=О CООН
1 фосфат 1
COOH СООН
Глутамино- Пировиноград- α-кетоглутаро- Аланин
вая кислота ная кислота вая кислота
Реакции являются основным источником в образовании одних заменимых аминокислот из других. Например, если в организме избыток аланина, но не хватает аспарагиновой кислоты, то протекает двухстадийный процесс:
Аланин + α-кетоглутарат Аланинаминотрансфераза Глутамат + Пируват;
ПФ
Глутамат + оксалоацетат Аспартатаминотрансфераза α-кетоглутарат + аспартат.
ПФ
Реакции декарбоксилирования – отщепление углекислого газа от карбоксильной группы аминокислоты. Коферментом декарбоксилаз аминокислот также является пиридоксальфосфат (ПФ). В этих реакциях образуются некоторые гормоны и нейромедиаторы, передающие импульсы в нервных клетках.
СООН СООН
1 1
СН2 СН2
1 -СО2 1
СН2 Глутаматде- СН2
1 карбоксилаза 1
СН-NH2 Пиридоксаль- СН2
1 фосфат 1
COOH NH2
Глутамино- γ-аминомасля-
вая кислота ная кислота
Реакции дезаминирования – отщепление от аминокислоты аминогруппы.
У микроорганизмов протекают реакции восстановительного, гидролитического и внутримолекулярного дезаминирования, а в клетках млекопитающих – реакции окислительного дезаминирования.
Лекция №7
ОБМЕН БЕЛКОВ (продолжение)
План
1. Генетический код.
2. Репликация ДНК, транскрипция, трансляция.
3. Мутации генов. Генная инженерия.
Биосинтез белка
В организме существует около 5 миллионов белков. Аминокислотный состав каждого из них, а у белков, имеющих четвертичную структуру, и состав их субъединиц, закодирован в гене ДНК. Место аминокислоты в будущем белке кодируется триплетом (кодоном), состоящим из трех нуклеотидов. Имеется 4 основные разновидности нуклеотидов: дезоксиаденозинмонофосфат (дАМФ), дезоксигуанозинмонофосфат, (дГМФ), дезоксицитидинмонофосфат (дЦМФ) и дезокситимидинмонофосфат (дТМФ). Последний триплет (терминирующий) не кодирует аминокислоту. Он дает сигнал об окончании сборки на поверхности расплетенной молекулы ДНК информационной РНК (иРНК), кодирующей один белок. Одну аминокислоту могут кодировать1, 2, реже - 3 или 4 триплета. Синтезу ДНК, РНК и белков в рибосомах предшествует биосинтез пуриновых или пиримидиновых нуклеотидов.
Биосинтез пуриновых нуклеотидов.
Глюкоза пентозный рибозо-5 →5-фосфорибо- + глутамин амидофосфорибо-
цикл фосфат зилдифосфат зилтрансфераза
Фосфорибо- 8 р е а к ц и й ИМФ 2 реакции АМФ
Зиламин + НАДФ-Н2,, производные фолиевой к-та ГМФ
Регуляция биосинтеза белков
Лекция №8
ОБМЕН БЕЛКОВ (продолжение)
План
1. Образование конечных продуктов белкового обмена: мочевины, мочевой кислоты, креатинина и др.
2. Патология белкового обмена
Образование конечных продуктов белкового обмена.
Окисление глюкозы в тканях
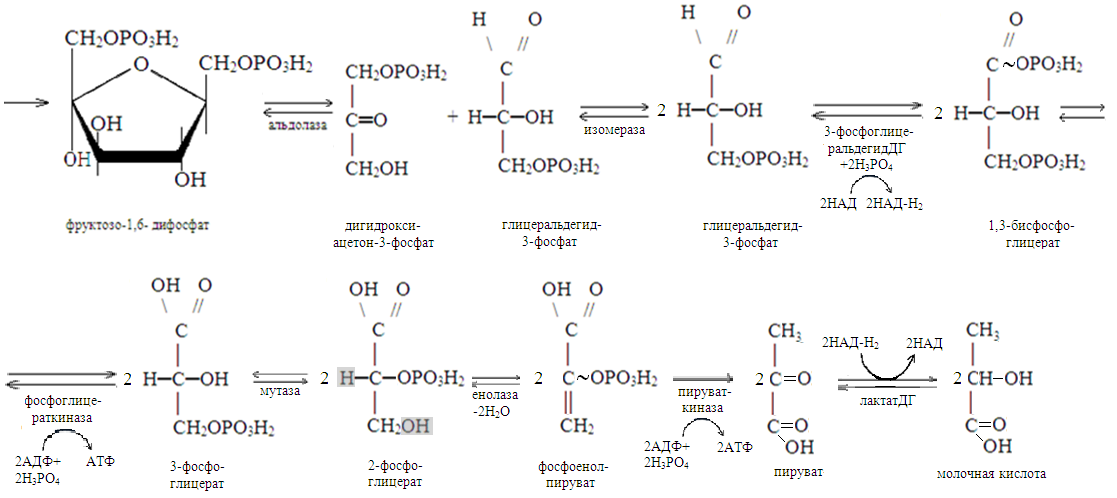
Этот процесс может протекать в отсутствии кислорода (анаэробный гликолиз), когда глюкоза расщепляется до молочной кислоты. В присутствии кислорода (аэробный гликолиз) она окисляется до углекислого газа и воды. Оба процесса, реакции которых совпадают до стадии образования пировиноградной кислоты, необходимы главным образом для генерации АТФ.
Анаэробный гликолиз – источник АТФ у анаэробных микроорганизмов. У аэробных организмов функционирует наряду с аэробным гликолизом, дополняя его.
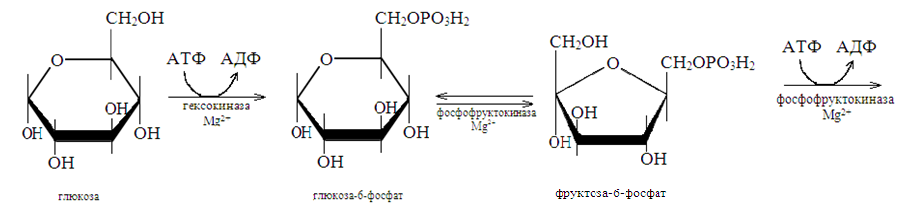
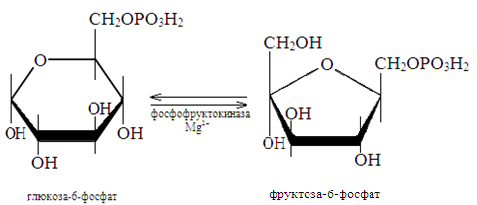
Анаэробное окисление гликогена в мышцах. При усиленном сокращении мышц в миоциты не успевает поступать кислород. В этих условия гликоген, содержащийся в мышцах, расщепляется гликогенфосфорилазой до глюкозо-1-фосфата. Последний превращается в результате фосфоглюкомутазной реакции в глюкозо-6-фосфат, который включается в реакции анаэробного гликолиза. При этом при окислении одного остатка глюкозы генерируется в конечном итоге 3 молекулы АТФ (при образовании глюкозо-1-фосфата АТФ не затрачивается).
Физиологическая роль анаэробного гликолиза.
Этот процесс является источником АТФ в клетках, особенно при недостатке кислорода в тканях. При окислении одной молекулы глюкозы в реакциях субстратного фосфорилирования образуется 4 молекулы АТФ: по 2 молекулы его в фосфоглицераткиназной и пируваткиназной реакциях. 2 молекулы АТФ затрачиваются на начальных этапах гликолиза: в гексокиназной фосфофруктокиназной реакциях. В конечном итоге, в реакциях анаэробного гликолиза из одной молекулы глюкозы генерируется 2 молекулы АТФ. При этом образуются 2 молекулы молочной кислоты, способные закислять ткани. Поэтому молочная кислота в реакциях глюкоконеогенеза обратно превращается в глюкозу.
Лекция №10
ОБМЕН УГЛЕВОДОВ
План
- Аэробный гликолиз.
- Глюконеогенез.
- Пентозный цикл.
- Регуляция и патология углеводного обмена.
Аэробный гликолиз – основной источник АТФ в клетках. До стадии образования 3-фосфоглицеральдегида реакции его совпадают с реакциями анаэробного гликолиза. В дальнейшем, в процессе превращения двух молекул 3-фосфоглицеральдегида в две молекулы 1,3-бисфосфоглицериновой кислоты из двух молекул НАД генерируются две молекулы НАД-Н2. При окислении последних в дыхательной цепи митохондрий вырабатывается 6 молекул АТФ (2Х3). Реакции окисления двух молекул1,3-бисфосфоглицериновой кислоты до двух молекул пировиноградной кислоты также совпадают с соответствующими реакциями анаэробного гликолиза. В дальнейшем все идет по-другому: 2 молекулы пировиноградной кислоты превращаются в 2 молекулы ацетил-КоА:

При этом происходит восстановление двух молекул НАД. При окислении двух молекул НАД-Н2 в дыхательной цепи митохондрий вырабатывается 6 молекул АТФ. Реакцию катализирует пируватдегидрогеназный комплекс, отщепляющий от молекул пирувата углекислый газ (окислительное декарбоксилирование) и присоединяющий к месту отщепления –S-КоА. В состав его входят 5 коферментов: НАД, ФАД, ТиаминДФ, HS-КоА и липоевая кислота. Образующиеся 2 молекула ацетил-КоА в дальнейшем окисляются в цикле Кребса. При этом генерируются 2 молекулы ГТФ, восстанавливаются 6 (2Х3)молекул НАД и 2 молекулы ФАД. При дальнейшем окислении НАД-Н2 и ФАД-Н2 в дыхательной цепи митохондрий генерируются 22 молекулы АТФ.
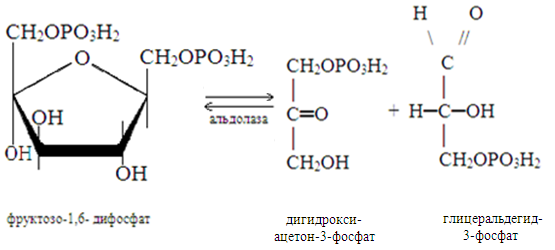
Пентозный цикл
Аэробный гликолиз называют дихотомическим путем окисления углеводов, поскольку он протекает в 2 стадии: окисления глюкозы до пирувата и последнего – до углекислого газа и воды. Существует еще апотомический (прямой) путь окисления глюкозы – пентозный цикл или гексозомонофосфатный шунт. В нем окисляется около 2% глюкозы (в печени – 25%). Этот процесс условно делят на 2 части: реакции окислительной и пластической ветвей пентозного цикла.
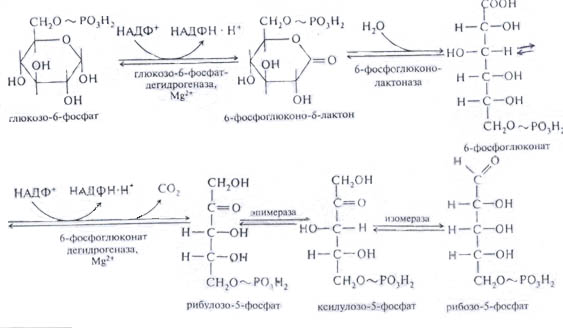

Итог пентозного цикла.
В реакции его вступают 6 молекул глюкозо-6-фосфата. Одна из них полность расщепляется до 6 молекул углекислого газа, 12 ионов водорода, восстанавливающих 6 молекул НАДФ. Остальные молекулы глюкозо-6-фосфата окисляются до 6 молекул пентозо-3-фосфатов: рибозо-5-фосфата, рибулозо-5-фосфата и ксилулозо-3-фосфата. В результате взаимодействия 6 молекул пентозо-3-фосфатов между собой образуется 5 молекул глюкозо-6-фосфата.
Лекция №11
ОБМЕН ЛИПИДОВ
План
1. Липиды: структура, классификация, биологическая роль.
2. Гидролиз липидов в органах пищеварительной системы, транспорт их кровью.
3. Метаболизм липидов: окисление глицерола и жирных кислот.
.
Липиды – природные органические соединения с различной
структурой, не растворимые в воде, но растворимые в органических растворителях ( ацетоне, хлороформе и т.д.).
Классификация липидов
1. Ацилглицеролы (нейтральные жиры).
2. Фосфоглицериды.
3. Сфинголипиды: сфингомиэлины, цереброзиды и ганглиозиды.
4. Стериды.
5. Воска.
Сфинголипиды содержат вместо глицерина остаток ненасыщенного аминоспирта сфингозина: СН3 -(СН2)12-СН=СН-CH- СН-СН2-ОН.
! !
OH NH2
Различают их три подкласса: сфингомиэлины, цереброзиды и ганглиозиды.
Сфингомиэлины входят в состав мембран растительных и животных клеток, особенно клеток нервной ткани. Содержат по одному остатку молекул сфингозина, жирной и фосфорной кислот и холина:
СН3 -(СН2)12-СН=СН-CH- СН-СН2-О-РО3-О - СН2 -СН2-N+(СН3)3
! !
OH NH -СО-жирная кислота
Биологическая роль липидов
1. Ацилглицеролы являются источником энергии в организме. При окислении 1 г их выделяется 9,1 ккал.
2. Ацилглиценролы жировых депо являются не только запасным энергетическим материалом, но и защищают тело от переохлаждения, травм, фиксируют органы.
3. Фосфоглицериды входят в состав транспортных и структурных липопротеинов. Из последних построены мембранные структуры клеток.
4. Сфинголипиды входят в состав нервной ткани.
5. Из стеридов синтезируются холестерин, гормоны половых желез коркового слоя надпочечников и желчные кислоты.
6. Воска образуют верхний слой растений, пчелиные соты.
Лекция №12
ОБМЕН ЛИПИДОВ (продолжение)
План
1. Биосинтез глицерола и жирных кислот.
2. Биосинтез ацилглицеролов, фосфоглицеридов и холестерина.
3. Патология липидного обмена.
Биосинтез жирных кислот (путь Linean)
Этот процесс протекает в цитоплазме клеток. Суть его – постепенное удлинение молекулы жирной кислоты на 2 углеродных атома за счет молекулы ацетил-КоА и четырех ионов водорода, поставляемых НАДФ-Н2. на первом этапе происходит присоединение к ацетил-КоА углекислого газа с участием биотин-фермента.
рибозо-5-фосфат и НАДФ-Н2, генерируемые из глюкозы в реакциях пентозного цикла, а также кобаламин и фолиевая кислота, вырабатываемые микрофлорой рубца.
рибозо-5-фосфат и НАДФ-Н2, генерируемые из глюкозы в реакциях пентозного цикла, а также кобаламин и фолиевая кислота, вырабатываемые микрофлорой рубца.
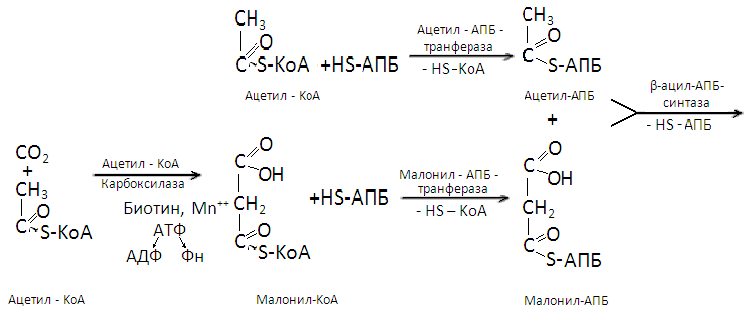
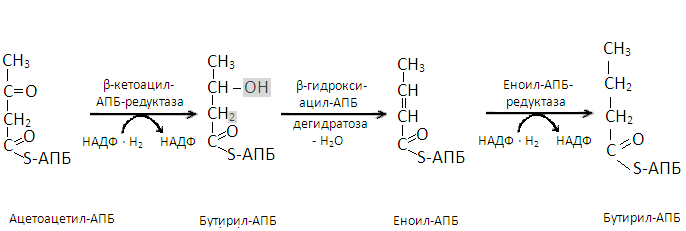
В образовавшемся малонил-КоА радикал –S-КоА заменяется на радикал ацилпереносящего белка (-АПБ). Параллельно радикал –S-КоА заменяется на радикал -АПБ в молекуле ацетил-КоА. Затем малонил-АПБ, отщепляя углекислый газ, соединяется с ацетил-АПБ и образуется ацетоацетил-АПБ. Последний восстанавливается ионами водорода, отщепляемыми от НАДФ-Н2, в β-гидроксибутирил-АПБ. После отщепления от этого вещества молекулы воды образуется кротонил-АПБ, восстанавливающийся в дальнейшем ионами водорода НАДФ-Н2 до бутирил-АПБ. Этой реакцией завершается первый цикл биосинтеза жирной кислоты.
Второй цикл начинается с соединения β-гидроксибутирил-АПБ с ацетил-АПБ с отщеплением молекулы углекислого газа. Образовавшийся капронил-АПБ таким же образом, как и ацетоацетил-АПБ, цикл за циклом, превращается в ацил-АПБ синтезируемой жирной кислоты с последующим отщеплением от последнегорадикала АПБ.
Количество молекул АТФ, затрачиваемое на биосинтез одной молекулы жирной кислоты (ХАТФ) рассчитывают про формуле: ХАТФ = n/2 – 1, где где n – число углеродных атомов, включая группу –СООН, а количество НАДФ-Н2 (ХНАДФ-Н) – по формуле: ХНАДФ-Н = n – 2.
Биосинтез глицерол-3-фосфата происходит из 3-фосфоглицеральдегида, образовавшегося из глюкозы в реакциях гликолиза:
Биосинтез ацилглцеролов.
На первом этапе его глицерол-3-фосфат взаимодействует с двумя активированными молекулами жирных кислот (например, стеарил-КоА)с образованием фосфатидной кислоты. От последней отщепляется остаток фосфорной кислоты с последующим присоединением на его место третьего радикала жирной кислоты.
СН2 –ОН СН2 –О-СО- С17Н35
1 1
НО-СН + 2 Стеарил-КоА Ацил-КоА- С17Н35–СО-О-СН Фосфатидиофосфатаза
1 трансфераза 1 + НОН
СН2-О-РО3Н2 СН2-О-РО3Н2 -Н3РО4
3-фосфоглицерол Фосфатидная кислота
СН2 -О-СО-С17Н35 СН2 -О-СО-С17Н35
1 1
С17Н35 –CO-О-СН + Стеарил-КоА Ацил-КоА- С17Н35 –CO-О-СН
1 трансфераза 1
СН2-ОН СН2 -О-СО-С17Н35
Дистеарин Тристеарин
Биосинтез фосфоглицеридов.
Вначале, как описано выше, синтезируется фосфатидная кислота, в которой к второму углеродному атому глицерола присоединен остаток арахидоновой кислоты.После этого активируется молекула холина:
НО-СН2 -СН2–N+ ≡(CH3)3 + АТФ Холинкиназа Н2О3Р-О-СН2 -СН2–N+≡(CH3)3
Холин -АДФ Фосфохолин
Фосфохолин взаимодействует с цитидинтрифосфатом (ЦТФ):
Н2О3Р-О-СН2 -СН2–N+≡(CH3)3 + ЦТФ Трансфераза Цитидилдифосфохолин
-Н4Р2О1
СН2 –О-СО- С17Н35
1
С17Н35–СО-О-СН + Цитидилдифосфохолин Трансфераза
1
СН2-О-РО3Н2
Фосфатидная кислота
СН2 –О-СО- С17Н35
1
С17Н35–СО-О-СН
1
СН2-О-РО3Н -О-СН2 -СН2–N+ ≡(CH3)3
Фосфатидилхолин.
Биосинтез холестерола.
На первом этапе этого процесса из двух молекул ацетил-КоА в результате реакции, катализируемой тиолазой, образуется ацетоацетил-КоА. После присоединения к последнему третьей молекулы ацетил-КоА, катализиремого β-гидрокси-β-метил-глутатил-КоА-синтазой, образуется β-гидрокси-β-метил-глутатил-КоА. (ГМГ-КоА). Этот фермент способны ингибировать некоторые лекарственные средства, применяющиеся для лечения больных атеросклерозом, в частности зокор. ГМГ-КоА в дальнейшем восстанавливается ионами водорода, отщепляемыми от НАДФ-Н2 в результате реакции, катализируемой ГМФ-КоА-редуктазой, до мевалоната. Последний в результате шести последовательно протекающих реакций превращается в сквален, углеводород с длинной открытой цепью:
Березов- 312 стр.
В дальнейшем сквален в результате реакции, катализируемой скваленоксидоциклазой, циклизируется в ланостерин. Последний через несколько последовательных реакций превращается в холестерин.
Регуляции обмена веществ
Условия внешней среды постоянно изменяются и клетки вынуждены приспосабливать к ним свой метаболизм. Это достигается путем регулирования активности ферментов с последующим изменением скорости биохимических реакций, которое происходит на уровне клетки или целостного организма. На уровне клетки это может осуществляться путем изменения проницаемости их мембранных структур, концентрации коферментов, субстратов, продуктов собственной или других реакций, эффекторов (активаторов или ингибиторов) аллостерических энзимов, количества ферментов экспрессией или репрессией их биосинтеза.
На уровне целостного организма метаболизм клеток регулируется эффекторами, вырабатываемые специальными клетками или структурами, несущими контрольные функции. Главными из них являются нейромедиаторы, факторы роста, цитокины и гормоны. Первые из них участвуют в передаче импульса через синапс от нейрона к нейрону или от нейрона также через синапс на рабочую клетку (мышечную, железистую и др.). Протекает этот процесс быстро, но не может охватить все клетки организма. Поэтому нейроны воздействуют на клетки, вырабатывающие специальные информационные молекулы, при помощи которых различные структуры организма поддерживают связь друг с другом. Регуляторами метаболизма являются также факторы роста и цитокины. Последние генерируются клетками, расположенными, в отличие от желез внутренней секреции, диффузно в различных тканях, а не в виде отдельных органов. Могут действовать на свою клетку, расположенные рядом или отдаленные клетки.
Эндокринная система
Гормоны – группа веществ с различной структурой и физико-химическими свойствами, вырабатываемые железами внутренней секреции, отдельными органами, состоящими из группы клеток. Из них гормоны током крови могут доставляться к любым клеткам, но оказывают влияние лишь на некоторые из них – клетки-мишени. Особенности их действия:
1) запуск или прекращение выработки гормонов эндокринными железами регулируется импульсами из центральной нервной системы;
2) работают на расстоянии от места выработки (дистантно);
3) действуют в очень низких концентрациях – 10-9- 10-12 моль/л.
На мозговой слой надпочечников, заднюю доли гипофиза, поджелудочную и паращитовидные железы импульс поступает непосредственно из коры головного мозга. Выработка гормонов в других железах регулируется по более сложному механизму. Нервный импульс поступает в гипоталамус, усиливает в нем выработку релизинг-гормонов, поступающих через портальный сосуд в переднюю долю гипофиза (аденогипофиз) и усиливающих (либерины) или тормозящих (статины) выработку в нем ряда тропных гормонов. Последние током крови доставляются в рабочие эндокринные железы. Они вырабатывают гормоны, которые кровью доставляются к клеткам-мишеням.
Лекция №16
Витамины
План
1. Классификация витаминов.
2. Гиповитаминозы
3. Жирорастворимые витамины.
4. Водорастворимые витамины.
5. Витаминоподобные вещества.
Витамины – низкомолекулярные органические соединения, необходимые для жизнедеятельности организма, но не синтезирующиеся в нем или синтезирующиеся в недостаточных количествах и поэтому поступающие в малых количествах с пищей или от микроорганизмов, базирующихся в органах пищеварительной системы.
Еще в 1880 г. Н.И. Лунин доказал, что, кроме белков, углеводов, липидов, воды и минеральных веществ, организму необходимы дополнительные вещества. К. Функ выделил из рисовых отрубей одно из таких веществ, витамин В1, содержащий аминогруппу. Поэтому он предложил называть эти вещества витаминами (vita – жизнь). Потом оказалось, что не все витамины содержат аминогруппу.
Классификация витаминов. Из делят на 2 группы: жиро- и водорастворимые. У каждого витамина имеется 3 названия: буквенное, клиническое и химическое. Существуют еще ряд витаминоподобных веществ, не подходящих по какому-то из признаков к понятию «витамины». При отсутствии поступления витаминов развиваются авитаминозы, при сниженном поступлении – гиповитаминозы. При чрезмерном поступлении некоторых витамино (А, Д и др.) возможны гипервитаминозы.
Причины гиповитаминозов.
А. Экзогенныегиповитаминозы развиваются при:
1) отсутствии определенных продуктов питания: свежих овощей, мяса, жиров и т.д.;
2) потери витаминов при хранении, обработке продуктов, приготовлении пищи и т.д.
Б. Эндогенныегиповитаминозы развиваются при:
1) недостаточно эффективном поступлении витаминов из кишечника при воспалении его, а также из-за нарушения поступление в него желчных кислот при патологии печени и перекрытии желчевыводящих путей, приводящего к снижению гидролиза и всасывания липидов с растворенными в них витаминами;
2) гибели микроорганизмов пищеварительного тракта при кормлении высоко концентратными кормами, лечении антибиотиками и от других причин;
3) нарушении транспорта витаминов кровью при снижении содержания в ней некоторых белков;
4) нарушении превращения провитаминов в витамины при недостаточном ультрафиолетовом облучении, отсутствии ферментов, осуществляющих это превращение;
5) поступлении в организм антивитаминов.
Жирорастворимые витамины.
Витамин А (антиксерофтальмический); ретинол.
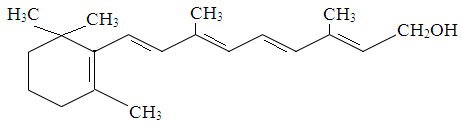
Биологическая роль витамина А:
1. Является компонентом биологических мембран, способствует биосинтезу их углевод-белковых комплексов, стабилизирует структуру клеток, особенно эпителиальных, поддерживает барьерную функцию их.
2. Обладает антиоксидантными свойствами.
3. Регулирует рост, дифференциацию тканей, развитие организма в целом, особенно организма молодняка.
4. Поддерживает функцию иммунной системы.
5. Входит в состав родопсина (зрительного пурпура) колбочек и палочек сетчатки глаза. Под действием света родопсин расщепляется на белок опсин и ретинальдегид (производное витамина А), что приводит к генерации светового импульса.
Суточная потребность (для человека) – 2,3 мг.
Продукты, богатые витамином А: рыбий жир, печень, молочные продукты, яичный желток и др. Каротин (предшественник витамина А, состоящий из двух остатков его) содержится в моркови и других коренеплодах, зеленых листьях, сочных кормах и т.д. В организме животного каротин расщепляется до витамина А каротиназой.
Проявления гиповитаминоза А:
Первые проявления его – ухудшение зрения в темноте (куриная слепота). Замедляется рост и развитие организма. Снижается иммунитет. Из-за нарушения барьерной функции эпителия поражаются слезные протоки, слеза не проходит к роговице глаза и она размягчается (ксерофтальмия). Поражается также эпителий дыхательных, мочеполовых путей, кожи и других структур, что приводит к их воспалению.
Витамины группы Д (антирахитические); кальциферолы (эргокальциферол и холекальциферол) Предшественником первого из них является эргостерин, который после облучения ультрафиолетовыми лучами превращается в эргокальциферол (витамин Д2). В коже содержится второй провитамин Д, который также после облучения ультрафиолетовыми лучами превращается в холекальциферол (витамин Д3). Обо витамина поступают в печень, где у них 25-й атом углерода подвергается гидроксилированию под действием 25-гидроксилазы, а затем – в почки. В последней под действием 1-гидроксилазы гидроксилируется еще и первый атом углерода и образуются 1,25-дигидрокальциферолы, обладающие биологической активностью. При недостаточной активности 25- и 1- гидроксилазы развивается Д-резистентный рахит.
Суточная потребность (у человека)- 10-25 мкг.
Биологическая роль.
1. Являются антиоксидантами (предотвращают образование перекисей в мембранных структурах клетки). Встраиваясь в мембраны клетки и ее органелл, токоферолы своей гидрофобной боковой цепью прикрывают двойные связи ненасыщенных жирных кислот фосфолипидов мембран от активных форм кислорода. При этом последние инактивируются, реагируя с хроманоловым циклом токоферола. Образовавшаяся окисленная форма витамина Е восстанавливается аскорбиновой кислотой. Образовавшийся при этом дегидроаскорбат обратно восстанавливается в аскорбат глутатионом, трипертидом состоящим из глутаминовой кислоты, цистеина и глицина. Донором ионов водорода являютя SH-группы цистеина.
2. Участвуют в окислительно-восстановительных процессах, протекающих в дыхательной цепи митохондрий, во время превращения креатина в креатинфосфат, в генах в процессе транскрипции и др.
Благодаря этим свойствам, токоферолы поддерживают структуру и функцию клеток различных органов, но особенно органов репродуктивной системы, весьма чувствительных к повреждению. Они поддерживают сперматогенез, образование яйцеклетки, способствуют ее оплодотворению, развитию беременности, ее течению. Поэтому витамины Е называют антистерильными.
Суточная потребность (у человека) - 5 мг.
Продукты, богатые витаминами Е: семена облепихи, злаков, сливочное и растительные масла, печень, мясо, капуста, сочные корма и т.д.
Проявления гиповитаминоза
У самцов развиваются дегенеративные изменения в семенниках, нарушается сперматогенез, вырабатываются сперматозоиды, не способные оплодотворить клетку. В тяжелых случаях развивается атрофия семенников с последующей деградацией половых признаков.
У самок нарушается образование яйцеклетки. Если оплодотворение ее, эмбриогенез происходят, то плод может не вынашиваться, появляются выкидыши.
Из-за нарушения окислительно-восстановительных процессов в мышечных волокнах наступает дегенерация миофибрилл. Из-за неэффективного превращения креатина в креатинфосфат он поступает из мышечных волокон в кровь (гиперкреатинемия) и появляется в моче (кретинурия). Это наблюдается при мышечнойц дистрофии у лошадей и крупного рогатого скота.
Витамины группы К (антигеморрагические): филлохинон (витамин К1) и менахинон (витамин К2). В основе структуры их цикл 1,4-нафтохинона и боковая изопреноавя цепь.
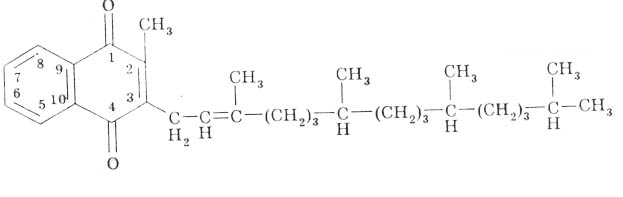
Биологическая роль
Участвуют в процессах свертывания крови, являясь коферментами энзимов, превращающих неактивные факторы свертывания крови в активные: протромбина в тромбин, проконвертина – в конвертин, фибриногена – в фибрин. В процессе активации этих факторов происходит превращение содержащейся в их составе глутаминовой кислоты в γ-карбоксиглутаминовую кислоту.
Суточная потребность (у человека) - 10-15 мг.
Продукты, богатые витаминами К: крапива, печень, капуста, коренеплоды, сочные корма и др. Образуют витамины К микроорганизмы пищеварительного тракта.
Проявления гиповитаминоза К – желудочные, кишечные, маточные и другие кровотечения.
Лекция №17
Витамины
План
.
1. Водорастворимые витамины.
2. Витаминоподобные вещества.
Водорастворимые витамины
Витамин В1 (антиневритный); тиамин содержит в своем составе пиримидиновый и тиозоловый циклы. Является предшественником в биосинтезе тиаминдифосфата (ТДФ): Тиамин + АТФТиаминкиназа ТДФ + АМФ.
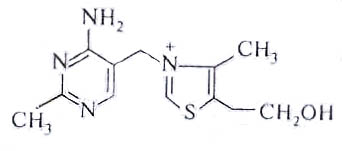
Биологическая роль
ТДФ является одним из пяти коферментов, входящих в состав полиферментных комплексов, осуществляющий одновременное отщепление ионов водорода и углекислого газа от пировиноградной кислоты (пируватдегидрогеназа; реакция аэробного гликолиза) и α-кетоглутаровой кислоты (α-кетоглутаратдегидрогеназа; реакция цикла Кребса). ТДФ также является коферментом транскетолазы.
Суточная потребность (у человека) - 1,5- 2 мг.
Продукты, богатые витаминами В1: зерно злаков, гречихи, бобовые культуры, печень, мясо и др.
Проявления гиповитаминоза В1 :
1. Торможение пируватдегидрогеназной реакции, ведущее к накоплению в нервной ткани пировиноградной кислоты. Она повреждает нервные стволы, развивается их воспалении - полиневриты. Снижается также выработка ацетил-КоА, что приводит к дефициту энергетического и пластического материала;
2. Недостатку последнего способствует и торможение активности транскетолазы, ключевого фермента окислительной ветви пентозного цикла;
3. Возможно развитие тиамин-зависимой анемии, поскольку ТДФ участвует в кроветворении;
Витамин В2 (фактор роста); рибофлавин имеет в основе своей структуры
изоаллоксаззиновый цикл. Является предшественником в биосинтезе коферментов флавинмононуклеотида (ФМН) и флавинадениндинуклеотида (ФАД).
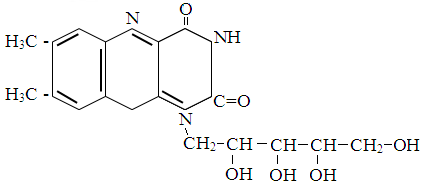
Биологическая роль:
1. ФМН является коферментом одного из энзимов дыхательной цепи митохондрий.
2. ФАД, как и ТДФ, является одним из пяти коферментов, входящих в состав пируватдегидрогеназного и α-кетоглутаратдегидрогеназного полиферментных комплексов, осуществляющий одновременное отщепление ионов водорода и углекислого газа соответственно от пировиноградной (реакция аэробного гликолиза) и α-кетоглутаровой кислот (реакция цикла Кребса).
3. ФАД является коферментом ацил-КоА-дегидрогеназы (фермент β-окисления жирных кислот), глутатионредуктазы, восстанавливающей глутатиондисульфид, и других энзимов.
Суточная потребность (у человека) - 1,7 мг.
Продукты, богатые витамином В2: зерна злаков, яйца, печень, мясо, овощи, сочные корма и др.
Проявления гиповитаминоза В2:
1. Торможение реакций гликолиза, цикла Кребса, функции дыхательной цепи митохондрий приводит к снижению эффективности выработки АТФ, процессов биосинтеза с последующим нарушением роста и развития молодняка, снижению резистентности организма к патогенным факторам.
2. Из-за недостатка пластического материала нередко нарушается биосинтез гемоглобина, развивается малокровие.
3. Нередко развиваются васкуляризация, воспаление глазного яблока, роговой оболочки (кератит), помутнение хрусталика (катаракта).
Витамин В3 (антидерматитный); пантотеновая кислота состоит из 2,4-дигидрокси-3,3-диметилмасляной кислоты и β-аланина, соединенных между собой через пептидную связь. Является предшественником в биосинтезе кофермента HS-коэнзима А (КоА).
СН3 ОН
! !
НО - СН2 - С----СН – СО – NH - СН2 -СН2 - COOH
!
СН3
2,4-диокси-3,3-диметил- β - а л а н и н
масляная кислота
П а н т о т е н о в а я к и с л о т а
Биологическая роль
1. КоА, как и ФАД и ТДФ, является одним из пяти коферментов, входящих в состав пируватдегидрогеназного и α-кетоглутаратдегидрогеназного полиферментных комплексов, осуществляющий одновременное отщепление ионов водорода и углекислого газа соответственно от пировиноградной (реакция аэробного гликолиза) и α-кетоглутаровой кислот (реакция цикла Кребса).
2. Будучи компонентом активированных жирных и других кислот (ацил-КоА), КоА участвует в реакциях их окисления.
3. В составе ацетил-КоА и других активированных органических кислот КоА принимает участие в биосинтезе многих веществ (жирных кислот, ацилглицеролов, холестерола, стероидных гормонов, гемма и др.).
Суточная потребность (у человека) - 3-5 мг.
Продукты, богатые витамином В3: печень, дрожжи и многие другие пищевые продукты.
Проявления гиповитаминоза В3:
1. Воспаление кожных покровов (дерматит) и выпадение шерсти
(аллопеция);
2. Поражение сердца, почек, желудка, надпочечников и других
внутренних органов;
3. Повреждение тканей головного мозга, выражающееся в нарушении
координации движений.
Витамин В5 (РР; антипеллагрический); никотиновая кислота и никотинамид имеет в своей основе цикл пиридина. Является предшественником в биосинтезе коферментов НАД и НАДФ.
Биологическая роль
НАД и НАДФ являются коферментами более чем 50 дегидрогеназ гликолиза, β-окисления жирных кислот, окислительного дезаминирования глутамата, цикла Кребса, дыхательной цепи митохондрий, пентозного цикла и др.
Суточная потребность (у человека) - 18 мг.
Продукты, богатые витамином В2: печень, мясо, зерна злаков, картофель, корнеплоды, сочные корма, дрожжи и другие пищевые продукты.
Проявление гиповитаминоза В5 – пеллагра. Признаки ее:
1) Воспаление в форме бабочки на открытых участках кожных покровов (дерматит);
2) Поражение тканей пищеварительной системы: гастрит со сниженной кислотностью, поражение кишечника, кровавый понос (диарея);
3) Повреждение нервных клеток и нарушение функции головного мозга.
Витамин В6 (антидерматитный); пиридоксин, пиридоксамин и пиридоксаль имеет в своей основе также цикл пиридина. Является предшественником в биосинтезе кофермента пиридоксальфосфат (ПФ).
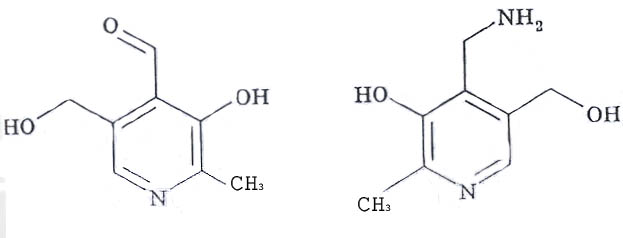
Биологическая роль:
ПФ является коферментом энзимов метаболизма аминокислот: аминотрансфераз (аспартатаминотрансферазы, аланинаминотрансферазы и др.), декарбоксилаз ( глутаматдекарбоксилазы, гистидиндекарбоксилазы и др.). Велика его роль в метаболизме серосодержащих аминокислот, синтезе гемма из аминолевулиновой кислоты, пиридоксина из триптофана и др.
Суточная потребность (у человека) - 2 мг.
Продукты, богатые витамином В6: печень, зерна злаков, дрожжи и др.
Проявление гиповитаминоза В5:
1) поражение эпителиальной ткани: пеллагроподобный дерматиты, воспаление слизистых оболочек глаз, полости рта, глотки и др.;
2) нарушение функции центральной нервной системы – эпилептоподобные припадки;
3) возможно появление в моче промежуточных продуктов обмена серосодержащих аминокислот: гомоцистеина и цистатиона.
Витамин В12 (антианемический); кобаламин содержит в своем составе кобальт, соединенный с атомами азота четырех пиррольных колец, остатки рибозы, фосфорной кислоты и другие радикалы. Кобаламин является предшественником в биосинтезе двух коферментов: метилкобаламина (СНз-витамин В12) и дезоксиаденозилкобаламина (дезоксиаденозил- витамин В12).
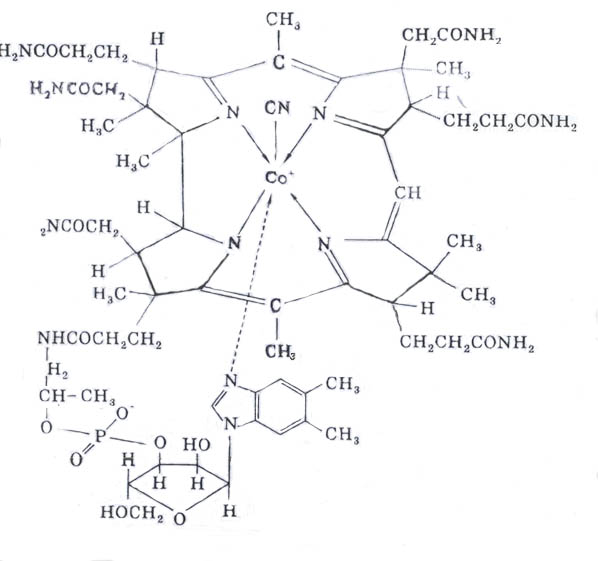
Биологическая роль витамина В12
1. Метилкобаламин является коферментом энзимов, катализирующих реакции переноса групп –СН3 и других одноуглеродных радикалов от одного вещества к другому, например от метил-тетрагидрофолиевой кислоты (СН3-ТГФК) к гомоцистеину (рекция биосинтеза метионина):
СН3-ТГФК + Гомоцистеин Тетрагидроптероилглутамат- Метионин + ТГФК
метилтрансфераза
Кобаламин
2. Дезоксиаденозилкобаламин входит в состав ферментов, катализирующих реакции изомеризации. Так при метаболизме аминокислот валина, изолейцина и треонина, а также пропионовой кислоты, образовавшейся в преджелудках жвачных при расщеплении микроорганизмами клетчатки, образуется одинаковый конечный продукт- метилмалонил-КоА. Последний вступает в реакцию изомеризации, катализируемую S-метилмалонил-КоА-мутазой, коферментом которой является дезоксиаденозилкобаламин:
Метилмалонил-КоА S-метилмалонил-КоА-мутаза Сукцинил-КоА
Дезоксиаденозилкобаламин
3. Производные кобаламина способствуют биосинтезу нуклеиновых кислот, участвуя в реакциях образования дезоксирибозы, тиминовых нуклеотидов и других веществ, особенно в кроветворных органах.
Суточная потребность (у человека) - 3 мкг. У жвачных она удовлетворяется за счет деятельности микрофлоры пищеварительного тракта.
Продукты, богатые витамином В12: говяжья печень, мясо, рыба, яйца. Для того, чтоб всосаться в кишечнике, кобаламин должен вступить в комплекс с гастромукопротеином, вырабатываемым в желудке. У жвачных полностью, а у других животных - частично потребность в витамине витамин В12 удовлетворяется за счет деятельности микрофлоры пищеварительного тракта.
Проявление гиповитаминоза В12:
1. При высоко концентратном кормлении жвачных животных нарушается деятельность микрофлоры, вырабатывающей витамина В12, что приводит не только к торможению превращения метилмалонил-КоА в сукцинил-КоА с последующим развитием кетоацидоза, но и к дефициту метионина и других липотропных веществ, способствующему накоплению в печени ацилглицеролов..
2. При патологии желудка нарушается выработка гастромукопротеина, что приводит к нарушению всасывания витамина В12, последующим торможением биосинтеза нуклеиновых кислот в кроветворных органах и развитием малокровия.
3. Накопление в тканях головного мозга метилмалонил-КоА приводит к вовлечению его вместо малонил-КоА в реакции биосинтеза жирных кислот. Это приводит к образованию жирных кислот с разветвленной цепью, способствующему нарушению структуры миэлиновых оболочек нервных волокон.
Витамин Вс (антианемический); фолиевая кислота содержит в своем составе птеридиновый цикл, связанный с п-аминобензойной и глутаминовой кислотами.

Биологическая роль:
Фолиевая кислота является предшественницей в биосинтезе коферментов трансфераз, участвующих в переносе метильной (–СН3), метиленовой (-СН2-), метенильной (-СН=), формильной (-СОН) и формиминовых групп
(-СН=NH). Данные энзимы участвуют в биосинтезе пуриновых нуклеотидов, холина, аминокислот серина, метионина, глицина и других веществ.
Суточная потребность (у человека) – 0,1 мг.
Продукты, богатые витамином В12: листья растений, дрожжи, люцерновая мука, соевый шрот, картофель и др.
Гиповитаминоз Вс развивается при дефиците фолиевой кислоты в кормах, нарушении всасывания в кишечнике при патологии его. Проявляется он в малокровии, сниженном содержание лейкоцитов в крови, нарушении роста, развития, снижении продуктивности животного. В тяжелых случаях возможны паралич шеи и конечностей.
Витамин С (антицинготный); аскорбиновая кислота. Является витамином лишь для человека, африканских обезьян и морских свинок. У других животных способна синтезироваться, но ее может недоставать при патологических состояниях. Структурно аскорбиновая кислота представляет собой производное спирта сорбита - лактон 2,3-диенол-гулоновой кислоты.
отдает два иона водорода, связанные со вторым и третьим углеродными атомами, превращаясь в дегидроаскорбат.
Биологическая роль:аскорбиновой кислоты
1. Является антиоксидантом. В водной фазе клеток взаимодействует с активными кислородными метаболитами, инактивируя их. В липидной фазе клеток восстанавливает глутатиондисульфид, образовавшийся в реакции восстановления токоферилхинона глутатионом или при взаимодействии последнего с активными кислородными метаболитами.
2. Поддерживает функцию дыхательной цепи митохондрий, передавая ионы водорода цитохромам или молекуле кислорода.
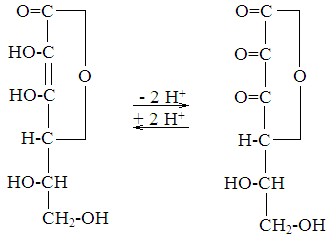
Аскорбиновая Дегидроаскорбино-
кислота ваяя кислота
3. Способствует созреванию соединительной ткани, участвуя в реакциях гидроксилирования пролина в оксипролин и лизина в оксилизин.
4. Участвует в других реакциях гидроксилирования, сопряженных с катаболизмом тирозина до тироксина, меланина, дофамина, норадреналина и адреналина, биосинтезом гликопротеинов межклеточного вещества соединительной ткани, стероидных гормонов, желчных кислот и других веществ.
Суточная потребность (у человека) – 100 мг.
Продукты, богатые витамином В12: фрукты, ягоды, свежие овощи, шиповник и др.
Биологическая роль холина.
1. Входит в состав фосфатидилхолина (лецитина), компонента мембранных структур клетки. Участвуя в биосинтезе этого фосфоглицерида, холин способствует выходу из печени ацилглицеролов, предотвращая жировую инфильтрацию этого органа.
2. В качестве донора метильных групп участвует в биосинтезе метионина, адреналина, креатина, и других веществ.
3. Входит в состав ацетилхолина, передающего импульс от нервной клетки.
Источники холина в клетках.
Частично животные получают холин с животной и растительной пищей, а частично - за счет эндогенного синтеза: декарбоксилированием аминокислоты серин с последующим метилированием образовавшегося этаноламина. Донорами метильных групп могут быть метионие, фолиевая кислота и витамин В12.
Проявление недостатка холина в организме: жировая инфильтрация печени, геморрагическая дистрофия почек, нарушение свертывания крови вследствие недостаточно эффективного синтеза акцелерина и др.
Инозитол (инозит) является по своей структуре циклическим шестичленным спиртом.
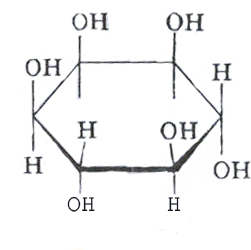
Биологическая роль:
1. Является компонентом фосфоглицерида фосфатидилинозитола.. От последнего в результате реакции, катализируемой фосфолипазой Д, отщепляется инозитол-1,4,5-трифосфат, являющийся вторичным посредником при воздействие на клетки инсулина, паратгормона, тиреокальцитонина и других биологически активных веществ;
2. Обладает липотропным эффектом, предотвращает жировую инфильтрацию печени;
3. регулирует перестальтику кишечника, осмотическое давление в сперматозоидах, окисление жирных кислот, активность амилазы и др.
Продукты, богатые инозитолом: зародыши пшеницы, апельсины, зеленый горошек. Много его и в продуктах животного происхождения: печени, мясе, молоке.
Проявление недостатка инозитола наиболее выражено у мышей и крыс. Оно выражается в остановке роста и развития, жировой инфильтрации печени с отложением в нее холестерина.
Коэнзим Q (убихинон) похимической структуре представляет собой 2,3-диметокси-5-метил-1,4-бензохинон с изопреновой цепью в шестом положении.
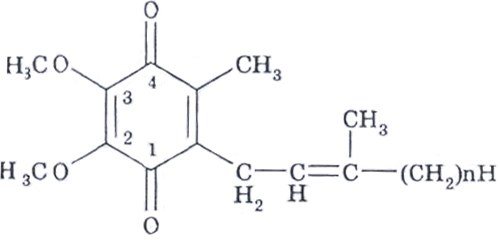
Биологическая роль убихинона: является обязательным компонентом дыхательной цепи митохондрий, осуществляя перенос электронов от мембранных дегидрогеназ на цитохромы.
Структура белков.
Белки - органические соединения, состоящие из аминокислот, связанных между собой пептидной связью. Аминокислоты - кабоновые кислоты, содержащие аминную и карбоксильную групп, находящиеся у одного и того же углеродного атома.В состав белков входят 22 аминокислоты, которые по свойствам боковой цепи делят на 4 группы: гидрофобные,
гидрофильные неионные, гидрофильные с отрицательным зарядом и гидрофильные с положительным зарядом.
I . гидрофобные аминокислоты.
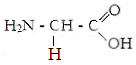
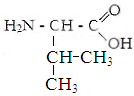


Глицин. Аланин Валин Лейцин

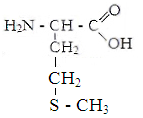


Изолейцин Метионин Цистин Фенилаланин


Триптофан Пролин
II . гидрофильные неионные аминокислоты.




Серин Треонин Аспарагин Глутамин

Оксипролин
Дата: 2019-02-02, просмотров: 455.