Кафедра химии
ТЕТРАДЬ
Для лабораторных работ
По органической химии
для студентов, обучающихся по специальности «Фармация»
 Студента
Студента 
 № группы
№ группы
Тверь.
2017 уч. год
Тетрадь для лабораторных работ по органической химии рекомендуется использовать студентам 2 курса фармацевтического факультета при проведении практических занятий. Составлено на основании Программы по дисциплине «Органическая химия» для студентов фармацевтических вузов (факультетов), утвержденной руководителем Департамента медицинских образовательных учреждений и кадровой политики Минздрава России Н.Н.Володиным (Москва, 2000г.), и Рабочей программы, утвержденной на кафедральном совещании коллективом кафедры химии ТГМУ.
Составители:
д.б.н., профессор Г.М.Зубарева
ассистент Л.Р. Волкова
Рецензент:
Зав.кафедрой биологии д.б.н.,профессор М.Б.Петрова
Тетрадь для лабораторных работ обсуждена на заседании кафедры химии Тверского государственного медицинского университета.
Тетрадь для лабораторных работ одобрена советом ЦМК «Естественнонаучных дисциплин» ТГМУ.
Утверждено решением
ЦКМС ТГМУ
Профессор М.Н.Калинкин
2017 г.
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ И МЕТОДЫ ОКАЗАНИЯ ПЕРВОЙ ПОМОЩИ ПРИ РАБОТЕ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ
НЕОБХОДИМО:
♦ работать в хлопчатобумажном халате;
♦ личные вещи хранить в специально отведенном месте;
♦ при попадании химических реактивов на стол, пол и другие предметы
сообщить преподавателю и произвести уборку;
♦ опыты с едкими, ядовитыми или сильно пахнущими веществами
разрешается проводить только в вытяжном шкафу при наличии включенной вентиляции;
♦ при разбавлении концентрированных кислот необходимо соблюдать порядок смешивания: кислоту постепенно вливать в воду;
♦ после завершения работы необходимо отключить газ, воду, вытяжные
шкафы и электроэнергию;
♦ при порезе стеклом: вынуть кусочки стекла, если они попали в рану, затем смазать рану спиртовым раствором йода; при сильном кровотечении, связанном с ранением более крупных кровеносных сосудов, рука временно перетягивается эластичным жгутом из резиновой трубки, и обращаются к врачу;
♦ при термических ожогах обожженное место смачивается 5% раствором танина в 40% этиловом спирте;
♦ при ожогах крепкими кислотами обожженный участок промывается водой, и накладывается компресс из ваты или марли, смоченной 1% раствором соды;
♦ при ожогах крепкими щелочами пораженный участок промывается водой и накладывается компресс из ваты или марли, смоченный 1% раствором уксусной кислоты (можно применять и соляную кислоту);
♦ при попадании кислоты или щелочи в глаза следует их тщательно промыть водой, затем 2% раствором соды (для нейтрализации кислоты), либо 2% раствором борной кислоты (для нейтрализации щелочи);
♦ при ожогах бромом пораженное место смачивается 1% раствором карбоната натрия, пока не исчезнет бурая окраска от брома, затем накладывается компресс из ваты или марли, смоченной 5% раствором мочевины;
♦ при ожогах фенолом побелевший участок кожи растирается глицерином.
КАТЕГОРИЧЕСКИ ЗАПРЕЩАЕТСЯ:
♦ принимать пищу в лаборатории;
♦ проводить опыты в загрязненной посуде;
♦ набирать жидкие растворы в пипетку ртом;
♦ нагревать, смешивать и взбалтывать реактивы вблизи лица;
♦ зажигать одну спиртовку от другой;
♦ переносить горящую спиртовку;
♦ выливать в раковину остатки кислот и щелочей, огнеопасных и
взрывоопасных веществ;
♦ бросать в раковину стекла от разбитой посуды, бумагу и вату.
ЗА НЕСОБЛЮДЕНИЕ ПРАВИЛ ТЕХНИКИ БЕЗОПАСНОСТИ СТУДЕНТ ОТСТРАНЯЕТСЯ ОТ ЗАНЯТИЙ!
С правилами техники Инструктаж провел (а)
ознакомлен и обязываюсь их выполнять
_______________________________ ______________ 200 г.
Дата
 |
Лабораторная работа №1
Опыт № 1 Свойства бензола.
а) Бензол не присоединяет бром из бромной воды.
В пробирку с 3 каплями бромной воды (9) добавьте 3 капли бензола (63). Бензол легче воды и в ней не растворяется. Поэтому, после встряхивания смеси бензола с водой, он всплывает наверх при стоянии. Нижний слой бромной воды при этом обесцвечивается. Однако такое обесцвечивание объясняется не тем, что бром присоединяется по месту разрыва двойной связи, как это наблюдалось, например, у этилена, а тем, что бром легче растворяется в бензоле, чем в воде, и поэтому переходит в верхний слой бензола, окрашивая его в желтый цвет.
б) Бензол не окисляется раствором перманганата калия.
В пробирку с 5 каплями воды (I) добавьте 1 каплю 0,1 Н КМnО4 (101) и 1 каплю 2Н H2SO4 (27). К полученному розовому раствору добавьте 1 каплю бензола (63) и встряхните. Обесцвечивания не наблюдается.
Основываясь на современных представлениях об электронном строении молекулы бензола, объясните его инертность по отношению к бромной воде и перманганату калия.

в) Получение нитробензола.
В пробирку наливают 5 мл нитрующей смеси (для этого взять равный объем концентрированных азотной и серной кислот) и добавляют по каплям при постоянном взбалтывании 2 мл бензола. Смесь встряхивают 3 мин, а затем содержимое пробирки выливают в стакан с холодной водой. На дне стакана собираются капли нитробензола.
Написать уравнение реакции, назовите и напишите её механизм.
Назвать по М.Н. соединение, полученное в результате реакции.
д) Получение бензолсульфокислоты.
В пробирку помещают 0,5 мл концентрированной серной кислоты и 3 капли бензола (63). Содержимое пробирки нагревают на водяной бане до получения однородного раствора, а затем выливают в пробирку с водой. Если сульфирование закончено, образуется прозрачный раствор.
Написать уравнение реакции, назовите и напишите её механизм.
Назвать по М.Н. соединение, полученное в результате реакции.

Лабораторная работа №2
Лабораторная работа №3
Опыт №3 Образование триброманилина.
Поместите в пробирку 1 каплю анилина (90) и 5-6 капель воды (1); хорошо взболтайте и прибавьте несколько капель бромной воды (9) до появления белого осадка 2,4,6 - триброманилина.
В то время как в бензоле атомы водорода замещаются на бром только в присутствии катализатора, водородные атомы в о- и п- положениях весьма легко замещаются бромом уже при действии бромной воды.
Эта реакция протекает количественно и используется в фармацевтическом анализе.
1. Напишите схему реакции образования триброманилина и механизм процесса для реакции получения монобромпроизводного анилина.
2. Какой эффект проявляет аминогруппа? Покажите ориентирующее
действие заместителя.
Опыт №5 Образование и гидролиз изонитрила.
ВНИМАНИЕ!
Проводится один на подгруппу, обязательно в хорошо работающем вытяжном шкафу и под непосредственным наблюдением преподавателя!
Поместите в пробирку 1 каплю анилина (90), 2-3 капли концентрированного раствора щелочи (на общем столе), 2-3 капли хлороформа (17), 0,5-1 мл спирта ( на общем столе ) и медленно нагрейте смесь до начала кипения. Появляется характерный тошнотворный запах изонитрила (не выносить из-под тяги).
После того, как все студенты подгруппы ознакомятся с запахом изонитрила (не вынося из-под тяги), он должен быть разложен гидролизом. Для этого в пробирку прилейте несколько мл 2 н. H2SO4 (27) и кипятите, не вынося из вытяжного шкафа, до исчезновения запаха. Только после этого пробирку можно вынести из-под тяги.
1. Напишите схему реакции получения изонитрила из анилина в щелочной
среде.
2.Напишите схему реакции гидролиза изонитрила.
Выполнение работы проверил(а)
 |
Дата:
 |
Лабораторная работа №4
Лабораторная работа №5
Тема: Карбоновые кислоты.
Опыт №1. Открытие уксусной кислоты. Получение комплексной железной соли и разложение её при кипячении.
Поместите в пробирку несколько крупинок ацетата натрия CH3COONa (14). Убедитесь в том, что он не имеет запаха. Добавьте в пробирку 3 капли воды (1) и 2 капли 0,1н FeCl2 (6). Появляется жёлто-красное окрашивание от образующейся железной соли уксусной кислоты - ацетата железа (III). Напишите уравнение реакции. Фактически, же, ацетат железа частично гидролизуется с образованием комплексного соединения, имеющего гораздо более сложное строение.
Подогрейте раствор до кипения. Немедленно происходит гидролиз железной соли. Выделяется красно-бурый осадок нерастворимого в воде основного ацетата железа (III) - FеОН(СН3СОО)2. Получающийся над ним раствор, не содержащий ионов железа (III), становится бесцветным.
Описанную реакцию применяют в качественном анализе для удаления оксида железа (III) из раствора.
Напишите молекулярное, полное ионное и краткое ионное уравнения реакции гидролиза ацетата железа (III), учитывая, что гидролиз происходит по 1 ступени с образованием основного ацетата железа (III) - FeOH(CH3COO)2.
Опыт №4 Открытие щавелевой кислоты в виде кальциевой соли.
Оксалат натрия (45) (на общем столе) растворите в 4-5 каплях воды (1). Если потребуется, то подогрейте. С помощью пипетки возьмите 1 каплю раствора и нанесите её на предметное стекло. Добавьте 1 каплю 0,5н СаСl2 (37). Прибавьте к образовавшемуся осадку 1 каплю 2н СН3СООН (36). Осадок не растворяется. Затем прибавьте 1-2 капли 2н НСl (28). В этом случае осадок полностью растворяется. Запомните эту характерную особенность оксалата кальция. Кристаллы оксалата кальция нередко наблюдаются при клиническом исследовании мочи. При рассмотрении в микроскоп они напоминают по форме почтовые конверты.
1. Допишите уравнение реакции:
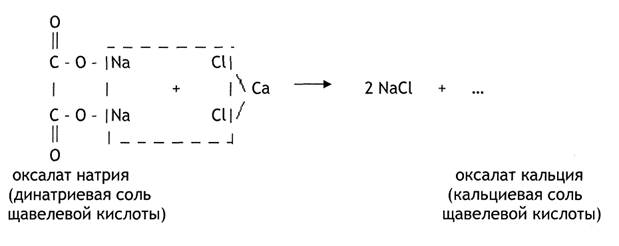
2. Напишите уравнение реакции растворения оксалата кальция в соляной кислоте. Назовите образовавшеюся в результате реакции кислоту по М.Н.
Выполнение работы проверил(а)
 |
Дата:
 |
Лабораторная работа №6
Опыт № 2.Разложение мочевины при нагревании. Образование биурета и циануроновой кислоты.
Поместите в сухую пробирку 1 лопаточку мочевины(44). Нагревайте над пламенем спиртовки. Мочевина сначала начинает плавиться, наблюдается частичный возгон цианата аммония. Через несколько секунд начинается выделение пузырьков газа-аммиака, который можно легко узнать по запаху или по посинению красной лакмусовой бумажки. Вскоре выделение пузырьков аммиака прекращается и реакционная масса затвердевает (при продолжающемся нагревании) вследствие образования новых веществ – биурета и циануроновой кислоты. Для разделения этих веществ можно воспользоваться различной их растворимостью в воде.
Охладив пробирку, добавьте в неё 5-6 капель воды (1) и прокипятите в течении 2-3 мин. При этом более растворимый биурет перейдёт в раствор. Дайте отстояться труднорастворимому осадку циануроновой кислоты, затем слейте осторожно раствор биурета в другую пробирку.
В пробирку с раствором биурета добавьте 2 капли 2Н NaOH (2). При этом незначительная муть от следов циануроновой кислоты исчезнет. Добавьте 1 каплю 0,2Н CuSO4(19). Появляется розово-фиолетовое окрашивание из-за образования комплексной медной соли биурета (биуретовая реакция). Избыток сульфата меди вреден, так как вызывает посинение
раствора, маскирующее характерную розовую окраску. Биуретовая реакция - одна из цветных реакций на белок и полипептиды.
Напишите уравнение реакции образования биурета, учитывая, что молекула аммиака отщепляется от двух молекул мочевины.
К оставшемуся в пробирке осадку циануроновой кислоты добавьте 2-3 капли 2Н раствора аммиака (3), энергично встряхните и добавьте 1 каплю 0,2Н раствора медного купороса(19). Образуется сиреневый осадок комплексной медной соли циануроновой кислоты.
1 .Напишите уравнение реакции образования изоциануроновой кислоты, учитывая, что её молекула является щестичленным гетероциклом, имеет лактамную форму и образуется из трёх молекул мочевины с выделением трёх молекул аммиака.
2.Напишите схему кето-енольной таутомерии изоциануроновой кислоты, если процесс осуществляется при участии всех трёх кетогрупп.
Обозначьте изоциануроновую кислоту, имеющую лактамную (кетонную) форму, и циануроновую кислоту, имеющую лакимную (енольную) форму.
Опыт № 4 Растворимость мочевины в воде и образование её солей.
В пробирку вносят 0.2-0.5 г мочевины (44) и добавляют несколько капель воды до полного её растворения. По капле раствора наносят на синюю и красную лакмусовую бумагу. Раствор мочевины нейтрален на лакмус. Тем не менее, основные свойства мочевины можно обнаружить при взаимодействии её с кислотами. Полученный концентрированный раствор мочевины делят на две части. К первой части добавляют 2-3 капли концентрированной азотной кислоты (в вытяжном шкафу), а ко второй 2-3 капли насыщенного раствора щавелевой кислоты ( в вытяжном шкафу). Через несколько секунд наблюдают выпадение кристаллов солей мочевины.
1 .Напишите уравнение реакции.
2.Почему мочевина даёт соль только по одной аминогруппе?

Выполнение работы проверил(а)
 |
Дата:
 |
Лабораторная работа №7
Тема: Аминокислоты. Белки.
Лабораторная работа №8
Образование сахарата меди ( II ).
В пробирке смешивают 1 мл 1%-ного раствора глюкозы и 0,5 мл 10%-ного раствора гидроксида натрия. Затем по каплям добавляют 5%-ный раствор сульфата меди. Образующийся вначале голубой осадок гидроксида меди (II) при встряхивании растворяется, и получается синий прозрачный раствор сахарата меди.
1. Почему наблюдают образование синего прозрачного раствора.

2. Запишите соответствующие уравнения реакций.
3. Для какого класса соединений характерно данное свойство.

Лабораторная работа №9
Лабораторная работа №10
Опыт №2. Образование солей пиридина.
В две пробирки наливают по 1мл 2%-ных растворов хлорида железа (III) и сульфата меди и добавляют по 1-2 капли раствора пиридина. В пробирке с хлоридом железа (III) выпадает осадок бурого цвета. В пробирке с сульфатом меди сначала выпадает голубой осадок гидроксида меди (II).
Напишите соответствующие реакции.
Опыт №3. Образование пикрата пиридиния.
К 1мл насыщенного раствора пикриновой кислоты приливают 5-10 капель раствора пиридина. При встряхивании образуются игольчатые кристаллы пикрата пиридиния. Эта реакция используется для обнаружения пиридина.
Напишите уравнение реакции пиридина и пикриновой кислоты.
Кафедра химии
ТЕТРАДЬ
Для лабораторных работ
По органической химии
для студентов, обучающихся по специальности «Фармация»
 Студента
Студента 
 № группы
№ группы
Тверь.
2017 уч. год
Тетрадь для лабораторных работ по органической химии рекомендуется использовать студентам 2 курса фармацевтического факультета при проведении практических занятий. Составлено на основании Программы по дисциплине «Органическая химия» для студентов фармацевтических вузов (факультетов), утвержденной руководителем Департамента медицинских образовательных учреждений и кадровой политики Минздрава России Н.Н.Володиным (Москва, 2000г.), и Рабочей программы, утвержденной на кафедральном совещании коллективом кафедры химии ТГМУ.
Составители:
д.б.н., профессор Г.М.Зубарева
ассистент Л.Р. Волкова
Рецензент:
Зав.кафедрой биологии д.б.н.,профессор М.Б.Петрова
Тетрадь для лабораторных работ обсуждена на заседании кафедры химии Тверского государственного медицинского университета.
Тетрадь для лабораторных работ одобрена советом ЦМК «Естественнонаучных дисциплин» ТГМУ.
Утверждено решением
ЦКМС ТГМУ
Профессор М.Н.Калинкин
2017 г.
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ И МЕТОДЫ ОКАЗАНИЯ ПЕРВОЙ ПОМОЩИ ПРИ РАБОТЕ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ
НЕОБХОДИМО:
♦ работать в хлопчатобумажном халате;
♦ личные вещи хранить в специально отведенном месте;
♦ при попадании химических реактивов на стол, пол и другие предметы
сообщить преподавателю и произвести уборку;
♦ опыты с едкими, ядовитыми или сильно пахнущими веществами
разрешается проводить только в вытяжном шкафу при наличии включенной вентиляции;
♦ при разбавлении концентрированных кислот необходимо соблюдать порядок смешивания: кислоту постепенно вливать в воду;
♦ после завершения работы необходимо отключить газ, воду, вытяжные
шкафы и электроэнергию;
♦ при порезе стеклом: вынуть кусочки стекла, если они попали в рану, затем смазать рану спиртовым раствором йода; при сильном кровотечении, связанном с ранением более крупных кровеносных сосудов, рука временно перетягивается эластичным жгутом из резиновой трубки, и обращаются к врачу;
♦ при термических ожогах обожженное место смачивается 5% раствором танина в 40% этиловом спирте;
♦ при ожогах крепкими кислотами обожженный участок промывается водой, и накладывается компресс из ваты или марли, смоченной 1% раствором соды;
♦ при ожогах крепкими щелочами пораженный участок промывается водой и накладывается компресс из ваты или марли, смоченный 1% раствором уксусной кислоты (можно применять и соляную кислоту);
♦ при попадании кислоты или щелочи в глаза следует их тщательно промыть водой, затем 2% раствором соды (для нейтрализации кислоты), либо 2% раствором борной кислоты (для нейтрализации щелочи);
♦ при ожогах бромом пораженное место смачивается 1% раствором карбоната натрия, пока не исчезнет бурая окраска от брома, затем накладывается компресс из ваты или марли, смоченной 5% раствором мочевины;
♦ при ожогах фенолом побелевший участок кожи растирается глицерином.
КАТЕГОРИЧЕСКИ ЗАПРЕЩАЕТСЯ:
♦ принимать пищу в лаборатории;
♦ проводить опыты в загрязненной посуде;
♦ набирать жидкие растворы в пипетку ртом;
♦ нагревать, смешивать и взбалтывать реактивы вблизи лица;
♦ зажигать одну спиртовку от другой;
♦ переносить горящую спиртовку;
♦ выливать в раковину остатки кислот и щелочей, огнеопасных и
взрывоопасных веществ;
♦ бросать в раковину стекла от разбитой посуды, бумагу и вату.
ЗА НЕСОБЛЮДЕНИЕ ПРАВИЛ ТЕХНИКИ БЕЗОПАСНОСТИ СТУДЕНТ ОТСТРАНЯЕТСЯ ОТ ЗАНЯТИЙ!
С правилами техники Инструктаж провел (а)
ознакомлен и обязываюсь их выполнять
_______________________________ ______________ 200 г.
Дата
 |
Лабораторная работа №1
Тема: Свойства бензола и его производных.
Опыт № 1 Свойства бензола.
а) Бензол не присоединяет бром из бромной воды.
В пробирку с 3 каплями бромной воды (9) добавьте 3 капли бензола (63). Бензол легче воды и в ней не растворяется. Поэтому, после встряхивания смеси бензола с водой, он всплывает наверх при стоянии. Нижний слой бромной воды при этом обесцвечивается. Однако такое обесцвечивание объясняется не тем, что бром присоединяется по месту разрыва двойной связи, как это наблюдалось, например, у этилена, а тем, что бром легче растворяется в бензоле, чем в воде, и поэтому переходит в верхний слой бензола, окрашивая его в желтый цвет.
б) Бензол не окисляется раствором перманганата калия.
В пробирку с 5 каплями воды (I) добавьте 1 каплю 0,1 Н КМnО4 (101) и 1 каплю 2Н H2SO4 (27). К полученному розовому раствору добавьте 1 каплю бензола (63) и встряхните. Обесцвечивания не наблюдается.
Основываясь на современных представлениях об электронном строении молекулы бензола, объясните его инертность по отношению к бромной воде и перманганату калия.

в) Получение нитробензола.
В пробирку наливают 5 мл нитрующей смеси (для этого взять равный объем концентрированных азотной и серной кислот) и добавляют по каплям при постоянном взбалтывании 2 мл бензола. Смесь встряхивают 3 мин, а затем содержимое пробирки выливают в стакан с холодной водой. На дне стакана собираются капли нитробензола.
Написать уравнение реакции, назовите и напишите её механизм.
Назвать по М.Н. соединение, полученное в результате реакции.
д) Получение бензолсульфокислоты.
В пробирку помещают 0,5 мл концентрированной серной кислоты и 3 капли бензола (63). Содержимое пробирки нагревают на водяной бане до получения однородного раствора, а затем выливают в пробирку с водой. Если сульфирование закончено, образуется прозрачный раствор.
Написать уравнение реакции, назовите и напишите её механизм.
Назвать по М.Н. соединение, полученное в результате реакции.

Дата: 2019-02-02, просмотров: 411.