Министерство сельского хозяйства Российской Федерации
ФГБОУ ВО Ульяновский ГАУ
С.Н. Золотухин, Д.А. Васильев, А.И. Калдыркаев,
Ю.Б. Васильева, А.В. Летаров, А.В. Алешкин
Учебное пособие
В двух частях
«Дезинфекция, дезинсекция и дератизация»
Часть 1
(электронный ресурс)
Для обучающихся по направлению подготовки 19.03.04 «Технология продукции и организация общественного питания»

Ульяновск 2018 г.
УДК: 614.4
Золотухин С.Н. Дезинфекция, дезинсекция и дератизация. Часть 1.: Учебное пособие в двух частях [Электронный ресурс] / С.Н. Золотухин, Д.А. Васильев, А.И. Калдыркаев, Ю.Б. Васильева, А.В. Летаров, А.В. Алешкин - Ульяновск, 2018. - 129с.
Рецензент:
С.В. Мерчина, к.б.н., доцент кафедры микробиологии, вирусологии, эпизоотологии и ветеринарно-санитарной экспертизы ФГБОУ ВО Ульяновский ГАУ
Курс лекций по «Дезинфекция, дезинсекция и дератизация» составлен на основании рабочей программы, целью которой является дать студенту новую научную информацию и подробно разъяснить ключевые положения разделов названной дисциплины.
В учебном пособие представлены рисунки, таблицы, излагается материал, которые позволят студентам лучше подготовиться к зачету по данной дисциплине, более подробно разъяснить ключевые положения разделов дисциплины.
Рекомендовано методической комиссией
факультета агротехнологий,
земельных ресурсов и пищевых производств,
Ульяновского ГАУ
Протокол № 5 от 5 февраля 2018 г.
©Золотухин С.Н., Васильев Д.А., Калдыркаев А.И.,
Васильева Ю.Б., Летаров А.В., Алешкина А.В.
© ФГБОУ ВО Ульяновский ГАУ, 2018 г.
Содержание
Лекция 1. Введение в предмет. Понятие о дезинфекции, дезинсекции и дератизации 5
1.1 Факторы и способы передачи инфекции 5
1.2 Понятие о дезинфекции, дезинсекции и дератизации 10
Лекция 2. Влияние факторов внешней среды на микроорганизмы 11
2.1 Физические факторы 12
2.2 Химические факторы 25
2.3 Биологические факторы 31
Лекция 3. Основы микробиологического и санитарно-гигиенического контроля на предприятиях общественного питания и пищевой промышленности 34
3.1. Санитарно-показательные микроорганизмы 34
3.2. Микробиологический и санитарно-гигиенический контроль 36
3.3 Контроль пищевых продуктов 37
3.4 Контроль воды 40
3.5 Контроль воздуха производственных помещений 40
3.6 Контроль оборудования, инвентаря, тары 41
3.7 Контроль чистоты рук и одежды персонала 43
Лекция 4. Дезинфекция на предприятиях общественного питания 43
4.1 Понятие и цель дезинфекции 43
4.2 Методы и средства дезинфекции 45
4.3 Требования к дезинфицирующим средствам и способы
дезинфекции 51
4.4 Мытьё и обеззараживание посуды, оборудования и инвентаря 56
4.5 Контроль качества дезинфекции 62
Лекция 5. Членистоногие и их эпидемиологическая значимость 63
5.1 Специфические и механические переносчики инфекции 63
5.2. Основные представители членистоногих имеющие эпидемиологическую значимость 64
Лекция 6. Организация дезинсекции на предприятиях общественного питания 66
6.1 Общие вопросы дезинсекции 66
6.2 Методы дезинсекции 67
6.2.1 Механический метод 68
6.2.2 Физический метод 69
6.2.3 Биологический метод 71
6.2.4 Химический метод 74
6.3 Устойчивость членистоногих к инсектицидам 76
6.4 Методы и средства защиты от кровососущих членистоногих 80
Лекция 7. Роль грызунов в жизнедеятельности человека. Биология синантропных грызунов и их эпидемиологическое значение 87
7.1 Эпидемиологическое значение грызунов 88
7.2 Отдельные виды грызунов и борьба с ними 89
Лекция 8. Дератизация на предприятиях пищевой промышленности и общественного питания. Методы и средства борьбы с грызунами 102
8.1 Общие вопросы дератизации 102
8.2 Истребительные методы борьбы с грызунами 103
8.2.1 Физический метод дератизации 103
8.2.2 Биологический метод дератизации 110
8.2.3 Химический метод дератизации 111
8.3 Бесприманочный способ использования ядов кишечного пути поступления 123
8.4 Использование долгодействующих точек отравления 124
Лекция 1. Введение в предмет. Понятие о дезинфекции, дезинсекции и дератизации.
Химические факторы
К химическим факторам, влияющим на жизнедеятельность микробов, относят: химический состав питательной среды, реакцию среды, окислительно-восстановительный потенциал среды и действие ядовитых (антисептических) веществ.
Состав питательной среды является основным показателем микроорганизмов. Он определяет ее питательную ценность, реакцию (рН) и окислительно-восстановительный потенциал (Еh).
Реакция питательной среды (концентрация водородных ионов рН) играет роль фактора, определяющего границы существования живой материи. Кислотность среды воздействует на ионное состояние, а поэтому на доступность для организма многих химических веществ.
Ионы водорода влияют на электрический заряд коллоидов клеточной стенки. При сдвиге рН в кислую или щелочную сторону изменяется знак заряда поверхности клетки, что приводит к изменению ее проницаемости для различных молекул и ионов питательного субстрата и нарушению нормального процесса обмена веществ. Изменение рН также влияет на степень дисперсности коллоидов цитоплазмы, активность ферментов, интенсивность и направление биохимических реакций. Так, например, дрожжи в кислой среде (рН 4,5-5,0) образуют в основном этиловый спирт (спиртовое брожение), а в щелочной среде (рН 8,2) – глицерин (глицериновое брожение).
В зависимости от отношения микрооргаизмов к кислотности среды их подразделяют на ацидофилы (кислотолюбивые), нейтрофилы (нейтральная зона) и алкалофилы (щелочелюбивые). Микроорганизмы, обладающие способностью выживать при значениях рН за пределами 4-9, рассматриваются как кислото - и щелочетолерантные.
Кислотолюбивые микроорганизмы, растущие при очень низком значении рН, встречаются редко. К ацидофильным относятся уксуснокислые, молочнокислые, некоторые дрожжи и плесени. Уксуснокислые бактерии растут в пределах рН от 3 до 5, молочнокислые развиваются при рН от 3 до 8. Оптимум рН роста дрожжей находится в области 4,5 - 6. Однако некоторые из них способны развиваться в более кислой среде – рН 2, другие - в щелочной - 8,5.
К самым устойчивым к кислой среде относятся плесневые грибы, многие из них характеризуются ацидотолерантностью и способностью роста в широких пределах рН (от 2 до11).
Оптимальная рН для нейтральнофильных микроорганизмов находится в пределах 7,0. Типичными представителями нейтрофилов являются бактерии группы кишечных палочек (БГКП), стрептококки, бациллы, сальмонеллы и большинство других патогенных микроорганизмов.
К алкалофилам относят некоторые виды бактерий и мицелиальных грибов. Клубеньковые бактерии рода Ризобиум (Rhizobium) активно развиваются при рН 10-12. Бациллюс цереус (Bacillus cereus) и Бациллус циркулянс (Bacillus circulans) способны развиваться при рН 10-11. Энтерококки также толерантны к щелочной среде.
Многие микроорганизмы, развиваясь в питательной среде, выделяют продукты обмена, изменяющие реакцию субстрата, это является одним из факторов, обусловливающих антогонизм между различными группами микробов. Так, молочнокислые бактерии в процессе жизнедеятельности образуют молочную кислоту, которая подавляет развитие большинства гнилостных бактерий. Это используется при хранении кисломолочных продуктов, сыров, при консервировании силоса, квашении капусты и других продуктов.
Зная отношение различных микроорганизмов к реакции среды и регулируя ее рН, можно подавлять или стимулировать их развитие.
Окислительно-восстановительный потенциал служит количественной мерой способности некоторых соединений или элементов отдавать электроны. Этот отсчитывается относительно потенциала молекулярного водорода.
Окислительно-восстановительные условия питательной среды выражаются величиной окислительно-восстановительного потенциала, который принято обозначать Еh (rH2).
Окислительно-восстановительный (ОВ) потенциал среды представляет собой отрицательный логарифм числа, выражающего давление (в МПа) молекулярного водорода при давлении Н2 0,1 МПа. ОВ потенциал среды равен 0. Величина Еh минимальна при насыщении среды водородом и максимальна при насыщении ее кислородом. Она измеряется от 0 до 41 единиц. При равновесии окислительно-восстановительных процессов в среде rH2 равен 28.
Присутствие в среде окисляющих веществ (метиленового синего, резазурина, кислот, перманганата калия и др.) повышает значение потенциала. Значение же соединений, обладающих восстановительными свойствами (цистеин, тимоловая кислота), снижает потенциал. ОВ потенциал также резко уменьшается при отмирании микроорганизмов, лизисе их фагом и действии на культуры лизоцимом. Изменяя ОВ потенциал среды, можно повлиять на интенсивность размножения различных групп микроорганизмов и направленность вызываемых ими биохимических процессов.
По отношению к окислительно-восстановительным условиям среды микроорганизмы разделяют на четыре основные группы: облигатные аэробы, облигатные и факультативные - анаэробы и микроаэрофилы. Облигатные анаэробы развиваются при низком значении Еh (0-14), факультативные анаэробы при Еh (0-30), аэробные микроорганизмы Еh (11-35), микроаэрофилы- Еh (10-20).
Влияние антисептических веществ на микробную клетку может проявляться различным действием. Одни подавляют жизнедеятельность или задерживают развитие чувствительных к ним микробов. Такое действие называют бактериостатическим (в отношении бактерий) или фунгистатическим (в отношении мицелиальных грибов). Другие вещества вызывают гибель микроорганизмов, оказывая на них соответственно бактерицидное или фунгицидное действие. В очень малых дозах многие химические яды оказывают даже благоприятное действие, стимулируя размножение или биохимическую деятельность микробов. В каждом конкретном случае доминирующий эффект зависит от химической природы этого антимикробного агента.
Эффективность действия химических веществ на микроорганизмы зависят от природы вещества, концентрации, биологических особенностей микроорганизмов, продолжительности воздействия, температуры, состава и рН среды. Чувствительность микроорганизмов к одному и тому же антисептику неодинакова.
Из неорганических соединений сильными ядами для микробов являются:
- соли тяжелых металлов (свинца, меди, цинка, серебра, золота, ртути),
- различные окислители (хлор, хлорная известь, хлорамин, йод, бром, перманганат калия, пероксид водорода, озон, диоксид углерода, аммиак и др.),
- минеральные кислоты (борная, серная, хлористоводородная, азотная и др.),
- щелочи (гидроксид натрия, гидроксид калия и др.).
Среди органических соединений губительное воздействие оказывают органические кислоты (молочная, салициловая, масляная, уксусная, бензойная и др.), используемые в качестве консервантов в пищевой и парфюмерно-косметической промышленностях. Консервант должен обладать определенными липофильными свойствами для того, чтобы проникать через гидрофобную клеточную оболочку или разрушать ее. В то же время, для антимикробного действия консерванту требуется хорошая растворимость в воде, так как развитие микроорганизмов происходит исключительно в водной фазе и поэтому консервант должен находиться именно в ней.
Эффективность конкретного консерванта неодинакова в отношении плесневых грибов, дрожжей и бактерий, то есть он не может быть эффективен против всего спектра возможных микроорганизмов, вызывающих порчу пищевых продуктов.
Кроме того, к дезинфицирующим веществам этой группы относятся также диэтиловый эфир, спирты жирного и ароматического ряда (этиловый, бутиловый, амиловый, пропиловый и др.), эфирные масла, смолы, дубильные вещества, органические красители, формалин, фенол, крезол и их производные..
Ионы серебра и золота обладают олигодинамическим действием. В очень малых количествах, не поддающихся химическому обнаружению, они губительно действуют на микробные клетки. На этом основан метод дезинфекции воды с помощью серебряных фильтров. Посуда из серебра при контакте с водой сообщает ей бактерицидные свойства, этим объясняется длительное хранение «святой воды».
Химические вещества, бактерицидно действующие на микроорганизмы в небольших концентрациях, называют антисептическими или дезинфицирующими. Механизм бактерицидного действия антисептических веществ заключается в том, что в результате взаимодействия химического яда с веществами цитоплазмы в ней происходят необратимые изменения, вызывающие нарушения процессов жизнедеятельности и приводящие к гибели клетки.
Соли тяжелых металлов вызывают коагуляцию белков клетки. Олигодинамическое действие серебра и др. тяжелых металлов заключается в том, что положительно заряженные ионы металлов адсорбируются на отрицательно заряженной поверхности микробов, изменяется проницаемость их цитоплазматической мембраны и при этом нарушаются процессы питания и размножения микроорганизмов.
Окислители действуют на сульфгидрильные группы активных белков и влияют на другие группы (феноловые, тиоловые, индольные и аминные).
Неорганические кислоты и щелочи гидролизуют белки клетки. Диоксид углерода, сероводород, цианистые соединения инактивируют ферменты клетки.
Органические спирты, диэтиловый эфир, ацетон разрушают полипептидную оболочку клетки. Формалин (40%-й раствор формальдегида) присоединяется к аминогруппам белков и вызывает их денатурацию.
Многие антисептические вещества используются в медицине, сельском хозяйстве, в промышленности и в быту, как дезинфицирующие средства для борьбы с болезнетворными микробами. Широко применяют хлор и его соединения для дезинфекции питьевой воды, тары, оборудования, инвентаря.
Антисептические вещества используют для защиты от микробных поражений текстильных материалов, древесины, бумаги и изделий из нее, других материалов и объектов.
Применение антисептиков для консервирования продуктов ограничено и строго нормируется санитарным законодательством.
В нашей стране разрешено использовать немногие химические консерванты в малых дозах (от сотых до одной двух десятых процента) и только для некоторых пищевых продуктов.
Для консервирования полуфабрикатов из плодово-ягодного сырья, рыбных консервов, кетовой икры используют бензойную кислоту и ее натриевую соль. В качестве консерванта для многих пищевых продуктов все чаще применяют сорбиновую кислоту и ее соли. Эта кислота менее токсична, чем бензойная и сернистая, и более активно воздействует на микроорганизмы. При концентрации 0,03-0,1% эта кислота на длительное время задерживает рост грибов, дрожжей и некоторых бактерий и при этом безвредна для людей, не придает продукту посторонних вкуса и запаха. Особенно эффективно действие сорбиновой кислоты в кислой среде рН 3-4,5.
Этот консервант вводят непосредственно в продукт или обрабатывают им поверхность продукта, оберточные материалы.
Для борьбы с картофельной болезнью хлеба, для предотвращения его плесневения рекомендуется введение в тесто солей пропионовой кислоты. Этот консервант можно применять и для некоторых рыбных продуктов.
Биологические факторы
Под биологическими факторами понимают влияние на жизнедеятельность микроорганизмов других видов и групп микробов, а также животных и растений, составляющих в природных условиях специфический биоценоз. В процессе эволюции возникли и сформировались различные типы взаимоотношений между микроорганизмами. В связи с этим различают несколько типов взаимоотношений (симбиоза) между организмами: мутуализм, синергизм, комменсализм, паразитизм, метабиоз и антагонизм (антибиоз).
Мутуализм (взаимовыгодный симбиоз) представляет собой сожительство, благоприятное для обоих симбионтов, совместно они развиваются даже лучше, чем каждый в отдельности. Примером может служить совместное развитие молочнокислых бактерий и дрожжей (в кефирных грибках).Молочнокислые бактерии в кефирных грибках продуцируют молочную кислоту и создают среду, благоприятную для роста дрожжей, а дрожжи, выделяя витамины группы В, стимулируют развитие молочнокислых бактерий. Симбиотические взаимоотношения этих микроорганизмов используют в процессе изготовления некоторых молочнокислых продуктов (кефира, кумыса).
Синергизм - содружественное действие двух или нескольких видов, когда при совместном развитии усиливаются отдельные физиологические функции. Например, повышается синтез определенных веществ (образование ароматических веществ лактококками при совместном выращивании с молочнокислыми стрептококками.
Комменсализм – тип взаимоотношений между двумя организмами, при котором один живет за счет другого, не принося заметной пользы и не причиняя вреда. Такие взаимоотношения наблюдаются между молочнокислыми бактериями, а также кишечными палочками и организмом человека или животного. При развитии в толстом отделе кишечника бактерии получают от макроорганизма необходимые питательные вещества, не причиняя ему вреда и даже принося известную пользу тем, что подавляют развитие гнилостных и некоторых патогенных микроорганизмов.
Паразитизм – вид взаимоотношений, когда один из них (паразит) живет за счет другого (хозяина), причиняя ему вред. Паразитами являются все патогенные микроорганизмы по отношению к человеку, животному и растениям. Абсолютными паразитами являются риккетсии и вирусы, развивающиеся внутри клеток макро- и микроорганизмов.
Метабиоз - такой вид взаимоотношений, когда продукты жизнедеятельности одного микроорганизма являются продуктами питания других. Так, дрожжи, сбраживая сахар в этиловый спирт, создают условия для развития уксуснокислых бактерий, а образуемая последними уксусная кислота используется плесенями, которые ее окисляют до С2О и Н2О.
Антагонизм (антибиоз) – тип взаимоотношений между микроорганизмами, при котором одни микроорганизмы подавляют развитие других. Причин антагонизма может быть несколько: истощение питательного субстрата вследствие более быстрого развития одного из микроорганизмов; изменение рН среды (при развитии ацидофилов , алкалофилов); выделение в среду микробами - антагонистами антибиотиков. Антибиотики - вещества биологического (микробного, растительного и животного) происхождения, подавляющие развитие и биохимическую активность чувствительных к ним микробов.
По происхождению антибиотики подразделяют на группы: антибиотические вещества, продуцируемые актиномицетами, плесневыми грибами, бактериями, организмом животного или человека; антибиотики растительного, синтетического и полусинтетического происхождения Известно более 5000 антибиотиков, обладающих различным спектром действия.
Антибиотики актиномицетного происхождения - стрептомицин, тетрациклины, неомицин, нистатин обладают широким антибактериальным спектром действия. Они активны в отношении грамположительных бактерий, возбудителей туберкулеза, брюшного тифа, туляремии, бруцеллеза, сальмонеллезов и др.
Наиболее активными продуцентами антибиотиков являются мицелиальные грибы. Плесень рода Penicillium продуцирует широко используемый пенициллин. Он обладает бактерицидным действием главным образом на грамположительные стафилококки и стрептококки. Плесени рода Aspergillus выделяют антибиотики- фумингацин и аспергиллин. Mucor продуцирует клавицин.
К антибиотикам, продуцируемым бактериями, относят грамицидин – С (Вac. Brevis), пиоцианин (Ps. aeruginoza), субтилин (Bac. subtilis), полимиксин (Bac. polymixa). Молочнокислые бактерии Lbm. Plantarum выделяют антибиотик лактолин, Lac. Lactis –низин, Lac. Cremoris- диплококцин и др.
Эффективность бактериальных антибиотиков ниже, чем антибиотиков грибного и актиномицетного происхождения, однако они способны подавлять развитие возбудителя туберкулеза, маслянокислых бактерий, кишечных палочек, стафилококков и других видов молочнокислых бактерий.
К антибиотическим веществам животного происхождения относят лизоцим, эритрин и экмолин. Лизоцим содержится в яичном белке, слезах, слюне, молозиве, молоке. Он убивает и растворяет (лизирует) многие виды бактерий. Эритрин получен из красных кровяных шариков (эритроцитов) крови животных, проявляет бактериостатическую активность. Экмолин получают из тканей рыб. Он активен в отношении стафилококков и стрептококков.
Антимикробные вещества высших растений называют фитонцидами. Наиболее сильной бактерицидностью обладают фитонциды лука, чеснока, хрена, горчицы, алое, крапивы, можжевельника, почек березы, листьев черемухи и др. Антимикробное действие фитонцидов обусловлено продуктами жизнедеятельности растительных организмов: эфирных масел, глюкозидов, органических кислот, дубильных веществ, смол и др.
Полусинтетические антибиотики получают химическим путем. Они имеют широкий спектр действия, активны в отношении не только грамположительных, но и грамотрицательных микроорганизмов (исключение составляет синегнойная палочка). Синтезированы полусинтетические пенициллины (оксациллин, ампициллин, карбенициллин), цефалоспорины (цефалоредин), тетрациклины (метацилиногидрохлорид) и др.
Химическая природа антибиотиков различна. Они отличаются химической структурой и биологическими свойствами. Антибиотические вещества из бактерий являются полипептидами, а выделенные из актиномицетов и грибов относятся к сложным циклическим соединениям.
Лекция 3. Основы микробиологического и санитарно-гигиенического контроля на предприятиях общественного питания и пищевой промышленности
3.1. Санитарно-показательные микроорганизмы
Быстрое и непосредственное обнаружение в объектах внешней среды (воде, воздухе, пищевых продуктах) патогенных микроорганизмов осуществить очень трудно, так как их количество ничтожно мало по сравнению с сапрофитной микрофлорой исследуемых объектов. Поэтому возможное загрязнение их патогенными микроорганизмами определяют косвенно - на основании количественного и качественного учета санитарно - показательных микроорганизмов.
К санитарно - показательным микроорганизмам относятся кишечная палочка, гемолитические (растворяющие эритроциты крови) стрептококки и стафилококки. Они являются постоянными обитателями естественных полостей тела человека и животных (кишечника, слизистых оболочек полости рта и верхних дыхательных путей). Присутствие санитарно - показательных микроорганизмов в объектах внешней среды указывает на загрязненность их выделениями человеческого организма, а, следовательно, и возможность наличия в них соответствующих патогенных микроорганизмов.
Кишечная палочка (Еscherichia coli). Название связано с именем ученого Эшериха, впервые выделившего ее из испражнений человека, и латинского слова «колон» (кишка). Она является постоянным обитателем толстых кишок, безвредна для человека. Она является показателем фекального загрязнения воды и пищевых продуктов, т. е. выделениями кишечника человека, что свидетельствует о возможном наличии возбудителей тяжелых кишечных заболеваний (дизентерии, брюшного тифа, паратифов и т. п.), которые выделяются из больного организма, или носителем инфекции во внешнюю среду (также с фекалиями). Для санитарно-гигиенической оценки воды, пищевых продуктов и других объектов необходимо не только установить наличие в них кишечной палочки, но в ряде случаев провести количественный учет этих бактерий.
Интенсивность фекального загрязнения характеризуется двумя микробиологическими показателями: коли-титром и коли-индексом.
Коли-титр - наименьшее количество исследуемого материала (объем, масса), в котором обнаруживается одна кишечная палочка. Чем меньше величина коли-титра, тем опаснее данный объект в эпидемиологическом отношении.
Коли-индекс - это количество кишечных палочек в единице объема (массы) исследуемого вещества.
Гемолитические стрептококки и стафилококки. Эти постоянно обитающие па слизистых оболочках полости рта и верхних дыхательных путей микроорганизмы также являются санитарно-показательными. Их наличие указывает на обсемененность воздушной среды и некоторых продуктов микрофлорой дыхательных путей, среди которой могут быть возбудители ангины, коклюша, туберкулеза и др., попадающие туда при кашле, чихании и пр.
Чем больше количество санитарно - показательных микроорганизмов в исследуемом объекте, тем больше он загрязнен выделениями человеческого организма и тем вероятнее, что в нем содержатся патогенные микроорганизмы - возбудители инфекционных заболеваний.
Контроль пищевых продуктов
Для оценки качества сырья, полуфабрикатов, вспомогательных материалов, готовой продукции в нашей стране в основном используются два показателя – МАФАМ КоЕ – количество мезофильных аэробных и факультативно - анаэробных микроорганизмов колоний образующих единиц и количество бактерий кишечной группы (преимущественно кишечной палочки)
МАФАМ определяют в основном чашечным методом. Выполнение анализа включает четыре этапа:
- приготовление ряда разведений из отобранных проб (при обследовании поверхности продукта или оборудования пробу отбирают путем смыва или соскоба с определенной площади);
- посев на стандартную плотную питательную среду (для выявления бактерий - на мясо - пептонный агар в чашки Петри);
- выращивание посевов в течение 24—28 ч в термостате при 30°С;
- подсчет выросших колоний. Число колоний, выросших на каждой чашке, пересчитывают на 1 г или 1 мл продукта с учетом разведения.
Окончательным результатом будет среднее арифметическое от результатов подсчета колоний в 2 - 3 чашках.
Полученные результаты будут меньше истинного обсеменения продукта, так как чашечным методом учитываются только сапрофитные мезофильные бактерии (аэробы и факультативные анаэробы). Термофильные и психрофильные бактерии не растут из-за несоответствия температуры оптимальной; анаэробы не растут, поскольку выращивание проводится в аэробных условиях; другие бактерии (в частности, патогенные) не растут из-за несоответствия питательной среды и условий культивирования. Не образуют колоний мертвые клетки. Однако эти микроорганизмы можно не учитывать и ошибкой анализа пренебречь, поскольку сапрофиты являются основными возбудителями порчи пищевых продуктов.
В некоторых производствах (консервном, сахарном, хлебопекарном и др.) используются дополнительные микробиологические показатели, например, количество анаэробных, термофильных, спорообразующих и других микроорганизмов, характерных для каждого вида исследуемого объекта. Для их учета имеются специальные методические приемы, описанные в соответствующей нормативной документации. Например, для определения процентного содержания спорообразующих бактерий посев производят из пробирок с разведениями проб, предварительно прогретых несколько минут в кипящей водяной бане. При посевах из прогретых проб вырастают только спороносные бактерии, а из непрогретых - все остальные.
Затем рассчитывают процентное содержание спорообразующих форм микроорганизмов.
Чем выше показатель МАФАМ, тем больше вероятность попадания в исследуемый объект патогенных микроорганизмов - возбудителей инфекционных болезней и пищевых отравлений. Обычно в 1 г (или 1 мл) продукта, не прошедшего термической обработки, содержится не более 100 тысяч сапрофитных мезофильных бактерий. Если же их количество превышает 1 млн. клеток, то стойкость готового продукта при хранении снижается и его употребление может нанести вред здоровью человека.
Определение бактерий кишечной группы основано на способности кишечной палочки сбраживать лактозу до кислоты и газа. При санитарно - гигиеническом контроле сырья, полуфабрикатов, готовой продукции исследование на наличие бактерий кишечной группы ограничивают проведением так называемой первой бродильной пробы.
Бродильную пробу осуществляют путем посева в пробирки со специальной дифференциально-диагностической средой для кишечной палочки (среда Кесслера с лактозой) различных объемов (или навесок) исследуемого объекта - 1,0; 0,1; 0,01; 0,001 мл (или г). Пробирки с посевами .помещают в термостат при 37°С на 24 ч, затем их просматривают и устанавливают бродильный титр, т. е. те пробирки, в которых наблюдается рост (помутнение среды) и образование газа в результате брожения. При отсутствии газообразования объект контроля считают не загрязненным кишечной палочкой. При наличии газообразования производят вычисление коли-титра для различных объектов контроля по специальным таблицам. Существуют нормы допустимой общей бактериальной обсемененности и содержания кишечной палочки в объектах контроля.
Контроль воды
Для санитарно-гигиенической оценки воды используются два микробиологических показателя: общее количество бактерий в воде и коли-индекс, которые определяются в. соответствии с ГОСТ 18963—73 “Вода питьевая. Методы санитарно - бактериологического анализа”.
Общее количество бактерий - это количество колоний аэробных и факультативно-анаэробных мезофильных сапрофитных бактерий, вырастающих при посеве 1 мл неразбавленной воды на мясо - пептонном агаре (МПА) за 24 ч при 37°С.
Для оценки качества воды наибольшее значение имеет не общее количество бактерий, а наличие в ней патогенных микроорганизмов. Микробиологическим показателем загрязненности воды патогенными бактериями кишечной группы служит коли-индекс. В соответствии с ГОСТ 2874—82 “Вода питьевая. Гигиенические требования и контроль за качеством” общее количество клеток бактерий в 1 мл воды должно быть не более 100, а коли-индекс - не более 3 в 1 л.
Анализ воды проводится при пользовании городским водопроводом 1 раз в квартал, а при наличии собственных источников водоснабжения - 1 раз в месяц.
Выявление патогенных микроорганизмов в воде (возбудителей брюшного тифа, холеры и дизентерии) осуществляется местными санитарно-эпидемиологическими станциями только по эпидемиологическим показателям.
Понятие и цель дезинфекции
Выполнение требований санитарного законодательства на предприятиях общественного питания является не только залогом успешного прохождения плановых и внеплановых проверок со стороны органов, уполномоченных осуществлять государственный санитарно-эпидемиологический надзор, получения удовлетворительных результатов производственного контроля, но и гарантией качества и безопасности реализуемой продукции для потребителей, что, несомненно, способствует повышению престижа организации.
Согласно санитарно-эпидемиологическим правилам, в частности, СП 2.3.6.1079-01 «Санитарно-эпидемиологические требования к организациям общественного питания, изготовлению и оборотоспособности в них пищевых продуктов и продовольственного сырья» особо пристальное внимание на предприятиях общественного питания должно уделяться дезинфекции.
Известно, что некоторые болезнетворные микробы (патогенные) при попадании на пищевые продукты способны размножаться и вырабатывать токсины (яды), которые могут вызывать различные заболевания микробной природы. Следует подчеркнуть, что тщательная уборка с использованием теплой воды, моющих средств, проветривания, вытряхивания и т.п. несколько снижает поверхностную обсемененность различных предметов.
Однако для полного уничтожения в окружающей человека среде патогенных микроорганизмов необходимо проводить специальный метод борьбы, который, называют дезинфекцией.
Следовательно, дезинфекция (обеззараживание) - это учение об уничтожении патогенных микроорганизмов, находящихся во внешней среде, с целью предупреждения инфекционных заболеваний и микробных пищевых отравлений.
Целью дезинфекции является уничтожение патогенных и условно-патогенных микроорганизмов на объектах внешней среды, служащих факторами передачи инфекции.
На предприятиях общественного питания дезинфекция проводится, как правило, с профилактической целью и ее основное назначение - предупредить скопление микробов на различных объектах (инвентарь, оборудование, посуда и др.), чтобы исключить возможность инфицирования (заражения) пищевых продуктов и готовых кулинарных изделий, а также предупредить порчу пищевого сырья и готовых продуктов питания.
Обязательная дезинфекция на предприятиях общественного питания проводится ежемесячно в санитарный день. Однако по определенным эпидемическим показаниям дезинфекция может быть проведена и в другие сроки.
Требования к дезинфицирующим средствам и способы дезинфекции
Для осуществления дезинфекционных мероприятий в организациях (на соответствующих объектах) должен быть создан запас дезинфицирующих средств, в установленном порядке разрешенных к применению. Дезинфицирующие средства должны иметь свидетельство о государственной регистрации, декларацию о соответствии, инструкцию о порядке обращения с ними.
Дезинфицирующие средства, используемые для проведения дезинфекционных мероприятий, должны обладать широким спектром действия в отношении всех видов микроорганизмов, в том числе бактерий, вирусов, грибов, микобактерий туберкулеза, а также возбудителей особо опасных инфекций в сочетании с хорошими физико-химическими свойствами (быстрой растворимостью в воде), моющими и дезодорирующими свойствами. На каждое применяемое организацией дезинфицирующее средство должны быть определены нормы расхода, концентрация, время экспозиции, способы и кратность обработки.
С учетом изложенного предпочтение следует отдавать тем дезинфицирующим средствам, которые могут использоваться для проведения дезинфекции всеми основными способами с экспозицией не более 60 минут при проведении обработки поверхностей методом протирания при бактериальных и вирусных инфекциях.
Оптимальными по своим эксплуатационным характеристикам считаются, в частности, дезинфицирующие средства из группы катионных поверхностно-активных веществ (КПАВ), включающие четвертичные аммониевые соединения (ЧАС), кислородосодержащие средства, третичные амины, производные гуанидина — их широко применяют для обеззараживания поверхностей в помещениях, жесткой мебели, оборудования по режиму, обеспечивающему гибель грамотрицательных и грамположительных бактерий.
Дезинфектант не должен быть агрессивным по отношению к обрабатываемым объектам.
Данными свойствами обладают дезинфицирующие такие препараты как «Эком-25М», «Эком-50М», «Эком-50», «Эковир», «Ника-Экстра М», «Ника-полицид», «Диабак», «Петролайт».
Преимуществами дезсредств на основе ЧАС является хорошая растворимость в воде, практически полное отсутствие запаха рабочих растворов, низкая токсичность для персонала. Растворы дезинфектантов на основе ЧАС обладают бактерицидной активностью в отношении возбудителей острых кишечных инфекций, пищевых токсикоинфекций, плесневых грибов. Для расширения спектра антимикробной активности ЧАС часто используют в составе композиционных дезинфицирующих препаратов совместно с другими действующими веществами, например, в таких препаратах, как «Эволайн-4Д», «Авансепт», «Славянка», «Ника-неодез», «Ника-септ», «Ультрадез-форте».
Методы дезинсекции
· Уборка с помощью пылесоса
· Защитные сетки
· Защитные костюмы
· Липкая бумага
· Высокие температуры:
· сухой горячий воздух
· водяной пар
· огонь и т.д.
· вымораживание
· ультразвуковые ловушки
· Гормональные препараты
· Регуляторы развития насекомых
· Ферромоны
· Бактериальные препараты
· Естественные враги-хищники
· Генетические методы
Инсектициды:
· контактные
· кишечные
· фумиганты
6.2.1 Механический метод
Механический метод дезинсекции – это снижение численности членистоногих путем использования различных механических приемов, таких как:
· очистка и уборка помещений и территории;
· вытряхивание, выколачивание, чистка щетками и пылесосами одежды и постельных принадлежностей;
· вылов в различные ловушки (в световые – комаров, с приманкой – тараканов, мух и др.);
· вылов на липкую ленту мух и блох;
· уничтожение с помощью хлопушек мух и комаров;
· использование защитных сеток, пологов, специальных костюмов.
Механические методы являются вспомогательными, т.к. с их помощью невозможно предотвратить распространение переносчиков за пределы очага инфекционного заболевания и обеспечить полную защиту людей от их укусов.
6.2.2 Физический метод
Физический метод – это истребление членистоногих с помощью физических средств.
Этот метод предусматривает уничтожение членистоногих главным образом путём применения высокой температуры. Как известно, температура тела членистоногих, практически не обладающих способностью к терморегуляции, зависит от температуры окружающей среды.
Каждый вид членистоногого имеет свой определенный температурный оптимум, который является наиболее благоприятным для его жизнедеятельности. Изменение температуры выше или ниже оптимальной сказывается на процессах обмена веществ.
Под действием высоких температур в организме членистоногих происходят резкие необратимые изменения (прежде всего свертывание белков), приводящие их к гибели.
В качестве дезинсекционных агентов используются огонь, горячая и кипящая вода, горячий водяной пар и воздух, глажениеутюгом белья и одежды. В ряде случаев для уничтожения членистоногих (например, тараканов) применяется вымораживание.
Огонь применяется для сжигания сорной растительности, валежника, мусора, сухостоя и ненужных вещей, пораженных клещами, блохами, клопами, вшами. Горячая вода используется при проведении санитарной обработки людей и стирке белья. Горячий водяной пар и паро-воздушная смесь применяются для дезинсекции белья, одежды и других вещей, пораженных вшами, в стационарных и подвижных паровых, пароформалиновых и горячевоздушных дезинфекционных камерах.
Скорость гибели членистоногих при воздействии высоких температур зависит от их видового состава, стадии развития, интенсивности и длительности температурного воздействия:
· кипячение белья в течение 20-30 мин. обеспечивает полное уничтожение вшей и гнид;
· при температуре 50˚С взрослые вши погибают через 1-1,5час, гниды – через 2 часа, рыжие тараканы – в течение 1-2 часов, постельные клопы - через 10 мин;
· при температуре 60˚С взрослые вши погибают через 30 мин., гниды – через 45 мин., рыжие тараканы – в течение 0,5-1 часа, а постельные клопы – через 5 мин.
Вымораживание (в зимнее время оставляют помещение открытым в течение нескольких суток при температуре -7 - 10˚С), как правило, является малоэффективным методом, так как тараканы легко проникают в самые незначительные трещины и щели, а некоторые из них, в том числе и оотеки, могут оставаться жизнеспособными в подобных условиях.
Кроме того, при понижении температуры окружающего воздуха у насекомых замедляются процессы метаболизма и наступает анабиоз. При наступлении благоприятных условий насекомые способны частично восстанавливать свою активность.
В целом, к пониженным температурам насекомые проявляют достаточную устойчивость:
· взрослые вши и гниды погибают при температуре -14 – -20˚С в течение 1 суток, при -40 – -50˚С – в течение 1-2 часов;
· постельные клопы и их яйца при температуре -4 – -6˚С остаются жизнеспособными в течение месяца;
· воздействие на этих насекомых и их яйца температуры -25˚С приводит к их гибели только в течение 1 суток.
Замачивание одежды и других предметов в воде при комнатной температуре не обеспечивает быстрого уничтожения насекомых: вши остаются жизнеспособными в течение 2 суток, постельные клопы – в течение 1 суток.
К физическим методам можно отнести и применение ультразвуковых ловушек(установок) для отпугивания тараканов, но это не нашло широкого применения, так как насекомые часто передвигаются по участкам и щелям, недостижимым для ультразвука, а также ультразвуковые колебания оказывают вредное побочное влияние на организм человека.
Физический метод не используется широко в профессиональной практике.
Биологический метод
Биологический метод– это уничтожение членистоногих во внешней среде биологическими средствами.
Этот метод основан на применении биохимических средств (гормональных препаратов, регуляторов развития насекомых, ферромонов, иммунодепрессантов), бактериальных препаратов, использование стественных врагов-хищников членистоногих.
Гормоны насекомых делятся на три группы: а) активационный (мозговой); б) гормоны линьки (экдизоны) – регулируют каждую линьку; в) ювенильный гормон – регулирует метаморфоз насекомого.
Преимуществами гормонов и их аналогов являются избирательность действия, низкая токсичность для теплокровных, эффективность в очень низких концентрациях, медленное развитие резистентности. Внесение гормонов в среду обитания резко нарушает процессы жизнедеятельности членистоногих.
Особую группу представляют регуляторы развития насекомых (РРН). РРН – это синтетические гормоны, имитирующие биологическое действие природных гормонов, их используют в периоды, когда они не должны быть в организме насекомого. Сюда входят аналоги ювенильного гормона (АЮГ), ингибиторы синтеза хитина (ИСХ).
Механизм действия АЮГ заключается в том, что введение экзогенного аналога в тот период, когда титр истинного ювенильного гормона в организме насекомых минимален, вызывает эффекты, отсутствующие при нормальном прохождении метаморфоза (образование нежизнеспособных гигантских личинок, деформация куколок, нежизнеспособность имаго, стерильность яиц). Средство метопрен (альтозид) из этой группы при добавлении в воду на 2 месяца освобождает водоём от личинок комаров.
ИСХ блокируют синтез глюкозы, необходимой для образования хитина. Под действием этих препаратов перелинявшее насекомое погибает, так как образуется мягкая и расслаивающаяся кутикула. ИСХ вызывают нарушение процесса линьки в течение всего цикла развития насекомых, действуют в момент очередной линьки с возраста на возраст. Так, средство димилин эффективно в борьбе с комарами (в нерыбохозяйственных водоёмах), тараканами и мухами. Добавление его в навоз приводило к 100% гибели личинок мух, а скармливание коровам предотвращало выплод мух в навозе.
Применение РРН ограничено, так как они не имеют острого действия и эффект проявляется не сразу, также следует вести учет стадии развития насекомого. АЮГ нестабильны в природных условиях. Наиболее эффективно использовать РРН, чередуя их с применением инсектицидных препаратов, для предупреждения развития у членистоногих устойчивости к инсектицидам.
К биологическому методу относится использование пищевых аттрактантов, половых феромонов и мозговых активационных гормонов. Они привлекают членистоногих к источникам питания, местам выплода, особям противоположного пола, мотивируют их поведение. На половые гормоны насекомые реагируют, даже если во внешней среде их только несколько молекул.
Среди синтетических веществ используются капроновая кислота, мускамор, амины, аммиак, диоксид углерода.
При применении биологического метода в борьбе с насекомыми наиболее перспективно использование культур определённых видов бактерий, вирусов и грибов, способных вызвать массовые заболевания среди насекомых.
Из известных бактериальных препаратов практическое значение имеют в настоящее время бактокулицид , бактоларвицид и сфероларвицид. В них содержится токсин, вырабатываемый патогенными для членистоногих микроорганизмами и вызывающий паралич ротовых органов и кишечника. Препараты предназначены в основном для борьбы с личинками комаров.
Бактокулицид и сфероларвицид выпускаются в виде порошка, бактоларвицид –в виде пасты и порошка. Применяются путем распыления по поверхности водоема из расчета0,5-3 кг/га – может это убрать?.Концентрация зависит от глубины водоема, степени загрязнения воды, наличия растительности. Препараты можно применять также в форме водных суспензий путем разведения50-300 г препарата в 10 л воде. Рабочая доза – 150-200 л/га. Сфероларвицид более эффективен в водоемах, загрязненных биологическими отходами. Гибель комаров наступает через 2-10 суток. Повторную обработку необходимо проводить через 10-15 суток. Препараты мало токсичны для человека и животных, не оказывают отрицательного влияния на полезную гидрофауну, но допускается обработка ими лишь водоемов, не имеющих рыбохозяйственного значения.
В качестве естественных врагов-хищников используют хищных водных насекомых (жуки-плавунцы, водолюбы, клопы-водомерки, водные скорпионы и клопы, личинки стрекоз) и личинкоядных рыб. Используется более 200 видов рыб.
Клопы-водомерки и водные скорпионы поедают личинок комаров в 2-3 раза активнее рыб.
Генетические методы очень дорогостоящи и могут быть использованы на ограниченных территориях.
При скрещивании особей некоторых видов насекомых из популяций, географически удаленных друг от друга, возникают стерильные гибриды. Эффекта стерилизации добиваются и в результате использования рентгеновского или гамма-излучения, а также хемостериллянтов (тиоТЭФ, диматиф, бисазир). Выпуск во внешнюю среду стерильных самцов насекомых, которые успешно конкурируют со здоровыми, приводит к снижению репродукционного потенциала популяции.
При нанесении на поверхность водоемов биологических пленок происходит нарушение дыхания и в результате – гибель личинок комаров. Для этих целей используют белки, хлопковую пыль, льняную пыль, сенную пленку, высшие жирные спирты, высшие жирные кислоты. В связи с технологическими сложностями этот метод широко не используется.
Применение биологических средств борьбы с членистоногими не гарантирует полное подавление их популяции; для этого требуется дополнительное использование химического метода дезинсекции.
6.2.4 Химический метод
Химический метод – это уничтожение членистоногих с помощью различных химических средств.
Применение химических ядов для борьбы с членистоногими является наиболее эффективным методом.
Химические вещества, применяемые для борьбы с насекомыми, называются инсектицидами, для борьбы с клещами – акарицидами, против вшей – педикулицидами . В зависимости от того, на какую стадию развития членистоногого направлено действие инсектицидного средства, они подразделяются на ларвициды (уничтожение личинок членистоногих), –овоциды (уничтожение яиц), имагоциды (уничтожение половозрелых форм). Общее название этих препаратов –инсектоакарициды которые в свою очередь относятся к пестицидам.
В зависимости от путей проникновения в организм членистоногих, инсектоакарициды подразделяют на контактные, проникающие через покровы тела, кишечные, проникающие через органы пищеварения, ифумиганты, проникающие через трахейную систему (рис.2). К группе кишечных ядов относятся и системные инсектоакарициды, которые попадают в организм членистоногих при их питании кровью животных или человека. Многие инсектоакарициды могут действовать сочетанно, как контактно-кишечные яды, кишечно-контактные, контактно-фумигационные и т.д.
В связи с тем что фумиганты оказывают токсическое действие на членистоногих через дыхательные пути, применяются они в газообразном или парообразном состоянии. Очевидно, что использование этих инсектицидов против тех стадий развития членистоногих, которые не имеют дыхательной системы, оказывается бесцельным.
Проникновение яда через наружные покровы связано со способностью растворяться в липидах кутикулы членистоногих. Толщина же кутикулы и строение её у отдельных видов членистоногих различны. Кроме того у членистоногого одного и того же вида в зависимости от стадии развития, от физиологического состояния свойства кутикулы неодинаковы. Все это объясняет различия как в сроках гибели от одних и тех же дозировок инсектицида, так и в эффективности одного и того же инсектицида в отношении разных стадий развития одного вида членистоногого.
При всех способах проникновения в организм членистоногих инсектицид попадает в ток гемолимфы и разносится в различные участки тела, оказывая токсическое воздействие на обменные процессы и проведение нервных импульсов.
Динамика отравления членистоногих складывается из следующих периодов: скрытого (латентного), возбуждения, токсического воздействия и гибели членистоногих (либо восстановления функций). В зависимости от вида членистоногого и специфики действия инсектицида эти периоды отравления различны по времени. Применение сублетальных дозировок препаратов в большинстве случаев приводит к выздоровлению членистоногих, но иногда за периодом кажущегося восстановления жизненных функций следует период отдаленного эффекта инсектицида на организм, вызывающий их гибель.
К дезинсекционным средствам (инсектицидам) любой группы предъявляются следующие требования:
· избирательность действия на вредных членистоногих;
· безвредность для человека и животных в применяемых дозировках, отсутствие кумуляции в организме теплокровных;
· обеспечение гибели членистоногих в возможно короткие сроки;
· остаточное действие при нанесении на поверхность;
· активность в широком диапазоне температуры и влажности воздуха;
· отсутствие отпугивающего действия на членистоногих;
· минимальная активность в отношении гидробионтов и других полезных организмов, обитающих в воде и почве;
· быстрое разложение в окружающей среде с образованием безопасных продуктов, отсутствие накопления в окружающей среде;
· доступность по цене;
· простота в применении;
· эстетичность (отсутствие маркости и неприятного запаха).
6.3 Устойчивость членистоногих к инсектицидам
Одним из важных факторов, снижающих эффективность проводимых истребительных мероприятий, является развитие устойчивости у членистоногих к применяемым для их уничтожения препаратам.
Различают устойчивость природную (естественную) и приобретенную (специфическую).
Природная устойчивость основана на биологических и биохимических особенностях организма. В популяциях членистоногих всегда существует часть особей, которые обладают природной пониженной чувствительностью к пестициду и выживают после его воздействия в дозировке, смертельной для большинства других особей данной популяции. В ряде случаев менее чувствительны к препаратам самки, личинки старших возрастов, зимующие и собирающиеся уходить на зимовку особи (мало питаются, имеют значительное количество жира).
Механизм устойчивости может быть морфологическим, поведенческим или биологическим.
В первом случае развиваются или в результате воздействия инсектицида отбираются особи, у которых морфологическая структура препятствует проникновению яда в организм. Например, у устойчивых мух отмечено утолщение хитина, в связи с чем в организм проникает меньшее количество яда.
При развитии поведенческой устойчивости членистоногое избегает контакта с обработанными поверхностями. Это связано с повышенной возбудимостью членистоногих, которая имеется у некоторых особей в популяции при самом коротком контакте с обработанной поверхностью. В результате этого особи, покидающие необработанную поверхность, не поглощают то количество инсектоакарицида, которое может вызвать их гибель и выживают.
Поскольку это качество наследуется, то популяция становится резистентной по этому признаку. Однако при принудительном контакте с инсектицидом эти особи погибают. В других случаях наблюдается неприятие инсектицидных приманок (некоторые виды комаров, мух).
Один из компонентов механизма резистентности – устойчивость места действия (мишени) инсектоакрицида. Например, у комнатных мух, резистентных к разным ФОС, устойчивая форма ацетилхолинэстеразы, у которой есть изменения в последовательности аминокислот и ориентации активного центра.
Основной вклад в формировании популяций членистоногих, резистентных к инсектоакрицидам, вносят неспецифические системы детоксикации ксенобиотиков. Членистоногие обладают ферментативными системами, способными детоксицировать большинство инсектицидов. В процессах метаболизма инсектицидов определяющую роль играют три группы ферментов: эстеразы, монооксигеназы и глутатион-S-трансферазы. У особей с высокой природной устойчивостью эти системы выражены сильнее.
Кроме того, резистентные особи способны с большей скоростью, чем чувствительные, выводить с экскрементами инсектоакарициды.
Эти свойства определяются особыми генами, и поэтому отбор выживающих особей может быстро повысить генетическую чистоту устойчивости рас.
Приобретенная устойчивость – это способность особей данного вида выживать и размножаться в присутствии вещества (химического, биологического), которое раньше подавляло его жизнедеятельность.
Развитие устойчивости часто сопровождается снижением биологического потенциала популяции: уменьшается продолжительность жизни устойчивых особей, у самок развивается меньшее количество яиц.
Увеличение дозировок инсектицидов, применение длительно действующих препаратов на больших площадях, как против личинок, так и против имаго приводят к быстрому отбору и способствуют ускорению возникновения устойчивости. Устойчивость быстрее возникает на ограниченных участках, где нет притока с необработанных территорий. Там же, где происходит обмен популяциями между обработанными и необработанными территориями, резистентность развивается медленнее и степень ее относительно невысока. Если прекратить воздействие инсектицида, то популяция членистоногих через определенное число поколений восстановит восприимчивость к яду. При возобновлении воздействия тем же препаратом устойчивость возникает вновь и быстрее.
Раса, сформировавшаяся под воздействием одного препарата, становится перекрестно устойчивой к родственным и даже не родственным соединениям. Так, насекомые, устойчивые к ФОСам, часто устойчивы и к карбаматам, так как у них сходный механизм действия. Устойчивость к ХОСам часто сопровождается устойчивостью (но в меньшей степени) к синтетическим пиретроидам.
Устойчивость возникает не только к химическим соединениям. Она отмечается и к биологическим агентам, хемостерилянтам, ингибиторам развития.
Для предупреждения формирования устойчивости следует:
· не завышать рекомендуемые концентрации;
· использовать комбинированные препараты с несколькими активнодействующими веществами (АДВ) или синергистами, усиливающими действие АДВ;
· проводить ротацию (чередование) средств с разными механизмами действия;
· вести поиск новых групп химических соединений;
· применять инсектоакрициды только в сезоны наивысшего уровня передачи или активности членистоногих;
· применять нехимические методы борьбы, когда они эффективны и рентабельны;
· осуществлять замену инсектицидов с остаточным действием инсектицидами без такового.
Основной мерой преодоления сформировавшейся резистентности и предупреждения ее развития является использование ротации инсектоакрицидов с разными механизмами действия.
Обработки препаратами с одними и теми же АДВ проводят 1-2 раза с обязательной сменой не только препарата, но и АДВ. Рекомендуется следующий порядок смены: 1-3 обработки пиретроидами – 2 обработки препаратами ФОС – 2-3 обработки кишечными ядами – обработка пиретроидами. Никогда не следует чередовать ФОС и карбаматы, пиретроиды и ХОС, фенил-пиразолы и авермектины, так как у них похожий механизм действия.
6.4 Методы и средства защиты от кровососущих членистоногих
Защита людей от нападения кровососущих членистоногих достигается механическим, химическим или комбинированным методом.
Индивидуальная механическая защита включает ношение защитной одежды (зеленого, коричневого, серого цветов), противоэнцефалитного костюма (состоит из двух рубашек-сеток: нижняя из толстой плети с размером ячеек 0,5х0,5 см., верхняя – из синтетической мелкой сетки), использование сеток, накомарников и пологов, а при коллективной защите групп людей – засетчивание окон, дверных, вентиляционных и других отверстий в стационарных или подвижных объектах.
Химический метод основан на использовании различных химических соединений (репеллентов), обладающих отпугивающим действием в отношении кровососущих членистоногих и благодаря этому предотвращающих укусы в открытые части тела и через одежду. Репелленты делят на истинно отпугивающие и дезодорирующие, а также на летучие (фумиганты) и нелетучие (контактного и кишечного действия).
Комбинированный метод предусматривает использование механических защитных средств, обработанных репеллентами, что обеспечивает наиболее эффективную защиту людей.
Средства, отпугивающие насекомых и клещей, известны с давних пор. Для этих целей ранее пользовались дымом костров, применяли деготь, скипидар, растительные масла. Использование репеллентов значительно снижает возможность трансмиссивной передачи тех или иных инфекционных заболеваний. Кроме того, нельзя не отметить такой положительный момент, как существенное повышение работоспособности человека в полевых условиях.
Наличие репеллентов в виде различных форм позволяет равномерно распределять препарат по обрабатываемой поверхности. Для нанесения на кожу используют репелленты в виде лосьонов, кремов, аэрозолей. Кроме этого применяют бумажные салфетки, пропитанные раствором определённого репеллента.
К репеллентам, которые наносятся на кожу, предъявляют особые требования, они должны:
· не раздражать кожу;
· минимально впитываться в кожу;
· быть нетоксичными;
· не вызывать аллергических реакций;
· обладать устойчивостью к смыванию.
Кремы обладают рядом преимуществ по сравнению с лосьонами. Они лучше сохраняются на поверхности кожи и более равномерно распределяются по ней, менее токсичны вследствие медленного диффундирования через кожу, а также обеспечивают более продолжительную защиту.
Продолжительность защитного действия репеллентов, нанесённых на кожу, составляет несколько часов. Наиболее длительную защиту (8- 10 ч) обеспечивают кремы, в течение 3 – 5 ч – лосьоны.
На эффективность и продолжительность действия репеллентов влияет интенсивность труда, температура и относительная влажность воздуха, численность насекомых. Обработку вещей проводят методом орошения или пропитки. Для орошения используют аэрозольные баллоны или любую распылительную аппаратуру. Продолжительность защитного действия при ежедневной носке 1 – 7 сут.
В медицинской практике наиболее часто используются следующие репелленты:
Диэтилтолуамид (ДЭТА) – прозрачная маслянистая жидкость со слабым приятным запахом. Нерастворим в воде, хорошо растворяется в органических растворителях. Эффективен в отношении комаров, мокрецов, мошек, блох, гораздо слабее отпугивает клещей.
ДЭТА входит в состав многих выпускаемых промышленностью препаратов (ДЭТА – эмульсионный, наполнитель аэрозольных баллонов рефтамид, октадэт), предназначенных для обработки открытых участков тела и для обработки одежды, палаток, занавесей (эмульгирующий концентрат ДЭТА-98, аэрозольные баллоны неорепеллент).
Продолжительность защитного действия ДЭТА от комаров и других кровососущих насекомых составляет на коже – 2-6 часов, на одежде при ежедневной носке – 3-10 суток; на сетках, занавесях – 7-15 суток в зависимости от нормы расхода препарата, метеорологических и других условий.
Бензоилпиперидин – белое кристаллическое вещество без запаха. Слабо растворим в воде, хорошо в органических растворителях. Обладает отпугивающим действием в отношении комаров, мошек, мокрецов и блох. Входит в состав выпускаемых промышленностью препаратов: крема (20%) и эмульсии (13%) ребефтал, предназначенных для обработки открытых участков тела. Продолжительность защитного действия – 3-5 часов.
Диметилфталат (ДМФ)– продолжительность защитного действия при замачивании одежды 2-4 недели, а при использовании аэрозоля 1-7 суток.
Бензимин – при 20оС действует в течение 16 часов, при более высоких температурах не эффективен. Эффективен в отношении гнуса.
Гексамат– прозрачная желтоватая жидкость со специфическим запахом. Хорошо смешивается с органическими растворителями. Обладает широким спектром отпугивающего действия на насекомых и клещей разных видов. Входит в состав выпускаемых промышленностью аэрозольных баллонов пергезоль (22%), предназначенных для обработки одежды, палаток.
Продолжительность остаточного действия – 7-10 суток.
Инсектицид перметрин обладает также свойством отпугивать все виды насекомых и является лучшим репеллентом в отношении клещей.
Применяется для защиты открытых частей тела и импрегнации одежды и палаток (остаточное действие – 14 суток).
Контроль эффективности дезинсекции
Эффективность дезинсекции оценивается по степени снижения численности членистоногих на объекте после проведения истребительных работ. Методы учета численности членистоногих зависят от их вида и характера обрабатываемого объекта.
При оценке эффективности мероприятий по уничтожению блох используют липкие листы (20х30 см) из расчета 2 листа на 10 м2 поверхности пола. Если на один лист в течение суток в среднем попало не более 2 блох, считают, что «блохи единичные», от 3 до 10 – «блох много», более 10 – «блох очень много».
Эффективность дезинсекции оценивают на 5 – 7 сутки. При низкой эффективности работы повторяют. Двух – трехкратные обработки одних и тех же помещений с интервалом 10 – 15 дней, проведенные в оптимальные сроки весной, летом и осенью освобождают дома от блох на 3 – 4 месяца.
При визуальной оценке эффективности мероприятий по уничтожению рыжих домовых муравьев обследуют в первую очередь, места хранения продуктов, обогреваемые, облицованные кафельными плитками участки стен (около раковин, ванн), подоконники и т.д. При обнаружении муравьев отмечают их численность в каждом помещении, используя следующую градацию:
· «муравьи единичные» - при обнаружении не более 10 отдельно передвигающихся муравьев;
· «муравьев много» - обнаружено до 3 путей передвижения муравьев;
· «муравьев очень много» - установлено более 3 путей передвижения.
При объективной оценке работ осматривают тару с инсектицидной приманкой и указывают: если через сутки после ее применения в одной таре в среднем обнаруживается не более 10 насекомых, то в помещении – «муравьи единичные», от 10 до 100 – «муравьев много», если более 100 особей - «муравьев очень много». Объект считается освобожденным от рыжих домовых муравьев после полного их исчезновения во всех помещениях (квартирах).
Определение эффективности выполняемых притивомушиных мероприятий проводят путем учета численности окрыленных мух, а также личинок и куколок в местах выплода, уделяя особое внимание очагам инфекционных заболеваний.
Учет численности окрыленных мух в помещениях проводят с помощью стандартных липких листов (лент), вне помещений – выловом в сетчатые мухоловки. Критерием оценки эффективности мероприятий по борьбе с окрыленными мухами является показатель численности мух в местах учета. Показателем численности называется среднее количество мух, отловленных в течение суток на липкий лист (ленту) или сетчатую мухоловку.
На канализованных участках эффективность выполненных работ считается хорошей при отсутствии окрыленных мух и удовлетворительной – при численности мух в среднем не более 1 экз. на 1 стандартный липкий лист (ленту) или 2 экз. на 1 сетчатую мухоловку. Для участков с преобладающей индивидуальной застройкой, при отсутствии канализации, и для сельской местности удовлетворительными являются, соответственно, показатели 3 и 5 экз.
Учет численности личинок и куколок мух проводят в твердых и жидких отходах и почве на площадке размером 25 х 25 см, отмечая наличие или отсутствие личинок и куколок. Критерием оценки противоличиночных мероприятий является отсутствие (или наличие) личинок и куколок в отходах и почве.
Хорошей степенью эффективности является их отсутствие; удовлетворительной – наличие в отходах единичных личинок и отсутствие куколок в отходах и почве; неудовлетворительной – присутствие куколок в отходах и в окружающей их почве.
Оценку эффективности обработок от тараканов проводят через 3 – 10 суток. При ежемесячном контрольном обследовании объект считают свободным от тараканов, если насекомые не обнаружены ни одним из объективных методов контроля ни в одном помещении.
Если при проведении контроля, последующего после обработки, вновь обнаруживают живых насекомых, строение переводят в категорию заселенных. При этом заселенной считается та площадь, где обнаружены насекомые. При обнаружении единичных живых тараканов проводится обработка мест их обитания. Заселенность тараканами объекта считается высокой, если единичных насекомых обнаруживают более чем в 20% площади помещений и низкой менее 20%.
При оценке эффективности мероприятий по уничтожению постельных клопов осматривают места возможного обитания клопов. При этом отмечают места нахождения клопов и их численность, указывая: «единичные насекомые» (1- 2 клопа – малая заселенность), или «скопления насекомых» (до 10 мест скопления насекомых – средняя заселенность; свыше 10 мест скопления – высокая заселенность), а при их отсутствии – «насекомые не обнаружены».
Критерием эффективности педикулицидных обработок является отсутствие насекомых и гнид через 7 дней после обработки.
В природных очагах заболеваний, передаваемых комарами, численность окрыленных форм учитывается до и после обработки с помощью колокола Березанцева. Колокол изготавливается из черного сатина (бязи) диаметром 1,5 м и высотой 2 м, укрепляется на проволочных обручах и подвешивается между деревьями или кольями на высоту 2-3 м от земли. В верхней части конуса оставляется отверстие, на которое надевают съемный марлевый садок.
При опускании колокола на грунт комары устремляются вверх, попадая в садок, который лучше освещать. Затем марлю завязывают снизу, садок снимают и подсчитывают численность комаров. При высокой численности комаров интенсивность их нападения можно оценивать по количеству особей, пойманных за 50 или 100 взмахов сачком вокруг стоящего человека.
Численность личинок и куколок комаров учитывается с помощью стандартного сачка диаметром 20 см, глубиной 25 см, с длиной ручки до 1,5м. Сачок изготавливается из белой бязи. Погруженный в воду сачок проводится на протяжении 1 метра на площади водоема в 1 га. Водоемы обследуются до обработки, через сутки и через 3-5 суток. Эффективной считается обработка, обеспечившая гибель не менее 98% личинок и куколок комаров.
Учет численности окрыленных мошек в природе проводится теми же методами, что и комаров. Метод учета численности преимагинальных фаз мошек заключается в отборе субстрата, к которому они прикрепляются (камни, палки, растительность). Субстрат переносится в кювету, где с помощью пинцета проводится отбор личинок и куколок.
Для учета численности слепней используются чучелообразные ловушки Скуфина. Ловушка представляет собой чехол из темной материи, надетый на каркас диаметром 50 см в нижней и 20 см в верхней части, длиной 1,5 м. Нижняя сторона ловушки открыта, на верхнее ее отверстие надевается садок из марли. Ловушка привлекает слепней цветом и формой. Залетев в ловушку, слепни устремляются вверх и попадают в садок. Учет их численности проводится днем в течение 1-2 часов.
Ловушки желательно устанавливать на берегах водоемов. Учет численности личинок и куколок слепней проводится отбором проб грунта и мха на берегах водоемов.
Численность иксодовых клещей в природе определяется путем вылова их в стациях обитания с помощью волокуши (флага) из вафельной или фланелевой ткани размером 60х100 см. Учетчик медленно протягивает волокушу (флаг) по почве или растительности. Каждые 10-15 мин. учетчик останавливается и собирает в пробирки с полосками фильтровальной бумаги (свернутых "гармошкой") клещей, прицепившихся на ткань. Обследование проводится в утренние часы после подсыхания росы или вечером по маршруту длиной не менее 0,5 км. Количество собранных клещей высчитывают как среднее на 1 учетчика за единицу учета (1 человеко-час или 1 км маршрута).
Учет численности клещей после обработки при применении фосфор-органических инсектицидов и пиретроидов проводится через 5 суток. Приняты следующие показатели численности иксодовых клещей на 1 флаго/км: очень высокая – свыше 100 экземпляров, высокая – 50-100, повышенная – 10-50, низкая – 1-10, очень низкая – менее 1 экземпляра. Если численность клещей более 3 экземпляров – обработка повторяется.
Эффективной считается обработка в случае гибели 100% клещей.
Численность личинок и нимф устанавливается путем определения их количества на зверьках, выловленных давилками или в ловчие канавки, которые располагаются на маршрутах. Число клещей высчитывается как среднее на единицу учета. Дезинсекция считается эффективной также при 100% гибели преимагинальных форм.
Численность аргасовых клещей проводят путем выбора их из субстрата. С помощью совка (лопаты, ложки) субстрат собирают в местах концентрации клещей (норы, пещеры, трещины построек, скопления мусора и т.д.) и распределяют тонким слоем на ровной поверхности. Клещей выбирают пинцетом, количество их рассчитывают по фазам развития на 1 кг субстрата.
Лекция 7. Роль грызунов в жизнедеятельности человека. Биология синантропных грызунов и их эпидемиологическое значение.
Грызуны широко распространены во всем мире, составляют около 40% млекопитающих и являются важнейшими источниками инфекции и хранителями возбудителей многих инфекционных заболеваний. Помимо эпидемиологической опасности грызуны причиняют огромный экономический ущерб.
7.1 Эпидемиологическое значение грызунов
Среди млекопитающих особенно большое эпидемиологическое значение имеют грызуны. В фауне млекопитающих СНГ они представлены 145 видами, относящимися к 13 семействам. Из них более 60 видов могут формировать природные очаги инфекционных болезней, к которым восприимчив человек.
Грызуны являются важнейшими источниками инфекций и хранителями многих возбудителей инфекционных болезней. Они могут быть переносчиками следующих возбудителей: риккетсиозов, лихорадки Цуцугамуши и Ку-лихорадки, геморрагической лихорадки с почечным синдромом (ГЛПС), чумы, псевдотуберкулеза, лептоспироза, листериоза, эризипелоида, сальмонеллеза, туляремии, бруцеллеза, токсоплазмоза, клещевого энцефалита, энцефалита, брюшного тифа, спирохитоза, кожного лейшманиоза, гименолепидоза, трихофитии, трихинеллеза, крысиного сыпного тифа, лямблиоза.
Роль отдельных видов грызунов в поддержании и распространении инфекционных заболеваний приведена в таблице 1(приложение 1).
Являясь естественными хранителями большого числа видов возбудителей, патогенных для человека, грызуны могут жить в непосредственной близости от жилищ людей (полусинантропы) или в самих жилищах (синантропы) и в силу своих экологических особенностей теми или иными путями вступать в контакт с человеком. Эпидемиологическое значение грызунов заключается также в том, что они являются прокормителями многих видов кровососущих насекомых (клещи, блохи, комары и москиты). Последние, имея широкий круг хозяев среди позвоночных животных, могут нападать и на человека.
Однако, “вредоносная” роль теплокровных носителей, их паразитов и микроорганизмов не ограничивается опасностью занесения инфекции человеку или домашним животным. Гораздо чаще вред, наносимый ими, касается хозяйственной деятельности человека: повреждение электропроводки, тары и самих пищевых продуктов, как в результате грызущей деятельности, так и путем загрязнения мочой, калом, шерстью, отпечатками лап и хвоста. Известны случаи попадания самих животных в пищевые продукты в пунктах общественного питания, на пищевых производствах.
Грызуны причиняют огромный экономический ущерб. Так, по данным ВОЗ, ежегодно во всём мире грызуны, особенно крысы, поедают и портят около 33 млн т зерновых культур и риса. Подсчитано, что 1 крыса в год в состоянии съесть более 37 кг продовольственных запасов и выделить большое количество экскрементов, портящих продукты.
Эпидемиологическое значение грызунов объясняется также их биологической особенностью быстро размножаться. Это обусловлено тремя основными моментами:
1. ранним наступлением половозрелости;
2. большим количеством пометов в год;
3. значительным количеством детенышей в помете.
Высокая плодовитость грызунов приводит к тому, что в благоприятные для размножения годы их численность резко возрастает. В результате может наступить эпизоотия, приводящая к резкому снижению численности зверьков в последующие годы. Возникновение эпизоотии среди животных может способствовать повышению заболеваемости людей.
Высокая вероятность контакта людей на территории населенных пунктов, в жилых и производственных помещениях с сообществами потенциальными носителей зоонозных инфекций и инвазий - синантропных и полусинантропных видов мелких млекопитающих требует разработки комплексных и постоянно действующих мер защиты.
Рис. 1. Крыса серая-пасюк (Ratus norvegicus)
Распространены широко в пределах Евразии и Северо-Западной Африки. Заселяют большую часть территории бывшей СССР. Отсутствуют лишь в полярных районах и Средней Азии. Лишь в южных районах ареала могут обитать в дикой природе круглый год, селясь в норах и питаясь преимущественно животной пищей. Обычно же поселяются в жилище человека (подвалы, подполья, чуланы и т. п.) или подсобных помещениях, мигрируя летом на прилежащие к жилищам территории обрабатываемых земель и долины рек. Здесь они роют норы длиной до 2—5 м и диаметром 8—10 см с 2—5 округлыми гнездовыми камерами.
У серой крысы развито стремление жить ближе к грунту, они прокапывают гнезда под фундаментом, кучами отбросов. Излюбленными местами их поселения служат сырые подвалы, подполья, первые этажи домов. В современных домах они могут обитать в пустотных блоках панельных домов, канализационных устройствах Путями перемещения и расселения их по застроенным территориям населенного пункта являются технические коммуникации, теплоцентрали, канализационная система.
Серые крысы хорошо преодолевают различные препятствия, свободно перемещаются по негладким поверхностям, прыгают вверх до 70 см и выше.
Серые крысы живут большими семьями в одних и тех же местах. Избегают человека. В случае отсутствия пищи и опасности могут нападать на животных, больных и беспомощных людей. Серой крысе присущ каннибализм – поедание в стае более слабых и больных особей. Активнее всего они ведут себя в сумеречное время суток.
Они очень плодовиты и в благоприятных условиях размножаются в больших количествах. Половозрелость наступает через 2 – 4 месяца после рождения. Беременность длиться 21 – 24 дня. Самки способны рожать от 3 до 7 раз в год, в помете может быть от 4 до 15 детенышей (в среднем - 8). Одна самка за год приносит в среднем 50 – 80 крысят. Крысята через 2 недели после рождения становятся зрячими, а через месяц – самостоятельными.
Пищевой рацион серой крысы различный. Они всеядны: потребляют мясо, рыбу, зерновые продукты, пищевые отходы.
Наиболее излюбленной пищей является черный хлеб, вареная колбаса, копченое сало, творог, сметана, мясной фарш. Суточная норма сухой пищи равна 21 – 28 грамм и воды 14 – 30 мл. Если в помещении для крысы нет доступа к воде и отсутствуют влажные корма, они такие помещения покидают. Незначительное изменение привычной обстановки на объекте резко повышает осторожность грызунов.
Серые крысы играют заметную роль в эпидемиологии чумы. Являясь восприимчивыми, часто заболевают острой формой инфекции и погибают. В отдельных случаях инфекция может иметь хроническое течение, поддерживая эпизоотии чумы среди крыс. Заражение человека может произойти при нападении на него зараженных блох, паразитирующих на крысах.
Крысы являются также основным резервуаром возбудителей иктерогеморрагического лептоспироза (болезнь Васильева—Вейля), возбудителей крысиного и везикулезного риккетсиозов, а также естественными носителями возбудителей водной лихорадки. Естественное носительство крысами иктерогеморрагических лептоспир обнаружено во многих странах Европы, Азии и Америки.
Крысиный риккетсиоз протекает у крыс подостро, возбудитель сохраняется в их организме несколько месяцев. Распространяется трансмиссивным путем (преимущественно через блох, а также через вшей крыс и гамазовых клещей).
Везикулезный риккетсиоз распространяется трансмиссивным путем. Основным переносчиком возбудителей являются гамазовые клещи.
Крысы имеют важное значение также в эпидемиологии трихинеллеза.
Заражение трихинами крыс происходит при пожирании диких животных или выброшенных остатков и туш убитых свиней. Погибшие (возможно, и от трихинеллеза) крысы являются источником заражения свиней, а свиньи — людей.
Черная крыса (Рис. 13). Отличается от пасюка несколько меньшей величиной, более тонким телом и окраской. Черная крыса имеет массу тела около 200 грамм, длина 13 – 19 см. В СНГ распространена преимущественно в Европейской части.


Рис.2. Крыса черная (Rattus rattus).
Данный вид крыс для поселения отыскивает сухие места. Обладают более выраженной способностью к лазанию, живут в верхних этажах зданий, на чердаках деревянных строений, а в природе ведут полудревесный образ жизни. Часто встречается в хлебных элеваторах, складах. Контакт черной крысы с человеком более тесен. Они проявляют активность не только ночью, но и днем.
Черные крысы предпочитают растительную пищу (зерно, мука, плоды, овощи). Суточная норма сухих продуктов составляет 14 – 28 грамм, воды – 28 мл.
Размножаются медленнее, чем пасюки. В год самки дают 3 – 4 помета по 4 – 8 детенышей.
Эпидемиологическое значение сходно с таковым пасюка.
Домовая мышь (Рис. 3). Домовая мышь имеет длину около 9 см. Масса тела взрослой особи от 14 до 21 грамм. Распространена в Евразии и Северо-Восточной Африке. В СНГ встречается по всей территории, кроме северной и Северо-Восточной Сибири, высокогорных районах Памира, Тянь-Шаня и Кавказа.


Рис.3. Домовая мышь ( Mus muskulus ).
Домовая мышь встречается всюду, где только поселяется человек. В природных условиях живут в норах, состоящих из 2 – 3 подземных ходов и гнездовой камеры. В населенных пунктах поселяются преимущественно в жилище человека, а также в сараях, складских и подсобных помещениях.
Могут жить в мебели, старых вещах, пространствах внутри стен и многих других местах. В помещениях, где поселились мыши, может присутствовать специфический запах, присущий их моче.
Размножается домовая мышь 3 – 8 раз в году, принося по 4 – 8 детенышей. Первые детеныши покидают гнездо на 12-14 день жизни.
Половозрелость наступает на пятой неделе. В летнее время размножается интенсивнее, чем зимой.
Домовая мышь предпочитает сухие корма (крупы, хлеб),в открытых стациях питается в основном зерном. Суточная норма около 3 грамм сухой пищи и 1,5 мл воды.
Для домовой мыши характерно перемещение из построек в открытую природу весной, и в постройки – осенью. Кроме активных миграций, значительную роль в их распространении играют пассивные перемещения вместе с грузами (ящики с продуктами, промышленными товарами и т.д.), внутри которых зверьки устраивают свои гнезда.
В помещении мыши передвигаются вдоль стен. Мыши очень чистоплотны, многократно умываются и чистят мех.
Имеет важное эпидемиологическое значение как источник инфекции при туляремии, чуме, клещевых сыпнотифозных лихорадках, лептоспирозе, трихинеллезе. Будучи высокочувствительной к туляремии, домовая мышь нередко вовлекает в эпизоотии серых полевок на гумнах, откуда заносит инфекцию в жилье человека.
Сравнение некоторых особенностей экологии и поведения синантропных видов грызунов представлены в таблице 2 ( приложение 2).
Рис. 4. Водяная полевка (Arvicola terrestris).
Распространены от западных границ СНГ до о. Байкал и р. Лена. Отсутствуют в пустынях Казахстана и в Средней Азии. На север проникают до побережья северных морей. Заселяют поймы рек, берега озер, искусственных морей и других водоемов (кроме горько-соленых).
Роют норы вдоль оросительных каналов, на полях и огородах. Встречаются в стогах сена и постройках человека. К осени часто концентрируются на полях и огородах, особенно расположенных близ пойм.
Норы поверхностные, редко достигают глубины залегания до 1 м. Ходы различной сложности могут достигать 1—50 м, иметь множество выходов (10 и более) и несколько камер (7—8).
Размножаются в течение всего лета, принося на сезон до 4 пометов по 6—8 детенышей в каждом. Питаются водяными растениями, луговыми травами, а также животной пищей (насекомые, моллюски, мелкая рыба). Имеют промысловое значение.
Водяная полевка является одним из основных хранителей возбудителей туляремии. Она болеет острой формой инфекции и большей частью погибает при явлениях септицемии. Эпизоотии туляремии среди крыс наблюдаются в периоды их массового размножения и приводят к гибели множества зверьков (нередко до 96% состава популяции). В период эпизоотии среди водяных крыс больные зверьки и их трупы заражают всю территорию очага, воду, почву и других зверьков, а также кровососущих насекомых (комары, мухи-жигалки, слепни) и клещи.
Обыкновенная полевка. Размеры сравнительно небольшие, длина тела до 13 см (рис. 5). Встречается в Европе и Азии. Селится на полях в стогах, также их можно обнаружить в садах, на лесных полянах, опушке леса. В СНГ распространена от западных границ до р. Обь. К северу доходит до Ленинградской, Архангельской и Новосибирской областей, к югу - до Черноморского побережья, Закавказья и Казахстана. Встречается в Западной Европе, Турции и Северном Иране. Питается растительной пищей, поедая наиболее сочные части растений.


Рис.5. Обыкновенная полевка (Microtus arvalis).
Обыкновенные полевки живут в верхних слоях почвы, где устраивают норы на глубине 10-25 см. Размножаются главным образом в течение теплого времени года. Один из самых плодовитых грызунов. Они отличаются ранним достижением половой зрелости (13 – 18 дней), малым сроком беременности (16 – 18 дней) и солидным выводком (5 – 6 особей). В год приносят 4-6 пометов.
Обыкновенные полевки являются наиболее многочисленными грызунами, обитающим на плодоовощных базах. Заселение плодоовощных баз обыкновенной полевкой происходит путем активного проникновения грызунов с прилегающих полей, лугов, пустырей. В годы высокой численности особенно часты случаи завоза грызунов с овощами на авто - и железнодорожном транспорте из отдаленных районов.
В выборе мест обитания полевки неприхотливы. Склонны к сезонным миграциям, зависящим от климатических условий и характера хозяйственной деятельности человека. Весной во время паводков селятся на возвышенных участках (кочки леса, межи, остатки соломы на полях, а также в населенных пунктах и т. п.). К середине мая после подсыхания полей мигрируют в открытые полевые и луговые угодья. Во время пахоты, сенокоса, уборки урожая легко меняют места обитания, чему способствуют простое устройство нор, кратковременный период беременности и др. После уборки урожая нередко концентрируются в скирдах, ометах и кучах мякины, где продолжают интенсивно размножаться.
Обыкновенные полевки являются носителями таких инфекционных болезней, как туляремия, лептоспироз, геморрагическая лихорадка с почечным синдромом и др.
Дикоживущие грызуны
Эта группа животных способна существовать неопределенно долгое время только в дикой природе. Преобразование человеком ландшафтов приводит к исчезновению в их пределах зверьков и сокращению их ареала.
Малый суслик. Распространен в степной, полупустынной и пустынной зонах, к северу от южных границ лесостепи. В зону пустынь заходит по участкам степей и долинам рек. Наиболее плотные поселения (до 100 экземпляров на 1 га) отмечаются на выгонах у населенных пунктов, в местах водопоя, вдоль грунтовых дорог (рис.6).


Рис.6. Малый суслик — Citellus pygmaeus
В состоянии летней и зимней спячки суслики проводят от 6,5 до 9 месяцев. Размножаются один раз в году, приносят в среднем 5—8 детенышей. От зимней спячки суслики просыпаются вслед за установлением положительных температур. Далее наступает период спаривания (10—12 дней) беременности самок (20—25 дней), лактации (25 дней). Затем молодые суслики переходят к самостоятельному питанию. Самки покидают детенышей, и последние расселяются. Половозрелые самцы и неразмножившиеся самки строят норы, и в конце мая — начале июня залегают в спячку. Через 1,5 месяца залегают размножившиеся самки и еще через 1,5 месяца — молодые суслики.
На малых сусликах паразитирует большое количество блох — переносчиков чумы. В норах сусликов встречаются иксодовые клещи.
Алтайский сурок. Широко распространен в горных степях Алтая, хребтах центрального, восточного и северного Тянь-Шаня и в других горных местах со слоем мелкозема, достаточно мощным для рытья нор. В настоящее время наибольшая плотность сурков приходится на альпийские луга. В горах с лесным поясом сурки селятся на полянах.
Алтайский сурок — один из наиболее крупных современных представителей отряда грызунов. Длина тела достигает 58 см, масса 5—7 кг. Питаются сурки травянистыми растениями (рис.7).


Рис.7. Алтайский сурок.
Сурки являются носителями чумной инфекции. Заразившись перед спячкой, они сохраняют инфекцию в латентном состоянии. Весной инфекция обостряется. Эпизоотии среди сурков сопровождаются их падежом.
Блохи сурка принадлежат к «блохам шерсти» и отличаются значительной продолжительностью жизни. Эти блохи преобладают над другими видами в местах постоянных чумных эпизоотии у сурков.
Алтайский сурок является промысловым видом. Заготовляют шкуру и жир. Охоту ведут в период от конца линьки до залегания в норы. В это время и возможен тесный контакт человека с сурком, что может привести к заболеванию.
Из рода сурков эпидемиологическое значение в распространении чумы имеют так же сибирский сурок, или тарбаган, и длиннохвостный, или красный, сурок. По экологии и течению эпизоотии тарбаган и красный сурок близки к алтайскому.


Рис.8. Сибирский сурок Рис. 9. Длиннохвостый сурок
Большая песчанка. Распространена в пустынях и полупустынях Казахстана и равнинных частях Средней Азии от прикаспийского района Урала, Эмбинского междуречья, севера Приаральских Каракумов, южного Прибалхашья на севере и низовий р. Лепса на востоке. Большая песчанка — одна из самых крупных песчанок, относится к семейству хомякообразных (длина тела до 200 мм). Хвост с развитой метелкой черноватых волос (рис.21).


Рис.10. Большая песчанка.
Питаются большие песчанки преимущественно зелеными частями травянистых растений и ветками кустарников, особенно саксаула. Едят верблюжью колючку, злаки. Хорошо лазают по деревьям и обгрызают ветви саксаула на высоте до 3 м. Живут семьями в сложных норах. Селятся большими колониями, иногда занимающими до 2 га. Такие обширные колонии создаются деятельностью многих поколений в течение нескольких лет. Норы имеют несколько этажей на глубине до 2,5 м. В одной норе обитает 4—6 зверьков.
Большие песчанки тяготеют к окраинам жилых населенных пунктов, разрушенным постройкам, кладбищам и т. д. Размножение идет от ранней весны до осени. Самки приносят за сезон 2—3 выводка по 5—6 детенышей.
В зимнюю спячку не залегают. Активны в дневные часы. В жаркие дни отсиживаются в норах. Зимой в сильные морозы на поверхность не выходят.
На песчанках паразитируют многочисленные блохи.
Весной песчанки спариваются, расселяется молодняк. Кроме того, весной организм песчанок ослаблен. Все это создает условия для оживления эпизоотии и распространения чумы среди грызунов. В разгар лета, когда активность песчанок падает, эпизоотия ослабевает. Период заготовок кормов способствует новому подъему заболевания. Зимой число чумных заболеваний снижается. Таким образом, для большой песчанки основными сезонами активизации чумы являются весенний и осенний. Большие песчанки являются также резервуаром кожного лейшманиоза.
Кроме большой песчанки, эпидемиологическое значение при чуме, кожном лейшманиозе и клещевом возвратном тифе имеют полуденная, гребенщиковая, а также краснохвостая песчанки.
Выяснение положения животного (например, отловленного в природе, в очаге болезни) в биологической систематике производится по специальным определительным таблицам, которые в подавляющем большинстве случаев составляются на основе различий морфологических признаков видов.
Лекция 8. Дератизация на предприятиях пищевой промышленности и общественного питания. Методы и средства борьбы с грызунами.
8.1 Общие вопросы дератизации
Дератизация– это комплекс противоэпидемических мероприятий по борьбе с грызунами, являющимися источниками инфекции или наносящими экономический ущерб.
Дератизация как система организационных, санитарно - технических, санитарно - гигиенических и истребительных мероприятий, направленных на регулирование численности грызунов, осуществляется с целью обеспечения санитарно - эпидемического благополучия населения, создания благоприятных условий жизнедеятельности человека путем уменьшения и (или) устранения воздействия грызунов на человека.
Дератизационные мероприятия подразделяются на профилактические и истребительные.
Профилактические мероприятия в системе дератизации направлены на лишение грызунов корма, пространства и условий для гнездования.
Эти мероприятия предусматривают создание таких условий, при которых затрудняется или полностью ликвидируется проникновение и поселение грызунов в различных постройках или вблизи них, а так же исключается доступ грызунов к продуктам питания и другим объектам, которым может быть нанесён экономический ущерб. Профилактические меры борьбы направлены на изменение условий внешней среды в неблагоприятную для существования грызунов сторону.
Это достигается путем проведения санитарно-гигиенических, санитарно-технических и агротехнических мероприятий.
Санитарно-гигиенические мероприятия сводятся к систематическому поддержанию чистоты в жилых, торговых и производственных помещениях, на дворовых территориях и строительных площадках. Пищевые продукты должны храниться в недоступном для грызунов месте или в соответствующей таре. Необходимо правильно утилизировать отбросы и мусор (сжигание, компостирование), а также правильно размещать, эксплуатировать и содержать свалки.
Санитарно-технические мероприятия проводятся при капитальном строительстве или текущем ремонте зданий (помещений) и предусматривают специальные меры, которые не позволяют грызунам проникать в здания различного назначения. Вентиляционные и другие отверстия, окна подвалов, люки, низко расположенные над поверхностью земли, должны быть закрыты проволочной сеткой. Полы в подвалах обязательно должны быть из бетона толщиной не менее 10 – 12 см, межэтажные перекрытия – плотными, без полостей. При строительстве холодильников, элеваторов, продуктовых складов и т.п. должны выполняться специфические требования по созданию крысонепроницаемости.
Агротехнические мероприятия являются одним из наиболее эффективных способов создания неблагоприятных условий для существования и размножения грызунов в открытых стациях. Эти мероприятия ведут к существенному уменьшению численности их и, как следствие, к предупреждению эпизоотий среди грызунов, а значит к уменьшению их эпидемиологической опасности для человека. Для этого очень важно уборку урожая проводить своевременно, в кратчайшие сроки и с наименьшими потерями. Нельзя оставлять необмолоченный хлеб на полях и зерно на токах.
Рис.11. Живоловка для отлова
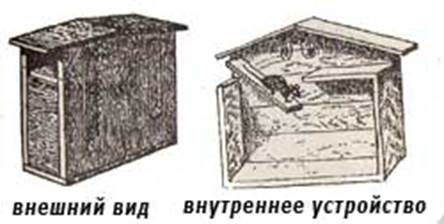
Рис.12. Ловушка Цюрнера мышей и крыс
Рис.13. Ловушка «верша»

Рис.14. Ловушка для крыс Тишлеева.
· убивающие- электрические ловушки, тарелочные дуговые капканы, пружинные и проволочные капканы, электорнные ловушки (рис.15, 16,17).

Рис.15. Пружинный капкан с пластинкой для приманки

Рис.16. Электронная крысоловка Rat Zapper 2000

Рис.17. Пружинный капкан
В основном механический способ применяется на объектах, на которых ограничено применение химических и биологических средств борьбы с грызунами (например, в детских учреждениях, на пищевых предприятиях).
Применение орудий для отлова живых грызунов, позволяет удалять их с объектов дератизации, не порождая проблем, связанных со смертью (разложение с появлением запаха гниения, переходом эктопаразитов грызунов с основных хозяев на случайных других, в том числе и на людей).
Количество грызунов, вылавливаемых с помощью механических орудий лова, зависит от их численности на данном объекте, количества приманки, правильности расстановки и использования орудий лова.
Орудия лова размещают в местах наибольшего скопления грызунов, которые определяются следами их жизнедеятельности, заслеженными пылевыми площадками, наличием нор. Ловушки наиболее эффективны при расположении их в тихих, укромных местах, ближе к стенам и перегородкам, по ходу плинтусов.
Количество орудий лова, требующихся для расстановки на отдельных объектах или на открытых площадках, определяются в зависимости от вида грызунов и интенсивности заселения, санитарно-технического состояния заселенных грызунами мест. В среднем один капкан следует устанавливать на каждые 10-30 м2заселенной площади, одну живоловку – на 50-70 м2. По периметру заселенных помещений, где чаще встречаются выходы из нор и происходит перемещение грызунов, орудия лова ставят в большем количестве, чем в центре.
Орудия лова для отлова живых грызунов всегда должны быть чистыми и в исправном состоянии. Мыть и чистить их следует по мере загрязнения водой без добавления дезинфицирующих и других пахнущих веществ. Деревянные части орудий не следует окрашивать.
Большое значение имеет подбор приманки. Запах и вид приманки, закладываемой в механические орудия лова, должны привлекать грызунов.
Для большей эффективности следует за несколько дней до применения механических орудий лова исключить любую возможности доступа грызунов к пище. Приманки всегда должны быть свежими и незагрязненными и сменяться по мере необходимости, но не реже чем через 1-2 дня в теплое время года, в холодное – через 3-4 дня.
В качестве приманки в пружинных капканах используют хлеб, колбасу, сало, рыбу, овощи. Продукты режут на мелкие кубики со стороной не более 1 см (массой 0,5-2 г). В качестве приманки в ловушках Тишлеева рекомендуется использовать поджаренные измельченные семечки подсолнечника, тыквы, кабачков. Выбор пищевой приманки следует проводить с учетом специфики объекта. На хлебокомбинатах лучше использовать в качестве приманки овощи, рыбу, мясо, а на мясоперерабатывающих предприятиях – зерно, крупу, муку.
Для изготовления клеевых ловушек используют липкие массы (клей) (рис.18).


Рис.18. Клей и клеевая ловушка
Для отлова мышей липкую массу наносят тонким слоем на подложки. Клеевые ловушки раскладывают по тропам грызунов, около их выходов из нор. При низких температурах липкая масса не должно использоваться по причине замерзания. Следует учесть, что в отношении мелких грызунов (мышей и полевок) учетно-клеевые ловушки достаточно эффективны, но крайне не экономичны, особенно при низкой численности грызунов.
Электрические ловушки. Принцип действия основан на использовании электрического тока в несколько миллиампер при напряжении до 5000 вольт. Грызун, проникая во внутрь ловушки, замыкает электрическую цепь и поражается ударом электротока, приводящем к гибели.
Пойманных с помощью механического способа живых грызунов умерщвляют в резиновых (клеенчатых, пластиковых мешках), в которые добавляют вату, смоченную в 50г 25% нашатырного спирта или таком же количестве эфира.
Павших грызунов на объектах собирают с помощью щипцов, защищая руки резиновыми перчатками и складывают в специальные мешочки, а затем закапывают в землю на глубину не менее 0,5 м, предварительно засыпав сухими препаратами хлорной извести, хлорамина или их растворами 10-20% концентрации, по эпидемиологическим показаниям направляют на исследование в лабораторию ООИ.
Акустический способ дератизации - использование ультразвуковых колебаний для отпугивания грызунов. Современные ультразвуковые отпугиватели не убивают грызунов, а лишь отпугивают их особыми звуковыми сигналами, которые практически не улавливает человеческое ухо, но отлично слышат все вредители в округе.
Грызуны быстро привыкают к ультразвуковым сигналам и перестают на них реагировать. Применяется этот способ совместно с другими методами и способами (рис. 19).

Рис. 19. Современный ультразвуковой
Рис.20. Готовые отравленные пищевые приманки.
Отравленные пищевые приманки для разных видов грызунов следует подбирать с учетом их пищевых предпочтений.
В качестве пищевой основы, в составе отравленных пищевых приманок с использованием ядов острого действия, рекомендуется применять следующие продукты и их смеси:
для серых крыс - цельное зерно пшеницы или овса, жареную рыбу, мясо, воду с сахаром (10%), сгущенным молоком, пиво;
для домовых, полевых, лесных мышей - мелко раскрошенный хлеб с 3% растительного масла; кашу; смесь мелкодробленых круп (пшеницы, овсянки, ячменя, проса) с добавкой подсолнечного или др. масла; слегка поджаренное дробленое зерно или мука;
для черных крыс, водяных крыс, полевок – шинкованная морковь, спелые помидоры, арбузы и другие овощи и фрукты, воду с сахаром (10%), сгущенным молоком, пиво.
По типу действия яды, используемые для уничтожения грызунов с помощью пищевых приманок, подразделяются на:
· яды острого действия (нейротоксические);
· яды кумулятивного (хронического) действия (антикоагулянты).
Рис. 21. Фосфид цинка
Фосфид цинка сильно ядовит не только для грызунов, но и для других животных, а также для человека, поэтому при его применении необходима особая осторожность. Хранить фосфид цинка нужно в сухом, хорошо вентилируемом помещении. Для приманок следует брать только сухой препарат.
Альфанафтилтиомочевина (Крысид) — порошок серого или серо-бурого цвета, горьковатый на вкус (рис. 22). Почти не растворим в воде, хорошо растворяется в эфире и спирте. Токсическое действие крысида сильнее всего проявляется на взрослых серых крысах и взрослых домовых мышах.


Рис. 22. Альфанафтилтиомочевина (Крысид)
Смерть грызунов наступает при явлениях поражения легочных капилляров, прекращении дыхания с последующей остановкой сердечной деятельности. Крысид применяют в приманках; им можно также опыливать норы и тропы грызунов. Приманки с крысидом не рекомендуется подвергать термической обработке. Сначала нужно сварить пищевую основу, а затем после охлаждения смешать ее с ядом.
Так как при частом применении отравленных приманок с крысидом у грызунов появляется устойчивость к атому препарату, применять крысид следует с перерывами в несколько месяцев, чередуя с другими средствами.
Продолжительное хранение крысида в сухом помещении при разной температуре не изменяет его качества, а хранение в сыром помещении приводит к образованию комков, что вызывает необходимость дополнительного просеивания.
Фторацетамид (из группы фторорганических соединений) – кристаллический порошок белого или сероватого цвета без запаха, хорошо растворяется в воде (рис. 23). В приманке действует медленно. Летальная доза для крыс – 7-10 мг (35-50 мг/кг), мышей – 0,4 мг (35 мг/кг). Является ферментным ядом нарушающим деятельность центральной нервной системы.
Ядовит для человека и домашних животных.


Рис. 23. Фторацетамид
Препарат используется в приманках из хлеба, различных каш. Содержание вещества – 0,5% к общему весу массы. Сухое зерно пропитывают 1% водным раствором в течение 12 часов и последующей его просушкой. Для борьбы с крысами рекомендуется предварительно прикармливать их в течение 4-6 дней. Препарат нельзя использовать для опыления нор и троп грызунов, а также применять в детских, лечебных учреждениях и пищевых предприятиях, так как он токсичен для людей и домашних животных. Эффективны приманки в полевых условиях, угольных шахтах и канализационной сети.
При гибели грызунов от фторацетамида погибают и блохи, обитающие в их покрове. Блохи, после сосания крови грызунов, отравленных препаратом, теряют способность передавать инфекцию.
Тиосемикарбазид (производное тиомочевины) – стойкий твердый кристаллический порошок (рис. 24), малорастворимый в холодной воде (до 3%), более растворимый в горячей воде (до 10%). Опасен для человека и теплокровных, поэтому применение его требует соблюдения предосторожностей.
Острое отравление после поедания приманки с препаратом наступает через 6 часов: грызуны приходят в возбуждение, у них появляются конвульсии, обильное слюнотечение, припадки.

Рис. 24. Тиосемикарбазид
У грызунов может развиться привыкание и выработаться устойчивость к препарату, поэтому дератизацию надо проводить в короткие сроки (не более 7 дней), после чего яд следует сменить. Применение препарата можно возобновить только через 2 месяца после последнего его использования.
Устойчивость к тиосемикарбазиду распространяется и на крысид, поэтому тиосемикарбазид нельзя применять после крысида, и наоборот.
Пищевые приманки с тиосемикарбазидом целесообразно применять после фосфида цинка, зоокумарина, ратиндана.
Тиосемикарбазид — стойкий препарат, его токсические свойства сохраняются в течение нескольких лет при хранении в сухом помещении при обычной температуре.
Тиосемикарбазид добавляется к пищевым приманкам, изготовленным из хлеба и каши, содержащим 5% препарата и 3% подсолнечного масла. На крысиную нору кладут 10-15 г приманки, на мышиную – 3-5 г. Препарат также можно использовать для опыления нор в 5% концентрации. Для полевой дератизации готовят зерновую приманку. Для этого зерно заливают горячим 5% раствором препарата из расчета 500 мл/кг крупы, овса, пшеницы. Затем смесь подогревают слегка до полного поглощения раствора зерном (15-20 мин.) и зерно подсушивают.
Быстрота и интенсивность действия ядов этой группы приводит обычно к тому, что не все особи грызунов поглощают достаточное количество приманки. С процессом развития отравления у грызунов возникает настороженность и отказ от повторного употребления приманки с ядом. Грызуны, не успевшие проглотить летальную дозу яда острого действия, остаются живыми, начинают избегать любые приманки. В отдельных случаях вырабатывают устойчивость, и организм грызуна становится маловосприимчив к этим препаратам. Симптомы отравления фторацетамидом и сульфатом таллия развиваются сравнительно медленнее и приманки с этими видами хорошо поедаются даже на фоне не отравленного корма. В составе сухих приманок крысы легко распознают яды острого действия, тогда как влажные приманки с этими же ядами поедаются ими лучше.
Длительное применение одного вида отравленных пищевых приманок, приводит к распознаванию их грызунами, меньшему их поеданию и меньшей гибели зверьков. Чередование пищевой основы и ядов, применение нескольких приманок с ядами острого действия позволяет преодолеть реакцию вторичного избегания (аверсию) отравленных пищевых приманок грызунами. Не исключено, что при широком выборе приманок серые крысы хуже различают их по степени опасности.
С целью получения наилучшего результата, приманки с ядами острого действия раскладывают после предварительного приучения грызунов к не отравленной пищевой основе (прикорму) до начала непосредственного истребления. Этот прием получил название предварительного прикорма. В зависимости от осторожности крыс и привлекательности предложенной приманки длительность предварительного прикорма может составлять до двух недель и более.
После того, как поедание не отравленной приманки стабилизировалось, в этих же местах кладут ядовитую приманку в количестве значительно меньшем, чем поедался прикорм. Спустя 1-2 суток отравленную пищевую приманку следует собрать и уничтожить, с целью снижения опасности случайных отравлений. При обработке помещений, заселенных домовыми мышами предварительный прикорм разными приманками без яда позволяет выявить наиболее предпочитаемые ими продукты.
При проведении дератизации вне строений в предварительном прикорме нет необходимости.
Недостатками приема предварительного прикорма являются дополнительные затраты времени и повышение затрат на проведение дератизации.
Яды хронического действия
К ядам хронического, кумулятивного действия относятся антикоагулянты.
При однократном попадании в организм грызунов небольших количеств этих ядов симптомы отравления практически не проявляются, однако при многократном потреблении их токсичность резко возрастает, вызывая снижение уровня протромбина, кровоизлияния и гибель грызунов.
Приманки с ядами кумулятивного действия поедаются грызунами охотно и многократно. Их применение не требует предварительного прикорма, представляет меньшую опасность случайных отравлений (невысокая концентрация яда), возможность долговременного использования, в том числе крупными порциями (от 0,5 до 5,0 кг).
Применение приманок с ядами кумулятивного действия упрощает процесс дератизации, экономичен, снижает затраты рабочего времени.
Антикоагулянты относятся к двум группам органических соединений: индандионы и кумарины. По числу доз, вызывающих гибель они разделяются на 1 и 2 поколение.
К первому поколению относятся следующие соединения: дифенацин (ратиндан), этилфенацин, трифенацин, варфарин (зоокумарин), куматетралил, хлорфацинон.
К антикоагулянтам второго поколения: изоиндан (тетрафенацин, изопропилфацинон, изоцин), бродифакум, флокумафен, дифетиалон, бромадиолон, дифенакум.
Дифенацин (ратиндан) - голубой или иного цвета (что зависит от используемого красителя) кристаллический порошок, без вкуса и запаха. Стабилен при хранении (рис.25).


Рис. 25. Дифенацин (ратиндан)
Нерастворим в воде. Растворяется в органических растворителях, уксусной кислоте. Препарат сравнительно не опасен для домашних животных. Применение в чистом виде для дератизации запрещено ввиду его сильной токсичности.
Выпускается в виде 0,5% дуста с крахмалом или мукой под названием «Ратиндан», используют для приготовления отравленных пищевых приманок, а также для опыления нор, выходов из них и путей передвижения грызунов. Для крыс и мышей применяют 3% смесь. Для гибели серой крысы достаточен четырехкратный прием ратиндана по 2 мг или 0,01 мг дифенацина. По своим ратицидным свойствам ратиндан примерно в 25 раз токсичнее зоокумарина. После поедания приманки с ратинданом крысы погибают через 5 -8 дней. Яд нарушает проницаемость стенок кровеносных сосудов и вызывает кровоизлияния. Однократная смертельная доза ратиндана для мышей — 4 мг, для крыс - 6-8 мг. При хранении в сухом помещении в течение 2 лет ратиндан не теряет ядовитых свойств.
Приманку готовят на хлебе, крупах, муке и пищевых отходах. Полезно комбинировать метод жидких приманок с опылением. Для уничтожения мышей расходуют 5-10 г приманки, крыс – 100-200 г на одно место. При опыливании нор нужно 10-15 г на один выход из норы. При опыливании воды – 3 г при толщине не более 1 см. При приготовлении приманок необходимо соблюдать меры предосторожности (ношение масок или респираторов). Препарат в виде 1% дуста хорошо зарекомендовал себя в природных очагах чумы для пропыливания нор. Ратицидный эффект пропыления составил 90%.
Смесь индандионов (дифацинона, этилфенацина, изоиндана) обладает большим эффектом, чем каждое вещество по отдельности, что связано с их фармакинетикой и влиянием на разные точки системы свертывания крови.
Варфарин (Зоокумарин) -1,5% мелкодисперсный порошок фиолетового цвета (рис.26). Применяется в очагах природно-очаговых инфекций, застроенных и незастроенных частях населённых пунктов, включая жилые помещения, пищевые, детские и лечебные объекты (в недоступных для детей местах или в их отсутствии).


Рис. 26. Варфарин (Зоокумарин)
Отравленные приманки готовят на основе пищевых продуктов (зерно, круто отваренные каши, хлебная крошка, мука и т.д.), к которым добавляют и тщательно перемешивают средство с таким расчетом, чтобы содержание ДВ в готовой приманке составляло 0,025%. Для наибольшей привлекательности приманок в них добавляют 3% растительного масла или 10% сахарного песка.
Для борьбы с серыми крысами решающее значение имеет привлекательность приманки по сравнению с принадлежностью применяемого антикоагулянта к первому или второму поколению. Для борьбы с домовыми мышами большее значение имеет токсичность входящего в состав приманки антикоагулянта (антикоагулянты второго поколения более эффективны), по сравнению с привлекательностью приманки (свежесть, сохранность и количество).
При борьбе с серыми крысами, обитающими во влажных местах, для лучшего сохранения приманки, целесообразно приготовление парафинированных брикетов.
Антикоагулянты довольно быстро завоевали признание во всем мире и прочно заняли ведущее место среди других химических средств борьбы с грызунами. Это было достигнуто благодаря следующим приёмам и обстоятельствам:
· используемая группа ядов не вызывает острых болевых ощущений, действует замедленно и в результате, как правило, не провоцирует образования реакции избегания;
· концентрация яда в приманке снижена до порога вкусовой чувствительности, когда зверьки его практически не ощущают, что не вызывает у грызунов настороженности и животные повторно поедают отравленную приманку в тех же количествах вплоть до самой гибели;
· вместо крохотных порций приманки раскладывают в одном месте 0,2 – 0,5 -1,0 кг приманки и более, с таким расчетом, чтобы приманку могли поедать все зверьки, обитающие в данном месте;
· вместо быстро портящихся продуктов стали использовать измельченные, долго сохраняющиеся продукты, что не требует предварительного прикорма и существенно снижает трудоемкость работ.
Перспективным направлением считается изучение стерилянтов. Для снижения численности грызунов, особенно в природных условиях, применяют вещества, не только вызывающие гибель, но и действующие на половую систему грызунов, т.е. снижающих их плодовитость. К ним, например, относится «Севин», который кроме инсектицидного эффекта, нарушает в организме у грызуна сперматогенез и эстральный цикл, что приводит к снижению численности популяции грызунов.
Литература
1. Статья 225 ТК РФ. Обучение в области охраны труда.
2. Статья 221 ТК РФ. Обеспечение работников средствами индивидуальной защиты.
3. Статья 223 ТК РФ. Санитарно-бытовое обслуживание и медицинское обеспечение работников.
4. Смирнова, Е.В. Дезинфекция в организациях общественного питания// http://dezr.ru/84-dezinfektsiya-na-predpriyatiyakh-obsluzhivaniya/85-dezinfektsiya-v-organizatsiyakh-obshchestvennogo-pitaniya, 2015
5. Вилькович В.А. Дезинфекционное дело. – М.: Медицина, 1987. – 429 с.
6. Вилькович В.А. Руководство к практическим занятиям по дезинфекционному делу. – М.: Медицина, 1983. – 144 с.
7. Гандельсман Б.И. Дезинфекционное дело. – М.: Медицина, 1971. С. 232 – 279.
8. Руководство к практическим занятиям по эпидемиологии / под редакцией В. И. Покровского. М., 200_. С. 132 – 164.
9. Шкарин В.В., Шафеев М.Ш. Дезинфектология. – Н.Новгород: НГМА, 2003. С.153 – 176.
10. Рыльников В.А. Методы и средства при проведении истребительных мероприятий против серых крыс. // Ж. «Дезинфекционное дело», 2006. - №3. – С. 53 – 61.
11. МР 3.5.0071-13 «Организация и проведение дезинфекционных мероприятий на различных объектах в период подготовки и проведения массовых мероприятий».
12. Приказ Минздравсоцразвития России от 05.03.2011 № 169н «Об утверждении требований к комплектации изделиями медицинского назначения аптечек для оказания первой помощи работникам».
13. Приказ Минздравсоцразвития России от 12.04.2011 № 302н «Об утверждении перечней вредных и (или) опасных производственных факторов и работ, при выполнении которых проводятся обязательные предварительные и периодические медицинские осмотры (обследования), и Порядка проведения обязательных предварительных и периодических медицинских осмотров (обследований) работников, занятых на тяжелых работах и на работах с вредными и (или) опасными условиями труда».
14. Приказ Минздравсоцразвития России от 04.05.2012 № 477н «Об утверждении перечня состояний, при которых оказывается первая помощь, и перечня мероприятий по оказанию первой помощи» (в ред. от 07.11.2012).
15. ФЗ № 52 от 30.03.1999 (в ред. от 25.06.2012).
16. Приказ Минздрава России от 13.11.2012 № 911н «Об утверждении порядка оказания медицинской помощи при острых и хронических профессиональных заболеваниях».
17. Обухов, П.Р. «Санэпидконтроль. Охрана труда» № 5, 2013.
Золотухин Сергей Николаевич
Васильев Дмитрий Аркадьевич
Калдыркаев Андрей Иванович
Васильева Юлия Борисовна
Летаров Андрей Викторович
Алешкин Андрей Владимирович
Часть 1
учебное пособие для обучающихся по направлению подготовки 19.03.04 «Технология продукции и организация общественного питания» [Электронный ресурс] / С.Н. Золотухин, Д.А. Васильев, А.И. Калдыркаев, Ю.Б. Васильева, А.В. Летаров, А.В. Алешкин - Ульяновск, 2018. - 129 с.
Подписано в печать___________
Формат 60 ´ 84
Усл . п. л. 5,9
Тираж _____ Заказ _____
________________________________________
Министерство сельского хозяйства Российской Федерации
ФГБОУ ВО Ульяновский ГАУ
С.Н. Золотухин, Д.А. Васильев, А.И. Калдыркаев,
Дата: 2018-12-28, просмотров: 565.