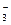УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ
к самостоятельной работе по дисциплине
«ХИМИЯ ВОДЫ И АТМОСФЕРЫ»
(для студентов
направления подготовки - 08.03.01 «Строительство» ;
профиль –ГСХ, всех форм обучения)
(контрольные задания, вопросы к зачету, лабораторные работы)
Макеевка 2017
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
ДОНЕЦКОЙ НАРОДНОЙ РЕСПУБЛИКИ
ГОУ ВПО «ДОНБАССКАЯ НАЦИОНАЛЬНАЯ АКАДЕМИЯ СТРОИТЕЛЬСТВА И
АРХИТЕКТУРЫ»
ФАКУЛЬТЕТ ИНЖЕНЕРНОГО И ЭКОЛОГИЧЕСКОГО СТРОИТЕЛЬСТВА
КАФЕДРА "ПРИКЛАДНАЯ ХИМИЯ"
МЕТОДИЧЕСКОЕ ПОСОБИЕ
к самостоятельной работе по дисциплине
«ХИМИЯ ВОДЫ И АТМОСФЕРЫ»
(для студентов
направления подготовки - 08.03.01 «Строительство» ;
профиль – ГСХ, всех форм обучения)
(контрольные задания, вопросы к зачету, лабораторные работы)
Утверждено
на заседании совета
факультета ИЭСС
Протокол № 4 от 30.11. 2016
Макеевка, 2017
УДК 541.13
Учебно-методическое пособие к самостоятельной работе по курсу «Химия воды и атмосферы» для студентов направления подготовки - 08.03.01 «Строительство»; профиль –ГСХ; всех форм обучения)
Составители: З.З. Малинина, С.И. Сохина. – Макеевка: ГОУ ВПО ДонНАСА, 2017. – 96с.
Содержит материал для самостоятельного изучения теоретического материала, для подготовки к выполнению расчетных и лабораторных работ по дисциплине «Химия воды и атмосферы».
1. Задачи и значение курса “Химия воды и атмосферы”.
В настоящее время во всех технически развитых странах первостепенное значение приобрели вопросы рационального использования водных ресурсов и охраны водоемов от загрязнения, охраны атмосферы от загрязнений. В нашей стране с особенным вниманием относятся к внешней среде, стремясь сохранить чистоту атмосферного воздуха и создать больше всего благоприятные условия для жизни и труда людей.
Вопрос защиты окружающей среды и, в частности, воды и атмосферы давно уже вышли за рамки кабинетов ученых и рассматриваются в парламентах, в международных комитетах. Перед учеными и инженерами, которые работают в области водоснабжения и очистки стоковых вод, теплогазопостачання, вентиляция и охраны воздушного бассейна поставлен ряд безотлагательных задач. Среди них важнейшее значение имеют:
1. Максимальное расширение оборотного водоснабжения и сводки к минимуму образования стоковых вод.
2. Внедрение комплексной автоматизации и механизации всех технологических процессов по водообработке и контролю за качеством воды..
3. Разработка и внедрение новых более эффективных методов водообработки.
4. Уменьшение выбросов загрязняющих веществ в атмосферу за счет усовершенствования технологических процессов переработки топлива, сырьевых компонентов промышленности.
5. Внедрение комплексной автоматизации и механизации всех технологических процессов и более тщательный контроль за выбросами.
6. Разработка и внедрение новых более эффективных методов утилизации загрязняющих атмосферу веществ.
Решение этих проблем жаждет от специалиста кроме инженерной подготовки ґрунтовних знаний о закономерностях химических процессов, которые протекают при очистке газовых потоков.
В связи с этим курс “Химия воды и атмосферы”, что выкладывается для студентов специальности «Городское строительство и хозяйство» должен дать студентам необходимый объем теоретических знаний химических процессах, которые перебегают в воде и атмосфере, при очистке водных и газовых потоков от загрязняющих веществ и подготовить студентов к изучению специальных курсов.
За сравнительно короткий срок студентам нужно овладеть основными методами химического анализа воды и воздуха, ознакомиться с элементарными приемами обработки результатов анализа и их использования для оценки качества воды и воздуха по сравнению с ПДК и сделать вывод о необходимой степени его очистки. Студенты должны также получить навыки работы на современных лабораторных приборах (рН - метр, хроматограф, фотоколориметр).
Базируя на программах курсов общей химии, физики и математики, курс “Химия воды и атмосферы”, в свою очередь, дает прочное основание для прослушивания специальных дисциплин, а также способствует формированию мировоззрения будущих специалистов
Объем и структура курса.
Курс "Химия воды и атмосферы" состоит из общей теоретической и специальной части, что рассматривает процессы загрязнения воды и атмосферы, устранения загрязняющих веществ, а также из короткого курса основ методов анализа воды и воздуха.
Лабораторный практикум знакомит студентов с современными методами анализа воды и воздуха и включает 8 лабораторных работ. Всего на изучение курса уделяется 54 часов, с их 16 - лекционные, 16 - лабораторные работы и 22 часа для самостоятельной работы студентов.
Изучение курса заканчивается зачетом в 4 семестре. В разделе 5 представленный перечень лекций за курсом и рабочий план выполнения лабораторных работ.
Общие методические рекомендации.
Теоретическая часть курса "Химия воды и атмосферы" базируется на химических понятиях и законах, которые выкладывались студентам в курсе общей химии. При чтении специальной части для объяснения явлений, которые имеют место при устранении загрязнений атмосферы, привлекаются химические теории и учебы (о направлении процессов и их скорости, о здании вещества и т.д.), основные представления о которых также были данные при изучении общей химии.
Показателем понимания того или другого материала служит не просто информированность о нем, а умения использовать имеются данні для решения поставленных задач. Потому практически во всех лекциях за данным курсом используются элементы проблемной учебы. Этот вид учебы основан на утверждении, что мышление человека начинается там, где создается проблемная ситуация, познавательное противоречие. При решении проблемы активное участие принимают студенты, что содействует развитию у них творческого мышления и формированию системы интеллектуальных навыков.
Решение проблемных ситуаций может быть сугубо индивидуальным, однако существуют и общие познавательные приемы.
Во время поиска решения нужно пытаться использовать все приобретенные знания, а также и те, которые получены при изучении других предметов - физики, математики, философии, и др.
Однако всегда стоит помнить, что решение тех или других проблем может строиться только на базе крепких знаний. Именно поэтому большое внимание уделяется и решению расчетных задач, которые преследуют целью запоминания формул и их применения для расчета, например, возможности образования тех или других загрязняющих веществ в определенных условиях.
При решении таких задач тщательным образом ознакомьтесь с условием, найдите отсутствующие данные в учебниках, справочниках. Поставьте ряд вытекающих один из одного вопросов, начиная с необходимого ответа. При решении задач такого типа могут с успехом использоваться те познавательные приемы, о которых речь шла выше.
Эксперимент - один из методов познания окружающего мира, играет решающую роль при выборе методов анализа и очистки атмосферы, определение оптимальной дозы реагентов и т.д. Основная цель практикума - помочь студенту овладеть методами химического анализа воздуха и использовать данные анализа в практической деятельности подбора методов очистки газовых потоков. При подготовке к лабораторной работе рекомендуется осознать теоретические основы метода, ознакомиться с приборами и оборудованием, предусмотреть потребность в посуде и реактивах продумать последовательность действий при выполнении анализа.
Нужно поставить больше всего вопросов. Почему? Зачем? Какое влияние тех или других условий на ход работы? Постарайтесь самостоятельно получить формулу для расчета результатов анализа. Работая в лаборатории, обращайте внимание на технику работу, тщательным образом и аккуратно выполняя все аналитические операции. Соблюдайте правила пользования химической посудой и правила техники безопасности. После выполнения работы оцените результаты и сделайте выводы по сравнению с ПДК загрязняющих веществ.
Некоторые лабораторные работы практикума имеют научно-исследовательский характер.
Цель такой экспериментальной работы - научиться элементарных приемов научного поиска и способам объяснения явлений, которые наблюдаются. Те закономерности, что получают студенты в результате работы, уже известны науке, однако, используя известную им методологию в следующей деятельности, смогут получить новые научные знания.
Самостоятельная работа студентов и ее контроль.
Современное высшее образование ставит за цель научить студентов умению самостоятельно и постоянно пополнять свои знания. Потому в процессе изучения курса необходимо соединять работу на лекциях и лабораторных занятиях с систематической проробкою материала при домашней подготовке.
Можно рекомендовать следующие виды самостоятельной работы:
· Подготовка к лекциям и проробка лекционного материала с использованием только обязательной литературы.
· Для углубленного изучения материала стоит обратиться к дополнительной литературе. Психологами доказано, что одним из найдійовіших способов усвоения знаний является речь (устная или письменная). Потому, желательно составлять короткий конспект материала при работе с учебниками.
· Для лучшего усвоения и контроля знаний теоретического материала как домашнее задание предлагается один из нескольких вопросов проблемного характера и расчетные задачи (задание выполняется в письменном виде). Устно студент должен уметь ответить на вопрос для тестового самоконтроля.
Подготовка к лабораторным занятиям.
Студенты знакомятся с лабораторной работой за кафедральными методическими пособиями. При этом стоит осознать цель работы, методику анализа и составить в лабораторном журнале короткое ее описание за следующим планом:
1) Принцип метода.
2) Приборы.
3) Необходимые реактивы и посуда.
4) Ход работы.
5) Расчет результата анализа.
6) Выводы.
После выполнения лабораторной работы ее нужно защитить, то есть ответить на вопрос по теоретической и экспериментальной части работы.
Эффективной формой приобщения до самостоятельной работы является работа над рефератом за темой, предложенной или преподавателем, или избранной студентом.
В процессе работы над рефератом студент получает возможность ознакомиться с основными научными изданиями, монографиями, периодической литературой, справочными материалами, Интернет-изданиями. Эта работа способствует формированию основных интеллектуальных навыков: умение классифицировать, сравнивать, делать выводы и обобщать.
Наиболее интересные рефераты докладываются и обсуждаются на кафедральных семинарах и студенческих научных конференциях.
Перечень учебных элементов
Загрязнение воздуха промышленными выбросами: черной металлургии. Загрязнение воздуха промышленными выбросами цветной металлургии. Загрязнение воздуха промышленными выбросами строительной индустрии. Загрязнение воздуха промышленными выбросами вугле- и нефтеперерабатывающей промышленности. Загрязнение воздуха промышленными выбросами химической и пищевой промышленности. Сжигание отходов. Предельно допустимые концентрации.
Смысловой модуль АТ-Б-7 ” Предотвращение загрязнения воздуха” (8 часов).
Основные и вторичные источники загрязнения Скруббера, их назначение и принципиальная схема. Типичные адсорбенты, активированный уголь.
Смысловой модуль АТ-Б-8 ”Использования химических реакций для очистки воздуха” (6 часов).
.Використання химических реакций для очистки воздуха от SO2. Использование химических реакций для очистки воздуха от H2S. Использование химических реакций для очистки воздуха от NH3. Использование химических реакций для очистки воздуха от окислов азота. Использование химических реакций для очистки воздуха от фтора и фторидов. Дезодорация. Процессы улавливания газообразных загрязнений Процессы улавливания газообразных загрязнений: USBM-процесс. Процессы улавливания газообразных загрязнений Лургі-процесс. Процессы улавливания газообразных загрязнений Мацубісі-процесс. Процессы улавливания газообразных загрязнений ВеллманЛорд-процесс. Процессы улавливания газообразных загрязнений Процесс клауса. Процессы улавливания газообразных загрязнений Гирботол-процесс. Процессы улавливания газообразных загрязнений Ветрококк-процесс. Процессы улавливания газообразных загрязнений Феррокс. Глуд и Манчестер процессы. Очистка воздуха от аэрозольных загрязнений. Осаждаемые камеры. Электрофильтры. Фильтрование и мокрое пылеулавливание.
Раздел (учебный объект) “Современные методы анализа компонентов атмосферы и веществ, что ее загрязняют.” (24 часа).
Смысловой модуль АТ-А-1 ”Методы отбора проб воздух и их анализ” (6 часов)..
Отбор проб воздуха и их классификация. Подготовка проб воздуха к анализу. Волюмометричний метод определения состава газовых смесей. Газогравиметрический, акустический метод. Фотоакустическая спектроскопия. Диффузный, термохимический, віскозіметричний методы. Манометрия и катарометрія.
Смысловой модуль АТ-А-2 ”Методы спектрального анализа воздуха”.(4 часа)..
Методы спектрального анализа. Эмиссионный спектральный анализ. Пламенная спектроскопия. Люминесцентный метод. Адсорбционный спектральный анализ.
Тема: Образование и трансформация аэрозолей в атмосфере
Определить правильный ответ:
1. Самые многочисленные аэрозольные частицы имеют радиус
а). 0,1 мкм.
бы). 0,5 мкм.
в). 1,0 мкм.
г). 0,3 мкм.
2. Наибольшая концентрация аэрозольных частиц над
а). большим городом.
бы). океаном.
в). сельской местностью.
3. «Ядра Айткена»- это аэрозольные частицы с радиусом
а). 0,1 мкм.
бы). 0,5 мкм.
в). 1,0 мкм.
г). 0,3 мкм.
4. Основными компонентами воздуха, которые способствуют образованию аэрозольных ионов сульфата, есть
а). сероводород
бы). метан
в). азот.
г). серистый газ.
д).оксиды азота.
5. Пары углеводородов инициируют цепные реакции фотолізу, которые приводят к образованию аэрозолей за счет:
а). атомарного кислорода О(1D).
бы).оксидов азота.
в).оксидов серы.
6. Процесс образования зародышей аэрозолю при участии аммиака протекает через фазу образования:
а) гидросульфата аммония.
бы). хлорида аммония.
в) сульфата аммония.
7. Длительность пребывания аэрозольных частиц в воздухе зависит от:
а). скорости падения.
бы). размера частиц.
в). состава частиц.
8. Путем осаждения из атмосферы отдаляются аэрозольные частицы в количестве
а). 20%.
бы). 80%.
в). 100%.
9. Очистка атмосферы от аэрозольных частиц осуществляется главным образом в итоге:
а). промывание атмосферы осадками.
бы). образование туманов.
в). орошение.
г). образование промышленных выбросов.
10. Среднее время пребывания аэрозольных частиц в атмосфере составляет:
а). 7 суток.
б). 2 недели.
в). 3 года.
г). 4 месяца.
11. Соляная кислота в виде раствора хлористого водорода во влаге образуется в атмосфере за счет:
а). адсорбции хлоридом натрием пары серной кислоты.
бы). десорбции хлорида водорода из хлорида натрия .
в). адсорбции хлоридом натрия пары азотной кислоты.
12. На аэрозольные частицы, что образовано естественным путем в тропосфере, приходится:
а). 10%
бы). 50%
в). 90%
13. Самый ярко выражен слой аэрозолей в атмосфере расположенный
а).за несколько километров над тропосферой.
бы). в стратосфере.
в). в тропопаузе.
г). над мезопаузой.
14. Наиболее опасные для здоровья человека аэрозольные частицы размером
а). менее 10 мкм
в). более 10 мкм
б). более 50 мкм.
15. Конденсируемые аэрозоли являют собой аномальные
а). кислотные дожди.
б). туманы.
в). кислые снега.
После изучения и анализа темы «Образование и трансформация аэрозолей в атмосфере» Вы должны ПОНИМАТЬ следующее:
- аэрозоли принимают участие в образовании фотохимического смога.
- пребывание аэрозольных частиц в атмосфере является динамическим процессом.
- трансформацию аэрозольных частиц в нижних слоях атмосферы.
В результате изучения данной темы Вы должны ЗНАТЬ:
- аэрозольные частицы размером менее 10 мкм наиболее опасные для здоровья человека.
- аэрозольные частицы находятся в состоянии равновесия между образованием в первобытной форме и удалением из атмосферы в совсем другой форме.
- влияние аэрозолей на человека и растительный мир.
Ваши знания должны обеспечивать следующие УМЕНИЯ:
- уметь объяснить расхождение в образовании аэрозолей в тропосфере и стратосфере.
- уметь написать реакции образования частиц аэрозолей (нитратов, сульфатов, аммонийных солей).
Литература
Основная
1. Аксенов В. И. Химия воды: Аналитическое обеспечение лабораторного Родионов и др.практикума: учебное пособие / В. И Аксенов, Л. И. Ушакова, И. И. Ничкова; М – во образования и науки Рос. Федерации, Урал.федер. ун – н. – Екатеринбург: Изд – во Урал. Ун – та, 2014 – 140 с.; ил. - ISBN 978 – 5 – 7996 – 1236 – 8.
2. Дульцева Г. Г. Химия атмосферы. Учебно – методическое пособие. – Новосибирск: Новосибирский государственный университет, 2012. – 47 с.
Основные источники загрязнения атмосферы и вещества, влияющие на здоровье лесов // Н. Краснова. 2016 Д. А. Лукин, О. Б. Мезенина. – Екатеринбург: Уральский государственный лесотехнический университет, 2016. – 9 с.
Дополнительная
3. Малинина З.З., Сохина С.И., Конспект лекций по дисциплине:
«Химия воды и атмосферы» для студентов направления подготовки 08.03.01 «Строительство» (профиль ГСХ). Макеевка : ДонНАСА, 2017, 88с.
4. Малинина З.З. Сохина С.И., Учебно-методическое пособие к выполнению лабораторных работ по дисциплине «Химия воды и атмосферы»для студентов направления подготовки 08.03.01 «Строительство» (профиль ГСХ). Макеевка: ДонНАСА, 2017, 70с.
8. Таблица вариантов контрольных заданий
| № варианта | Номера задач, відносних до даного завдання | ||||||||
| 1 | 1 | 16 | 31 | 46 | 61 | 76 | 91 | 106 | 121 |
| 2 | 2 | 17 | 32 | 47 | 62 | 77 | 92 | 107 | 122 |
| 3 | 3 | 18 | 33 | 48 | 63 | 78 | 93 | 108 | 123 |
| 4 | 4 | 19 | 34 | 49 | 64 | 79 | 94 | 109 | 124 |
| 5 | 5 | 20 | 35 | 50 | 65 | 80 | 95 | 110 | 125 |
| 6 | 6 | 21 | 36 | 50 | 66 | 81 | 96 | 111 | 126 |
| 7 | 7 | 22 | 37 | 52 | 67 | 82 | 97 | 112 | 127 |
| 8 | 8 | 23 | 38 | 53 | 68 | 83 | 98 | 113 | 128 |
| 9 | 9 | 24 | 39 | 54 | 69 | 84 | 99 | 114 | 129 |
| 10 | 10 | 25 | 40 | 53 | 70 | 85 | 100 | 115 | 130 |
| 11 | 11 | 26 | 41 | 56 | 71 | 86 | 101 | 116 | 131 |
| 12 | 12 | 27 | 42 | 57 | 72 | 87 | 102 | 117 | 132 |
| 13 | 13 | 28 | 43 | 58 | 73 | 88 | 103 | 118 | 132 |
| 14 | 14 | 29 | 44 | 59 | 74 | 89 | 104 | 119 | 134 |
| 15 | 15 | 30 | 45 | 60 | 75 | 90 | 105 | 120 | 135 |
| 16 | 1 | 17 | 33 | 49 | 65 | 81 | 97 | 113 | 136 |
| 17 | 2 | 18 | 34 | 50 | 66 | 82 | 98 | 114 | 137 |
| 18 | 3 | 19 | 35 | 51 | 67 | 83 | 99 | 115 | 138 |
| 19 | 4 | 20 | 36 | 52 | 68 | 84 | 100 | 116 | 139 |
| 20 | 5 | 21 | 37 | 53 | 69 | 85 | 101 | 117 | 140 |
| 21 | 6 | 22 | 38 | 54 | 70 | 86 | 102 | 118 | 141 |
| 22 | 7 | 23 | 39 | 55 | 71 | 87 | 103 | 119 | 142 |
| 23 | 8 | 24 | 40 | 56 | 72 | 88 | 104 | 120 | 143 |
| 24 | 9 | 25 | 41 | 57 | 73 | 89 | 105 | 106 | 144 |
| 25 | 10 | 26 | 42 | 58 | 74 | 90 | 91 | 107 | 145 |
| 26 | 11 | 27 | 43 | 59 | 75 | 76 | 92 | 108 | 146 |
| 27 | 12 | 28 | 44 | 60 | 61 | 77 | 93 | 109 | 147 |
| 28 | 13 | 29 | 45 | 46 | 62 | 78 | 94 | 110 | 148 |
| 29 | 14 | 30 | 31 | 47 | 63 | 79 | 95 | 111 | 149 |
| 30 | 15 | 16 | 32 | 48 | 64 | 80 | 96 | 112 | 150 |
9. Контрольные задания из дисциплины «Химия воды»
1. Проверить правильность выполнения анализа воды, результаты которого приведены ниже.
Концентрация, мг/л:
Са2+ 35,8
Мg2+ 24,8
Nа+ 23
К+ 7,8
НСО3- 73,2
SO42- 120
Cl- 46,1
Плотный остаток 320
Общая жесткость, мэкв/л 3,8
Карбонатная жесткость, мэкв/л 1,2
2. При нагревании раствора 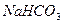 среда из слабощелочной превращается в сильнощелочную. Почему? Почему ровная константа гидролиза этой соли при стандартной температуре?
среда из слабощелочной превращается в сильнощелочную. Почему? Почему ровная константа гидролиза этой соли при стандартной температуре?
3. Можно ли действием 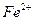 возобновить в кислой среде
возобновить в кислой среде 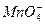 к
к 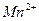 ? Ответ обоснуйте, напишите уравнение реакции, полуреакций.
? Ответ обоснуйте, напишите уравнение реакции, полуреакций.
4. Определить пригодная вода ли для питьевых целей, если она удовлетворяет требованиям ГОСТ 2874-82 по органолептическому и бактериологическому показателям, а из веществ, которые нормируются по санитарно-токсикологическому показателю вредности, обнаруженные ионы свинца [Рв2+] = 0,01 мг/л, стронция [Sr2+] = 3,64 мг/л, молибдена [Мо2+] = 0,1 мг/л.
5. Что можно сказать о воде, если при экспериментальном определении ее стабильности значения рН до опыта было 6,2, а после опыта очутилось ровно 6,9.
6. В воду состава, мэкв/л: 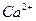 - 3;
- 3; 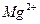 - 2;
- 2; 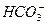 - 4;
- 4; 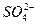 - 2;
- 2; 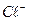 - 3;
- 3; 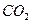 - 0,5ммоль/л ввели 108 мг/л коагулянта
- 0,5ммоль/л ввели 108 мг/л коагулянта 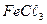 . Определить какое количество
. Определить какое количество 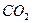 нужно удалить из воды, чтобы ее рН после этого стал ровным 7,5. Определите состав воды после введения коагулянта.
нужно удалить из воды, чтобы ее рН после этого стал ровным 7,5. Определите состав воды после введения коагулянта.
7. Понятие об активном хлоре. Требования ГОСТ 2874-82 по содержанию остаточного активного хлора в воде (свободного и связанного).
При определении процентного содержания активного хлора в хлорной известка на титрование было потрачено 10 мл 0,05н раствору 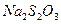 . Для определения был взят 5 мл 1 %-го раствора хлорной известка. Рассчитайте % активного хлора в известку. Сопоставьте с теоретической величиной. Состав хлорной известка отвечает формуле:
. Для определения был взят 5 мл 1 %-го раствора хлорной известка. Рассчитайте % активного хлора в известку. Сопоставьте с теоретической величиной. Состав хлорной известка отвечает формуле:
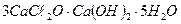
8. Как изменится состав воды из примера № 6, если до 100 л этой воды прибавить 20г 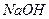 ? Сколько грамм
? Сколько грамм 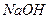 понадобится для полного смягчения этой воды?
понадобится для полного смягчения этой воды?
9. Какой метод того, что катионирует можно предложить для этой воды, если необходимо получит воду с остаточной жесткостью не более 0,2мэкв/л и щелочностью 1мэкв/л? Какой объем воды нужно пропустить через  – катионитовый фильтр, через
– катионитовый фильтр, через 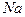 – катионитовый фильтр? Чем объяснить низкую эффективность смягчения воды с высокой постоянной жесткостью на
– катионитовый фильтр? Чем объяснить низкую эффективность смягчения воды с высокой постоянной жесткостью на 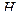 – катионитовых фильтрах?
– катионитовых фильтрах?
10. В двух водах содержаться ровные количества свободной углекислоты. Солесодержание первой воды выше, чем второй. В какой воде вероятнее появление агрессивной углекислоты? Доведите расчетом.
11. Специальный метод очистки воды экстракцией. В чем его суть, какие законы лежат в основе метода? Определите степень вытягивания никеля из 100 мл водного раствора (в виде диметилглиоксимата) при двукратной экстракции по 10 мл хлороформа. Коэффициент деления К = 410. По каким критериям следует выбирать экстрагент для вытягивания загрязняющих воду веществ?
12. При анализе 100 мл естественной воды найдено следующее содержание катионов и анионов (г):
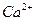 – 0,0040
– 0,0040 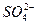 – 0,0096
– 0,0096
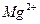 – 0,0036
– 0,0036 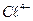 – 0,0071
– 0,0071
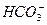 – 0,0122
– 0,0122
Представьте результаты анализа в мэкв/л и в виде диаграммы, рассчитайте содержание щелочных металлов.
13. Сколько граммов КМnО4 нужно для приготовления 1л 1н раствора, если раствор будет применяться для реакций окисления в кислой среде?
14. Рассчитайте общую и активную кислотность в растворе 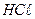 с концентрацией 0,02г
с концентрацией 0,02г 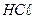 у 100 мл раствора.
у 100 мл раствора.
15. Вычислите растворимость 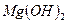 при
при 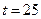 ° С в воде и в 0,001н растворе
° С в воде и в 0,001н растворе 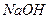 .
.
16. Дайте определение понятия «агрессивная углекислота». Определите, агрессивная вода ли по отношению к бетону, если в ней содержится 60 мг/л, 32 мг/л, щ = 3,2мэкв/л, общее солесодержание 600 мг/л 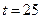 ° С.
° С.
17. В воду состава (мэкв/л) 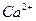 - 2;
- 2; 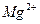 - 1,5;
- 1,5; 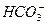 - 3,2;
- 3,2; 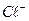 - 1;
- 1; 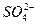 - 0,5 с содержанием
- 0,5 с содержанием 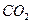 - 30 мг/л ввели 3мэкв/л
- 30 мг/л ввели 3мэкв/л 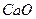 . Как измениться состав воды?
. Как измениться состав воды?
18. Какой из анионов, 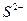 будет окисляться хлором в первую очередь и почему? Напишите уравнение реакций.
будет окисляться хлором в первую очередь и почему? Напишите уравнение реакций.
19. Сколько будет нужно хлора для обеззараживания 100 т воды с хлоропоглащаемостью 4,5 мг/л (содержание остаточного хлора 0,5 мг/л)?
20. Определение когда - титра и когда - индекса. Санитарно-показательные микроорганизмы воды.
21. Какой вред причиняют микробиологические обрастания в трубках и сооружениях? Какие мероприятия проводятся по борьбе с обрастаниями?
22. Процессы биохимического окисления в аэротенках. Роль простых при контроле качества очистки воды.
23. В воду (состав воды из задания № 17) прибавили 108 мг/л коагулянта 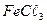 . Определите состав воды после введения коагулянта и найдите, сколько миллиграмма
. Определите состав воды после введения коагулянта и найдите, сколько миллиграмма 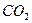 нужно удалить, чтобы рН воды довести до 7,6.
нужно удалить, чтобы рН воды довести до 7,6.
24. Речная вода содержит в мг/л: 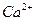 - 90;
- 90; 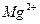 - 8,5;
- 8,5; 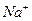 - 240;
- 240; 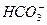 - 134;
- 134; 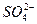 - 50,4;
- 50,4; 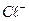 - 440. Выразите содержание ионов в мэкв/л. Результаты представьте в виде диаграммы.
- 440. Выразите содержание ионов в мэкв/л. Результаты представьте в виде диаграммы.
25. Доза коагулянта 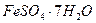 150 мг/л. В оборотной воде содержится 5 мг/л
150 мг/л. В оборотной воде содержится 5 мг/л 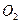 . Сколько хлора следует ввести в воду для полного окисления железа в
. Сколько хлора следует ввести в воду для полного окисления железа в 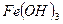 ?
?
26. Содержание фенола в стоковых водах 15 г/л, коэффициент деления фенола между водой и растворителем, что не смешивается с ней, ровный 0,1. Экстрагирование 4м3 воды проводиться растворителем, употребимым для этого в количестве 10 % от объема воды. Определить концентрацию фенола.
27. Определить равновесную концентрацию 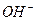 в 0,05 н. растворе
в 0,05 н. растворе 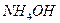 и выразите содержание этого иона в мг/л. Как измениться эта концентрация, если в раствор прибавить
и выразите содержание этого иона в мг/л. Как измениться эта концентрация, если в раствор прибавить 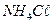 0,01 мг/л.
0,01 мг/л.
28. Рассчитайте степень гидролиза 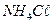 в растворе, что содержит 0,265г этой соли у 1л раствора.
в растворе, что содержит 0,265г этой соли у 1л раствора.
29. Можно ли осадить сероводородом железо из раствора с концентрацией 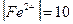 мг/л.
мг/л.
30. Определите, агрессивная вода ли по отношению к бетону, если в ней содержится 250 мг/л, 70 мг/л, 22 мг/л 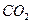 . Общее солесодержание 600 мг/л.
. Общее солесодержание 600 мг/л.
31. Что можно сказать о воде, если при экспериментальном определении ее стабильности значения рН к опыту было ровно 6,2, а после опыта оказалось ровным 6,9?
32. Сколько грамм известка и сода понадобиться для смягчения 100л воды (состав воды нужно взять из задания № 17), если доза коагулянта, что добавляется для ускорения осаждения, составляет 114 мг/л в пересчете на безводную соль?
33. Разница потенциалов между водородным и насыщенным каломельным электродом, погруженным в кислый раствор составляет 0,435В при 25° С. Определите рН раствора.
34. При взаимной нейтрализации стоков смешивают щелочной сток с концентрацией едкого натра 0,8 мг/л и кислый сток с концентрацией серной кислоты 1,96 мг/л. Сколько м3 кислого стока понадобится для полной нейтрализации 100 м3 щелочного стока?
35. Доведите, что растворенный в воде кислород может окислить 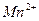 к
к 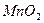 в нейтральной среде или слабощелочной среде. Напишите уравнение реакции.
в нейтральной среде или слабощелочной среде. Напишите уравнение реакции.
36. Вода реки Днепр содержит в мг/л: 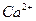 - 60,0,
- 60,0, 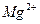 - 12,0,
- 12,0, 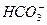 - 183,0,
- 183,0, 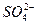 - 72,
- 72, 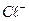 - 17,7. Определите общую, карбонатную и некарбонатную жесткость воды. Результаты представьте в виде диаграммы.
- 17,7. Определите общую, карбонатную и некарбонатную жесткость воды. Результаты представьте в виде диаграммы.
37. Определите часовую затрату алюминиевого коагулянта на 1л, если производительность установки 300 т/ч, доза его 50 мг/л. Используемый раствор коагулянта содержит 40 % безводного сульфата алюминия.
38. Сколько килограмм гидрокарбоната натрия необходимо прибавить до 100м3 стоковой воды, что содержит только карбонат натрия с концентрацией 0,01 мг/л, чтобы снизить рН 9,2.
39. Рассчитайте общую и активную кислотность в растворе соляной кислоты с концентрацией 0,02г  у 100 мл раствора.
у 100 мл раствора.
40. У 500 мл стоковой воды содержится 0,35г 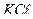 и 0,95г
и 0,95г 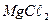 . Выразите содержание отдельных ионов в воде в мг/л и мэкв/л.
. Выразите содержание отдельных ионов в воде в мг/л и мэкв/л.
41. На 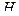 – катионитовых фильтрах смягчается вода с карбонатной жесткостью 5,6мэкв/л. Определите какое количество
– катионитовых фильтрах смягчается вода с карбонатной жесткостью 5,6мэкв/л. Определите какое количество 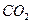 (мг/л) образуется при смягчении воды.
(мг/л) образуется при смягчении воды.
42. Какое количество остаточного хлора содержится в 1л воды, если установлено, что на титрование 100 мл этой воды потрачен 2,5 мл 0,01н раствору 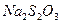 ?
?
43. Определите дозу известка для подщелачивания, если оптимальная доза коагулянта 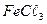 56 мг/л, а начальная щелочность воды 2,5мэкв/л.
56 мг/л, а начальная щелочность воды 2,5мэкв/л.
44. Дайте определение понятию «агрессивная углекислота». Определите, агрессивная по отношению к бетону вода ли, если в ней содержится 32 мг/л 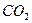 ; щ = 3,2мэкв/л;
; щ = 3,2мэкв/л; 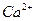 - 60 мг/л. Общее солесодержание 600 мг/л
- 60 мг/л. Общее солесодержание 600 мг/л 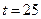 ° С. Определите рН, при котором такая вода окажется стабильной (для расчета используйте Сноп 2.04-84).
° С. Определите рН, при котором такая вода окажется стабильной (для расчета используйте Сноп 2.04-84).
45. Вычислите величину рН в воде, насыщенной углекислым газом под давлением 1,5 атм. при 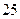 ° С.
° С.
46. При каком рН выпадет осадок 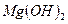 из раствора с содержанием
из раствора с содержанием  - 10 мг/л, ионная сила раствора 0,05
- 10 мг/л, ионная сила раствора 0,05 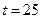 ° С?
° С?
47. При анализе 100 мл естественной воды найдено следующее содержание катионов и анионов (г):
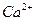 – 0,0040 S – 0,0096
– 0,0040 S – 0,0096
Мg2+ – 0,0036 Cl- – 0,0071
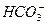 – 0,0122
– 0,0122
Представьте результаты анализа в мэкв/л и в виде диаграммы, рассчитайте содержание щелочных металлов.
48. Вода из задания № 17 была склонна 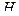 – катионирует. Как изменяется ее состав? Почему?
– катионирует. Как изменяется ее состав? Почему?
49. В раствор уксусной кислоты с концентрацией 0,1М прибавлен одинаковый объем ацетата натрия, 0,82 г/л, что содержит. Как изменится концентрация ионов водорода и рН в этом растворе?
50. Чем отличается свободная щелочность воды от ее общей щелочности, какими ионами обусловленная свободная щелочность? Какими ионами обусловленная щелочность естественных вод? Общая щелочность воды, что содержит только гидроксид натрия ровная 10мэкв/л, найдите рН этой воды.
51. Найдите остаточную концентрацию Мg2+ в смягченной воде при рН = 10,4, ионной силе I = 0,01 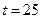 ° С.
° С.
52. Какая доза коагулянта называется оптимальной? От каких факторов она зависит? Как определить оптимальную дозу коагулянта в соответствии с требованиями Госта 2919-45. Объем воды 200м3, доза коагулянта 50 мг/л. Сколько 2,5 % раствора 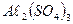 необходимо прибавить в эту воду для коагуляции.
необходимо прибавить в эту воду для коагуляции.
53. Определите, агрессивная вода ли по отношению к бетону, если в ней содержится 40 миллиграмм, 1ммоль, щ = 2,7мэкв/л, общее солесодержание 500 мг/л 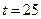 ° С.
° С.
54. Вычислите количество серистого газа, необходимое для дехлорирования 400м3 воды, если 1л ее содержит 8 миллиграмм 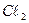 . Процесс идет по уравнению
. Процесс идет по уравнению 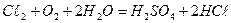 .
.
55. Какой из указанных ионов будет окисляться в первую очередь хлором?
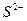
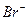 (рН < 7)
(рН < 7)
56. Один завод сбрасывает кислые стоковые воды в количестве 1600 м3/сутки. С концентрацией серной кислоты 0,049 г/л. Другой сбрасывает 1000м3 щелочные стоки с концентрацией едкого натра 0,060 г/л. Состоится ли взаимная нейтрализация этих вод при смешивании? Какой объем щелочной воды понадобиться для полной нейтрализации кислой воды?
57. рН-метр показал, что в питьевой воде рН = 7,2. Солесодержание воды 500 мг/л. В каком соотношении находятся в этой воде концентрации свободной углекислоты и ионов гидрокарбоната?
58. Найдите концентрацию 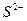 в 0,08М растворе сероводородной кислоты. Почему ровный рН этого раствора?
в 0,08М растворе сероводородной кислоты. Почему ровный рН этого раствора?
59. Какие растворы относятся к буферным? В чем заключается суть буферного действия? Какие системы обусловливают буферную естественных вод? Какой рН воды они обеспечивают?
60. Какой из указанных ионов будет окисляться хлором в первую очередь? 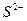 ,
, 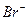 ,
, 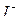 ,
, 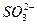 . Почему? Доведите это, используя значение стандартных окислительно-восстановительных потенциалов. Напишите уравнение реакций.
. Почему? Доведите это, используя значение стандартных окислительно-восстановительных потенциалов. Напишите уравнение реакций.
61. При каком рН начнется выпадение осадка гидроксида магния из раствора с магниевой жесткостью 2мг-экв/л. Ионная сила раствора 0,01; 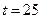 ° С. Какой рН следует создать, чтобы остаточная жесткость снизилась к 0,01мэкв/л?
° С. Какой рН следует создать, чтобы остаточная жесткость снизилась к 0,01мэкв/л?
62. Состав воды выражается следующей диаграммой:
5,0 3,2 1,8
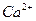
|
|
| ||
|
|
| 
| ||
6,2 2,3 1,5
Определите содержание отдельных ионов в воде мг/л. Найдите общее солесодержание воды.
63. В воду из примера № 62 с начальным содержанием 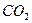 0,5ммоль/л прибавили 108 мг/л коагулянта
0,5ммоль/л прибавили 108 мг/л коагулянта 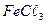 . Определите состав воды после введения коагулянта и сколько миллиграмма
. Определите состав воды после введения коагулянта и сколько миллиграмма 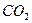 нужно удалить, чтобы снизить (повысить) рН воды 7,3
нужно удалить, чтобы снизить (повысить) рН воды 7,3
64. В воду с рН = 8,3 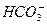 = 12 мг/л ввели 12 мг/л хлора. Как измениться щелочность и рН воды?
= 12 мг/л ввели 12 мг/л хлора. Как измениться щелочность и рН воды?
65. На схему параллельного - катионируют воды подается вода, состав которой приведен в примере № 62. Определите состав воды после смягчения, если соотношение расходов воды, что проходит через - и 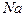 – катионитовые фильтры составляет 1: 2.
– катионитовые фильтры составляет 1: 2.
66. Как экспериментально определить разные виды жесткости воды? Сколько мл 0,05н раствора трилона Бы пойдет на титрование 100 мл воды из примера № 62 с индикатором: а) хромом темно синим, бы) мурексидом?
67. Дайте определение понятию «агрессивная углекислота». Определите, агрессивная по отношению к бетону вода ли, если в ней содержится 32 мг/л, щ = 3,2мэкв/л 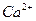 = 60 мг/л, общее солесодержание 600 мг/л
= 60 мг/л, общее солесодержание 600 мг/л 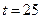 ° С. Определите рН, при котором такая вода окажется стабильной (используйте Сноп 2.04.02-84).
° С. Определите рН, при котором такая вода окажется стабильной (используйте Сноп 2.04.02-84).
68. Физико-химические основы очистки воды гиперфильтрацией (обратный осмос).
69. Дать технологическую оценку изменениям в составе воды в процессе ее предыдущей обработки (см. табл.). Предыдущая обработка предусматривает хлорирование воды с последующим отстаиванием в ковше. Можно ли использовать обработанную воду как питьевой ?
Таблица.
| Показатель | Начальная вода | Вода после обработки |
| Муть, мг/л | 83 | 50 |
| Окисляемость, мг/л | 10 | 1 |
| Ост. Хлор, мг/л | – | 0,54 |
| Цветность, град. | 46 | 30 |
| Число клеток в 1 мл Фитопланктона Зоопланктона | 1200 650 | 180 94 |
| Запах, баллы | 4 | 2 |
| Микробное число | 250 | 14 |
| Коли-индекс | 54 | 5 |
70. Превращение микроорганизмами азотсодержащих органических веществ в аэробных и анаэробных условиях.
71. При анализе 100 мл естественной воды найдено следующее содержание катионов и анионов (г):
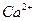 – 0,0040
– 0,0040 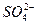 – 0,0096
– 0,0096
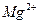 – 0,0036 С1- – 0,0071
– 0,0036 С1- – 0,0071
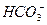 – 0,0122
– 0,0122
Представьте результаты анализа в мэкв/л и в виде диаграммы, рассчитайте содержание щелочных металлов.
72. Сколько граммов КМnО4 нужно для приготовления 1л 1н раствора, если раствор будет применяться для реакций окисления в кислой среде?
73. Рассчитайте общую и активную кислотность в растворе 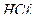 с концентрацией 0,02г
с концентрацией 0,02г 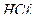 у 100 мл раствора.
у 100 мл раствора.
74. Вычислите растворимость 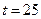 °С, в воде и в 0,001н растворе
°С, в воде и в 0,001н растворе 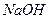 .
.
75. Дайте определение понятия «агрессивная углекислота». Определите, агрессивная вода ли по отношению к бетону, если в ней содержится 60 мг/л, 32 мг/л, щ = 3,2мэкв/л, общее солесодержание 600 мг/л 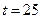 ° С.
° С.
76. В воду состава (мэкв/л) 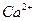 - 2;
- 2; 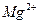 - 1,5;
- 1,5; 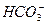 - 3,2;
- 3,2;  - 1;
- 1; 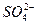 - 0,5 с содержанием
- 0,5 с содержанием 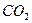 - 30 мг/л ввели 3мэкв/л
- 30 мг/л ввели 3мэкв/л 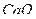 . Как измениться состав воды?
. Как измениться состав воды?
77. Какой из анионов, 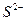 будет окисляться хлором в первую очередь и почему? Напишите уравнение реакций.
будет окисляться хлором в первую очередь и почему? Напишите уравнение реакций.
78. Сколько будет нужно хлора для обеззараживания 100 т воды с хлоропоглащаемостью 4,5 мг/л (содержание остаточного хлора 0,5 мг/л)?
79. Определение когда - титра и когда - индекса. Санитарно-показательные микроорганизмы воды.
80. Какой вред причиняют микробиологические обрастания в трубках и сооружениях? Какие мероприятия проводятся по борьбе с обрастаниями?
81. Процессы биохимического окисления в аэротенках. Роль простых при контроле качества очистки воды.
82. В воду (состав воды из задания № 62) прибавили 108 мг/л коагулянта 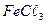 . Определите состав воды после введения коагулянта и найдите, сколько миллиграмма
. Определите состав воды после введения коагулянта и найдите, сколько миллиграмма 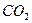 нужно удалить, чтобы рН воды довести до 7,6.
нужно удалить, чтобы рН воды довести до 7,6.
83. Найдите концентрацию 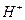 в 0,1М растворе сероводородной кислоты. Почему ровный рН этого раствора?
в 0,1М растворе сероводородной кислоты. Почему ровный рН этого раствора?
84. Как влияет рН растворов на гидролиз солей железа и алюминия? Какие продукты гидролиза образуются при рН > 10? Напишите уравнение гидролиза алюмината натрия?
85. Можно ли удалить воды соли железа (II) методом аэрации в щелочной среде? Доведите это, пользуясь значениями стандартных окислительно-восстановительных потенциалов. Напишите уравнение реакции.
86. Выпадет ли осадок сульфата бария, если к раствору, что содержит 0,02М хлориду бария прибавить ровный объем насыщенного раствора сульфата кальция?
87. Вода содержит в мг/л: 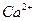 - 80;
- 80; 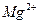 - 12;
- 12; 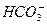 - 244;
- 244; 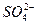 - 96;
- 96;  - 35,5,0. Найдите содержание (+) в мг/л. Выразите состав воды в виде диаграммы.
- 35,5,0. Найдите содержание (+) в мг/л. Выразите состав воды в виде диаграммы.
Дайте сравнительную характеристику разных коагулянтов. Их преимущества и недостатки. В каких случаях желательно применение смешанных коагулянтов? Объем воды ровный 200м3, доза коагулянта 50 мг/л. Какой объем 2,5 %-го (в пересчете на безводную соль) 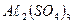 необходимо прибавить в эту воду для коагуляции?
необходимо прибавить в эту воду для коагуляции?
Константа диссоциации хлорноватистой кислоты 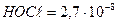 . Какой рН нужно создать в воде, чтобы степень диссоциации хлорноватистой кислоты не превышала 2 %?
. Какой рН нужно создать в воде, чтобы степень диссоциации хлорноватистой кислоты не превышала 2 %?
88. Какую схему обработки воды ионитами можно продлить для полного ее обессоливания? Охарактеризуйте современные методы обессоливания воды. Приведите схему и принцип действия электролиза с ионитными мембранами.
89. Общая жесткость воды – 7,2 мэкв/л, щелочность – 2,2 мэкв/л, содержание суммы ( 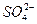 +
+  ) – 6,2мэкв/л. Определить общее содержание солей в этой воде в мэкв/л.
) – 6,2мэкв/л. Определить общее содержание солей в этой воде в мэкв/л.
90. Анализом воды найденное содержание в мг/л: 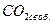 - 44,
- 44, 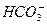 - 128,
- 128, 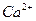 - 70, общее солесодержание – 350;
- 70, общее солесодержание – 350; 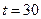 ° С. Графическим методом определите, будет ли данная вода проявлять активность по отношению к бетону. Если вода агрессивна, сколько агрессивной углекислоты в ней содержится? Какое количество углекислоты следует удалить из воды, чтобы она стала стабильной?
° С. Графическим методом определите, будет ли данная вода проявлять активность по отношению к бетону. Если вода агрессивна, сколько агрессивной углекислоты в ней содержится? Какое количество углекислоты следует удалить из воды, чтобы она стала стабильной?
91. Электролиз и электродиализ. Приведите схему установки электродиализа с ионитными мембранами для очистки воды от растворенных солей.
92. При анализе воды, взятой из водоносного горизонта, что намечается для водозабора, полученные следующие результаты: запах 1 балл, муть 1,2 мг/л, цветность 8 град., рН = 7,6, жесткость 3,4мэкв/л,  - 36,8 мг/л,
- 36,8 мг/л, 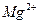 - 19,8 мг/л, железо общее - 0,32 мг/л,
- 19,8 мг/л, железо общее - 0,32 мг/л,  - 7 мг/л,
- 7 мг/л, 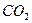 - 30 мг/л, плотный остаток 140 мг/л. Можно ли эту воду использовать для целей питьевого водоснабжения и достаточный объем ли выполненного анализа для такой оценки?
- 30 мг/л, плотный остаток 140 мг/л. Можно ли эту воду использовать для целей питьевого водоснабжения и достаточный объем ли выполненного анализа для такой оценки?
93. Найдите концентрацию 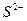 в 0,08М растворе сероводородной кислоты. Почему ровный рН этого раствора?
в 0,08М растворе сероводородной кислоты. Почему ровный рН этого раствора?
94. Какие растворы относятся к буферным? В чем заключается суть буферного действия? Какие системы обусловливают буферную естественных вод? Какой рН воды они обеспечивают?
95. Какой из указанных ионов будет окисляться хлором в первую очередь? 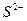 ,
, 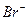 ,
, 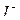 ,
, 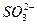 . Почему? Доведите это, используя значение стандартных окислительно-восстановительных потенциалов. Напишите уравнение реакций.
. Почему? Доведите это, используя значение стандартных окислительно-восстановительных потенциалов. Напишите уравнение реакций.
96. При каком рН начнется выпадение осадка гидроксида магния из раствора с магниевой жесткостью 2мэкв/л. Ионная сила раствора 0,01; 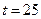 ° С. Какой рН следует создать, чтобы остаточная жесткость снизилась к 0,01мэкв/л?
° С. Какой рН следует создать, чтобы остаточная жесткость снизилась к 0,01мэкв/л?
97. Состав воды выражается следующей диаграммой:
5,0 3,2 1,8
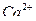
|
|
| ||
|
|
| 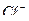
| ||
6,2 2,3 1,5
Определите содержание отдельных ионов в воде мг/л. Найдите общее солесодержание воды.
98. В воду из примера № 97 с начальным содержанием 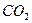 0,5ммоль/л прибавили 108 мг/л коагулянта
0,5ммоль/л прибавили 108 мг/л коагулянта 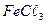 . Определите состав воды после введения коагулянта и найдите какое количество
. Определите состав воды после введения коагулянта и найдите какое количество 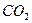 нужно удалить, чтобы снизить (повысить) рН воды 7,3
нужно удалить, чтобы снизить (повысить) рН воды 7,3
99. В воду с рН = 8,3 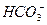 = 12 мг/л ввели 12 мг/л хлора. Как измениться щелочность и рН воды?
= 12 мг/л ввели 12 мг/л хлора. Как измениться щелочность и рН воды?
100. На схему параллельного - катионируют воды подается вода, состав которой приведен в примере № 97. Определите состав воды после смягчения, если соотношение расходов воды, что проходит через - и  – катионовые фильтры 1:2.
– катионовые фильтры 1:2.
102. Как экспериментально определить разные виды жесткости воды? Сколько мл 0,05н раствора трилона Бы пойдет на титрование 100 мл воды из примера № 97 с индикатором: а) хромом темно синим, бы) мурексидом?
103. Дайте определение понятию «агрессивная углекислота». Определите, агрессивная по отношению к бетону вода ли, если в ней содержится 32 мг/л, щ = 3,2мэкв/л 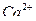 = 60 мг/л, общее солесодержание 600 мг/л
= 60 мг/л, общее солесодержание 600 мг/л 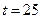 ° С. Определите рН, при котором такая вода окажется стабильной (используйте Сноп 2.04.02-84).
° С. Определите рН, при котором такая вода окажется стабильной (используйте Сноп 2.04.02-84).
104. Физико-химические основы очистки воды гиперфильтрацией (обратный осмос).
105. Дать технологическую оценку изменениям в составе воды в процессе ее предыдущей обработки (см. табл.). Предыдущая обработка предусматривает хлорирование воды с последующим отстаиванием в ковше. Можно ли использовать обработанную воду как питьевой ?
Таблица.
| Показатель | Начальная вода | Вода после обработки |
| Муть, мг/л | 83 | 50 |
| Окисляемость, мг/л | 10 | 1 |
| Ост. Хлор, мг/л | – | 0,54 |
| Цветность, град. | 46 | 30 |
| Число клеток в 1 мл Фитопланктона Зоопланктона | 1200 650 | 180 94 |
| Запах, баллы | 4 | 2 |
| Микробное число | 250 | 14 |
| Кругу - индекс | 54 | 5 |
106. Превращение микроорганизмами азотсодержащих органических веществ в аэробных и анаэробных условиях.
107. Рассчитайте молярную концентрацию раствора едкой щелочи, если у 0,5л раствора содержится 20г NaOH ?
108. Есть водные растворы глицерина С3Н5(ВИНА)3 и этилового спирта С2Н5ОН, которые содержат в одном литре ровные весовые количества растворенных веществ. Температура растворов одинакова. В который из этих растворов осмотическое давление больший? В сколько раз?
109. Составьте уравнение диссоциации воды и выражение для расчета константы диссоциации. При каком допущении можно получить из этого выражения ионное произведение волы К (Н2О) ?
110.Какие условия процессов образования осадков и их растворения?
111.К 50 мл 0,01М раствор едкого калия прибавлено 50,0 мл 0,01М раствору соляной кислоты. Найдите рН этого раствора.
112. В чем заключается суть окислительно-восстановительных процессов? Дайте определение следующим понятиям: окисление, возобновление, окислитель, восстановитель, степень окисления.
113. Константа диссоциации НClO=2.7·10. Какой рН нужно создать в воде, чтобы степень диссоциации хлорноватистой кислоты не превышала 2% ?
114. Вода имеет Щ=2,8мэкв/л; СО2=1,0мэкв/л. У нее ввели 80 мг/л коагулянта FeSO4 . Определите, есть ли необходимость в обработке воды щелочью?
115. Виды жесткости воды. Определите общую, карбонатную и некарбонатную жесткость воды, содержание Саи Мg 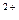 (в мг/л), если состав воды выражается следующей диаграммой:
(в мг/л), если состав воды выражается следующей диаграммой:
4 2 2
| Са | Мg | Na | ||
| HCO | SO | Cl | ||
4,4 2 1,6
Cоответствует данная вода ли по жесткости питьевой (ГОСТ 2874-82) ?
116. В воде содержится 0,1мг Mn/л. Марганец отдаляется в виде MnO при продувке воды воздухом, что содержит 5% О. Сколько кубических метров воздуха понадобится для продувки 200м воды под давлением 3атм при температуре 25С?
117.Проверить правильность выполнения анализа воды, результаты которого приведены ниже.
Концентрация, мг/л:
Са 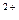 ...........35,8 SO
...........35,8 SO 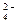 ...........120
...........120
Мg 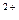 ...........24.8 Cl
...........24.8 Cl 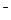 ............46.1
............46.1
Na 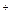 ...........23 Плотный остаток.....320
...........23 Плотный остаток.....320
К 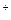 ...........7,8 Общая жесткость, мэкв/л.3,8
...........7,8 Общая жесткость, мэкв/л.3,8
НСО 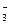 ...........73,2 Карбонатная жесткость
...........73,2 Карбонатная жесткость
мэкв/л..........1,2
118. Рассчитайте нормальную концентрацию уксусной кислоты, если у 1л раствора содержится 6г СНСООН.
119. Рассчитайте величину осмотического давления раствора, что содержится в литре 3,1 г анилина С6Н5NH2. Температура раствора 21С
120. Вычислите рН: а) 0,28%-го раствора соляной кислоты; бы) 0,1%-го раствора азотной кислоты; в) 1,15%-го раствора едкого натра; г) 0,7%-го раствора уксусной кислоты; д) 0,14%-го раствора аммиака.
121. Kак изменится растворимость карбоната кальция при увеличении в насыщенный раствор СаСО3 одной из следующих веществ: (NH4)2CO3 Na2CO3, HCl, NaOH NH4Cl?
122. Электродные потенциалы, их зависимость от концентрации и растворов. Гальванические элементы.
123. Растворимость СО2 при атмосферном давлении и температуре 25С составляет 1,45 мг/л. Определите рН этой воды. Найдите концентрацию ионов гидрокарбоната в воде.
124.Как и чему влияют на бактерицидные свойства хлора и других хлорсодержащих веществ рН, температура и другие факторы?
125. Определите, сколько коагулянта Al2(SO4)3 введено в воду, если ее щелочность в процессе коагуляции снизилась с 3 к 2,5мэкв/л. Сколько технического сульфата алюминия нужно прибавить в воду, если содержание активного продукта в нем составляет 40%?
126.Найдите: 1)остаточную концентрацию Mg в смягченной воде при рН= 10,4; ионной силе I=0,01, t=25 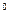 C; 2)остаточную концентрацию Са в смягченной воде при рН=9,2; ионной I=0,05, t=30
C; 2)остаточную концентрацию Са в смягченной воде при рН=9,2; ионной I=0,05, t=30  C, Щ=2,5мэкв/л .
C, Щ=2,5мэкв/л .
127. Речная вода, используемая для питьевого водоснабжения, содержит 1,7 мг/л фтора. Производительность водопровода 40000м/сутки. Определите годовую затрату кремнефтористого натрия для фторирования воды.
128. Рассчитайте титр раствора двууглекислого натрия, если у 4л раствора содержится 6,3г Na2CO3.
129. Раствор, что содержит 2,1г едкого калия в 250г воды, замерзает при температуре -0,519 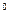 С.
С.  Найдите изотонический коэффициент для этого раствора.
Найдите изотонический коэффициент для этого раствора.
130. Растворы содержат, мг/л: а) HCl-100; бы) NaOH-600; в) HNO2-2500; г) NH4NO 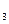 -2000. Вычислите рН растворов, учитывая их ионную силу.
-2000. Вычислите рН растворов, учитывая их ионную силу.
131. рН-метр показал, что в питьевой воде рН=7. Солесодержание воды 500 мг/л. В каком соотношении находятся в этой воде свободная углекислота и ионы гидрокарбоната?
132.Реакцию гидролиза иона алюминия представляют в виде следующих стадий:
Al 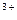 + H2O=Al(OH)
+ H2O=Al(OH) 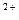
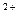
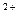 + H
+ H
Al(OH) 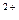
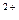
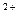
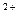
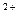 +H2O=Al(OH)2+H
+H2O=Al(OH)2+H
 Как сместить равновесие реакций гидролиза вправо и получить Al(OH)3?
Как сместить равновесие реакций гидролиза вправо и получить Al(OH)3?
134.Рассчитайте: а) потенциал водородного электрода, погруженного в чистую воду; бы) потенциал стеклянного электрода, погруженного в раствор, что содержит 0,01моль/л NH3, если Е=0,2510 В.
135.Вычислите потенциал медного электрода в растворе, что содержит 0,01М хлориду меди и 0,02М сульфата меди. Какая ошибка будет внесена в расчет, если не учитывать коэффициент активности ионов меди?
136. Щелочность воды составляет 15мэкв/л, рН=6,0. Определите, какое количество СО2 необходимо удалить из воды аэрацией, чтобы получить воду с рН =7,0?
137. Определить затрату раствора сернокислого алюминия и известкового молока для станции производительностью 25000м/сутки при обработке воды с Щ=1,2мэкв/л, мутью 240 мг/л и цветностью 110 градусов.
138. Определить, будет ли стабильной вода после ее обработки сернокислым алюминием дозой 20 мг/л, если щелочность воды 2мэкв/л, содержание свободной углекислоты 4 мг/л t=10 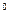 С, общее солесодержание 750 мг/л, а концентрация кальция 80 мг/л.
С, общее солесодержание 750 мг/л, а концентрация кальция 80 мг/л.
139. Остаточная жесткость воды после ее смягчения содово-известковым способом 0,5мэкв/л. Сколько граммов Na3PO4 нужно прибавить до 100л этой воды, чтобы снизить ее жесткость к 0,1мэкв/л?
140. До 50 мл 0,15М раствора карбоната натрия прибавлено 25 мл 0,3М раствору соляной кислоты. Вычислите рН раствору.
141. Раствор, 6 г мочевины, что содержит, в 50г воды, замерзает при –3,72 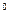 С. Определите молекулярную массу мочевины.
С. Определите молекулярную массу мочевины.
142. Почему будет ровен рН, если: а) 0,01М раствор аммиака разбавить в 10 раз; бы)0,2М раствор серной кислоты разбавить в 200 раз?
143. Вычислите концентрацию ионов водорода и ионов гидроксида в растворах с рН: а) 9,48; бы)2,22; в) 5,86; г)0,3; д)11,75.
144. Найдите рабочую обменную вместимость катионитового фильтра объемом 100л, если при том, что катионирует воды с общей жесткостью 7,2мэкв/л смягчается к проскоку солей жесткости 4000л воды.
При 42С давление водяной пары 61,5мм рт. ст. На сколько снизится давление пара пи указанной температуре, если в 450г воды растворить 36г глюкозы С6Н12О6?
145. Для нейтрализации 30 мл 0,1н раствора щелочи было нужно 12 мл раствору кислоты. Определите нормальность кислоты.
146. Определите активность гидроксильных ионов в 0,2н растворе едкого натра, если степень диссоциации, что кажется, NaOH ровная 90%.
147. Какие растворы относятся к буферным? В чем заключается суть буферного действия? Какие системы обуславливают буферные естественных вод?
148. Определите рН, при котором вода окажется стабильной. Какие воды называются стабильными?
150. Сколько будет нужно гипохлорита кальцию для обеззараживания 100 т воды с хлорпоглощаемостью 4,5 мг/л (содержание остаточного хлора 0,5 мг/л)
Контрольные задания из дисциплины «Химия атмосферы»
1. Чем объясняется слоистое строение атмосферы?
2. Химический состав воздуха у земной поверхности.
3. Зависимость температуры и давления атмосферы от высоты.
4. Как переменные составляющие части атмосферы влияют на температурный режим тропосферы?
5. Почему температура тропосферы с высотой понижается?
6. Как переменные составляющие части атмосферы влияют на температурный режим стратосферы?
7. Почему температура стратосферы с высотой повышается?
8. Чем можно объяснить понижение температуры в мезосфере?
9. Влияние жизнедеятельности человека на атмосферу (парниковый эффект).
10. Влияние жизнедеятельности человека на атмосферу (озоновые дыры).
11.Какое влияние имеет окисел углерода (1У) на климат атмосферы?
12. Озоновый цикл в стратосфере.
13. Реакционно способные частицы и их влияние на качество атмосферы.
14. Содержание газообразных выбросов от курения топлива без учета выбросов от двигателей внутреннего курения.
15. Загрязнение атмосферы двигателями внутреннего сгорания.
16. Влияние выхлопных газов на человека.
Образование фотохимического смога в газовой фазе.
18. Выбросы при производстве цемента из обжигательных печей без системы очистки
19. Вредные выбросы при производстве известки.
20. Вредные выбросы от стекловарных печей в отсутствии увлажнения.
21. Вредные выбросы при производстве кирпича и керамики.
22. Загрязнение атмосферы предприятиями химической и коксохимической промышленности.
23. Предельная концентрация распознавания запаха?
24. Вредные загрязнения атмосферы от курения отходов.
25. Предельно допустимые концентрации (ПДК) веществ в атмосфере? В каких единицах измеряется ПДК?
26. Какие источники загрязнения рассматриваются как основные?
27. Методы очистки воздуха от газообразных соединений.
28. Химические реакции в методах очистки воздуха от окисла серы (1У)? Какой вред наносят окислы серы атмосфере и человеку? Какая ПДК окисла серы (1У) в атмосфере ?.
29. Химические реакции в методах очистки воздуха от сероводороду. Какая ПДК сероводороду в атмосфере ?.
30. Какие Вам известные промышленные методы очистки воздуха от аммиака, аминов и піридинових основ? Какая ПДК аммиака и амиінів в атмосфере ?.
31. Какой метод очистки воздуха от аммиака и аминов наиболее эффективный?
32. Очистка воздуха от окислов азота. Какой вред наносят окислы азота атмосфере и человеку? Какая ПДК окислов азота в атмосфере ?.
33. Очистка воздуха от фтора и фторидов. Какая ПДК фтора и фтор дев в атмосфере ?.
34. Какие Вам известные промышленные методы очистки воздуха от окислов углерода? Какой метод очистки воздуха от окисла углерода (11) наиболее эффективный? Какая ПДК окисла углерода (11) в атмосфере ?.
35. Волюмометричний метод анализа компонентов воздуха. Приведите пример.
36. Прямое и обратное титрование как метод анализа компонентов воздуха. Примеры.
37. Газоманометрический анализ компонентов воздуха.
38. Основы эмиссионного спектрального анализа воздуха.
39. Основы абсорбційного спектрального анализа воздуха.
40. Рассчитайте рН раствору, если концентрация ионов водорода в растворе при потенціометричному методе анализа равняется 10-9 г-іон/л? Какая среда этого раствора (кислое, щелочное или нейтральное)?
41. Какая концентрация ионов водорода в растворе равняется, если рОН раствора о потенціометричному методе анализа равняется 5? Какая среда этого раствора (кислое, щелочное или нейтральное)?
42. Использование фотоколориметрического метода при анализе воздуха.
43. Закон Бугера-Ламберта-Бера и анализ воздуха.
44. Основы ІК-спектроскопии.
45. Основы хроматографических методов.
46. Основы электрохимических методов анализа воздуха.
47. Определить массу водорода (г), что содержит 3,01•1024 молекул?
48. Определить, в каком объеме простого вещества F2 содержится 2,408 1023 атомов фтора?
49. Масса 8 литров некоторого газа (н.у.) составляет 5,72 г. Определить относительную молекулярную массу этого газа.
50.Определить, в каком количестве озона содержится 5,412•1026 атомов?
51. В трех закрытых посудинах одинакового объема проводят независимо один от одного реакции. Через 30с после начала реакции:
1) в первой посудине получен 11,1г HCl;
2) во второй посудине получен 16,2 г HBr ;
3) в третьей посудине получен 19,2 г HI .
Определить номер посудины, в которой реакция перебегает с большей скоростью.
52. Для которых из приведенных реакций изменение давления не оказывает влияния на смещение равновесия:
1). H2(г) + S (тв) = H2S(г) + RН; 4). N2(г) + О2(г)= 2NO (г) + SН;
2). 2NO2 (г) = N2O4(г) + RН; 5). Н2(г)+ I2(тв) = 2HI(г)+ TН;
3). 2NO(г)+ Cl2(г) = 2NOCl + QН; 6). 2SO2(г)+ О2(г)= 2SO3(г)+ SН.
В ответе указать номера реакций в растущем порядке.
53. Для которых из приведенных реакций уменьшения объема посудины, в которой происходит реакция, приведет к сдвигу равновесия в том же направлении, что и снижение температуры?
1. N2(г) + О2(г)= 2NO(г) - TН;
2. СО2(г)+ С(тв)= 2СО(г) - TН;
3. 2СО(г)+ О2(г)= 2СО2(г)+ TН;
4. CО(г)+ Н2О(г)= СО2(г)+ Н2(г)+ ;Н;
5. 2SO3(г)+ О2(г)= 2SO3(г)+ UН.
В ответе нужно указать номера соответствующих реакций в растущем порядке.
54. Скорость химической реакции при 20оС равняется 1 моль/(л.с). Рассчитайте скорость этой реакции при 60оС, если температурный коэффициент равняется 3.
55. Две многообразных реакции протекают с выделением водорода. За одну минуту у одной из них образуется 2,24л водороду (н.у.), а в другой выделяется 2 г водороду. В сколько раз скорость одной из этих реакций больше скорости другой ?
56. Скорость химической реакции при 50оС равняется 5 моль/(л.с). Рассчитать скорость этой реакции при 100оС, если температурный коэффициент равняется 2.
57. В сколько раз уменьшится скорость прямой реакции
2SO2(г)+ О2 (г) = 2SO3(г)+ SН
если при постоянной температуре уменьшить в 4 раза давление газовой смеси?
58. При охлаждении реакционной смеси с 50 к 20оС скорость химической реакции уменьшилась в 27 раз. Определить температурный коэффициент этой реакции.
59. Как повлияет уменьшение давления на сдвиг равновесия в реакциях:
1). 2SO2(г)+ О2(г)= 2SO3(г)
2). 3Fe2O3(тв)+ СО(г)= 2Fe3O4(тв)+ СО2(г)
3). N2O4(г) = 2NO2(г)
Введите обозначение: если равновесие будет смещаться вправо, помечайте цифрой 1, если влево - цифрой 2, не будет смещаться - цифрой 0. В ответе запишите соответствующие цифры.
60. Реакция при температуре 40оС перебегает за 180 с. Температурный коэффициент реакции равняется 3. За время сколько завершится эта реакция при 60оС? В ответе отметьте время завершения реакции в секундах.
61. При действии соляной кислоты на смесь магния и карбоната магния выделяется 11,2 л газа (н.у.). После сгорания этого газа и конденсации пары объем газа уменьшается до 4,48 л (н.у.). Определите массовую судьбу (%) карбоната магния в смеси.
62. При действии избытка серной кислоты (конц.) на сульфит натрия образовался газ, который взаимодействует с газом, что образовался в результате реакции избытка соляной кислоты с сульфидом железа (II). При этом добыли 10,9 г твердого вещества. Рассчитайте массы (г) сульфита натрия и сульфида железа, которые было использовано.
63. Сквозь раствор соды, который содержит 1000 мл воды и 132,5 г безводного карбоната натрия, пропустили избыток окисла углерода (1Y). Рассчитать массу соли, что выпадает в осадок по окончании реакции, если ее растворимость при температуре опыта составляет 8 г на 100 г воды.
64. Окисел фосфора (Y), что образовался при сгорании 6,2 г фосфора в избытке кислорода, растворили в 140 мл 14% раствора КОН (густота - 1.14 г/мл). Определить массовый процент соли, что образовалось в растворе.
65.Пробу смеси азота, окисла азота (11), окисла азота (1Y) объемом 82,4 мл пропустили сквозь воду. Объем газов, что не поглотился водой, составляет 50,4 мл. К ним прибавили 16 мл кислорода. Объем после смешивания стал 56,1 мл. Определить процент (по объему) окисла азота (11) в исходной пробе.
66. При обработке 40 г смеси меди, цинка, окисла кремния и окисла цинка серной кислотой (розвед.) выделяется 4,48 л газа. Осадок, что остался, сплавлен с карбонатом натрия. При этом добыли 3,36 л газа (н.у.). После обработки плаву водой твердый остаток растворили в серной кислоте (конц.) и добыли 2,24 л газа. Определите масс.% окисла цинка в смеси.
67. Газ, что добыто при сгорании сероводороду в избытке кислорода, прореагировал с КОН, что содержится в 100 мл 40% раствора КОН (густота 1,4 г/мл). В результате реакции образовалось 120 г соли. Рассчитайте объем сероводороду (н.у.) в литрах.
68. При взаимодействии 72,8 г смеси неизвестного металла (П) и его карбоната с соляной кислотой выделено 8,96 л (н.у.) газов. После сгорания смеси газов и конденсации водяной пары объем газов уменьшился до 6,72 л. Определите масс.% металла в смеси.
69. 52.8 г сульфиду железа (11) обработан НСl. Газ, что выделено, сгорел в избытке воздуха. Этим газом нейтрализован 120мл 40% раствора КОН. Определите густоту раствора КОН.
70. Газ, что образовался при сгорании пирита, растворен в воде. При анализе к раствору прибавили по каплям бромну воду к прекращению обесцвечивания брома, а затем избыток раствора хлорида бария. Осадок, что образовано, имел массу 116,5 г. Определите массу пирита.
71. Газ, что образовано при пропускании избытка окисла углерода (1Y) сверх 0,84 г накаленого угля, направленно на реакцию из 11,2 г окисла меди. Сколько мл 63% НNO3(густота 1.4 г/мл) понадобится для полного растворения образованного в последней реакции вещества?
72. Окисел фосфора (Y), что образовано при сгорании 1,55 г фосфора, было направлено на анализ. С этой целью образованный газ пропустили сквозь 3,7 л 0.1% раствора Са(ВОН)2 (густота 1 г/мл). Какая соль была образована в результате реакции окисла фосфора с Са(ВОН)2.
73. 6.4 г серы сгорело на воздухе. В случае анализа продукт сгорания был поглощен 160 мл 5% раствором КОН.(густота 1г/мл). Раствор какого вещества при этом образован?
74. Газ, что образовано при сгорании 4,48 л (н.у.) метана, был поглощен 14 мл 40% раствора NаОН (густота 1.43 г/мл). Определить массу образованной соли.
75. В замкнутом сосуді емкостью 2м3 содержится смесь сероводороду с избытком кислорода за н.у. Смесь сожгли и после растворения в воде продуктов реакции образовалось 220г 1% раствора кислоты. Определите объемную судьбу сероводороду в исходной смеси (%).
76. Газовая смесь содержит кислород объемом 2,24л и окисел серы (1Y) объемом 3,36л. Объемы газов приведены к нормальным условиям. Определить массу смеси.
77. Смесь состоит из трех газов: окисла углерода(1Y), азота и аргона. Объемные частицы газов равняются соответственно 20,50 и 30%. Определить массовые частицы газов в смеси.
78. Есть смесь, массовые частицы газов в которой равняются %: водорода - 35, азота - 65. Определить объемные частицы газов в смеси.
79. Которые из перечисленных ниже газов легче воздуха: окисел углерода (11), окисел углерода (1Y), фтор, неон, ацетилен С2Н2,фосфін РН3?
80. Газ массой 30,3 г заполнил посудину объемом 15л при температуре 18оС. Давление газа в середине посудины составляет 122 кПа. Определите молярную массу газа.
81. Окисел углерода (1Y) находится в посудине, вместимость которой равняется 20 л, при температуре 22 С и давления 500кПа. Определите массу окисла углерода (1Y).
82. Какой объем занимает при температуре 20оС и давления 250 кПа аммиак массой 51г?
83. Какой объем водорода выделится при нормальных условиях, если растворить алюминий массой 10,8 г в избытке соляной кислоты?
84. Какой объем аммиака, измеренный при нормальных условиях, должен прореагировать с избытком хлороводню для добывания хлорида аммонию массой 10,7 г?
85. При очистке воздуха от серистого газа (SO2) его переводят в серный газ. Какой объем окисла серы(1Y) нужно взять для реакции окисления кислородом, чтобы добыть окисел серы (Y1) массой 20 г, если выход продукта равняется 80%? Объем рассчитать при нормальных условиях.
86. При очистке воздуха от сероводороду объем сероводороду 2.8 л (нормальные условия) пропустили сквозь избыток раствора сульфата меди (П). При этом образовался осадок массой 11,4г. Определите выход продукта реакции.
87. Во время сжигания угля массой 50г образовался окисел углерода (1Y), который пропустили сквозь раствор гидроксида бария. Какая масса осадка образовалась, если массовая частица углерода в угле составляет 96%?
88. В посудине находится смесь водорода и кислорода объемом 25 мл. В результате реакции между компонентами остался кислород, что не прореагировал, объемом 7 мл. Определите объемную частицу кислорода в исходной смеси, если все объемы приведены к одинаковым условиям.
89. Какой объем хлору (н.у.) нужный для хлорирования смеси меди и железа массой 60г? Массовая частица меди в смеси составляет 53,3%.
90. Во время разложения галогенида аммонию массой 4,9 г добыт аммиак, объем которого при нормальных условиях составляет 1,12 л. Какой галогенид был взят?
91. Во время сгорания технической серы массой 10 г выделился газ, который пропустили сквозь избыток раствора гидроксида натрия. В реакцию вступил гидроксид массой 24 г. Определите массовую частицу серы в техническом продукте.
92. Некоторый газ, образованный бором и водородом, причем массовая частица водорода в нем равняется 18,5%. Густота этого газа за водяному составляет 27. Определите формулу этого газа.
93. Массовые частицы кремния и водорода, которые входят в состав некоторого соединения, равняются соответственно 91,3 и 8,7%. Определите формулу соединения, если густота ее пары за воздухом равняется 3,172.
Ответ: Si3H8
94. Уголь массой 10кг сгорел на воздухе. Объемная частица кислорода в воздухе составляет 21%. Уголь содержит углерод (массовая частица 96%), серу (0,8%) и негорючие примеси. Какой объем воздуха при этом потрачен? Объем воздуха вычислить при температуре 30оС и давления 202,6 кПа.
Ответ: 47,36 м3.
95. Продуктами сгорания вещества массой 3,2г есть азот объемом 2,24л (нормальные условия) и вода массой 3,6г. Определите формулу соединения, если густота ее пары за водородом равняется 16.
96. При анализе смесь водорода и хлороводню объемом 7л (нормальные условия) пропустили сквозь раствор нитрата серебра, взятый с избытком, и достали осадок массой 28,7г. Определите объемную частицу водорода в смеси.
Ответ: 36%.
97. При анализе сквозь раствор йодида натрия массой 50г с массовой частицей 15% пропустили избыток хлору. Выделился иод массой 5,6г. Определите выход продукта реакции.
Ответ: 88,2%.
98. Газ, что образовался во время взаимодействия сульфида железа (II) массой 17,6 г с избытком серной кислоты, пропустили сквозь раствор сульфата меди (II) массой 300г. Образовался осадок массой 14,4г. Определите массовую частицу сульфата меди (II) в растворе.
Ответ: 8%.
99. Какой объем газа измерен при температуре 22оС и давления 98 кПа, выделится, если к раствору карбоната натрия массой 230г с массовой частицей 15% долить раствор хлороводню массой 220г с массовой частицей 20%?
Ответ: 6,26л.
100. Раствор хлороводню объемом 33,2мл и густотой 1,1г/мл прореагировал с 4,5 л. аммиака при нормальных условиях. Определите массовую частицу хлороводню в исходном растворе.
Ответ: 20%.
101. Какой объем водорода, измеренный при нормальных условиях, выделится при действии на алюминий массой 32,4г раствора объемом 200мл с массовой частицей гидроксида калию 30% и густотой 1,29 г/мл?
Ответ: 40,32л.
102. Водород сожгли в избытке кислорода. Объем газовой смеси, приведенный к нормальным условиям, уменьшился на 240 мл. Определите исходный объем водорода. Объем вычислите при нормальных условиях.
103. Во время взаимодействия щелочно-земельного металла массой 3,425г с водой выделился водород объемом 560мл (нормальные условия). Определите, какой металл был взят для анализа.
Ответ: барий.
104. Для нейтрализации раствора, добытого при взаимодействии гидрида кальция с водой, потратили раствор хлороводню объемом 43,67 мл с массовой частицей 29,2% и густотой 1,145 г/мл. Какой объем водорода, измеренный при нормальных условиях, выделился при разложении гидрида?
Ответ: 8,96л.
105. Хлороводень, добытый сульфатным средством из хлорида натрия массой 11,7г, пропустили сквозь раствор нитрата серебра. Добыли осадок массой 20,09г. Считая, что выход реакции количественен, определите выход хлороводню.
Ответ: 70%.
106. Все хлороводень, добытый действием избытка серной кислоты на хлорид калию массой 14,9г, поглотили водой массой 200г. Определите массовую частицу хлороводню в растворе, если его выход в реакции составляет 70%.
Ответ: 2,5%.
107. Какой объем сероводороду, измеренный при нормальных условиях, выделится из технического сульфида железа массой 3 кг, в котором массовая частица FeS составляет 95%?
Ответ: 725л.
108. Какой объем окисла серы (Y1), измеренный при температуре 27оС и давления 98,5 кПа, образуется во время выжигания пирита массой 30г, который кроме дисульфіду железа FeS2, содержит примеси, которые не образуют при выжигании SO2? Массовая частица примесей в пирите составляет 20%.
Ответ: 10,1л.
109. Аммиак, объемом 20л (нормальные условия) растворили в воде массой 400г. Определите массовую частицу аммиака в растворе.
Ответ: 3,7%.
110. Во время очистки газового потока от аммиака хлороводень массой 7,3г взаимодействует с аммиаком массой 5,1г. Какой газ останется в избытке? Определите массу избытка.
Ответ: 10,7г, избыток аммиака 1,7г.
111. Для определения содержания аммиака в пробе воздуха взято 50 мл серной кислоты (Сн(H2SO4)= 0,1н) Для измерении остатка серной кислоты после взаимодействия части ее с аммиаком согласно с уравнением реакции
H2SO4+ 2NH3 = (NH4)2SO4
для определения точки эквивалентности потрачен 35,6 мл 0,1н розчина NaOH.
112. Рассчитать содержание аммиака в воздухе по объему (v%) если 50мл проб воздуха при температуре 25оС и давления 747мм.рт.ст. содержат 3•10-4 г. Сделайте вывод, превышают ли полученные результаты предельно-допустимую концентрацию (ПДК) аммиака в воздухе.
113. Рассчитать исходную концентрацию аммиака в воздухе (г/л), если рН раствора пробы с аммиаком в воде 9,5. Сделайте вывод, превышают ли полученные результаты предельно-допустимую концентрацию аммиака в воздухе (ПДК).
114. Рассчитать содержание аммиака в воздухе по объему (v%), если объем пробы воздуха 50 мл (температура 21оС; давление 740мм.рт.ст.), а рН раствора в воде пробы воздуха с аммиаком измеренный потенціостатичним методом составляет 9,5. Сделайте вывод, превышают ли полученные результаты предельно-допустимую концентрацию (ПДК) аммиака в воздухе.
115. Рассчитать ступней диссоциации (б), если рН раствора в воде пробы воздуха с аммиаком измеренный потенціостатичним методом составляет 9,5. (Константа диссоциации равняется Kд(NH4OH)= 1,8 10-5).
116. Определение содержания СО2 в пробе воздуха, основано на измерении остатка щелочи после взаимодействия части его с углекислым газом. Рассчитать содержание СО2 в пробе газа если объем раствора щелочи в заборной бутылке 50 мл (Сн(КОН)= 0,1н), а объем раствора кислоты (Сн(НС1)=0,1н), что тратит на титрование составляет 34,5 мл.
117. Рассчитать процентное содержание СО2 в воздухе по объему, если объем пробы воздуха 300 мл (температура 24оС; давление 745мм.рт.ст.) содержит 3•10-4г углекислого газа.
118. Определить концентрацию окислов азота (в пересчете на N2O5 ) в воздухе (мг/м3) с использованием фотоколориметрического метода, если для анализа взят объем пробы воздуха 500 мл при температуре 25оС и давлении 747мм.рт.ст. Метод основан на реакции диоксида азота с иодидом калия:
2КI + 2NO2 = I2 + 2KNO2
Содержание диоксида азота определяют по реакции получения азокрасителя с реактивом Гриса и измерении оптической плотности раствора. По зависимости в=f(D) определяем по оптической плотности массу диоксида азота, что найденного в объеме анализируемого раствора. Общий объем исследуемого раствора 50 мл, объем раствора, взятого для анализа составляет 10 мл, оптическая плотность раствора 0,085.
Данные для построения калибровочного графику D = f(в):
| Номер стандарта | 1 | 2 | 3 | 4 | 5 | 6 |
| Содержание (в) N2O5, мг | 5,0 | 6,0 | 7,0 | 8,0 | 9,0 | 10,0 |
| Оптическая плотность (D) | 0,06 | 0,07 | 0,085 | 0,095 | 0,11 | 0,12 |
119. Определить концентрацию окислов азота (в пересчете на N2O5 ) в воздухе (мг/м3) с использованием фотоколориметрического метода, если для анализа взят объем пробы воздуха 200 мл при температуре 298К и давления 752мм.рт.ст. Метода заснован на ходу реакции диоксиду азота с іодідом калию:
2КI + 2NO2 = I2 + 2KNO2
Содержание диоксиду азота определяют за реакцией создания азокрасителя с реактивом Гриса и измерении оптической плотности раствора. За зависимостью в=f(D) определяем по оптической плотности массу диоксиду азота, что найдено в объеме раствора, что анализируется. Общий объем раствора, что исследуется, 50 мл, объем раствора, что взято к анализу, 10 мл, оптическая плотность раствора 0,11.
Данни для построения калібровочного графику D = f(b):
| Номер стандарта | 1 | 2 | 3 | 4 | 5 | 6 |
| Содержание (в) N2O5, мг | 5,0 | 6,0 | 7,0 | 8,0 | 9,0 | 10,0 |
| Оптическая щільнісь (D) | 0,06 | 0,07 | 0,085 | 0,095 | 0,11 | 0,12 |
120. При сгорании 20 л метана и етану образовано 25л окислу углерода (1Y). Определите состав смеси в процентах.
Задачи 121-150
Определить, может ли при температуре Т самочинный перебегать в дымарях промышленных предприятий нижеприведенная реакция, и тип этой реакции: экзотермическая или эндотермическая. Рассчитайте константу равновесия (Кр(Т)). При расчетах пользуйтесь справочником физико-химических величин или смотрите дополнение 1.
121. 2H2+O2=2H2O T=400 K
(Ответ: перебегает самочинный, экзотермическая Кр=1.021080)
122. 2CO2=2CO+O2 T=500 K
(Ответ: не перебегает самочинный, эндотермическая Кр=0.8910-51)
123. 3H2+N2=3NH3 T=800 K
(Ответ: не перебегает самочинный, экзотермическая Кр=0.9510-6)
124. H2+CO2=CO+H2O T=1200 K
(Ответ: перебегает самочинный, эндотермическая Кр=1.41)
125. Сl2+CO=COCl2 T=400 K
(Ответ: перебегает самочинный, экзотермическая Кр=1.20107)
126. 4СO+2SO2=4CO2 + S2(Г) T=700 K
(Ответ: перебегает самочинный, экзотермическая Кр=7.201019)
127. 2NO+H2=N2O+H2O T=900 K
(Ответ: перебегает самочинный, экзотермическая Кр=1.301013)
128. SO2+Cl2=SO2Cl2 T=400 K
(Ответ: перебегает самочинный, экзотермическая Кр=2.09)
129. 2SO2+O2=2SO3 T=600 K
(Ответ: перебегает самочинный, экзотермическая Кр=2.50107)
130. S2+4CO2=4CO+2SO2 T=800 K
(Ответ: не перебегает самочинный, эндотермическая Кр=9.1210-17)
131. S2+4H2O = 2SO2+4H2 T=900 K
(Ответ: не перебегает самочинный, эндотермическая Кр=2.2410-12)
132. N2O4 =2NO2 T=400 K
(Ответ: перебегает самочинный, эндотермическая Кр=48.98)
133. 2NO2 = 2NO + O2 T=500 K
(Ответ: не перебегает самочинный, эндотермическая Кр=6.0310-5)
134. 4NO+6H2O = 4NH3+5O2 T=800 K
(Ответ: не перебегает самочинный, эндотермическая Кр=2.4010-69)
135. 2N2+6H2O = 4NH3+3O2 T=1200 K
(Ответ: не перебегает самочинный, эндотермическая Кр=5.0110-63)
136. N2+O2 = 2NO T=400 K
(Ответ: не перебегает самочинный, эндотермическая Кр=2.9510-23)
137. 2NO +O2 = 2NO2 T=400 K
(Ответ: перебегает самочинный, экзотермическая Кр=1.74105)
138 NH3+O2 = NO+H2O T=500 K
(Ответ: перебегает самочинный, экзотермическая Кр=1.5810112)
139. H2S+2HNO3 = 2NO2+2H2O+S T=600 K
(Ответ: перебегает самочинный, эндотермическая Кр=794,33)
140 3SO2+2H2O+2HNO3=2NO+3H2SO4 T=500 K
(Ответ: перебегает самочинный, экзотермическая Кр=2.821026)
141 4HNO3=4NO2 + O2+2H2O T=400 K
(Ответ: перебегает самочинный, эндотермическая Кр=5.01)
142. SO2+O3 = SO3+O2 T=250 K
(Ответ: перебегает самочинный, экзотермическая Кр=7.241031)
143. 2N2O+ O3 = 2NO +O2 T=250 K
(Ответ: перебегает самочинный, эндотермическая Кр=1.91)
144. CO+O3 = CO2+O2 T=250 K
(Ответ: перебегает самочинный, экзотермическая Кр=5.011070)
145. O3+NO = NO2 +O2 T=250 K
(Ответ: перебегает самочинный, экзотермическая Кр=2.571041)
146. 2NO+2СO = N2 +2CO2 T=500 K
(Ответ: перебегает самочинный, экзотермическая Кр=6.461067
147. 2NO+CO = N2O+CO2 T=500 K
(Ответ: перебегает самочинный, экзотермическая Кр=4.271023)
148. CO+H2O = H2 +CO2 T=500 K
(Ответ: перебегает самочинный, экзотермическая Кр=138.04)
149. 2NO+5H2 = 2NH3 +2H2O T=500 K
(Ответ: перебегает самочинный, экзотермическая Кр=3.91062)
150. 4NH3+5O2 = 4NO +6H2O T=500 K
(Ответ: перебегает самочинный, экзотермическая Кр=5.010103)
Лабораторная работа № 4.
Исследование изменения качества воды при ее обработке коагулянтами (щелочность и рН воды). Определение оптимальной дозы коагулянту
Прежде чем приступить к выполнению работы, ознакомьтесь с теоретическим материалом, изложенным в учебниках: Таубе П.Р., Баранова А.Г. " Химия воды и микробиология"; Возная Н.Ф. " Химия воды и микробиология"; Карюхина Т.А., Чурбанова І.Н. "Контроль качества воды", а также выучите Сноп 2.04.02-84, раздел "Освещения и обесцвечения воды".
Ответишь на вопрос: 1. Как проводится предыдущий расчет дозы коагулянту? Как определяется оптимальная доза коагулянту для освещения и обесцвечения воды? 2. Как влияют разные факторы на процесс обработки воды коагулянтами?
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ: выучите влияние дозы коагулянту на смену щелочности и рН воды.
Для выполнения опыта вам необходимо:
1) рассчитать необходимую дозу коагулянту, мг/л, исходя из мути (или цветности) воды;
2) коагулянт (чаще всего сульфат алюминия Al2(SO4)3 · 18Н2О) используется в виде 1%-го раствора (в пересчете на безводную соль). Как приготовить 1л такого раствора?
3) дайте ответ как вы допускаете осуществить опыт, которые посуда, приборы и реактивы понадобятся для этого?
4) как отмеряется доза коагулянту, рассчитанная в соответствии со СН1П 2.04.02-84?
5) Рассчитайте, сколько мілілітрів 1%-го сульфата алюминия нужно прибавить до 1л воды, что коагулирующаяся, если рассчитанная доза составляет 50 мг/л;
6) По изменению щелочности и рН в зависимости от дозы коагулянту постройте графики. Определите действительную оптимальную дозу на основании изменения щелочности;
7) Нужное в вашем случае подщелачивание ли воды? Если так, то какой реактив вы допускаете для этого использовать? Как лучше вводить его в воду: в твердом виде или в растворе? Рассчитайте предыдущую дозу известки соответствующую к оптимальной дозе коагулянту, определенной в пункте 5 (в мг/л и в мл, учитывая концентрацию раствора реагента, что используется для подщелачивания);
8) Повторите опыт, проведя предыдущее подщелачивание воды дозой известки. Проверьте значение щелочности и рН, максимальный эффект освещения воды;
9) Сделайте выбор условий коагуляции. Рассчитайте действительную дозу известки по изменению щелочности.
10.5 "ОПРЕДЕЛЕНИЕ АММИАКА В ВОЗДУХЕ"
ЦЕЛЬ РАБОТЫ: определить процентное содержание аммиака по объему в воздухе с использованием обратного метода титрования; полученные результаты сравнить с ПДК (граничнодопустимою концентрацией) (ГДКNH3 = 0.2 мг/м3).
I. Определение количества аммиака в пробе воздуха учреждается на измерении остатка серной кислоты после взаимодействия части ее с аммиаком согласно с уравнением реакции
H2SO4+ 2NH3 = (NH4)2SO4
титрованием ее раствором щелочи заданной концентрации. Точку эквивалентности при титровании определяют с использованием индикатору метилоранжу. Расчет содержания аммиака, что поглощено из пробы, осуществляется за формулой (1):
(н(H2SO4) V(H2SO4) – н(NaOH)· V(NaOH)) МЭ(NH3)
Х = ---------------------------------------------------------------------, (1)
1000
где: Х - содержание NH3 в пробе воздуха, г;
н(H2SO4), н(NaOH) - концентрация (нормальность) растворов
серной кислоты и гидроксида натрия;
V(H2SO4) - объем серной кислоты, что налито в колбу для
поглощение аммиака;
V(NaOH) - объем щелочи, что пошло на обратное титрование;
Мэ(NH3) - масса эквивалентная аммиаку.
2. Расчет процентного содержания аммиака в воздухе по объему (УNH3 v%).
Х•22,4•100
УNH3 (v%) = -------------- ------- (2)
17•Vо см.газов
где: Х /17 - количество (число молей) аммиака в пробе, моль;
Х· 22,4/17 - объем аммиака в пробе при нормальных условиях, л;
22,4 л - молярный объем газа за нормальных условиях, л.
Vо см.газов - объем пробы воздуха, что приведено к нормальным условиям, л.
Приведение объема смеси газа к нормальным условиям с использованием объединенного газового закона (3):
PатмV см. газов PоVо см. газов
------------------ = ------------------, (3)
T Tо
где: Pо = 101.33 кПа; 1 атм; 760 мм рт.ст.
Tо = 273 К (0оС)
Pатм = атмосферное давление.
Сделайте вывод, превышают ли полученные результаты предельно-допустимую концентрацию аммиака в воздухе (ПДК). Для этого переведите содержание аммиака в исследуемой пробе (Х) в единице ПДК (мг/м3) и сравните с ПДК для аммиака.
Вопрос для самоподготовки к лабораторной работе №1:
1. Что такое ПДК?
2. В каких единицах измеряется ПДК?
3. Почему равняется ПДК для аммиака?
4. Как делается отбор пробы воздуха в лабораторных и промышленных условиях?
5. Какой реагент используется как поглотитель аммиака?
6. В чем суть метода обратного титрования?
7. Как определялась точка эквивалентности в данной лабораторной работе?
8. Какой индикатор использовали при титровании?
9. Как влияет аммиак и амины на здоровье человека?
10. Какие Вам известные промышленные методы очистки воздуха от аммиака и аминов?
11. Какой метод очистки воздуха от аммиака и аминов наиболее эффективный?
10.6. "ОПРЕДЕЛЕНИЕ АММИАКА В ВОЗДУХЕ ПОТЕНЦІОМЕТРИЧНИМ МЕТОДОМ"
ЦЕЛЬ РАБОТЫ: определение аммиака потенціометричним методом, что основано на поглощении аммиака обычной водой из пробы воздуха и измерении рН раствора, что образовался.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1.1. ОТБОР ПРОБЫ: Отбор пробы воздуха, что содержит аммиак, проводят в колбы, (или бутылки), емкостью 0,5л, что вакуумировано и оборудовано одноходовыми кранами. Перед вакуумированием в бутылки наливают по 50 мл дистиллированной воды. Вакуумирования проводят с помощью электрического вакуумного насосу или механического ручного насосу Комовского. Забор пробы осуществляют в вытяжном шкафу, что загазованно аммиаком из открытой чаши с раствором аммиака, открытием крану колбы на 2-3 секунды. После отбора пробы включается тяга в вытяжном шкафу, а бутылки с пробами взбалтываются в течение 10-20 секунд.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Три способа расчета молекулярной массы газообразных веществ:
1. За следствием из закона Авогадро: один моль любого газа при нормальных условиях (То = 273 К; t = 0оС; Ро = 760 мм рт.ст., 101.33 кПа) занимает объем 22,4л (молярный объем).
То есть масса молярного объема (22.4 л) это и будет молярна (масса объема 1 молю газа (22.4 л).
Приведение объема газа к нормальным условиям с использованием объединенного газового закона (1):
Pатм•V сум.газів Pо•Vосум.газів
------------------ = ----------------- (1)
T Tо
где: Pо = 101.33 кПа; 1 атм; 760 мм рт.ст.
Tо = 273 К (0оС)
Pатм = атмосферное давление.
Отсюда рассчитывается объем газа при нормальных условиях:
Vо сум.газів= Pатм•V сум.газів· Tо/ Pо•T
2. Расчет за относительной плотностью газа. По закону Авогадро отношение масс ровных объемов газов равняется отношению их молекулярных масс. Относительная плотность одного газа за другим (D) это отношение масс ровных объемов газов (2) и (3):
mгазу/mH2 = Мгазу/МН2 = DH2 (2)
mгазу/mповіт = Мгазу/Мповітря = Dповітря (3)
где: mгазу - масса газа, что исследуется;
mH2 - масса водорода того же объема;
mповітря - масса воздуха того же объема;
Мгазу - молярная масса газа, что исследуется;
МН2 - молярная масса водорода;
DH2 - относительная густота газа за водородом;
Мповитря - молярная масса воздуха (среди);
Dповітря - относительная густота газа за воздухом.
За формулами (4) и (5), что выплывают из закона Авогадро (2) и (3), рассчитываем молекулярную массу газообразных веществ:
Мгазу = МН2•DH2 = 2•DH2 (4)
Мгазу = Мповітря· Dповітря = 29•Dповітря (5)
3. Расчет за формулой Клапейрона-Менделеева (6):
Pатм•Vгазу = mRT/Мгазу (6)
где: Ратм- давление газа по данным барометру
Vгазу- объем газа при атмосферных условиях
Т = 273 + tоС - температура, при которой проводится опыт
R - универсальная газовая постоянная, что равняется: 0.082 л-атм/моль· К;
62400 мл· мм рт.ст./моль· К; 8.314 л Дж/моль· К.
Вопрос для самоподготовки к лабораторной работе №3:
1. Что такое молярный объем?
2. Почему равняется молярный объем при нормальных условиях?
3. Что такое относительная плотность газа?
4. Как рассчитывается относительная плотность газа?
5. Математическое выражение закона Авогадро.
6. Как рассчитать количество вещества исходя из его массы?
7. Какое влияние на атмосферу имеет повышенное содержание углекислого газа в воздухе?
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Метод основан на ходу реакции диоксиду азота с іодідом калию (1):
2КI + 2NO2 = I2 + 2KNO2 (1)
Содержание диоксиду азота определяют фотоколориметрическим методом за реакцией создания азокрасителя с реактивом Гриса. Чувствительность метода 2 мг/м3. ПДК в воздухе (в пересчете на N2O5) 5 мг/м3.
ХОД ОПРЕДЕЛЕНИЯ
Из поглощающей колбы отбирают пипеткой 5 мл (с) раствора, что исследуется, и наливают в мерную колбу емкостью 50мл., взбалтывают и добавляют 1 мл реактива Гриса. За 20 минут после внесения реактива, непосредственно перед намерением в колбу вносят 0,5 мл 0,01 н раствору Nа2SO3, доводят водой к черточке 50 мл и определяют оптическую плотность раствора. За графической зависимостью в = f(Д) определяем количество диоксиду азота (в), что найдено в объеме, что анализируется (с). (л = 540 нм, чувствительность - 2).
ЗАДАЧА 121
ЗАДАЧА 122
ЗАДАЧА 123
ЗАДАЧА 124
ЗАДАЧА 125
ЗАДАЧА 126
ЗАДАЧА 127
ЗАДАЧА 128
ЗАДАЧА 129
ЗАДАЧА 130
ЗАДАЧА 131
ЗАДАЧА 132
ЗАДАЧА 133
ЗАДАЧА 134
ЗАДАЧА 135
ЗАДАЧА 136
ЗАДАЧА 137
ЗАДАЧА 138
ЗАДАЧА 139
ЗАДАЧА 140
ЗАДАЧА 141
ЗАДАЧА 142
ЗАДАЧА 143
ЗАДАЧА 144
ЗАДАЧА 145
ЗАДАЧА 146
ЗАДАЧА 147
ЗАДАЧА 148
ЗАДАЧА 149
ЗАДАЧА 150
СОДЕРЖАНИЕ
Стр.
1. Задачи и значения курса “Химия воды и атмосферы”. 5
2. Перечень учебных элементов 9
3. Тематический план лекционных занятий 12
4.Тематический план лабораторных занятий. 13
5. Самостоятельная работа студентов 14
6. Тесты для самоподготовки 1 15
7. Литература и методические пособия 36
8. Таблица вариантов контрольных заданий 38
9. Контрольные задания 35
10. Лабораторные работы 65
УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ
к самостоятельной работе по дисциплине
«ХИМИЯ ВОДЫ И АТМОСФЕРЫ»
(для студентов направления подготовки 08.03.01 «Строительство», профиль-ГСХ, всех форм обучения)
(контрольные задания, вопросы к зачету, лабораторные работы)
УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ
к самостоятельной работе по дисциплине
«ХИМИЯ ВОДЫ И АТМОСФЕРЫ»
(для студентов
направления подготовки - 08.03.01 «Строительство» ;
профиль –ГСХ, всех форм обучения)
(контрольные задания, вопросы к зачету, лабораторные работы)
Макеевка 2017
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
ДОНЕЦКОЙ НАРОДНОЙ РЕСПУБЛИКИ
ГОУ ВПО «ДОНБАССКАЯ НАЦИОНАЛЬНАЯ АКАДЕМИЯ СТРОИТЕЛЬСТВА И
АРХИТЕКТУРЫ»
ФАКУЛЬТЕТ ИНЖЕНЕРНОГО И ЭКОЛОГИЧЕСКОГО СТРОИТЕЛЬСТВА
КАФЕДРА "ПРИКЛАДНАЯ ХИМИЯ"
МЕТОДИЧЕСКОЕ ПОСОБИЕ
к самостоятельной работе по дисциплине
«ХИМИЯ ВОДЫ И АТМОСФЕРЫ»
(для студентов
направления подготовки - 08.03.01 «Строительство» ;
профиль – ГСХ, всех форм обучения)
(контрольные задания, вопросы к зачету, лабораторные работы)
Утверждено
на заседании совета
факультета ИЭСС
Протокол № 4 от 30.11. 2016
Макеевка, 2017
УДК 541.13
Учебно-методическое пособие к самостоятельной работе по курсу «Химия воды и атмосферы» для студентов направления подготовки - 08.03.01 «Строительство»; профиль –ГСХ; всех форм обучения)
Составители: З.З. Малинина, С.И. Сохина. – Макеевка: ГОУ ВПО ДонНАСА, 2017. – 96с.
Содержит материал для самостоятельного изучения теоретического материала, для подготовки к выполнению расчетных и лабораторных работ по дисциплине «Химия воды и атмосферы».
1. Задачи и значение курса “Химия воды и атмосферы”.
В настоящее время во всех технически развитых странах первостепенное значение приобрели вопросы рационального использования водных ресурсов и охраны водоемов от загрязнения, охраны атмосферы от загрязнений. В нашей стране с особенным вниманием относятся к внешней среде, стремясь сохранить чистоту атмосферного воздуха и создать больше всего благоприятные условия для жизни и труда людей.
Вопрос защиты окружающей среды и, в частности, воды и атмосферы давно уже вышли за рамки кабинетов ученых и рассматриваются в парламентах, в международных комитетах. Перед учеными и инженерами, которые работают в области водоснабжения и очистки стоковых вод, теплогазопостачання, вентиляция и охраны воздушного бассейна поставлен ряд безотлагательных задач. Среди них важнейшее значение имеют:
1. Максимальное расширение оборотного водоснабжения и сводки к минимуму образования стоковых вод.
2. Внедрение комплексной автоматизации и механизации всех технологических процессов по водообработке и контролю за качеством воды..
3. Разработка и внедрение новых более эффективных методов водообработки.
4. Уменьшение выбросов загрязняющих веществ в атмосферу за счет усовершенствования технологических процессов переработки топлива, сырьевых компонентов промышленности.
5. Внедрение комплексной автоматизации и механизации всех технологических процессов и более тщательный контроль за выбросами.
6. Разработка и внедрение новых более эффективных методов утилизации загрязняющих атмосферу веществ.
Решение этих проблем жаждет от специалиста кроме инженерной подготовки ґрунтовних знаний о закономерностях химических процессов, которые протекают при очистке газовых потоков.
В связи с этим курс “Химия воды и атмосферы”, что выкладывается для студентов специальности «Городское строительство и хозяйство» должен дать студентам необходимый объем теоретических знаний химических процессах, которые перебегают в воде и атмосфере, при очистке водных и газовых потоков от загрязняющих веществ и подготовить студентов к изучению специальных курсов.
За сравнительно короткий срок студентам нужно овладеть основными методами химического анализа воды и воздуха, ознакомиться с элементарными приемами обработки результатов анализа и их использования для оценки качества воды и воздуха по сравнению с ПДК и сделать вывод о необходимой степени его очистки. Студенты должны также получить навыки работы на современных лабораторных приборах (рН - метр, хроматограф, фотоколориметр).
Базируя на программах курсов общей химии, физики и математики, курс “Химия воды и атмосферы”, в свою очередь, дает прочное основание для прослушивания специальных дисциплин, а также способствует формированию мировоззрения будущих специалистов
Объем и структура курса.
Курс "Химия воды и атмосферы" состоит из общей теоретической и специальной части, что рассматривает процессы загрязнения воды и атмосферы, устранения загрязняющих веществ, а также из короткого курса основ методов анализа воды и воздуха.
Лабораторный практикум знакомит студентов с современными методами анализа воды и воздуха и включает 8 лабораторных работ. Всего на изучение курса уделяется 54 часов, с их 16 - лекционные, 16 - лабораторные работы и 22 часа для самостоятельной работы студентов.
Изучение курса заканчивается зачетом в 4 семестре. В разделе 5 представленный перечень лекций за курсом и рабочий план выполнения лабораторных работ.
Общие методические рекомендации.
Теоретическая часть курса "Химия воды и атмосферы" базируется на химических понятиях и законах, которые выкладывались студентам в курсе общей химии. При чтении специальной части для объяснения явлений, которые имеют место при устранении загрязнений атмосферы, привлекаются химические теории и учебы (о направлении процессов и их скорости, о здании вещества и т.д.), основные представления о которых также были данные при изучении общей химии.
Показателем понимания того или другого материала служит не просто информированность о нем, а умения использовать имеются данні для решения поставленных задач. Потому практически во всех лекциях за данным курсом используются элементы проблемной учебы. Этот вид учебы основан на утверждении, что мышление человека начинается там, где создается проблемная ситуация, познавательное противоречие. При решении проблемы активное участие принимают студенты, что содействует развитию у них творческого мышления и формированию системы интеллектуальных навыков.
Решение проблемных ситуаций может быть сугубо индивидуальным, однако существуют и общие познавательные приемы.
Во время поиска решения нужно пытаться использовать все приобретенные знания, а также и те, которые получены при изучении других предметов - физики, математики, философии, и др.
Однако всегда стоит помнить, что решение тех или других проблем может строиться только на базе крепких знаний. Именно поэтому большое внимание уделяется и решению расчетных задач, которые преследуют целью запоминания формул и их применения для расчета, например, возможности образования тех или других загрязняющих веществ в определенных условиях.
При решении таких задач тщательным образом ознакомьтесь с условием, найдите отсутствующие данные в учебниках, справочниках. Поставьте ряд вытекающих один из одного вопросов, начиная с необходимого ответа. При решении задач такого типа могут с успехом использоваться те познавательные приемы, о которых речь шла выше.
Эксперимент - один из методов познания окружающего мира, играет решающую роль при выборе методов анализа и очистки атмосферы, определение оптимальной дозы реагентов и т.д. Основная цель практикума - помочь студенту овладеть методами химического анализа воздуха и использовать данные анализа в практической деятельности подбора методов очистки газовых потоков. При подготовке к лабораторной работе рекомендуется осознать теоретические основы метода, ознакомиться с приборами и оборудованием, предусмотреть потребность в посуде и реактивах продумать последовательность действий при выполнении анализа.
Нужно поставить больше всего вопросов. Почему? Зачем? Какое влияние тех или других условий на ход работы? Постарайтесь самостоятельно получить формулу для расчета результатов анализа. Работая в лаборатории, обращайте внимание на технику работу, тщательным образом и аккуратно выполняя все аналитические операции. Соблюдайте правила пользования химической посудой и правила техники безопасности. После выполнения работы оцените результаты и сделайте выводы по сравнению с ПДК загрязняющих веществ.
Некоторые лабораторные работы практикума имеют научно-исследовательский характер.
Цель такой экспериментальной работы - научиться элементарных приемов научного поиска и способам объяснения явлений, которые наблюдаются. Те закономерности, что получают студенты в результате работы, уже известны науке, однако, используя известную им методологию в следующей деятельности, смогут получить новые научные знания.
Самостоятельная работа студентов и ее контроль.
Современное высшее образование ставит за цель научить студентов умению самостоятельно и постоянно пополнять свои знания. Потому в процессе изучения курса необходимо соединять работу на лекциях и лабораторных занятиях с систематической проробкою материала при домашней подготовке.
Можно рекомендовать следующие виды самостоятельной работы:
· Подготовка к лекциям и проробка лекционного материала с использованием только обязательной литературы.
· Для углубленного изучения материала стоит обратиться к дополнительной литературе. Психологами доказано, что одним из найдійовіших способов усвоения знаний является речь (устная или письменная). Потому, желательно составлять короткий конспект материала при работе с учебниками.
· Для лучшего усвоения и контроля знаний теоретического материала как домашнее задание предлагается один из нескольких вопросов проблемного характера и расчетные задачи (задание выполняется в письменном виде). Устно студент должен уметь ответить на вопрос для тестового самоконтроля.
Подготовка к лабораторным занятиям.
Студенты знакомятся с лабораторной работой за кафедральными методическими пособиями. При этом стоит осознать цель работы, методику анализа и составить в лабораторном журнале короткое ее описание за следующим планом:
1) Принцип метода.
2) Приборы.
3) Необходимые реактивы и посуда.
4) Ход работы.
5) Расчет результата анализа.
6) Выводы.
После выполнения лабораторной работы ее нужно защитить, то есть ответить на вопрос по теоретической и экспериментальной части работы.
Эффективной формой приобщения до самостоятельной работы является работа над рефератом за темой, предложенной или преподавателем, или избранной студентом.
В процессе работы над рефератом студент получает возможность ознакомиться с основными научными изданиями, монографиями, периодической литературой, справочными материалами, Интернет-изданиями. Эта работа способствует формированию основных интеллектуальных навыков: умение классифицировать, сравнивать, делать выводы и обобщать.
Наиболее интересные рефераты докладываются и обсуждаются на кафедральных семинарах и студенческих научных конференциях.
Перечень учебных элементов
Смысловой модуль АТ-Б-0 ”ВСТУПЛЕНИЕ” (1 час).
Химия воды и атмосферы как естественная наука. Общенаучное и практическое значение химии атмосферы. Основные направления химии атмосферы и ее теоретические и экспериментальные методы исследования. Химия воды и атмосферы и экологические проблемы в современном мире. Значение «Химии атмосферы» при рассмотрении природоохранных систем.
Раздел (учебный объект) “Атмосфера” (36 часов)
Смысловой модуль АТ-Б-1 Атмосфера, ее строение и состав (2 часа).
Дата: 2018-11-18, просмотров: 788.
 + Ka
+ Ka