1.1 Онтогенез иммунной системы человека
Основные элементы иммунной системы человека в норме полностью закладываются к 15-й неделе внутриутробного развития, однако иммунная система ребенка является незрелой и нуждается в антигенном воздействии и «обучении» для своего окончательного формирования. Вместе с тем, становление иммунной системы – это нелинейный процесс, который не коррелирует непосредственно с какими-либо антропометрическими или функциональными характеристиками организма. У новорожденных детей и детей первых лет жизни основные компоненты как врожденного, так и приобретенного иммунитета функционально менее активны, чем у детей более старшего возраста и взрослых. Этим объясняется повышенная чувствительность детей данного возраста к инфекциям.
Врожденный иммунитет.
Проницаемость анатомических барьеров (кожи и слизистых оболочек) для инфекционных агентов у детей первого месяца жизни повышена. Вероятность травматизации кожи и слизистых оболочек увеличивается во время родов. У детей, находящихся на грудном вскармливании, среда желудочного сока приближается к нейтральной, что сопровождается уменьшением инфицирующей дозы инфекционных агентов, вызывающих острые кишечные инфекции. В то же время данные показатели кислотности желудочного содержимого препятствуют разрушению компонентов иммунной системы, поступающих к ребенку с грудным молоком.
Клетки, обуславливающие врожденную резистентность - фагоциты и NK-клетки, у новорожденных отличаются сниженной активностью. Фагоцитоз у новорожденных характеризуется ограниченным объемом резервного пула полиморфноядерных лейкоцитов, сниженной способностью к адгезии и хемотаксису нейтрофилов и моноцитов, сниженными показателями микробоцидности и внутриклеточного киллинга бактерий гранулоцитами, особенно при осложненном течении неонатального периода. Причины сниженной миграционной и поглотительной функции лейкоцитов заключаются в дефиците хемотаксических факторов и опсонинов (IgG), сниженной активности ферментов (супероксидисмутазы, миелопероксидазы, лизосомальных ферментов и катионных белков), повышенной жесткости мембран клеток вследствие преобладания насыщенных жирных кислот над ненасыщенными в их составе. Дальнейшее подавление фагоцитоза у ряда детей может быть следствием перинатальной гипоксии и стресса. В пуповинной крови процент NK-клеток несколько ниже по сравнению со взрослыми, они характеризуются снижением уровня цитотоксичности (примерно на 1/3) и синтеза ФНОα в ответ на активационные стимулы. У новорожденных детей снижена экспрессия молекул HLA II класса на антигенпрезентирующих клетках.
По сравнению со старшими детьми, у новорожденных отмечается дефицит и гуморальных компонентов врожденного иммунитета. Это касается прежде всего системы комплемента, цитолитическая активность которой у новорожденных составляет около 50% от активности взрослых. У новорожденных ослаблены процессы активации системы комплемента и его альтернативного пути (дефицит фактора В и пропердина). Также снижены экспрессия рецепторов к компонентам комплемента, концентрация манноз-связывающего белка и фибронектина, уровень в крови γ-интерферона. В возрасте 1 недели уровень комплемента сыворотки крови быстро нарастает, и с 1 месяца не отличается от уровня взрослых. Содержание пропердина в момент рождения низкое, но в течение первой недели нарастает и держится на высоком уровне в течение всего детства. В то же время содержание лизоцима в сыворотке крови к рождению высокое и даже превышает уровень у взрослого человека. В родах повышается концентрация белка острой фазы прокальцитонина, сохраняясь высокой в течение первых двух суток жизни, что ограничивает его диагностическую значимость в определении раннего неонатального сепсиса.
Своеобразием отличаются у детей и системные проявления врожденной резистентности. На протяжении всего периода детства снижена ментальная защита от инфекции, ее развитие совпадает с развитием гигиенических навыков. Воспаление у детей первых трех месяцев жизни имеет две основные отличительные особенности:
Во-первых, отмечается преобладание альтеративно-продуктивной формы воспаления с недостаточной экссудативной реакцией и тенденцией к развитию «мезенхимоза», который выражается в избыточном развитии соединительной ткани. Примером такого диспропорционального фиброза может являться холангиодиспластический цирроз печени, бронхолегочная дисплазия. В данных случаях микроальтераций онтогенеза, возникающих постнатально, изменения неотличимы от пороков развития желчевыводящих путей или бронхов соответственно.
Во-вторых, воспаление чрезвычайно часто имеет тенденцию принимать характер генерализованного процесса. Примером этого являются внутриутробные инфекции, принимающие генерализованный характер, а также флегмона новорожденных и сепсис, регистрируемый в неонатальном периоде с максимальной, по сравнению с другими возрастами, частотой. Способность к отграничению процесса и сохранению его как местного очага у детей первых месяцев жизни значительно снижена, что связано с незрелостью как врожденного, так и приобретенного иммунитета новорожденного ребенка, а также не выраженностью местных тромботических изменений при инфекции у новорожденных детей, гемостаз которых характеризуется склонностью как к кровоточивости, так и к тромбозу.
Способность плода и новорожденного ребенка к синтезу провоспалительных цитокинов мало отличается от таковой взрослых. Ответ острой фазы лежит в основе развития врожденных инфекций, с ним, в частности, связана задержка внутриутробного развития (внутриутробная гипотрофия) при них. Каскад провоспалительных цитокинов стимулирует родовую деятельность, как физиологическую, так и преждевременную. Разница заключается в сроках и концентрации действующих медиаторов. В достаточно высоких концентрациях определяются провоспалительные цитокины (в частности, ИЛ-6) и у новорожденного ребенка, в том числе при физиологическом течении неонатального периода. Это ограничивает их диагностическое значение при инфекциях неонатального периода. Ответ острой фазы лежит в основе патогенеза всех детских инфекций, а незрелость систем, ответственных за его ограничение, у младенцев находит свое выражение в токсических формах инфекционных заболеваний, развитии инфекционного токсикоза.
Приобретенный (адаптивный ) иммунитет.
Основной количественной характеристикой приобретенного иммунитета является общее число лимфоцитов в периферической крови. У детей, начиная с 4-5 дня после рождения («первый перекрест» лейкоцитарной формулы), после нивелирования лимфопенического эффекта родового стресса отмечается физиологический лимфоцитоз. В возрасте 4-6 лет имеет место выравнивание относительного содержания лимфоцитов и нейтрофилов на уровне 40-45% («второй перекрест»). Это нашло отражение в мнемоническом правиле «четырех четверок» - относительное содержание в периферической крови лимфоцитов и нейтрофилов в 4 дня и в 4 года жизни составляет в среднем 44%. Далее физиологический относительный лимфоцитоз может сохраняться до 8-10 лет. При наличии дефицита железа, гипотрофии и рахита возрастное преобладание лимфоцитов усугубляется и затягивается. Максимальное количество лимфоцитов, как правило, в норме не должно превышать 9000/мкл у дошкольников и 7200/мкл – у детей школьного возраста. Абсолютный и относительный лимфоцитоз в крови детей вплоть до пубертатного возраста отражает физиологический процесс «обучения» множества клонов Т- и В-лимфоцитов, несущих TCR-рецепторы для распознавания чужеродных антигенов. К 5-7 годам лимфоциты по большей части обладают иммунологической памятью и уже не доминируют. Отражением созревания иммунной системы у детей является и иная по сравнению со взрослыми численность популяций и субпопуляций лимфоцитов, возрастная динамика экспрессии их мембранных маркеров, синтеза цитокинов.
Т-лимфоциты и их субпопуляции. Процент СD3 Т-лимфоцитов в крови пуповины несколько ниже, чем в периферической крови старших детей и взрослых, но в силу большего общего числа лимфоцитов абсолютное количество этих клеток у новорожденных достаточно велико. Кроме того, отношение СD4- к СD8-лимфоцитам в крови пуповины выше (3,5-4:1), чем в крови детей старшего возраста и взрослых (1,5-2:1). По некоторым данным соотношение субпопуляций Т-лимфоцитов 2:1 устанавливается к 2 годам. Кроме того, имеются клетки с двойными маркерами СD4 и СD8. Функциональные исследования обнаруживают супрессорную направленность реакций иммунной системы новорожденных. Это связывают с тем, что супрессорную функцию осуществляют не только клетки СD4+ СD25+Foxp3, но и другие, в частности циркулирующие в крови незрелые тимоциты с маркерами СD1, СD10, СD11, а также естественные киллеры. Биологический смысл общей супрессорной направленности реакций клеток иммунной системы (независимо от фенотипа клеток) состоит в предупреждении тяжелой иммунопатологии при контакте с огромным числом антигенов после рождения и интенсивного развития субпопуляций лимфоцитов-хелперов, необходимого для начала синтеза собственных антител.
В процессе противоинфекционного ответа у новорожденных отмечается замедленное формирование Т-зависимого антигенспецифического ответа. Частично это объясняется отсутствием у новорожденных клеток памяти. Кроме того, неонатальные Т-лимфоциты экспрессируют меньшее число молекул СD40-лиганда, необходимого для взаимодействия Т- и В-лимфоцитов и Т-лимфоцитов и макрофагов. В то же время Т-лимфоциты пуповинной крови нормально реагируют на фитогемагглютинин и конканавалин А и участвуют в смешанной лейкоцитарной реакции.
Практически все Т-лимфоциты пуповинной крови несут на своей поверхности незрелую изоформу СD45 - СD45RA. Преобладание СD45 RA над СD45 RО сохраняется на протяжении 2-3 лет жизни.
Соотношение Тh1 и Тh2 в разные возрастные периоды имеет определенные различия. Если у здоровых взрослых отмечается относительное преобладание Тh1 и отношение Тh2:Тh1 составляет 3:4 в периферической крови, то в пуповинной крови это отношение 10-100:1, то есть для плода и новорожденного ребенка характерна Тh2-поляризация. У новорожденных снижена продукция таких цитокинов как ИЛ-2, ИЛ-12, ИЛ-15. Тh2-поляризация чрезвычайно важна для физиологического течения беременности. Доминирование в конце внутриутробной жизни выработки Тh2 носит адаптационный характер и направлено на защиту плаценты от потенциальной токсичности Тh1. Это доминирование сохраняется еще в течение какого-то времени после рождения. В течение этого времени ребенок, с одной стороны, предуготован к развитию атопии, отмечается феномен «открытого окна» для внешней сенсибилизации и манифестации атопических заболеваний (атопический дерматит, бронхиальная астма). С другой стороны, благодаря частым вирусным и бактериальным инфекциям со стимуляцией Тh1, происходит переключение доминирующего Тh2-пути ответа на Тh1 ответ, типичный для противоинфекционного иммунитета у взрослых.
В последнее время, накапливается все больше данных о возможном протективном действии различных перенесенных в грудном и раннем детском возрасте инфекций (респираторных, кишечных, гельминтозов) на развитие атопических заболеваний. Это может быть связано с конкурентным воздействием микробных антигенов на Тh1, которые вырабатывают ИФНg, переключающий потенциально атопический Тh2-ответ, свойственный детям, на Тh1-ответ взрослых. Таким образом, инфекции, перенесенные детьми в возрасте до 10 месяцев, а по некоторым данным до 3 лет жизни , являются эффективным профилактическим мероприятием развития аллергических заболеваний у детей. Данная концепция получила название «гигиенической», так как основанием для нее послужили проспективные наблюдения за детьми, проживающими в разных гигиенических условиях. Так частота аллергии была ниже в странах с низким уровнем жизни, семьях с меньшим достатком и наличием младших братьев и сестер.
Нормативные показатели формулы периферической крови, лимфоцитов различных популяций и субпопуляций в зависимости от возраста представлены в таблице1.
В-лимфоциты и иммуноглобулины. Процент В-лимфоцитов в пуповинной крови несколько ниже, чем в крови старших детей и взрослых, но их абсолютное число значительно выше. В-лимфоциты новорожденных имеют, как правило, незрелый фенотип с повышенной экспрессией СD38 и СD10 и снижением экспрессии СD20 и СD21. С этой незрелостью связаны особенности гуморального иммунитета у новорожденных.
Имеющиеся у новорожденного антитела в основном получены от матери пренатально. Через плаценту проникают все субклассы IgG, в особенности IgG1 и IgG3, благодаря большей аффинности к ним Fc-рецепторов трофобласта, начиная с 12-й недели беременности. Слабее всего из четырех субклассов IgG проникает IgG2. Трансплацентарно поступающий плоду IgG матери выполняет ряд функций: обеспечение специфического пассивного иммунитета и торможение активности антителообразования.
Таблица 1.Нормальные показатели содержания иммуннокомпетентных клеток в зависимости от возраста.
| Иссле- дование | норма 1-3 мес | норма 4-12 мес | норма 12-14 мес | норма 2-5 лет | норма 6-8 лет | норма 9-11 лет | норма старше 12 лет |
| лейкоциты, абс | 7000-13000 | 7000-12000 | 7000-12000 | 6100-10000 | 4800-9000 | 4800-8000 | 52000-8000 |
| Грануло-циты,% | 18-36 | 20-40 | 23-43 | 34-56 | 43-59 | 43-59 | 45-61 |
| Грануло-циты, абс | 1260-4680 | 1400-4800 | 1610-5160 | 2074-5600 | 2064-5310 | 2064-4720 | 2340-4880 |
| Моноциты,% | 4-8 | 4-8 | 4-8 | 408 | 4-8 | 4-8 | 4-8 |
| Моноциты, абс | 285-500 | 285-500 | 285-500 | 285-500 | 285-500 | 285-500 | 285-500 |
| Лимфоциты, % | 55-78 | 45-79 | 44-72 | 38-64 | 36-43 | 36-43 | 36-43 |
| Лимфоциты, абс | 2920-8840 | 3610-8840 | 2180-8270 | 2400-5810 | 2000-2700 | 2000- 2700 | 2000-2700 |
| Т-тимфо-циты, % | 55-78 | 45-79 | 53-81 | 62-80 | 66-76 | 66-76 | 66-76 |
| Т-лимфо- циты, абс (кл/мкл) | 2070-6540 | 2280-6450 | 1460-5440 | 1610-4320 | 1400-2000 | 1400-2000 | 1400-2000 |
| В-лимфо- циты, % | 19-31 | 19-31 | 19-31 | 21-28 | 12-22 | 12-22 | 12-22 |
| В-лимфо- циты, абс, (мкл) | 500-1500 | 500-1500 | 500-1500 | 700-1300 | 300-500 | 300-500 | 300-500 |
| CD4, % | 41-64 | 36-61 | 31-54 | 35-51 | 33-41 | 33-41 | 33-41 |
| CD4, абс (кл/мкл) | 1460-5116 | 1690-4600 | 1020-3600 | 900-2860 | 700-1100 | 700-1100 | 700-1100 |
| CD8,% | 16-35 | 16-34 | 16-38 | 22-38 | 27-35 | 27-35 | 27-35 |
| CD8, абс (кл/мкл) | 650-2450 | 720-2490 | 570-2230 | 630-1910 | 600-900 | 600-900 | 600-900 |
| CD4/CD8 | 1,3-3,5 | 1,2-3,5 | 1,0-3,0 | 1,0-2,1 | 1,1-1,4 | 1,1-1,4 | 1,1-1,4 |
| CD16/CD56,% | 5,2-17,3 | 6,2-18,2 | 7,5-18,7 | 7,5-19,5 | 10,6-22,4 | 10,6-22,4 | 10,6-22,4 |
| CD16/CD56, абс | 319-1142 | 381-971 | 276-896 | 276-896 | 257-619 | 257-619 | 257-619 |
С трансплацентарным переходом в патологических условиях IgG связывают развитие таких заболеваний новорожденных как аллоиммунные, или изоиммунные цитопении (нейтропении, тромбоцитопении) у детей матерей, страдающих аутоиммунными цитопениями; гемолитической болезни новорожденных при АВ0-, резус-несовместимости или несовместимости эритроцитов по редким факторам; неонатальной красной волчанки обычно при переходе аутоантител к Rо-антигенам клеточных ядер от матерей, страдающих системной красной волчанкой; врожденного тиреотоксикоза у детей матерей с аутоиммунным диффузным токсическим зобом вследствие проникновения через плаценту тиреоидстимулирующих антител. В то же время, отсутствие свободного транспорта IgМ от матери (к данному классу принадлежат естественные материнские антитела, в том числе групповые изогемагглютинины) предотвращает гемолитическую болезнь новорожденных по системе АВ0 в случае гетероспецифической (разные группы крови матери и ребенка) беременности.
Сыворотка пуповинной крови содержит также небольшое количество IgМ (10% его уровня у взрослых) и несколько нанограммов IgA, IgD и IgE. Поскольку для этих иммуноглобулинов плацента непроницаема, они, по-видимому, образуются в организме плода. В «стерильный» плод, таким образом, поступают некоторые антигены из крови матери, вызывая у него иммунные реакции. Действительно, при атопическом дерматите у грудных детей иногда обнаруживаются антитела к антигенам, с которыми ребенок ранее не сталкивался. По всей вероятности, синтез таких антител (класса IgE) индуцируется у плода антигенами пищи матери. В ряде случаев такие антигены обнаруживали в амниотической жидкости. Высокий уровень IgМ-антител в сыворотке крови является маркером внутриутробных инфекций.
В течение первых месяцев происходит распад и удаление IgG, переданных трансплацентарно от матери. Период «полужизни» IgG составляет 21 день. Высокая концентрация IgG в первые месяцы жизни обуславливает защиту организма от грамположительных бактерий и вирусов, а также неэффективность вакцинации в этом возрасте – антигены вакцин связываются циркулирующими материнскими антителами.
Поскольку в крови недоношенных детей к моменту рождения содержится мало IgG, опсонизирующая активность их крови снижена по отношению ко всем микроорганизмам. Этим объясняется, в частности, высокая частота сепсиса у недоношенных детей, увеличивающаяся обратно пропорционально гестационному возрасту и массе тела при рождении. Материнский IgG, прошедший через плацентарный барьер, исчезает из организма ребёнка к шестому месяцу жизни. Результатом этого является «физиологический провал» в уровне IgG, наблюдаемый между 3 и 6 месяцами жизни ребёнка, что обуславливает повышенную чувствительность детей данного возраста к инфекциям. По мере синтеза собственных IgG уровень данного иммуноглобулина начинает медленно увеличиваться. Однако у ряда детей эта физиологическая гипогаммаглобулинемия сохраняется после 6-месячного возраста. В этих случаях говорят о преходящей (транзиторной) младенческой гипогаммаглобулинемии грудных детей. Количество Т- и В-лимфоцитов, а также функция Т-лимфоцитов и специфическое антителообразование нормальны. Данное состояние, являющееся пограничным между нормой и патологией и расцениваемое еще как поздний иммунологический старт, может сопровождаться повышенным риском инфекций (среднего отита, синуситов, бронхитов). Критерии диагностики данного состояния полностью не стандартизированы. Считается, что о транзиторной гипогаммаглобулинемии свидетельствует снижение концентрации одного или более изотипов иммуноглобулина более чем на два стандартных отклонения от возрастной нормы. Во всех случаях транзиторной младенческой гипогаммаглобулинемии с возрастом происходит нормализация уровней иммуноглобулинов, что отличает данное состояние от первичных иммунодефицитов.
К концу первого года жизни в норме уровень IgG составляет примерно 60% от показателей взрослых, к концу 2-го года – 80%, а к 7-8 годам он достигает средних значений взрослых. Концентрации IgG1 и IgG3 субклассов также достигают уровня взрослых к 8 годам. В отличие от них IgG2 и IgG4 субклассы синтезируются медленнее и достигают «взрослых» величин лишь к 10-12 годам. С медленным ростом количества IgG2 и IgG4 субклассов связывают повышенную чувствительность детей первых двух лет жизни к инфекциям, вызванным гемофильной палочкой, менингококком и пневмококком, так как именно эти субклассы антител синтезируются в ответ на полисахаридные антигены перечисленных микроорганизмов. Так, по некоторым данным, у 30% детей второго года жизни отсутствует гуморальный иммунитет к гемофильной палочке.
При стимуляции В-лимфоциты новорожденных синтезируют менее разнообразные иммуноглобулины (в основном IgM) и в гораздо меньшем количестве, чем В-лимфоциты старших детей и взрослых. IgM-антитела представляют собой термостабильные опсонины. Низкой концентрацией их после рождения объясняется неэффективность фагоцитоза, что является причиной повышенной восприимчивости детей в данном возрасте к грамотрицательным бактериям. Концентрация IgM в сыворотке крови резко возрастает примерно к 6-му дню жизни и продолжает увеличиваться, постепенно достигая уровня взрослых к годовалому возрасту. На первом году жизни на большинство инфекционных антигенов развивается первичный иммунный ответ с преимущественным синтезом антител класса IgM, не оставляя иммунологической памяти. Такой тип иммунного ответа наступает также и при вакцинации, вторичный иммунный ответ с формированием IgG-антител и клеток иммунологической памяти развивается лишь после 2-3-й вакцинации. Преобладание первичного иммунного ответа над вторичным у детей грудного возраста, таким образом, определяет необходимость ревакцинаций на первом году жизни (вакцины против коклюша, дифтерии, столбняка, полиомиелита, гепатита В).
В сыворотке пуповинной крови IgА практически отсутствует. Впервые его удается определить около 13-го дня после рождения. Далее уровень данного иммуноглобулина повышается медленно, достигая к 1 году лишь 20% от взрослых нормативов, а к концу 2-го года – 40%. Концентрация IgА достигает «взрослого» уровня к 10-12-му году. Секреторный sIgА полностью отсутствует у новорожденных, впервые появляясь в секретах на 2-м месяце жизни и достигая значений взрослых к 6-7-летнему возрасту. Данный факт позволяет говорить об относительной недостаточности системы местного иммунитета у детей первых лет жизни, чем определяется повышенная чувствительность их к респираторным и кишечным инфекциям, а также к проникающим через слизистую оболочку кишечника аллергенам.
Уровень IgЕ, как правило, изменяется параллельно содержанию IgА. Нарастание концентрации IgЕ в большой степени коррелирует с началом проявлений аллергических и, гораздо реже, других заболеваний (гельминтозы, паразитозы).Иммуноглобулин D в сыворотке крови у новорожденных имеет концентрацию 0,001 г/л. Затем она нарастает после 6-й недели жизни и достигает значений, свойственных взрослым, к 5-10 годам. Возрастная динамика иммуноглобулинов разных классов представлена на табл.2 и на рис. 1.
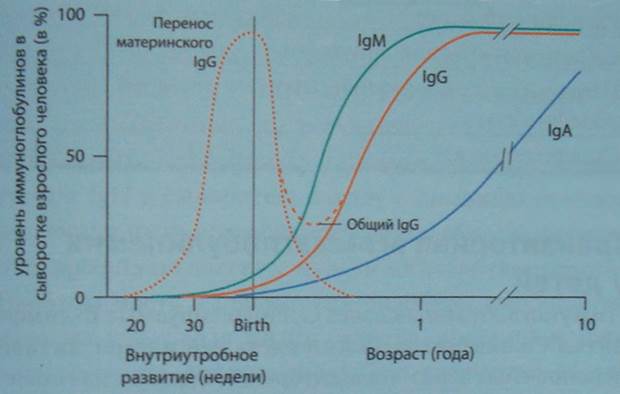
Рис.1.
Возрастная динамика иммуноглобулинов разных классов
Таблица 2.Нормальные показатели гуморального иммунитета в зависимости от возраста.
| Исследование | Норма 1-3 мес. | Норма 4-12 мес. | Норма 12-24 мес. | Норма 2-5 лет | Норма 6-8 лет | Норма 9-11 лет | Норма старше 12 лет |
| IgE (МЕ) | 0-30 | 0-30 | 0-45 | 0-100 | 0-100 | 0-100 | 0-100 |
| IgG (МЕ) | 3,3-9,1 | 3,2-12,8 | 4,6-14,6 | 8,8-15,4 | 9,7-11,7 | 9,4-16,6 | 9,7-20,0 |
| IgA (МЕ) | 0,1-0,2 | 0,1-0,4 | 0,1-1,0 | 0,3-1,5 | 0,9-1,9 | 0,9-2,9 | 1,0-2,3 |
| IgM (МЕ) | 0,4-1,2 | 0,4-0,8 | 0,6-1,8 | 0,8-1,6 | 0,8-1,9 | 0,6-2,0 | 0,6-2,0 |
Наряду со сниженными показателями общего уровня иммуноглобулинов разных классов, крайним выражением которого является транзиторная младенческая гипогаммаглобулинемия, у ряда детей отмечается дефицит специфического антителообразования. При заболевании кишечными инфекциями (сальмонеллез, эшерихиоз, дизентерия) антитела к их возбудителям у детей первых 6 месяцев жизни обнаруживаются лишь у 1/3 больных в возрасте от 6 до 12 месяцев , а у детей на втором году жизни – почти у 60%. Аналогичным образом при заболевании острыми респираторными инфекциями (аденовирусная, парагрипп) сероконверсия у детей одного года обнаруживается лишь у 1/3 переболевших ими, а на втором году жизни – уже у 60%. Данный феномен определяет особенности течения указанных инфекций у детей грудного и раннего возраста (большая тяжесть), а также вероятность ложноотрицательных результатов серологической диагностики.
Таким образом, возрастные физиологические особенности иммунитета у детей, в особенности первых лет жизни, определяют существенное повышение их чувствительности как к инфекционным факторам среды, так и к экспозиции аллергенов. Это определяет многие требования к уходу за детьми и профилактике их заболеваний. Сюда включается необходимость особого контроля за контактом с инфекционными больными (дети вплоть до 4-х-летнего возраста биологически не готовы к постоянному пребыванию в коллективе), целесообразность индивидуального или минигруппового воспитания, контроль за качеством пищевых продуктов и их переносимостью по симптоматике аллергических реакций. В этом контексте грудное вскармливание представляет собой уникальный механизм, компенсирующий физиологический иммунодефицит детей грудного возраста за счет присутствующих в молозиве и зрелом молоке факторов иммунной системы. К этим факторам относятся как растворимые компоненты (иммуноглобулины, прежде всего IgА и sIgА; цитокины – ИЛ-1, 2, 4, 5, 6, 8, 10, 12, 13, 16, 18, ИФН γ, ФНО α; хемокины и рецепторы – RANTES, CD 14, sFas, FasL; факторы роста – G-CSF, TGF, NGF, эритропоэтины; факторы врожденного иммунитета – комплемент, лактоферрин, лизоцим, пропердин, манноз-связывающий белок, альфафетопротеин, муцины, дефензины; простагландины), так и клетки (макрофаги, нейтрофилы, лимфоциты, преимущественно Т-лимфоциты). Грудное вскармливание ассоциируется со снижением частоты инфекционных, аллергических и аутоиммунных заболеваний у детей, по сравнению с детьми, получающими искусственное вскармливание. Повышение содержания иммуноглобулинов, обучение лимфоцитов и приобретение ими иммунологической памяти совпадает со снижением уровня инфекционной заболеваемости у детей к 5 годам жизни, а также с более легким и доброкачественным течением многих инфекционных заболеваний.
Старение иммунной системы и связанные с ним особенности иммунитета.
Изменения в иммунной системе, приводящие к старческому иммунодефициту, постепенно проявляются в течение всей жизни человека. Клинически значимые проявления иммунодефицита появляются обычно в возрасте более 70 лет или могут не проявляться вовсе. Возрастные проявления старения тесно связаны с инволюцией тимуса, которая начинается с годовалого возраста и проходит ряд этапов:
1. "Перифериализация" функций тимуса, т.е. передача части "полномочий" от тимуса перефирическому отделу иммунной системы - популяции периферических Т-лимфоцитов. В основе этого процесса лежит накопление на периферии набора Т-клеток памяти, против эпитопов основных внешних агентов (инфекционных, пищевых), часто встречающихся в данной экосистеме. Пул клеток поддерживается за счет периферических механизмов.
При необходимости ответа на более экзотические иммуногены поддерживается в незначительном масштабе обычный тимусзависимый путь развития Т-клеток из костномозговых предшественников.
В случае массовой гибели Т-клеток (стресс, действие радиации), функция тимуса временно усиливается до восстановления утраченного пула периферических Т-клеток. С возрастом эта "поддерживающая" функция тимуса ослабевает.
2. Снижение способности тимуса привлекать клетки-предшественники и "пропускной способности" в отношении созревающих Т-клеток. Уже в 1-ю неделю после рождения резко уменьшается способность стромы тимуса заполняться лимфоцитами в условиях сингенной трансплантации.
3. Атрофия эпителиального ретикулума происходит практически в течение всей жизни, резкое опустошение тимуса проявляется после 60 лет. При этом масса тимуса не меняется, поскольку лимфоэпителиальные структуры замещаются жировой тканью. Участки нормальной ткани тимуса сохраняются вокруг сосудов и в большей степени в мозговом слое, чем в коре. Потеря активной ткани тимуса составляет в среднем возрасте - 3 %, а в старости - 1%. Теоретически при таком темпе она должна практически полностью исчезнуть к 120 годам.
4. Снижается секреторная активность эпителия тимуса. С периода полового созревания неуклонно уменьшается секреция основного гормона тимуса - тимулина. К 60 годам гормон практически не удается обнаружить функциональными тестами. Уровень других гормонов тимуса с возрастом также снижается, хотя и несколько слабее. Функциональная недостаточность периферических Т-лимфоцитов, вследствие дефицита гормонов тимуса, может достаточно долго компенсироваться.
Снижение численности Т-лимфоцитов на периферии регистрируется после 60 лет и в большей степени затрагивает CD4+, чем CD8+ - субпопуляцию, а среди хелперов в большей степени Th1, чем Th2-клетки. При этом численность В-лимфоцитов и NK-клеток существенно не изменяется, а активность фагоцитов даже повышается.
Ослабление иммунной защиты, связанное с описанными изменениями, затрагивает реакции обусловленные Т-клетками (подавлены реакции на распространенные антигены и митогены). Полагают, что это служит одной из причин, способствующих повышению частоты опухолей в старости.
Происходит подавление тимусзависимого гуморального ответа и в то же время повышение концентрации Ig, преимущественно классов Ig G и Ig A. Происходит снижение аффинности антител, преобладают низкоаффинные антитела. Значительно чаще наблюдаются аллергические реакции.
Накапливаются аутоантитела как к органонеспецифическим (ДНК, коллаген, Ig G), так и к органоспецифическим (белки щитовидной железы) антигенам. Их титр повышен примерно у 50 % старых людей. Хотя у человека накопление аутоантител довольно редко сочетается с клиническими проявлениями аутоиммунных нарушений, отмечена положительная связь смертности старых людей (от сосудистых заболеваний, рака) с повышением уровня аутоантител. Гиперпродукцию аутоантител связывают с ослаблением контроля со стороны Т-супрессоров (вето-клеток), что в свою очередь обусловлено гипофункцией тимуса.
Не вызывает сомнения ключевая роль тимуса в развитии возрастного иммунодефицита хотя нельзя исключить воздействие и неблагоприятных факторов среды (например, лучевого). Иммунологические изменения, происходящие при старении, однонаправлены, и необратимы.
1.3 .Особенности функционирования иммунной системы при беременности, лактации и менопаузе.
Плод как аллотрансплантат. В иммунологическом аспекте вынашивание плода с полным набором чужеродных антигенов в течение длительного времени является иммунологическим парадоксом. Действительно, у млекопитающих срок жизни аллогенных трансплантатов, несовместимых по сильным антигенам системы HLA (МНС), составляет в среднем 10—15 дней. Однако эмбрион, у которого HLA-антигены появляются уже через 96 ч после оплодотворения (8 клеточных делений), несущий полный набор антигенов отца, не только не отторгается, но и полноценно развивается в течение нужного времени. Более того, повторные беременности от того же отца не только не индуцируют отторжения плода, но и не влияют на сроки беременности. Иными словами, полностью не работают законы трансплантационного иммунитета.
Хотя причины не отторжения плода остаются до конца не выясненными, есть основание полагать, что решающую роль в предотвращении реакции отторжения играют иммунологические потенции трофобласта и иммунные механизмы, регулирующие взаимоотношения плода и матери. Современная литература, посвященной этому вопросу, позволяет сформулировать ряд механизмов, обеспечивающих производство потомства .
Роль трофобласта заключается в выполнении, во-первых, барьерной функции, нарушение которой (в результате травм) приводит к реакции отторжения и аборту. Вторая особенность трофобласта — это отсутствие на нем свободных для распознавания HLA-антигенов матери и плода. Скорее всего речь идет о феномене специфической блокады этих антигенов с помощью антител матери (третья функция трофобласта). Данное обстоятельство не позволяет иммунной системе развивать реакции отторжения ни со стороны матери, ни со стороны плода , так называемая «реакция трансплантат против хозяина» (РТПХ).
Это положение подтверждается тем, что бесклеточные субстраты ткани трофобласта обладают способностью подавлять пролиферативный ответ лимфоцитов in vitro. Эти антитела представляют собой местно синтезируемые в матке и плаценте IgG против HLA-антигенов на клетках эмбриона и лимфоцитах матери. Рассматривается также специфическая роль так называемого отрицательно заряженного мукополисахарида, обладающего способностью маскировать антигены плаценты.
Супрессивные гуморальные и клеточные факторы. Существует достаточно много сообщений о том, что в организме матери все же синтезируется некоторое число антител и сенсибилизированных лимфоцитов против антигенов плода, но они не оказывают своего патогенного действия. Однако выдвинуто убедительное предположение, что в основе развития нефропатий при беременности, осложненной поздним токсикозом, лежит нарушение способности материнского организма вырабатывать антитела, блокирующие антигенные маркеры плаценты, которые перекрестно реагируют (общие антигенные детерминанты) с антигенными компонентами почечных клубочков и тканей головного мозга.
Таким образом, в норме в организме матери вырабатываются супрессирующие факторы (антитела и «отрицательно заряженный мукополисахарид»), содержание которых нарастает с увеличением срока беременности. Кроме того, в организме матери возрастает более чем в 2 раза активность Т-лимфоцитов, обладающих супрессорной функцией, что поддерживает специфическое иммунодепрессивное состояние. Большинство Т-супрессоров находится непосредственно в лимфатических узлах, дренирующих матку.
Более того, имеется и второй клеточный механизм иммуносупрессии — макрофагальный, осуществляемый местно расположенными макрофагами с большим числом Fc IgG-рецепторов.
Кроме механизмов, создающихся материнской иммунной системой, в процессе эмбриогенеза начинают синтезироваться (на 12— 16-й неделе) фетальные антигены. Это фетопротеины α (АФП), α2 , р-протеин и др. Данная группа, включающая примерно 10 антигенов, получила название раково-эмбриональных антигенов, поскольку они синтезируются и эмбрионом, и клетками опухолей печени. В том и другом случае синтез этих антигенов оказывает дополнительное иммуносупрессивное действие.
Иммунитет и беременность. Таким образом, в организме матери при нормально протекающей беременности всегда специально создается состояние временного частичного иммунодефицита, непосредственно обеспечивающее вынашивание плода. При этом в иммунном статусе организма матери наблюдается:
—снижение уровня IgG в сыворотке крови, возможно, вследствие переноса IgG через плаценту и временного, на период беременности, изменения механизмов регуляции синтеза IgG;
—компенсаторно в ряде случаев может умеренно увеличиваться
уровень IgA и IgM;
—значительно угнетается функциональное состояние фагоцитарных нейтрофилов крови (особенно хемотаксис и бактерицидность по отношению к грамотрицательной и кокковой флоре), а также синтез активных форм кислорода макрофагами. То есть их кислород зависимая бактерицидность;
—увеличивается число Т-супрессоров, но без значительных изменений соотношения Т- и В-лимфоцитов. Интересно отметить, что при задержке в матке остатков трофобласта (после выкидышей или патологических родов) наблюдается реверсия соотношения Т- и В-клеток.
Сформировавшийся при беременности иммунный статус (дефицит IgG, угнетение фагоцитоза нейтрофилов и макрофагов, гиперфункция Т-супрессоров) приводит прежде всего к повышенной восприимчивости к вирусной (грипп, гепатит, полиомиелит, краснуха, ветряная оспа) и бактериальной (особенно стрептококковая) инфекции. Несмотря на это, следует помнить, что любые попытки воздействия на иммунную систему беременных могут существенно осложнить беременность или стимулировать выкидыш и, следовательно, нецелесообразны и даже опасны. Исключением является Rh-конфликт при беременности.
Гемолитическая болезнь новорожденных, или Rh -конфликт. Лечение этой патологии относится к наиболее ярким достижениям клинической иммунологии, и практически проблему Rh-конфликта можно считать решенной.

 Суть феномена состоит в том, что гемолиз эритроцитов происходит у Rh+ детей, вынашиваемых Rh- матерями. Сенсибилизация у Rh- матерей может развиться в результате родов или абортов, поэтому частота абортов и родов усугубляет тяжесть Rh конфликта и повышает интенсивность гемолиза. Поскольку антигены Rh-системы расположены на поверхности эритроцитов, то повторная беременность протекает при развитии агрессии иммунной системы по отношению эритроцитов плода с их гемолизом (реакции II и III типа по P.Gell и R.Coombs). Этот процесс легко купируется введением aнти-Rh-иммуноглобулина, который образует непатогенные иммунные комплексы с антителами против эритроцитов и элиминируется из организма. Такая иммунизация необходима всем Rh-женщинам после первого аборта или сразу после рождения Rh+-pe6eнкa.
Суть феномена состоит в том, что гемолиз эритроцитов происходит у Rh+ детей, вынашиваемых Rh- матерями. Сенсибилизация у Rh- матерей может развиться в результате родов или абортов, поэтому частота абортов и родов усугубляет тяжесть Rh конфликта и повышает интенсивность гемолиза. Поскольку антигены Rh-системы расположены на поверхности эритроцитов, то повторная беременность протекает при развитии агрессии иммунной системы по отношению эритроцитов плода с их гемолизом (реакции II и III типа по P.Gell и R.Coombs). Этот процесс легко купируется введением aнти-Rh-иммуноглобулина, который образует непатогенные иммунные комплексы с антителами против эритроцитов и элиминируется из организма. Такая иммунизация необходима всем Rh-женщинам после первого аборта или сразу после рождения Rh+-pe6eнкa.
Если aнти-Rh-aнтителa не вводили профилактически, то необходимо их вводить во время беременности. Стандартная доза при однократном введении составляет 300 мкг. До внедрения иммунопрофилактики в широкую практику гемолитической болезни новорожденных внутриутробная смертность в результате Rh-конфликта составляла, по данным ВОЗ, 5—10%.
Иммунология лактации. Возрастные особенности онтогенеза иммунной системы новорожденных определяются как физиологическое иммунодефицитное состояние. В создании пассивного иммунитета в этот период большую роль играет IgG, проникший через плаценту из организма матери. Концентрация IgG у новорожденных в норме значительно превышает показатели у взрослого человека, но при недостатке IgA- и IgM-антител.
В раннем постнатальном периоде основные факторы иммунитета ребенок получает от матери через молозиво и молоко (табл. 19). Кроме того, в молоке содержатся лизоцим (мураминидаза), фактор резистентности к стафилококку, лактопероксидаза, лактоферрин, интерфероны, комплемент, иммуноглобулины (IgM и IgG в форме сывороточных иммуноглобулинов, a IgA в основном в виде S-IgA, причем в молозиве S-IgA в 15—40 раз больше, чем в молоке!). В молоке высокое содержание S-IgA восполняет недостаточность местного иммунитета кишечника ребенка и препятствует развитию инфекций, обусловленных Е. coli, пневмококками, стрептококками, холерным вибрионом и вирусом полиомиелита, к которым S-IgA имеет особое сродство.
Аллергия к грудному молоку. К сожалению, нередко у детей наблюдается аллергия к молоку матери. Основными антигенами (аллергенами) молока являются лактоальбумины, казеин и сывороточные альбумины. Аллергия I типа, особенно в сочетании с реакциями II—IV типа, может вызвать серьезные нарушения — геморрагии, поносы и даже отек гортани и легкого. Встречаются случаи аллергии к собственному молоку у кормящих матерей. При этом развиваются тяжелые неинфекционные маститы и/или прекращается лактация.
Иммунологические аспекты климактерического синдрома.
Развитие менопаузы и климактерический синдром сопровождаются не только гормональными ,но и иммунологическими нарушениями. Развитие климактерического синдрома (КС) и его тяжесть во многом определяются гиперактивностью аутоиммунных реакций по отношению к компонентам яичников. В качестве критериев тяжести КС еще в 1988 году акушер-гинеколог Майданник И.Л. предложила использовать величины титров антител против яичников: легкая степень тяжести — от 1:8 до 1:32; средняя степень тяжести — от 1:32 до 1128-тяжелый КС - выше 1:128 . Показатели антител при тяжелом климактерическом синдроме как правило в 8-10 раз выше, чем при легком варианте течения.
Механизмом поддержания аутоагрессии при КС служит снижение функции Т-супрессоров при умеренной активации В-клеток за счет гиперпродукции IgG. Климактерический синдром, осложненный ожирением, сопровождается уменьшением активности фагоцитов.Эти факты привели к успешному использованию для коррекции иммунного статуса и самих проявлений КС (наряду с заместительной гормональной терапией) тималина, или тактивина, спленина (в сочетании с витаминами Е и С, глютаминовой кислотой).
Необходимо помнить, что иммунный статус у больных КС имеет некоторые отличия от такового у лиц старшего возраста (более 70 лет). Первые признаки возрастных дисфункций иммунитета иногда выявляются у лиц обоего пола в возрасте более 50 лет: гиперпродукция IgG- и IgA-антител при снижении уровня S-IgA и аутоантител, снижение функции Т-лимфоцитов, но увеличение содержания CD8+-T-клеток (цитотоксических клеток). Таким образом, снижается в целом «цензорная» функция иммунитета, что обусловливает повышенную частоту онкологических, аутоиммунных и инфекционных заболеваний у людей старшего возраста. Согласно иммунологической теории старения G.Walford , сформулированной в 1971 году, в течение жизни человека накапливаются соматические мутации и повышается вероятность изменений аутоантигенов, распознающихся как чужеродные. Это дает начало аутоагрессии, прежде всего по отношению к ДНК и клеткам эндокринных желез.
Существуют еще две проблемы взаимоотношения иммунной и репродуктивной функции организма: бесплодие и предупреждение нежелательной беременности. Хорошо известно, что значительная часть (20—25%) всех случаев бесплодия относится к аутоиммунным формам.
Суть аутоиммунного бесплодия заключается в продукции антител против антигенов сперматозоидов, при этом последние блокируются или погибают. В первом случае сохраняется почти неизменная подвижность сперматозоидов.
У мужчин продукция аутоантител к сперматозоидам (иммунологически изолированная ткань) возможна лишь при травмах или инфекциях наружных половых органов. В подобных случаях в несколько раз увеличивается число спермальных антител. Наиболее точным методом диагностики этих нарушений является иммуноферментный анализ (ИФА) и MAR-test. Лечение заключается в санации урогенитальных инфекций, травм или элиминации условий повторения контакта с травматизирующим фактором (в том числе профессиональным). В организме женщин в ряде случаев также могут продуцироваться антиспермальные антитела, иногда даже без влияния каких-либо воспалительных или травматизирующих процессов (иммунный ответ на чужеродный антиген). Способ выявления этой формы бесплодия аналогичен предыдущему, а лечение заключается во временном прекращении непосредственного контакта с партнером при контроле титра антител.
Что касается иммунологических приемов профилактики нежелательной беременности, практические результаты исследований следует ожидать в ближайшее время. Способы же иммунодиагностики беременности, начиная с 96 ч после оплодотворения, вполне доступны (специальные диагностикумы для самоконтроля и самодиагноза можно приобрести в аптеках).
1.3. Факторы врожденного иммунитета
Факторы врожденного иммунитета организма включают в себя целый ряд компонентов (таблица 3).
Таблица 3.
Факторы врожденного иммунитета
| Барьерные | Клеточные | Гуморальные | Системные |
| Анатомические и физиологические барьеры | Фагоцитоз NK-клетки | Лизоцим Интерфероны Пропердин Лактоферин Комплемент Белки острой фазы | Ментальная защита Воспаление Ответ острой фазы |
1. Физические (анатомические) барьеры. Кожа, слизистые оболочки респираторного и желудочно-кишечного тракта, мерцательный эпителий, секреты слизистых, слезных и потовых желез препятствуют колонизации патогенами.
2. Физиологические барьеры. Этот тип защиты включает температуру тела, кислотность желудочного сока, также препятствующие колонизации.
3. Фагоцитоз – это особый процесс поглощения клеткой крупных макромолекулярных комплексов или корпускулярных структур. Высокопрофессиональными фагоцитами у млекопитающих являются всего два типа клеток – нейтрофилы и моноциты/макрофаги. Цель фагоцитоза – полное биохимическое расщепление до мелких метаболитов содержимого фагосомы при помощи специальных ферментов. Фагоцитоз включает ряд стадий (таблица 4).
Таблица 4.
Стадии фагоцитоза
| Стадия | Событие | Факторы фагоцитоза |
| Хемотаксис | Сближение фагоцита и объекта | Рецепторы хемотаксинов, цитоскелет, лейкотриены |
| Прилипание | Установление контакта | Соответствующие рецепторы, интегрины |
| Активация мембраны | Подготовка к погружению | Интегрины, рецепторы, липиды, протеинкиназа С, кальций |
| Инициация фагоцитоза | Обволакивание объекта | Элементы цитоскелета, кальций, интегрины |
| Формирование фагосомы | Замыкание мембраны и погружение объекта | Элементы цитоскелета |
| Формирование фаголизосомы | Слияние фагосом и лизосом | Компоненты мембраны, цитоскелета |
| Киллинг и переваривание | Гибель объекта фагоцитоза, его переваривание | Продукты кислородного и азотного метаболизма |
| Выброс продуктов деградации | Выброс содержимого фаголизосомы из клетки | Цитоскелет, мембрана |
Фагоцитоз занимает промежуточное место между врожденным и приобретенным иммунитетом, так как итогом фагоцитоза макрофагами является экспрессия антигенной части молекулы возбудителя для последующего развития иммунного ответа («представление антигена»).
3. Естественные киллеры (NK-клетки, от nature killer) представляют собой популяцию лимфоцитов, лишенных признаков Т- и В-лимфоцитов. Их клеточными мембранными маркерами являются молекулы CD16 и CD56. Их участие в функции врожденного иммунитета состоит в способности оказывать прямое цитотоксическое действие на злокачественные и вирусиндуцированные клетки, а также клетки, поглотившие внутриклеточные бактерии.
Существует две субпопуляции NK-клеток: циркулирующие в крови и тканевые (в печени и децидуальной оболочке беременной матки). Они различаются мембранным фенотипом и функциональными обязанностями в организме.
“Кровяные” NK-клетки имеют фенотип CD56+(мало)/CD16+ и несут рецептор для Fc-фрагмента IgG. Благодаря наличию этого рецептора “кровяные” NK распознают инфицированные вирусами клетки, на поверхность которых сели антитела класса IgG против вирусных антигенов, и развивают в отношении этих клеток антителзависимую клеточную цитотоксичность. Собственно механизм убийства инфицированной клетки такой же, как у ЦТЛ - выделение перфорина в месте контакта с мембраной клетки-мишени, через поры которой впрыскиваются гранзимы, обеспечивающие развитие апоптоза.
NK-клетки тканевых популяций имеют другой мембранный фенотип CD56+/CD16-. Возможно, что их главная физиологическая функция – киллерная в отношении активированных лимфоцитов. В печени эти NK-клетки убивают лимфоциты, принесенные из кишечника в кровь и активированные против пищевых антигенов.
5. Гуморальные факторы секретов - лизоцим, интерфероны, пропердин, лактоферин. Лизоцим – гидролитический фермент секретов слизи – способен разрушать пептидогликаны клеточных стенок бактерий. Интерфероны – группа белков, продуцируемых вирусинфицированными или активированными клетками. Среди прочих иммунорегуляторных функций интерфероны способны прямо подавлять размножение вирусов. Пропердин – один из компонентов комплемента, обладающий цитолитическим действием на бактерии. Лактоферрин – фактор секретов, связывающий железо, необходимое для пролиферации бактерий.
6. Комплемент (to complement – дополнить) – это сложный белковый комплекс, состоящий из более 25 сывороточных белков и нескольких белков клеточных мембран. Основные компоненты комплемента получили обозначение от С1 до С9, остальные выполняют регуляторные функции (таблица 3). Компоненты комплемента синтезируются преимущественно макрофагами и гепатоцитами.
Подобно белкам свертывания крови комплемент активируется за счет каскадного процесса, когда продукт предыдущей реакции выполняет роль катализатора следующей.
Активация системы комплемента в основном осуществляется тремя путями: при помощи иммунных комплексов (классический путь) или без участия антител (альтернативный путь, лектиновый путь).
Классический путь активации инициируется комплексами антиген-антитело. На молекулах IgM , IgG3, IgG1 есть специальные реакционно-способные участки, которые после формирования комплекса антиген-антитело способны связывать компонент С1 комплемента, а именно субкомпонент С1q. Реакция связывания С1q с антителами происходит только на поверхности микробных клеток.
Альтернативный путь активации инициируется клетками микроорганизмов. В сыворотке крови всегда имеется небольшой, но значимый уровень спонтанного расщепления С3 белка на C3a и C3b. Последний способен ковалентно связываться с поверхностными молекулами не всех, но некоторых микроорганизмов. Для него же есть рецепторы на фагоцитах. Кроме того, С3b, связанный с поверхностью микробных клеток, активирует другие компоненты системы комплемента. Так расщепляется С5 до С5а и С5b. С5а и С3а являются медиаторами воспалительной реакции и являются анафилотоксинами. Для них существуют рецепторы на тучных клетках (выброс содержимого гранул), на гладких мышцах (сокращение), они повышают активность, адгезию и экстравазацию фагоцитов. С С5b начинается реакция расщепления С5 -С9, завершающаяся формированием мембраноатакующего комплекса (МАК), с последующей перфорацией и лизисом микробной клетки.
Два пути действуют одновременно, потенцируя друг друга.
Лектиновый путь активации начинается со связывания с углеводами поверхностных структур микробных клеток МСЛ, что катализирует активное расщепление С4. Дальнейшие реакции лектинового пути активации полностью тождественны классическому пути активации.
Таблица 5.
Дата: 2018-11-18, просмотров: 369.