Исследование крови у многих больных с заболеваниями сердечно-сосудистой системы позволяет получить важную информацию о характере и активности патологического процесса. Наиболее часто анализ крови используется для оценки следующих патологических состояний:
1. острый инфаркт миокарда;
2. атеросклероз и дислипопротеидемии;
3. активность воспаления (бактериальный эндокардит, миокардит, перикардит);
4. активность ревматической лихорадки (в том числе у больных с приобретенными пороками сердца);
5. нарушения свертываемости крови и тромбоцитарно-сосудистого гемостаза;
6. ДВС-синдром;
7. нарушения углеводного обмена, пуринового обмена;
8. Диагностика СЗСТ и т.д.
В данном разделе мы рассмотрим диагностические возможности клинического и биохимического анализов крови при остром инфаркте миокарда и атеросклерозе.
Лабораторная диагностика острого инфаркта миокарда
Лабораторное подтверждение острого инфаркта миокарда (ИМ) основано на выявлении:
1) неспецифических показателей тканевого некроза и воспалительной реакции миокарда и 2) гиперферментемии.
Неспецифическая реакция организма на возникновение острого ИМ связана прежде всего с распадом мышечных волокон, всасыванием продуктов расщепления белков в кровь и местным асептическим воспалением сердечной мышцы, развивающимся преимущественно в периинфарктной зоне. Основными лабораторными признаками, отражающими эти процессы, являются:
1. лейкоцитоз, не превышающий обычно 12–15 х 109/л;
2. анэозинофилия;
3. небольшой палочкоядерный сдвиг формулы крови влево;
4. увеличение СОЭ.
Запомните
1) При остром ИМ повышение температуры тела и лейкоцитоз выявляются обычно к концу первых суток от начала заболевания и при неосложненном течении инфаркта сохраняются примерно в течение недели.
2) СОЭ увеличивается обычно спустя несколько дней от начала заболевания и может оставаться повышенной на протяжении 2-3 недель и дольше даже при отсутствии осложнений ИМ.
3) Длительное сохранение (более 1 недели) лейкоцитоза или/и умеренной лихорадки у больных острым ИМ свидетельствует о возможном развитии осложнений (пневмония, плеврит, перикардит, тромбоэмболия мелких ветвей легочной артерии и др.).
Следует подчеркнуть, что выраженность всех приведенных лабораторных признаков ИМ прежде всего зависит от обширности очага поражения, поэтому при небольших по протяженности инфарктах эти изменения могут отсутствовать. Необходимо также помнить, что правильная трактовка этих неспецифических показателей возможна только при сопоставлении с клинической картиной заболевания и данными ЭКГ.
Гиперферментемия при остром инфаркте миокарда
Гиперферментемия входит в классическую триаду признаков острого инфаркта миокарда: 1) болевой синдром; 2) типичные изменения ЭКГ; 3) гиперферментемия. Основной причиной повышения активности (и содержания) ферментов в сыворотке крови у больных острым ИМ является разрушение миокардиальных клеток и выход (вымывание) высвобождающихся клеточных ферментов в кровь.
Наиболее ценным для диагностики острого ИМ является определение активности нескольких ферментов в сыворотке крови:
1. креатинфосфокиназы (КФК) и особенно ее МВ-фракции (МВ-КФК);
2. лактатдегидрогеназы (ЛДГ) и ее изофермента 1 (ЛДГ1);
3. аспартатаминотранферазы (АсАТ).
Динамика активности этих ферментов при остром ИМпредставлена в табл. 3.17 и на рис. 3.316.
Таблица 3.17
Изменение активности некоторых ферментов при остром инфаркте миокарда (по И. С. Балаховскому в модификации)
| Фермент | Начало повышения активности, ч | Пик увеличения активности, ч | Возвращениек норме, сутки |
| МВ-фракция КФК | 3–4 | 10–12 | 2 |
| КФК | 6–12 | 24 | 3–4 |
| ЛДГ | 8–10 | 48–72 | 8–14 |
| ЛДГ1 | 8–10 | 24–84 | 10–12 |
| АсАТ | 4–12 | 24–36 | 4–7 |
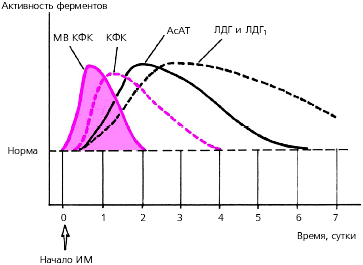
Рис. 3.316. Динамика активности ферментов сыворотки крови при остром инфаркте миокарда. Пунктиром обозначен нормальный уровень ферментов
| Биомаркеры | Время первичного увеличения | Время достижения пиковой концентрации | Длительность повышения |
| Тропонин Т | 3 - 12 ч | 12 ч – 2 дня | 5 – 14 дней |
| Тропонин I | 3 - 12 ч | 24 ч | 5 – 10 дней |
| КФК-МВ (более 25% от общей КФК) | 3 - 12 ч | 24 ч | 2 – 3 дней |
| Миоглобин | 1 - 4 ч | 6 – 7 ч | 24 ч |
Креатинфосфокиназа ( КФК ). Наиболее специфичным лабораторным тестом острого ИМ является определение МВ -фракции КФК ( МВ - КФК ). Ее активность начинает возрастать уже через 3–4 ч, достигает максимума через 10–12 ч и возвращается к исходным цифрам через 48 ч от начала ангинозного приступа. Активность общей КФК приИМ претерпевает сходную динамику: уже к концу первых суток уровень фермента в 3–20 раз превышает норму, а через 3–4 суток от начала заболевания возвращается к исходным значениям (рис. 3.316).
Как известно, КФК в большом количестве содержится в скелетных мышцах, миокарде, головном мозге и щитовидной железе. Поэтому увеличение активности этого фермента в сыворотке крови возможно не только при остром ИМ, но и при целом ряде других клинических ситуаций:
1. при внутримышечных инъекциях;
2. при тяжелой физической нагрузке;
3. после любого хирургического вмешательства;
4. у больных мышечной дистрофией, полимиозитом, миопатией;
5. при повреждениях скелетных мышц, при травмах, судорожном синдроме, длительной иммобилизации;
6. при инсультах и других повреждениях ткани головного мозга;
7. при гипотиреозе;
8. при пароксизмальных тахиаритмиях;
9. при миокардите;
10. при тромбоэмболии легочной артерии;
11. после проведения коронароангиографии;
12. после электроимпульсной терапии (кардиоверсии) и т. д.
В противоположность этому повышение активности МВ-фракции КФК, содержащейся преимущественно в миокарде, специфично для повреждения сердечной мышцы, в первую очередь, для острого ИМ. МВ-фракция КФК не реагирует на повреждение скелетных мышц, головного мозга и щитовидной железы. Тем не менее следует помнить, что любые кардиохирургические вмешательства, включая коронароангиографию, катетеризацию полостей сердца и электроимпульсную терапию, как правило, сопровождаются кратковременным подъемом активности МВ-фракции КФК. В литературе имеются также указания на возможность повышения уровня МВ-КФК при тяжелой пароксизмальной тахиаритмии, миокардитах и длительных приступах стенокардии покоя, расцениваемых как проявление нестабильной стенокардии.
Степень повышения активности МВ-КФК в крови в целом хорошо коррелирует с размером ИМ: чем больше объем поражения сердечной мышцы, тем выше активность МВ-КФК. Следует, однако, иметь в виду, что в ряде случаев при обширных ИМ вымывание ферментов в общий кровоток замедлено, поэтому абсолютное значение активностиМВ-КФК и скорость его достижения могут оказаться меньше, чем при обычном вымывании фермента, хотя и в том, и в другом случае площадь под кривой «концентрация-время» остается одинаковой (рис. 3.317, а, б).
Эти данные послужили основанием для разработки методики неинвазивного определения массы некроза (в граммах) как функции площади под кривой изменения концентрацииМВ-КФК во времени.
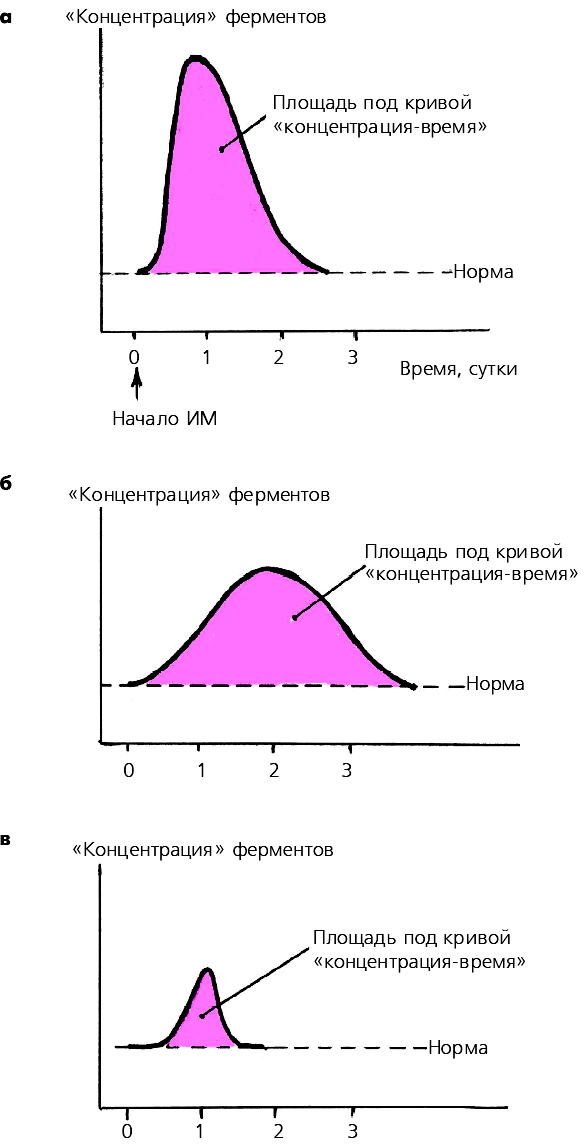
Рис. 3.317. Динамика активности МВ-фракции КФК при обширном трансмуральном (а,б) и интрамуральном (в) инфарктах миокарда.
В двух первых случаях площадь под кривой «концентрация–время» одинакова, хотя пиковые значения
активности МВ-КФК отличаются, что связано с различной скоростью вымывания фермента. При интрамуральном инфаркте миокарда площадь под кривой и максимальная ее амплитуда значительно меньше
Запомните
Площадь под кривой «концентрация-время» МВ-КФК отражаетразмеры ИМ, а абсолютные значения активности фермента и время достижения максимума кривой — не только обширность поражения сердечной мышцы, но и скорость вымывания фермента из некротизированного участка сердечной мышцы.
Лактатдегидрогеназа ( ЛДГ ). Активность этого фермента при остром ИМ нарастает медленнее, чем КФК и МВ-КФК, и дольше остается повышенной. Пик активности наступает обычно на 2–3 сутки от начала инфаркта, а возвращение к исходному уровню — только к 8–14 суткам.
Следует помнить, что активность общей ЛДГ повышается также при заболеваниях печени, шоке, застойной недостаточности кровообращения, гемолизе эритроцитов и мегалобластной анемии, тромбоэмболии легочной артерии, миокардите, воспалении любой локализации, коронароангиографии, электроимпульсной терапии, тяжелой физической нагрузке и т. д.
В этом отношении изофермент ЛДГ 1 более специфичен для поражений сердца, в частности, для острого ИМ, хотя он также присутствует не только в мышце сердца, но и в других органах и тканях, включая эритроциты.
Аспартатаминотранфераза ( АсАТ ) также относится к числу ферментов с относительно быстро наступающим пиком повышения активности (24–36 ч от начала инфаркта). Через 4–7 суток концентрация АсАТ возвращается к исходному уровню.
Изменение активности АсАТ также неспецифично для острого ИМ: уровень АсАТ вместе с активностью АлАТ повышается при многих патологических состояниях, в том числе при заболеваниях печени. Все же следует помнить, что при поражениях паренхимы печени в большей степени возрастает активность АлАТ, а при заболеваниях сердца —АсАТ. При ИМ коэффициент Ритиса (отношение АсАТ/АлАТ) больше 1,33, а при заболеваниях печени — меньше 1,33.
Учитывая специфические особенности вымывания различных ферментов из очага некроза и длительность их присутствия в сыворотке крови, необходимо помнить о нескольких принципах ферментативной диагностики острогоИМ.
Запомните
1. Исследование уровня активности КФК и МВ-КФК целесообразно только в течение 1–2 суток, а АсАТ — 4–7 суток от предположительного начала заболевания.
2. Если с момента ангинозного приступа прошло более двух суток, для лабораторного подтверждения ИМ необходимо исследовать в динамике уровень активности ЛДГ, ЛДГ1 и АсАТ вместе с АлАТ и расчетом коэффициента Ритиса.
3. Повышение активности КФК, МВ-КФК, ЛДГ, ЛДГ1, АсАТ не является строго специфичным для острого ИМ, хотя при прочих равных условиях активность МВ-КФК отличается более высокой информативностью.
4. Отсутствие гиперферментемии не исключает развития ИМ.
Окончательная трактовка результатов исследования ферментов в сыворотке крови при остром ИМ возможна только в комплексе с оценкой клинической картины заболевания, изменений ЭКГ и данных других лабораторных и инструментальных методов исследования.
Исследование липидного обмена
Нарушения липидного обмена (гиперлипопротеидемии) являются важнейшим фактором риска атеросклероза и патогенетически связанных с ним заболеваний сердечно-сосудистой системы (инфаркта миокарда, хронических формИБС, инсульта, облитерирующего атеросклероза артерий нижних конечностей и др.). Поэтому исчерпывающая характеристика нарушений липидного обмена является обязательным условием эффективной профилактики этих заболеваний, определяющих, по сути, прогноз жизни, трудоспособность и физическую активность в быту большинства людей преклонного возраста во всех экономически развитых странах.
Напомним, что в плазме (сыворотке) крови присутствуют три основных класса липидов: 1) холестерин (ХС) и его эфиры, 2) триглицериды (ТГ) и 3) фосфолипиды (ФЛ). Наибольшее значение в атерогенезе имеют холестерин и триглицериды. Основной транспортной формой липидов являются, как известно, липопротеиды (ЛП), в которых ХС, ТГ и ФЛ связаны с белками-апопротеинами (подробнее — см. главу 1).
Для характеристики нарушений липидного обмена используют определение: 1) общего количества ХС и ТГ в плазме (сыворотке) крови; 2) содержание отдельных классов липопротеидов (ЛПНП, ЛПОНП и ЛПВП); 3) расчет коэффициента атерогенности. В большинстве случаев этих данных бывает достаточно, чтобы оценить характер и выраженность нарушений липидного обмена, а также степени атерогенности этих нарушений. В последние годы дополнительно к этим исследованиям рекомендуют определять также содержание белков-апопротеинов, входящих в состав ЛП (апо-А, апо-В и др.) и отличающихся различным влиянием на атерогенез, хотя эти методы пока не нашли широкого распространения в клинической практике.
Общее содержание ХС и ТГ в плазме (сыворотке) крови
При различных дислипидемиях может повышаться содержание ХС (гиперхолестеринемия) или ТГ(гипертриглицеридемия). Часто встречается также так называемая комбинированная гиперлипидемия, при которой имеет место повышение концентрации как ХС, так и ТГ.
Одной из наиболее сложных проблем диагностики гиперлипидемий является вопрос о том, какой уровень ХС иТГ считать «нормальным». Как известно, содержание обоих липидов в плазме (сыворотке) крови здоровых людей колеблется в широких пределах и зависит прежде всего от возраста и пола (см. главу 1): с возрастом у здоровых людей уровень ХС и ТГ постепенно возрастает; у мужчин он выше, чем у женщин. Усредненной и весьма условной верхней границей считают для ХС-5,17 ммоль/л (200 мг/дл) и дляТГ-1,7 ммоль/л (150 мг/дл).
В то же время сопоставление этих границ с данными, полученными при обследовании больших популяций здоровых людей, показывает, что у многих из них уровень холестерина существенно превышает 5,17 ммоль/л, а триглицеридов — 1,7 ммоль/л. Дело в том, что атерогенное действие ХС и ТГ существенно возрастает при наличии у обследуемых таких факторов риска атеросклероза как отягощенная наследственность (ИМ, инсульт, внезапная смерть у родственников в возрасте до 55 лет), курение, артериальная гипертензия, сахарный диабет, ожирение (масса тела, на 30% превышающая идеальную массу тела, и др.). У этих лиц «нормативы» ХС и ТГ должны быть значительно снижены.
Многочисленные клинические наблюдения позволили рекомендовать наиболее приемлемые в настоящее время уровни ХС и ТГ, представленные в табл. 3.18. Они включают деление на желательный, погранично высокий и повышенный уровень ХС и ТГ.
Таблица 3.18
Градации уровней холестерина и триглицеридов в плазме (сыворотке) крови
| Липиды | Единицы измерения | Желатель- ный уровень | Пограничновысокий уровень | Повышен- ный уровень |
| ХС | ммоль/л | < 5,17 | 5,17–6,18 | 6,21 |
| мг/дл | < 200 | 200–239 | 240 | |
| ТГ | ммоль/л | < 1,70 | 1,71–2,29 | > 2,30 |
| мг/дл | < 130 | 130–200 | > 200 |
Формально гиперхолестеринемия диагностируется при содержании ХС в плазме (сыворотке) крови, превышающем 6,2 ммоль/л (240 мг/дл), а гипертриглицеридемия — при концентрации ТГ больше 2,3 ммоль/л (200 мг/дл). Однако следует иметь в виду, что сочетание погранично высокого уровня ХС (5,2–6,2 ммоль/л) и ТГ (1,7–2,3 ммоль/л), а иногда даже более низких их концентраций, с другими факторами риска может иметь такое же значение для формирования и прогрессирования атеросклероза, как и более высокий уровень этих липидов, но при отсутствии артериальной гипертензии, сахарного диабета, ожирения, отягощенной наследственности и т. п.
Как было показано выше (см. главу 1), гиперхолестеринемия, гипертриглицеридемия и комбинированная гиперлипидемия встречаются не только при атеросклерозе, но и при многих заболеваниях печени, желчевыводящей системы, почек, эндокринной системы и т. д. Так, повышение уровня ХС и ТГнередко наблюдается при сахарном диабете, нефротическом синдроме, микседеме, обтурационной желтухе, холестатическом синдроме, беременности и других состояниях.
Дата: 2018-11-18, просмотров: 539.