План занятия
1. Проверка посещаемости и информация
2. Программированный контроль и опрос
3. Решение ситуационных задач
4. Подведение итогов занятия
Контрольные вопросы и задания по теме занятия
1. Понятие об ионной атмосфере.
2. Активность ионов и ее связь с концентрацией.
3. Коэффициент активности и зависимость его величины от общей концентрации электролитов в растворе.
4. Ионная сила раствора. Расчет ионной силы раствора.
5. Зависимость коэффициента активности от ионной силы раствора (предельный закон Дебая и Хюккеля).
6. Электрохимия (определение). Проводники I и II рода. Формула для расчета сопротивления проводника I рода.
7. Кондуктометрическая ячейка. Удельная электрическая проводимость. Определение, обозначение, формула для расчета по известному сопротивлению раствора.
8. Молярная электрическая проводимость. Определение, обозначение. Формула для расчета по известной величине удельной электропроводимости.
9. Влияние разбавления на молярную электрическую проводимость растворов сильных и слабых электролитов. График и пояснение.
10. Движение катионов и анионов в электрическом поле при больших разведениях. Закон Кольрауша (формулировка и математическое выражение). Какую величину как именно можно рассчитывать, пользуясь законом Кольрауша?
11. Особенности подвижности ионов Н+ и ОН-.
12. Кондуктометрия. Кондуктометрическое определение степени и константы диссоциации слабого электролита. Формулы, на которых основано определение. Применение метода.
13. Кондуктометрическое титрование сильной и слабой кислот, а также их смеси со щелочью. Графики, пояснения и применение в медико-биологнческих исследованиях.
а). Основная литература:
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 221 – 226, 283 – 301 с.
б). Дополнительная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 83 – 89 c.
Ситуационные задачи
Задача 43
Рассчитайте ионную силу плазмозамещающего раствора «Тририсоль», который готовят по прописи:
Натрия хлорид 0,5 г
Калия хлорид 0,1 г
Натрия гидрокарбонат 0,4 г
Вода для инъекций до 100 мл
Задача 44
Рассчитайте ионную силу плазмозамещающего раствора «Ацесоль», который готовят по прописи:
Натрия ацетат 0,2 г
Натрия хлорид 0,5 г
Калия хлорид 0,1 г
Вода для инъекций до 100 мл
Задача 45
Рассчитайте ионную силу плазмозамещающего раствора «Хлосоль», который готовят по прописи:
Натрия ацетат 0,36 г
Натрия хлорид 0,475 г
Калия хлорид 0,15 г
Вода для инъекций до 100 мл
Задача 46
Рассчитайте ионную силу плазмозамещающего раствора «Квартасоль», который готовят по прописи:
Натрия хлорид 0,475 г
Калия хлорид 0,15 г
Натрия ацетат 0,26 г
Натрия гидрокарбонат 0,1 г
Вода для инъекций до 100 мл
Задача 47
Рассчитайте ионную силу плазмозамещающего раствора «Лактасоль», который готовят по прописи:
Натрия хлорид 0,62 г
Калия хлорид 0,03 г
Кальция хлорид безводный 0,016 г
Магния хлорид безводный 0,01 г
Натрия лактат 0,336 г
Вода для инъекций до 100 мл
Задача 48
Рассчитайте активность хлорид-ионов (см. Приложение 2) в кровезаменителе «Гемодез» следующего состава:
Поливинилпирролидон низкомолекулярный 6,0 г
Натрия хлорид 0,55 г
Калия хлорид 0,042 г
Кальция хлорид 0,05 г
Магния хлорид 0,0005 г
Натрия гидрокарбонат 0,023 г
Вода для инъекций до 100 мл
Задача 49
Рассчитайте активность иона калия (см. Приложение 2) в плазмозамещающем растворе следующего состава:
Глюкоза безводная 10,0 г
Натрия хлорид 0,5 г
Калия хлорид 0,3 г
Магния сульфат 0,05 г
Кислота глутаминовая 0,1 г
Вода для инъекций до 100 мл
Задача 50
Водные растворы сульфата цинка с массовой долей 0,1%; 0,25% и 0,5% применяются в качестве глазных капель как антисептическое и вяжущее. Рассчитайте активность иона цинка (см. Приложение 2) в таких растворах. Плотность каждого раствора условно принять равной 1 г/мл.
Задача 51
Водный раствор сульфата меди с массовой долей 1% назначают в малых дозах для улучшения кроветворной функции. Вычислите активность ионов меди в таком растворе (плотность раствора 1,009 г/мл).
Задача 52
При отравлениях цианидами внутривенно вводят 2%-ный водный раствор нитрата натрия с плотностью 1,011 г/мл. Вычислите активности ионов в этом растворе (см. Приложение 2).
Задания в тестовой форме
«ТЕОРИЯ РАСТВОРОВ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ ДЕБАЯ И ХЮККЕЛЯ»
Задание: Укажите один или несколько вариантов правильных ответов
1. Активность электролита Х определяется по формуле:
A. 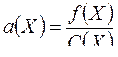
B. 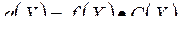
C. 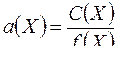
D. 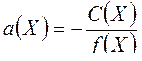
2. Отклонение раствора с концентрацией С(Х) от поведения раствора при бесконечном разведении выражаем:
A. активность а
B. ионная сила раствора I
C. коэффициент активности f
D. степень диссоциации α
3. Если f(X) = 1, то
A. а(Х) = С(Х)
B. а(Х) > С(Х)
C. а(Х) < С(Х)
D. а(Х) << С(Х)
4. Мерой общего содержания катионов и анионов является:
A. ионная сила раствора
B. активность электролита
C. концентрация электролита
D. коэффициент активности
5. Значение ионной силы раствора электролита рассчитывают по формуле:
A. 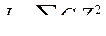
B. 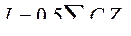
C. 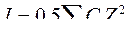
D. 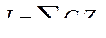
6. Значение I для фосфатного буфера при условии, что С(NaH2PO4) = 0,1 М, С(Na2HPO4) = 0,005 М равно? Ответ подтвердить расчетом.
A. 1,15
B. 0,115
C. 0,2
D. 11,5
7. Значение I для 0,02 н раствора K3PO4 равно? Ответ подтвердить расчетом.
A. 0,12
B. 1,2
C. 0,24
D. 2,4
8. Значение I для 0,01 М раствора алюминиевых квасцов K2SO4•Al2(SO4)3•2H2O равно? Ответ подтвердить расчетом.
A. 1,8
B. 0,18
C. 0,018
D. 18
9. Значения I для ацетатного буфера при условии, что С(CH3COONa) = 0,1 М, С(CH3COOH) = 0,05 М равно? Ответ подтвердить расчетом.
A. 0,2
B. 0,1
C. 0,05
D. 0,15
10. Значение I для фосфатного буфера при условии, что С(NaH2PO4) = 0,1 М, С(Na2HPO4) = 0,05 М равно? Ответ подтвердить расчетом.
A. 0,25
B. 2,5
C. 0,5
D. 25
11. Значение I для раствора 0,1 М Al2(SO4)3 равно? Ответ подтвердить расчетом.
A. 3
B. 1,5
C. 15
D. 0,3
12. Эффект уменьшения числа ионов сильных электролитов участвующих в химических реакциях объясняется в теории Дебая и Хюккеля
A. электростатическим межионным взаимодействием в растворах
B. сольватацией ионов
C. гидратацией ионов
D. десольватацией ионов
ЗАНЯТИЕ № 12 - 13
Электрохимия
План занятия
1. Проверка посещаемости и информация
2. Программированный контроль и опрос
3. Решение типовых задач
4. Решение ситуационных задач
5. Подведение итогов занятия
Контрольные вопросы и задания по теме занятия
1. Возникновение электродного потенциала металлического электрода.
2. Факторы, влияющие на величину электродного потенциала. Уравнение Нернста (для 298 К и др. температур).
3. Устройство и принцип действия стандартного водородного электрода. Ряд стандартных электродных потенциалов.
4. Правила записи схем гальванических элементов. Устройство, схема и принцип действия медно-цинкового гальванического элемента. ЭДС гальванического элемента.
5. Концентрационный гальванический элемент. ЭДС концентрационного гальванического элемента.
6. Окислительно-востановительные потенциалы. Уравнение Петерса.
7. Диффузионный потенциал.
8. Потенциометрия, ее применение в лабораторной и клинической практике. Классификация электродов, применяемых в потенциометрии. Стеклянный и хлорсеребряный электроды.
а). Основная литература:
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 231 – 266 с.
б). Дополнительная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 156 – 187 c.
Дата: 2018-12-21, просмотров: 1133.