Термодинамика разбавленных растворов. Электрохимия.
Учебные элементы модуля
| рН для буферных систем кислотного типа | 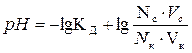 КД – константа диссоциации кислоты
Nc, Nк – нормальные концентрации соли и кислоты, взятых для приготовления буферного раствора
Vc, Vк – объемы в миллилитрах растворов соли и кислоты, взятых для приготовления буферного раствора
КД – константа диссоциации кислоты
Nc, Nк – нормальные концентрации соли и кислоты, взятых для приготовления буферного раствора
Vc, Vк – объемы в миллилитрах растворов соли и кислоты, взятых для приготовления буферного раствора
|
| рН для буферных систем основного типа | 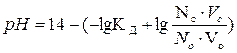 Кд – константа диссоциации основания
Nc, No – нормальные концентрации соли и основания, взятых для приготовления буферного раствора
Vc, Vo – объемы в миллилитрах растворов соли и основания, взятых для приготовления буферного раствора
Кд – константа диссоциации основания
Nc, No – нормальные концентрации соли и основания, взятых для приготовления буферного раствора
Vc, Vo – объемы в миллилитрах растворов соли и основания, взятых для приготовления буферного раствора
|
| Буферная емкость | 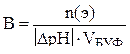 n(э) – число молей эквивалентов сильной кислоты или щелочи
n(э) = Nк·Vк (при титровании кислотой)
n(э) = Nо·Vо (при титровании основанием)
|∆ pH| - абсолютная величина изменения pH в результате добавления кислоты или щелочи
Vбуф – объем буферного раствора
n(э) – число молей эквивалентов сильной кислоты или щелочи
n(э) = Nк·Vк (при титровании кислотой)
n(э) = Nо·Vо (при титровании основанием)
|∆ pH| - абсолютная величина изменения pH в результате добавления кислоты или щелочи
Vбуф – объем буферного раствора
|
| Электродвижущая сила | ЭДС = Е+ – Е– Е+ – потенциалы положительного электродов E – – потенциалы отрицательного электродов |
| Электродный потенциал в нестандартных условиях (уравнение Нернста) | 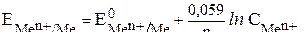
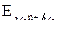 - электродный потенциал - электродный потенциал
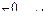 - стандартный электродный потенциал
n – заряд ионов металла
С – концентрация и o нов металла в растворе - стандартный электродный потенциал
n – заряд ионов металла
С – концентрация и o нов металла в растворе
|
| Электродвижущая сила для концентра-ционного гальванического элемента | 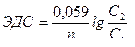 n – заряд ионов металла
С1 – концентрация анодного раствора
С2 – концентрация катодного раствора
n – заряд ионов металла
С1 – концентрация анодного раствора
С2 – концентрация катодного раствора
|
| Уравнение Нернста для водородного электрода | 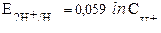 или или 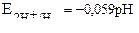 рН – водородный показатель
СН+ - концентрация протонов водорода
рН – водородный показатель
СН+ - концентрация протонов водорода
|
ЗАНЯТИЕ № 9
Буферные системы и растворы
План занятия
1. Проверка посещаемости и информация
2. Программированный контроль и опрос
3. Решение типовых задач
4. Подведение итогов занятия
Контрольные вопросы и задания по теме занятия
1. Что такое буферные системы, буферные растворы? Какие 3 вида буферных систем Вы знаете?
2. Дайте определение понятий “кислота” и “основание” с точки зрения протолитической теории. Какие кислота и основание называются сопряженными? Приведите пример
3. Механизм действия буферных систем:
Ø ацетатной,
Ø гидрокарбонатной,
Ø фосфатной,
Ø белковой,
Ø гемоглобиновой,
Ø оксигемоглобиновой,
Ø аммонийной
Уравнения реакций взаимодействия с сильной кислотой и сильной щелочью в ионном и молекулярном виде.
4. Формулы для расчета pH буферных систем кислотного и основного типов по уравнению Гандерсона-Гассельбаха. От каких факторов зависит рН буферных систем и почему он не зависит от разбавления раствора?
5. Что такое буферная емкость и чему она ровна количественно? Формула для расчета буферной емкости. От каких факторов и как именно зависит буферная емкость?
а). Основная литература:
1. Физическая и коллоидная химия [Текст]: учеб. пособие для вузов / А.П. Беляева [и др.]. - М., ГЭОТАР – Медиа, 2010. – 216 – 221 с.
б). Дополнительная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 109 – 119 c.
Дата: 2018-12-21, просмотров: 490.