Катализом называется явление увеличения скорости реакции под действием веществ – катализаторов, которые принимая участие в процессе, при его окончании остаются химически неизменны.
В настоящее время более 90 % всех новых процессов проводятся с участием катализаторов.
Например, синтез аммиака N2 + 3H2 = 2NH3 (катализатор железный с добавками оксидов К2О, Na2O, MgO, Al2O3)
Окисление аммиака 4NH3 + 5О2 = 4NО + 6Н2О (на платиновом катализаторе играющем главную роль в получении азотной кислоты)
Катализаторы не входят в стехиометрическое уравнение реакции, даже если в ходе её образует с реагирующими веществами промежуточные соединения, поскольку после реакции он возвращается в исходное состояние.
Увеличение скорости реакции под действием катализатора происходит потому, что в его присутствии изменяется механизм реакции и энергия активации лимитирующей стадии оказывается более низкой, нежели в отсутствие катализатора. В присутствие катализатора реакция может происходить в соответствии с иным кинетическим уравнением, нежели реакция без катализатора. В зависимости от того, однородна или неоднородна среда, в которой протекает каталитическая реакция, различают два вида катализа: гомогенный и гетерогенный.
При гомогенном катализе и катализатор, и реагенты находятся в одной фазе, газовой или растворе. При гетерогенном катализе катализатор и реагенты находятся в разных фазах, например газообразная реакционная смесь и твёрдый катализатор.
Гомогенный катализ
Называют газофазным или жидкофазным. В качестве жидкофазной гомогенной каталитической реакции приведем разложение пероксида водорода в водном растворе в присутствии катионов тетраамминмеди (II) [Cu(NH3)4]2+(p-p)
|
 H2O2(p-p) H2O(ж) + 0,5O2(г)
H2O2(p-p) H2O(ж) + 0,5O2(г)
Примером газофазного гомогенного каталитического процесса является термораспад ацетальдегида под действием катализатора – паров йода.
|
 СН3СОН(г) СН4(г) + СО(г)
СН3СОН(г) СН4(г) + СО(г)
К гомогенному катализу можно отнести и влияние растворителя на ход реакции в растворах. Обычно каталитическое действие растворителя тем сильнее, чем полярнее его молекулы.
Это объясняется деформацией молекул реагирующих веществ под влиянием растворителя, т.е. повышается их реакционная способность.
Гетерогенный катализ
При гетерогенном катализе реакция протекает на поверхности катализатора, поэтому особую роль играют площадь поверхности, состав и структура поверхностного слоя катализатора. Структура катализатора зависит от способа его приготовления, в частности – от термической обработки. Наилучшими каталитическими свойствами обычно обладают катализаторы, приготовленные при возможно более низкой температуре и потому имеющие несовершенную кристаллическую и большую удельную поверхность.
Обычно каталитическим действием обладает не вся поверхность катализатора, а лишь незначительная часть её – так называемые активные центры.
Есть вещества – «каталитические яды», которые попадая на катализатор, выводят его из строя, «отравляют» его.
(Например, платиновые катализаторы отравляются соединениями мышьяка, селена и теллура.) Отравление катализатора происходит под действием очень небольших количеств каталитических ядов, достаточных для блокирования лишь активных центров. Ими могут быть и продукты самой катализируемой реакции в том случае, если они прочно адсорбируются на поверхности катализатора и закрывают доступ к ней молекулам реагирующих веществ.
Активными центрами на поверхности катализатора являются трещины, углы, неправильные структуры, точки контакта двух фаз. Каталитическая активность резко возрастает в результате добавления к катализатору веществ, которые активируют катализатор, сами по себе не являясь катализаторами данной реакции. Эти вещества называются промоторами. В качестве промоторов применяют металлы и их оксиды и соли (Например, К2О, Na2O, MgO, Al2O3, СаО добавляют к железному катализатору при синтезе аммиака). В механизме гетерогенного катализа большую роль играют адсорбция и перевод адсорбированного вещества в более активное состояние из-за деформации его молекул («активированная адсорбция»).
Адсорбция - это разновидность сорбции, т.е. поглащение одного вещества другим веществом.
Если вещество поглащается всем объёмом другого вещества, то происходит абсорбция, если вещество концентрируется на поверхности раздела фаз, то имеет место адсорбция.
Вещество, способное поглащать, адсорбировать другое вещество, называется адсорбентом, вещество которое может адсорбироваться – адсорбтивом, а уже адсорбированное вещество адсорбатом. Обратный процесс называется десорбцией.
В гетерогенном катализе большую роль играет химическая адсорбция реагента на катализаторе (хемосорбция). Молекула реагента деформируется в ней ослабляются связи между атомами, что в дальнейшем способствует их разрыву. Адсорбированные молекулы находятся в более тесном контакте, что в дальнейшем способствует их разрыву. Адсорбированные молекулы находятся в более тесном контакте, что способствуют образованию активированного комплекса и снижению энергии активации. Хемосорбированные молекулы взаимодействуют с образованием продуктов реакции, последние освобождают активные центры путем десорбции. Важную роль играют электронные свойства поверхности катализатора (каталитическим действием часто обладают металлы, не слишком легко теряющие электроны).
Сущность каталитического действия четко сформулирована академиком Г.К. Боресковым. Катализ обусловлен промежуточным химическим взаимодействием реагирующих веществ с катализатором, в результате которого открывается новый реакционный путь, обычно более сложный по числу стадий, но более легкий в отношении величины преодолеваемых энергетических барьеров. Процессыпри гомогенном и гетерогенном катализе могут протекать по слитному и стадийному механизмам. При слитном механизме в состав образующегося активированного комплекса входят все реагенты и катализатор.
 |
|
На энергетической диаграмме реакции наблюдается единственный максимум, высота которого снижается при наличии катализатора (ЕАкат < EA), скорость реакции при этом увеличивается. Без катализатора реакция идёт по схеме:
А + В ↔ АВ* ↔ АВ
при применении катализатора схема процесса изменяется:
А + В + К ↔ АВК* ↔ АВ + К
|
 В то же время при увеличении числа реагентов в системе вероятность образования выше указанного активированного комплекса уменьшается. В таком случае каталитический процесс протекает по раздельному механизму. В этом случае на первой стадии только один из реагентов образует сначала активированный комплекс, а затем промежуточное химическое соединение с катализатором. На протяжении реакционного пути появляетя несколько активированных комплексов (max) и промежуточных продуктов (min). Реакция осуществляется по следующей стадийной схеме:
В то же время при увеличении числа реагентов в системе вероятность образования выше указанного активированного комплекса уменьшается. В таком случае каталитический процесс протекает по раздельному механизму. В этом случае на первой стадии только один из реагентов образует сначала активированный комплекс, а затем промежуточное химическое соединение с катализатором. На протяжении реакционного пути появляетя несколько активированных комплексов (max) и промежуточных продуктов (min). Реакция осуществляется по следующей стадийной схеме:
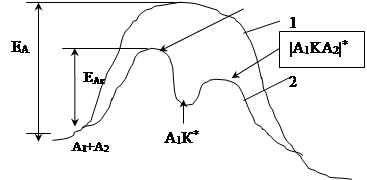
|
 |
А1 + К ↔ |А1К|* ↔ А1К*
А1K* + A2 ↔ |А1KA2|* ↔ А1' + A2' + K
Раздельный и слитный механизмы реализуются в различных областях температуры. По слитному механизму обычно протекают низкотемпературные (Т = 300….400К) реакции гомогенного и ферментативного катализа. Высокотемпературные (Т = 600….800К) процессы, в основном, осуществляются по стадийному механизму. Из уравнения Аррениуса видно, что даже малое уменьшение величины ЕА должно приводить к сильному возрастанию скорости процесса. Это определяет исключительно большое практическое значение катализаторов. Особенно ценно применение катализаторов в параллельных реакциях, т.к. подбором катализатора можно добиться понижения энергетического барьера только одного из параллельных процессов. Поэтому катализаторы находят широкое применение в реакциях органических соединений, которые могут претерпевать множественные превращения.
Различают положительный и отрицательный катализ. Присутствие посторонних веществ может не только ускорять, но и замедлять реакции. Вещество замедляющее реакции называется ингибитором (от англ. Inhibit – подавлять, препятствовать). Действие ингибиторов сводится к дезактивации либо «положительных» катализаторов либо активных частиц реагентов и промежуточных продуктов (свободных радикалов в цепных реакциях). При этом ингибитор претерпевает хим. превращения – т.е. термин «отрицательный катализ» не точен. Ингибиторы используются на практике для защиты металлов от коррозии, а также для стабилизации малоустойчивых веществ.
Например, активными катализаторами разложения пероксида водорода являются соединения меди, железа, марганца и др. металлов, которые легко могут попасть в неё при производстве.
Для связывания этих металлов в нерастворимые соединения к Н2O2 добавляют в качестве катализатора небольшое количество фосфатов (которые являются ингибиторами). В том случае, когда продукты реакции влияют на скорость взаимодействия исходных веществ, имеет место автокатализ. Например, окисление под действием перманганата калия, скорость реакции возрастает в присутствии катионов Mn2+.
Дата: 2018-12-21, просмотров: 834.