Первое истолкование связи скорости реакции с концентрацией реагентов дал Н. Н. Бекетов (1865 г). Обобщенно эту закономерность сформулировали Гульдберг и Вааге (1867 г).
При постоянной температуре скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведённых в степень, равную стехиометрическими коэффициентам в уравнении реакции.
Это основной закон химической кинетики – «закон действия масс».
Для реакции:
aА + bB = сС + dD
 (2)
(2)
где  k – коэффициент пропорциональности, называемый константой скорости хим. реакции, время-1.
k – коэффициент пропорциональности, называемый константой скорости хим. реакции, время-1.
СА, СВ – молярные концентрации реагентов А и В, моль/л.
a,b – стехиометрические коэффициенты.
Уравнение (2) является кинетическим уравнением для данной реакции.
Закон действия масс справедлив для гомогенных процессов, в случае гетерогенных в выражении скорости реакции войдут лишь концентрации веществ, находящихся в газообразном и растворенном состоянии. Концентрации твердых веществ не учитывают, предполагая, что реакция в этом случае происходит на поверхности твёрдого вещества, т.е. его концентрация постоянная и равна 1.
CaCO3(тв) = CaO(тв) + CO2(г)


H2(г) + I2(г) = 2HI(г)


Пример 1. Для простой реакции А + 2В® D начальные концентрации А и В равны 0,03 и 0,05 моль/дм3. константа скорости реакции равна 0,4 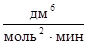 . Вычислите начальную скорость реакции и скорость реакции, когда концентрация вещества А уменьшится на 0,01 моль/дм3.
. Вычислите начальную скорость реакции и скорость реакции, когда концентрация вещества А уменьшится на 0,01 моль/дм3.
Р е ш е н и е
Запишем кинетическое уравнение данной реакции
u = k×[A]×[B]2.
Тогда скорость реакции в начальный момент времени равна
u = 0,4×0,03×(0,05)2 = 3×10-5  .
.
Определим концентрации реагентов, когда концентрация А уменьшится на 0,01 моль/дм3. Концентрация вещества А будет равна разности между начальным значением и израсходованным
[A] = 0,03 – 0,01 = 0,02 моль/дм3.
Согласно уравнению реакции расход по веществу В в два раза больше относительно вещества А, поэтому
[B] = 0,05 - 2×0,01 = 0,03 моль/дм3.
Вычисляем скорость реакции
u = 0,4×0,02×(0,03)2 = 7,2×10-6  .
.
Пример 2. Вычислите среднюю скорость реакции А + В = 3D, если начальная концентрация вещества А составляла 0,42 моль/дм3, а через 10 секунд стала равной 0,32 моль/дм3. Как изменяться за это время концентрации веществ В и D?
Р е ш е н и е
По условию задачи изменение концентрации вещества А за Dt = 10 с составило DСА = 0,32 – 0,42 = -0,1 моль/дм3. Следовательно, средняя скорость реакции
`u =  .
.
Поскольку на 1 моль вещества А, согласно уравнению реакции, расходуется 1 моль вещества В, то концентрация вещества В также уменьшилась на 0,01 моль/дм3, то есть DСВ = -0,01 моль/дм3. Вещества D образуется в три раза больше, чем расходуется вещества А или В. Таким образом, концентрация вещества D за 10 секунд увеличилась на 0,03 моль/дм3 или DСD = 0,03 моль/дм3.
Пример 3. Как изменится скорость реакции 2NO + O2 = 2NO2 , если при постоянной температуре повысить общее давление в системе в 2 раза?
Р е ш е н и е
Поскольку все участники реакции являются газообразными веществами, то увеличение общего давления в 2 раза при постоянной температуре вызовет уменьшение объема системы в 2 раза, то есть концентрация каждого из веществ увеличится в 2 раза. Согласно закону действующих масс скорость реакции до повышения давления равна
u1 = k×[NO]2×[O2],
а после повышения давления
u2 = k×(2[NO])2×2[O2] = 8k×[NO]2×[O2].
Так как константа скорости реакции не зависит от концентраций реагентов, то  , то есть, при повышении давления в 2 раза скорость данной реакции увеличится в 8 раз.
, то есть, при повышении давления в 2 раза скорость данной реакции увеличится в 8 раз.
Пример 4. Для реакции аА + вВ + dD® продукты при повышении концентрации вещества А в 2 раза скорость реакции возрастает в 8 раз, при увеличении концентрации В в 3 раза скорость реакции не изменяется, а при повышении концентрации D в 4 раза скорость реакции увеличивается в 4 раза. Запишите кинетическое уравнение реакции.
Р е ш е н и е
Согласно основному закону химической кинетики скорость реакции
u = k×[A]  ×[B]
×[B]  ×[D]
×[D]  .
.
При постоянных концентрация В и D соотношение скоростей реакции при изменении концентрации вещества А будет равно
 .
.
По условию задачи если [A]2 = 2[A]1, то есть  . Тогда решаем уравнение
. Тогда решаем уравнение
 или nА = 3.
или nА = 3.
По аналогии определяем, что nВ = 0, а nD = 1. Таким образом, кинетическое уравнение данной реакции имеет вид
u = k×[A]3×[B]0×[D]1.
§2. Механизмы химических реакций.
В зависимости от механизма реакции бывают простыми (идут в 1 стадию) и сложными (многостадийными).
Реакции могут быть обратимыми и необратимыми. Обратимые протекают как в прямом (слева направо), так и обратном направлениях до состояния равновесия. В таких системах всегда присутствуют как исходные вещества, так и продукты реакции. Необратимые – это реакции, в которых хотя бы одно вещество расходуется полностью. Теоретически все реакции обратимы.
В каждой стадии реакции может участвовать разное число молекул. Реакции различают по молекулярности, т.е. по числу частиц, учавствующих в элементарном взаимодействии.
Известны одно-(моно), двух- (би) и трех- (три) молекулярные реакции
Моно А → B + C
Би A + B → C
 Три A + 2B → АВ2
Три A + 2B → АВ2
3А → В + С + D
A + B + С → D
Порядком реакции называют показатели степеней при концентрациях реагирующих веществ в кинетическом уравнении реакции. Порядок определяют из экспериментальных измерений скорости реакции.
Кинетические уравнения реакций
1-го порядка:  n = nA (3)
n = nA (3)
2-го порядка:  n = nA+nB (4)
n = nA+nB (4)
3-го порядка:  n = nA + nB + nD (5)
n = nA + nB + nD (5)
Реакции, скорость которых не зависит от концентрации, имеют нулевой порядок реакции.
n - общий порядок реакции; nA, nB, nD - частные порядки.
Порядок реакции и молекулярность совпадают лишь для простых реакций идущих в одну стадию. Это связано с тем, что большинство химических реакций протекает по сложному механизму, при этом скорость реакции определяется концентрацией промежуточных продуктов, а не исходной концентрацией веществ, записанных в стехиометрическом уравнении процесса.
В гомогенной системе протекает реакция 2А + В = С. Написать кинетическое уравнение реакции указать порядок реакции и порядок по каждому веществу

порядок реакции 2 +1 = 3 (третьего порядка)
nA = 2 nB = 1.
Размерность константы скорости зависит от порядка реакции. Для реакции 1-го порядка k измеряется в с-1; 2-го порядка в моль-1·л·с-1.
Интегрированием дифференциальных уравнений можно получить формулы для вычисления k, так для реакции 0-го порядка:
 (5)
(5)
где индекс «0» означает порядок реакции.
Проинтегрировав выражение (5) при τ = 0 и С = С0

С0 – С = k0·τ (6)
С = С0 – k0·τ (7)
С учётом степени превращения α
 (8)
(8)
Выражения (6,7,8) называются интегральными кинетическими уравнениями реакции нулевого порядка.
Временем полупревращения τ0,5 или τ½ называется время, за которое начальная концентрация реагирующего вещества уменьшается в два раза (С = 0,5·С0) или при котором степень превращения исходного реагента равна 0,5 (50%). Подставив α = 0,5 в уравнение (8) получим

в реакции нулевого порядка время полупревращения пропорционально начальной концентрации исходного вещества.
2. реакции первого порядка

это уравнение для скорости мономолекулярных реакций (термическое разложение, радиоактивный распад), проинтегрировав уравнение получим







 (9)
(9)
Уравнение (9) показывает зависимость степени превращения от кинетических параметров процесса.
 (10)
(10)
в реакции 1-го порядка τ½ не зависит от начальной концентрации реагента.
3. реакции 2-го порядка к ним относятся взаимодействие Н2 и I2 с образованием HI, термическое разложение HI, омыление этилацетата щелочью. Для этих процессов порядок реакции равен двум.
а) А1 + А2 → продукты
 2А1 → продукты
2А1 → продукты
 (11)
(11)
проинтегрировав это уравнение в пределах от С0 до С и от τ = 0 до τ, получим

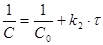
 (12)
(12)
подставив степень превращения  и текущую концентрацию
и текущую концентрацию

в уравнение (12) получим:
 (13)
(13)
 (14)
(14)
Соотношения (с 11 по 14) являются интегральными кинетическими уравнениями реакции второго порядка. Подставив в выражение (13) α = 0,5, получим
 (15)
(15)
в реакции второго порядка время полупревращения обратно пропорционально начальной концентрации реагента.
б) сложный случай, имеющий место при различных начальных концентрациях реагентов: 
 (16)
(16)
 (17)
(17)
С учетом 
 и
и 
 уравнение (17) примет вид
уравнение (17) примет вид
 (18)
(18)
где С01 и С02 – начальные концентрации реагентов А1 и А2; х – уменьшение концентрации веществ А1 и А2 к моменту времени τ. Разделив переменные в уравнении (18), получим
 ,
,
или  (19)
(19)
Проинтегрировав выражение (19) по х в пределах от 0 до х и по τ в пределах от 0 до τ, после преобразования получим:

Обозначив  и
и 
 , выразим из (19) константу скорости через величину β и степень превращения α:
, выразим из (19) константу скорости через величину β и степень превращения α:
 (20)
(20)
4. реакции третьего порядка
А1+А2+А3→ продукты
Простой случай С01 = С02 = С03, т.е. уравнение имеет вид
3А1→ продукты
 (21)
(21)
проинтегрировав уравнение (21) в пределах от С0 до С и от τ = 0 до τ получим
 (22)
(22)
 (23)
(23)
 (24)
(24)
Подставив степень превращения  и текущую концентрацию
и текущую концентрацию  в уравнение (23), получим
в уравнение (23), получим
 (25)
(25)
Соотношения (22) и (25) – интегральные кинетические уравнения реакции третьего порядка. Подставив в выражение (25) α = 0,5, получим
 (26)
(26)
В реакции третьего порядка время полупревращения обратно пропорционально квадрату начальной концентрации вещества.
Все химические реакции по их скорости грубо делят на медленные и быстрые. К медленным относят реакции у которых значения константы скорости 1-го и 2-го порядка лежат в интервале 10-8-10-1с (или л·моль-1·с-1). Все химические реакции, константа скорости которых находится в интервале 101-1011 с-1 (или л·моль-1·с-1), принадлежат к быстрым.
Сложные реакции могут быть последовательными, параллельными, сопряженными, цепными.
Последовательные реакции – связанная система реакций, в которых продукты предыдущих стадий являются исходными веществами последующих.

Скорость реакции определяется лимитирующей стадией. (Самой медленной стадией процесса). Лимитирующая или контролирующая стадия процесса.
Параллельные реакции – связанная система реакций имеющих одни и те же исходные вещества, но различные продукты реакции.
|
|

|





 |  | ||||||
 |  | ||||||
При нагревании бертолетовой соли KClO3 одновременно идут два превращения:
4KCl + 6О2
4KClO3
3 KСlO4 + KCl
Сопряженные реакции, две реакции, одна из которых индуцирует (вызывает) протекание другой.
|
|




| |||||||
|
| ||||||
Осуществление одной из реакций (А→В) обусловливает протекание другой (Д→Е) причем вторая реакция невозможна без первой. HI с Н2СrO4 не будет взаимодействовать, однако, при введении в систему оксида железа (+2) наряду с его окислением
6FeO + 2Н2СrO4 = 3FeO + Cr2O3 + 2H2O
одновременно происходит окисление HI
12 HI + 2Н2СrO4 = 3I2 + 2CrI3 + 8H2O
Цепные реакции связанная система сложных реакций, протекающих последовательно, параллельно и сопряженно с участием свободных радикалов. Основные стадии процесса: зарождение цепи, продолжение цепи, разветвление и обрыв цепи.
 Например, синтез хлористого водорода
Например, синтез хлористого водорода



 Cl2 → Cl0 + Cl0 зарождение цепи
Cl2 → Cl0 + Cl0 зарождение цепи







|
 Cl0 + Н2 → НCl + Н0
Cl0 + Н2 → НCl + Н0









 H0 + Cl2 → HCl + Cl0
H0 + Cl2 → HCl + Cl0












 Cl0 + Cl0 → Cl2 (обрыв цепи)
Cl0 + Cl0 → Cl2 (обрыв цепи)
Н0 + Н0 → Н2 (обрыв цепи)
В зависимости от электронных изменений в ходе реакции различают гомолитические и гетеролитические реакции.
В ходе первых происходит разъединение пары электронов, образующих химическую связь.
А : B → А° + B°
Иначе эти процессы называют радикальными, они образуют частицы с неспаренными электронами (радикалы).
В гетеролитических реакциях электронная пара остается у одного из партнеров по связи:
А : B → А:- + B+
В живых системах имеют место оба процесса.
Дата: 2018-12-21, просмотров: 605.