Переход из одного равновесного состояния в другое называется сдвигом химического равновесия или смещением положения равновесия.
Направление смещения химического равновесия в результате изменения внешних условий определяется принципом Ле Шателье.
Если на систему, находящуюся в состоянии равновесия оказать воздействие из вне, то равновесие сместится в сторону которая ослабит эффект внешнего воздействия.
При увеличении температуры равновесие смещается в сторону эндотермической реакции.
При уменьшении температуры равновесие смещается в сторону экзотермической реакции.
При увеличении давления равновесие смещается в сторону меньшего числа моль газообразных участников реакции.
При увеличении концентрации исходных веществ равновесие смещается в сторону образования продуктов реакции.
Применение катализатора изменяет скорости прямого и обратного процессов одинаково.
Пример 1. В состоянии равновесия для реакции N2 + 3H2 « 2NH3 концентрации участников реакции равны (моль/дм3): [N2] = 3; [H2] = 9; [NH3] = 4. Вычислите константу равновесия реакции и определите исходные концентрации азота и водорода, полагая, что до начала реакции аммиак в системе отсутствовал.
Р е ш е н и е
Данная реакция является гомогенной, поэтому константа равновесия равна
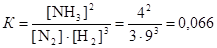
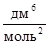 .
.
Из уравнения реакции следует, что для образования 4 моль продукта требуется 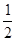 × 4 = 2 моль азота и
× 4 = 2 моль азота и 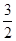 × 4 = 6 моль водорода. Следовательно, исходная концентрация азота составляет [N2]0 = 3 + 2 = 5 моль/дм3, а исходная концентрация водорода равна [H2]0 = 9 + 6 = 15 моль/дм3.
× 4 = 6 моль водорода. Следовательно, исходная концентрация азота составляет [N2]0 = 3 + 2 = 5 моль/дм3, а исходная концентрация водорода равна [H2]0 = 9 + 6 = 15 моль/дм3.
Пример 2. Константа равновесия реакции FeOтв + СО « Feтв + СО2 при некоторой температуре равна 0,5. Определите равновесные концентрации газов, если до начала реакции газовая смесь содержала 0,05 моль/дм3 СО и 0,01 моль/дм3 СО2.
Р е ш е н и е
Для данной гетерогенной реакции константа равновесия определяется выражением 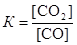 . Пусть к моменту равновесия в реакцию вступило х моль СО. Тогда, согласно уравнению реакции, образовалось столько же моль СО2. Следовательно, равновесные концентрации газов будут равны: [CO] = (0,05 – х) моль/дм3; [CO2] = (0,01 + х). Подставим эти концентрации в выражение для константы равновесия
. Пусть к моменту равновесия в реакцию вступило х моль СО. Тогда, согласно уравнению реакции, образовалось столько же моль СО2. Следовательно, равновесные концентрации газов будут равны: [CO] = (0,05 – х) моль/дм3; [CO2] = (0,01 + х). Подставим эти концентрации в выражение для константы равновесия
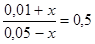 или
или 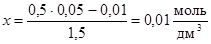 .
.
Таким образом, [CO] = 0,05 – 0,01 = 0,04 моль/дм3;
[CO2] = 0,01 + 0,01 = 0,02 моль/дм3.
Пример 3. Константа равновесия реакции Н2 + I2 « 2HI равна 64,8. Определите равновесные концентрации компонентов, если исходная смесь содержала 1,4 моль/дм3 водорода и 1,0 моль/дм3 йода.
Р е ш е н и е
Выражение для константы равновесия имеет вид
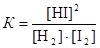 .
.
Пусть к моменту равновесия образовалось х моль HI. Тогда, согласно уравнению реакции, было израсходовано по 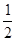 х моль йода и водорода. Следовательно, можно составить уравнение
х моль йода и водорода. Следовательно, можно составить уравнение
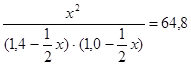 или 15,2 х2 – 77,76 х + 90,72 = 0.
или 15,2 х2 – 77,76 х + 90,72 = 0.
Решение данного квадратного уравнения даст корни: х1 = 3,32 моль/дм3;
х2 = 1,8 моль/дм3. Первый корень не удовлетворяет условию задачи по физическому смыслу (концентрация HI не может быть больше, чем удвоенная концентрация йода или водорода, то есть 2 или 2,8 моль/дм3). Таким образом, используем второй корень уравнения. Равновесные концентрации компонентов равны (моль/дм3):
[HI] = 1,8; [H2] = 1,4 - 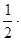 1,8 = 0,5; [I2] = 1,0 -
1,8 = 0,5; [I2] = 1,0 - 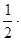 1,8 = 0,1.
1,8 = 0,1.
Пример 4. Вычислите константу равновесия реакции 2СО « Ств + О2, если известны значения констант равновесия реакций:
1) СО2 « Ств + О2 , К1 = 1,8×10-21;
2) 2СО2 « 2СО + О2 , К2 = 2×10-5 .
Р е ш е н и е
Запишем выражение для искомой константы равновесия 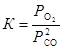 . Равновесное парциальное давление СО выразим из константы равновесия второй реакции
. Равновесное парциальное давление СО выразим из константы равновесия второй реакции
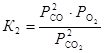 , откуда
, откуда 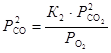 .
.
Тогда, 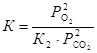 . Соотношение равновесных парциальных давлений кислорода и оксида углерода (IV) найдем из выражения для константы равновесия первой реакции
. Соотношение равновесных парциальных давлений кислорода и оксида углерода (IV) найдем из выражения для константы равновесия первой реакции 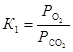 . Следовательно
. Следовательно
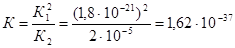 .
.
Пример 5. Константа равновесия некоторой реакции при 298 К равна 12,3 дм3/моль, а при 350 К - 1,07 дм3/моль. Вычислите изменение энтальпии реакции в данном интервале температур.
Р е ш е н и е
Используем уравнение изобары Вант-Гоффа
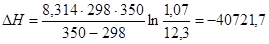 Дж/моль.
Дж/моль.
Пример 6. Какие меры можно предпринять для повышения выхода продукта реакции N2 + 3H2 « 2NH3, DН 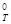 = -92,4
= -92,4 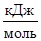 .
.
Р е ш е н и е
По условию задачи требуется сместить равновесие в сторону прямой реакции, поэтому следует:
1) увеличивать концентрации азота и водорода, то есть постоянно водить в систему свежие порции реагентов;
2) уменьшать концентрацию аммиака, иначе выводить его из реакционного пространства;
3) понижать температуру, так как прямая реакция является экзотермической;
4) увеличивать давление (уменьшать объем), потому что в прямом направлении происходит уменьшение числа моль газообразных веществ (из 4 моль газа образуется 2 моль газа).
Пример 7. Как изменится равновесная концентрация кислорода, если в системе 2Ств + О2 « 2СО при постоянной температуре увеличить концентрацию СО в 3 раза?
Р е ш е н и е
Запишем выражение для константы равновесия данного гетерогенного процесса 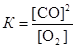 . По условию задачи
. По условию задачи 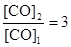 . Поскольку константа равновесия не зависит от концентраций реагентов, то должно выполняться равенство
. Поскольку константа равновесия не зависит от концентраций реагентов, то должно выполняться равенство
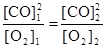 или
или 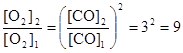 .
.
Таким образом, при повышении концентрации СО в 3 раза равновесная концентрация кислорода должна увеличится в 9 раз.
Дата: 2018-12-21, просмотров: 666.