Резкое увеличение скорости химической реакции с ростом температуры объясняет теория активации, согласно которой при столкновениях в химическую реакцию вступают только активные молекулы, обладающие по сравнению с другими некоторой избыточной энергией, называемой энергией активаци Еа, кДж/моль.
Энергия активации – это энергия, которую необходимо собщить 1 моль вещества, чтобы все молекулы в нем стали активными.
Активация молекул возможна при нагревании или растворении вещества, при выделении энергии в ходе самой реакции, при поглощении ими квантов излучения (светового, радиоактивного, рентгеновского, и т.п.), под действием ультразвука или электрического разряда и даже при их ударах о стенку сосуда.
С точки зрения теории активации исходные вещества сначала образуют неустойчивый активированный комплекс (АК). На это затрачивается Еа прямой реакции, на величину которой возрастает энергия системы
AB + CD ↔ AC + BD
|
|


|
|

|
 |
|  |
| ||||||||||
 |  | ||||||||||||
|
|
|
|
|
|
|
Далее происходит распад АК с образованием продуктов реакции и выделением энергии, которая численно равна энергии активации продуктов реакции.
Если при распаде АК энергии выделяется больше, чем было затрачено на активацию исходных веществ (Еа(прод)>Ea(исх)) то реакция экзотермическая, а если меньше (Еа(прод)<Ea(исх)) – эндотермическая реакция.
Энергия образования активированного комплекса называется энергией активации Еа. Реакция начинается только тогда, когда столкнувшиеся частицы будут обладать необходимой энергией активации и сумеют преодолеть энергетический барьер, ограничивающий их химическую активность.
Разность энергий активации прямой и обратной реакции равна изменению энтальпии. Константа скорости реакции зависит от числового значения Еа: чем меньше энергия активации, тем больше значение константы скорости реакции.
Возможность образования активированного комплекса, а соответственно и химического взаимодействия, определяется энергией молекул. Молекула, энергия которой достаточна для образования активированного комплекса, называется активной. Доля их в системе зависит от температуры.
Согласно уравнению Максвелла-Больцмана доля частиц с большей энергией (NEa), чем Ea, по отношению к общему числу молекул (N) составляет:
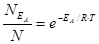
 |
Рис. 1. Распределение молекул по энергиям при двух температурах (Т2 > T1).
Как видно на рис.1. с увеличением температуры растет доля молекул, энергия которых равна или выше энергии активации Еа, соответственно растёт доля молекул способных к активным столкновениям с образованием активированного комплекса, т.е. происходит ускорение реакции. Чем выше энергия активации, тем меньше доля частиц, способных к активному взаимодействию. Экзотермические реакции протекают с меньшей энергией активации, чем эндотермические. Высокая энергия активации, или как иногда говорят, высокий энергетический барьер является причиной того, что многие химические реакции при невысоких температурах не протекают, хотя и принципиально возможны (ΔG < 0). В обычных условиях самопроизвольно не загораются: дерево, ткани, бумага, уголь, хлеб, керосин хотя ΔG < 0.
При высоких температурах доля активных частиц достаточно велика и реакции идут быстро. При температурах 10000К и выше реакции завершаются за 10-5-10-3с. Раздел химии, изучающий реакции в низкотемпературной плазме, получил название плазмохимия. Плазмохимические реакции используются для очистки сточных вод, получения тугоплавких элементов и т.д.
Экспериментально установлено, что зависимость 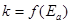 достаточно точно передается уравнением Аррениуса.
достаточно точно передается уравнением Аррениуса.
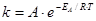 ,
,
где А – предэкспоненциальный множитель, отражающий долю эффективных соударений в общем числе соударений и не зависящий от температуры и концентрации;
R – универсальная газовая постоянная, Дж/мольК
Т – абсолютная температура, К
Еа – энергия активации, Дж/моль
Запишем уравнение Аррениуса в диференциальном виде:
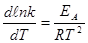
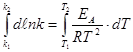
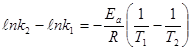
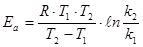
Скорость химической реакции очень чувствительна к изменению температуры. Так как процесс образования активированного комплекса – эндотермический, то k реакции увеличиваеется с повышением температуры. Зависимость скорости гомогенной химической реакции от температуры описывается эмпирическим уравнением Вант-Гоффа:
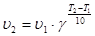 ,
,
где υ1 и υ2 – скорости реакции при температуре Т1 и Т2 соответственно;
γ – температурный коэфициент Вант-Гоффа, для большинства реакций лежит в интервале от 2 до 4.
Указанная математическая зависимость может быть выражена в виде правила: при повышении температуры на каждые 10 градусов скорость реакции возрастает в 2-4 раза, если реакция проводится при температуре, близкой к комнатной.
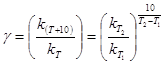
Есть определенная зависимость между скоростью реакции и временем.
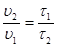 отсюда
отсюда 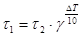
Для ускорения очень медленно протекающих химических реакций применяют катализаторы – вещества, способные понижать энергию активации реакции, ослабляя связи между молекулами. При этом молекулы становятся реакционно-способными при более низких температурах. Изменение скорости реакции путем добавления небольших порций катализатора называют катализом. Увеличение скорости реакции в присутствии катализатора можно оценить по уравнению
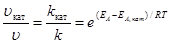 ,
,
где uкат, kкат – скорость и константа скорости реакции в присутствии катализатора; u, k –скорость и константа скорости реакции без катализатора; ЕА, кат, ЕА – энергия активации реакции в присутствии катализатора и без него.
Пример 1. При 150 °С реакция заканчивается за 16 минут. Определите время, необходимое для протекания реакции при 200 °С, если температурный коэффициент Вант-Гоффа равен 2,5.
Р е ш е н и е
Между скоростью протекания химической реакции и ее продолжитель-ностью существует обратно пропорциональная зависимость
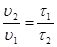 ,
,
тогда правило Вант-Гоффа в данном случае можно записать в виде
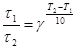 , откуда
, откуда 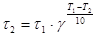
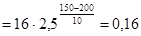 мин.
мин.
Пример 2. Вычислите энергию активации реакции, если при повышении температуры от 290 К до 300 К скорость реакции увеличивается в 2 раза.
Р е ш е н и е
Согласно основному закону химической кинетики, скорость реакции и константа скорости реакции прямо пропорциональны друг другу, то есть выполняется соотношение
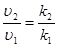
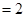 .
.
Подставим это в формулу для расчета энергии активации
ЕА = 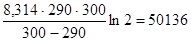 Дж/моль.
Дж/моль.
Пример 3. Определите, на какую величину произошло снижение энергии активации при введении в систему катализатора, если при температуре 450 К в присутствии катализатора скорость реакции увеличилась в 1000 раз.
Р е ш е н и е
Преобразуем уравнение 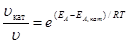 к виду
к виду
(ЕА, кат – ЕА) = R × T×ln 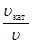 .
.
По условию задачи 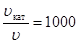 , тогда
, тогда
(ЕА, кат – ЕА) = 8,314 × 450 × ln1000 = 25844 Дж/моль.
§4. Химическое равновесие.
Все самопроизвольные реакции можно разделить на две группы:
1) необратимые реакции, идущие до конца и не изменяющие своего направления при изменении температуры и давления.
Химические реакции принято считать необратимыми, если: - один из продуктов выводится из зоны реакции в виде газа, осадка, малодисоциированного соединения или комплекса; -выделяется большое количество теплоты (реакция горения).
2) большинство химических реакций является обратимыми. При одних условиях они идут в прямом направлении, при других – в обратном, а при некоторых промежуточных – протекают одновременно в двух взаимно противоположных направлениях.
Любая химическая реакция может стать необратимой, если вывести вещество из зоны реакции или изменить условия её протекания.
Состояние системы, при котором скорости прямой и обратной реакции равны, называются химическим равновесием, а концентрации реагирующих веществ равновесными.
По мере прохождения реакции наступит такой момент, когда 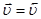 .
.
Такое состояние называется химическим равновесием.
H2 + I2 = 2HI
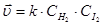
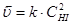
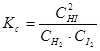
Химическое равновесие является динамическим, т.е. его установление не означает прекращения реакции. Различают 2 вида химического равновесия: истинное и метастабильное (заторможенное).
Признаки истинного химического равновесия: - скорости прямой и обратной реакций равны; - при сохранении внешних условий состояния системы не изменяется во времени; - при изменении внешних условий система приходит к новому состоянию равновесия; - состояние системы не зависит от того, с какой стороны она подходит к равновесию; - ΔGP,T = 0 термодинамическое условие химического равновесия; - КР = 1.
В общем случае для любой обратимой гомогенной реакции выражение константы равновесия может быть записано:
аА + вВ ↔ сС + дД
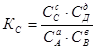
Кс – определяет глубину протекания процесса, если Кс → ∞, реакция является практически необратимой; если Кс → 0, то это свидетельствует о полном отсутствии взаимодействия между исходными веществами. В выражение для константы равновесия входят только равновесные концентрации газообразных участников реакции.
Химическое равновесие между газообразными веществами при небольших давлениях можно выразить с помощью парциальных давлений Рi участников реакции:
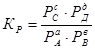
Между Кс и Кр существует определенное соотношение уравнение Менделеева-Клапейрона (Р ·V = C ·R ·T).
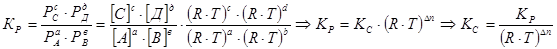
где Δn – разность числа мольгазообразных продуктов и исходных реагентов химической реакции.
Если реагенты находятся в состояниях отличных от стандартного, то изменение энергии Гиббса рассчитывается по уравнению изотермы Вант-Гоффа:
aA + bB = cC + dD
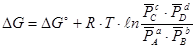
где 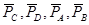 - относительное парциальное давление соответствующих веществ.
- относительное парциальное давление соответствующих веществ.
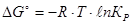
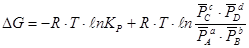
Для гетерогенных реакций закон действующих масс выполняется при условии, что в уравнения констант равновесия не входят равновесные концентрации (парциальные давления) твердых исходных веществ и продуктов реакции. Например, для гетерогенной реакции
Сграфит + 2Н2Огаз « СО2 + 2Н2
константа равновесия выражается уравнением
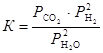 .
.
Константа химического равновесия зависит от природы реагирующих веществ и от температуры. Влияние температуры на К определяется знаком теплового эффекта реакции. Для эндотермической реакции (Q < 0) при повышении температуры константа равновесия увеличивается, и наоборот, для экзотермической реакции (Q > 0) при возрастании температуры К уменьшается. Строгую связь между температурой и константой равновесия реакции, протекающей при постоянном давлении, отражает уравнение изобары Вант-Гоффа
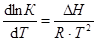 ,
,
где lnК – натуральный логарифм константы равновесия; DН – изменение энтальпии реакции; R – универсальная газовая постоянная; Т –абсолютная температура, К. Из уравнения видно, что при увеличении абсолютного значения энтальпии реакции и уменьшении температуры чувствительность К к изменению температуры повышается. Используя уравнение изобары Вант-Гоффа, можно вывести формулу для расчета среднего значения DН реакции, если известны значения константы равновесия при двух температурах
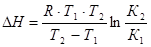 ,
,
где К1, К2 – константы равновесия реакции при температурах Т1 и Т2 соответственно.
Дата: 2018-12-21, просмотров: 742.