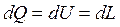 (3.5)
(3.5)
Формула (3.5) выражает самое общее выражение первого закона термодинамики
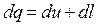 (3.6)
(3.6)
(3.6) – первый закон, записанный через удельные величины
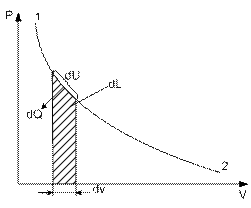
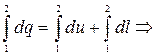
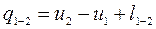 (3.7)
(3.7)
Формула (3.7) - первый закон термодинамики для конечного процесса.
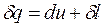 (3.8)
(3.8)
Выражение (3.7) получено из (3.6) с учетом того, что теплота и работа – это функции процесса или, dq и dl не являются полными дифференциалами. Поэтому, вместо (3.6) часто записывают выражение (3.8), где d q и d l – просто бесконечно-малые величины, а не дифференциалы.
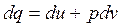 (3.9)
(3.9)
(3.9) - первый закон термодинамики для случая, когда работа равна только работе изменения объема.
Энтальпия
Этот параметр широко используется в технике. Дадим сначала его математическое определение.
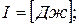
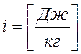
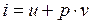 - энтальпия (3.10)
- энтальпия (3.10)

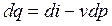 - первый закон термодинамики через энтальпию (3.11)
- первый закон термодинамики через энтальпию (3.11)
Рассмотрим газ в цилиндре с поршнем. Давление газа уравновешивается
грузом G. Это позволяет выяснить физический смысл энтальпии
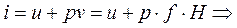
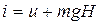

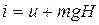 (3.12)
(3.12)
Из формулы (3.12) следует, что энтальпия равна внутренней энергии данной системы плюс потенциальная энергия взаимодействия с окружающей средой. Сравнивая (3.11) и (3.9) и при этом учитывая (3.12) можно сделать вывод, что величина
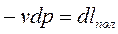 (3.13)
(3.13)
имеет смысл работы.
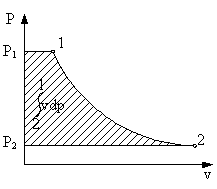 Формула (3.13) представляет собой полезную (располагаемую) работу.
Формула (3.13) представляет собой полезную (располагаемую) работу.
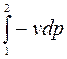
Таким образом, полезная работа в координатах (P-V) численно равна площади между кривой процесса и осью Р.
Теплоемкость
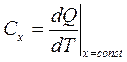 (3.14)
(3.14)
Формула (3.14) - математическое определение теплоемкости, где х - условие процесса
3.7 Зависимость теплоемкости от количества вещества
1. Массовая - теплоемкость, отнесенная к одному килограмму масс.
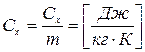
2. Объемная - 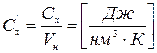
3. Мольная - теплоемкость, отнесенная к одному молю газа
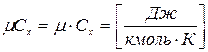
Связь теплоемкости с другими параметрами
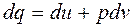
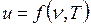
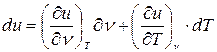 (*)
(*)
Разделим (*) на dT:
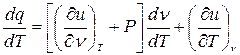
1. 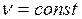
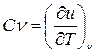 (4.1)
(4.1)
Формула (4.1) справедлива для любого рабочего тела.
Для идеального газа 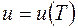 .
.
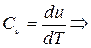
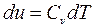 (4.2)
(4.2)
Формула (4.2) справедлива только для идеального газа.
2. 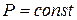
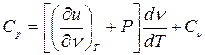 (4.3)
(4.3)
Формула (4.3) определяет теплоемкость Ср для любого рабочего тела и показывает, насколько Ср больше, чем Сv.
Идеальный газ.
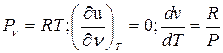
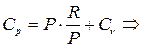
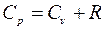 (4.4)
(4.4)
Формула (4.4) выражает закон Майера.
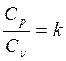 - показатель адиабаты (4.5)
- показатель адиабаты (4.5)
k зависит от числа атомов в молекуле газа:
k =1.67 - одноатомные газы;
k = 1.4 - двухатомные газы.
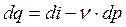
если взять  , то
, то 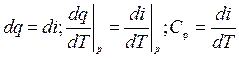
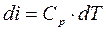 (4.6)
(4.6)
(4.6) – для энтальпии.
Зависимость теплоемкости от температуры
Во всех вышеприведенных формулах используется истинная теплоемкость:
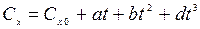
Введем понятие средней теплоемкости на некотором интервале изменения температуры.
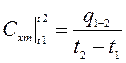 (4.7)
(4.7)
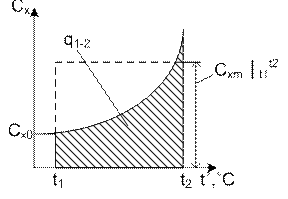
Формула (4.7) определяет среднюю теплоемкость в интервале (t1, t2)
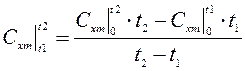 (4.8)
(4.8)
(4.8) - рабочая формула для определения средней теплоемкости, при этом
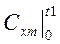 и
и 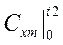 берут из справочных таблиц.
берут из справочных таблиц.
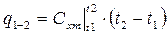 (4.9)
(4.9)
(4.9) - расчетная формула для теплоты, в ней 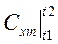 находится по (4.8)
находится по (4.8)
Теплоемкость смеси идеальных газов
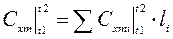 (4.10)
(4.10)
(4.10) - массовая теплоемкость.
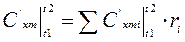 (4.11)
(4.11)
(4.11) - для объемной теплоемкости.
Раздел 4 Второй закон термодинамики
Энтропия
Это одно из наиболее сложных понятий термодинамики. Физический
смысл его мы рассмотрим в дальнейшем, а пока дадим математическое определение.
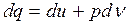
Рассмотрим частный случай идеального газа: 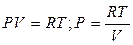
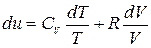 (4.12)
(4.12)
Формула (4.12) не является полным дифференциалом, поэтому умножим левую и правую часть на интегрирующий множитель (1/Т)
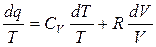 (4.13)
(4.13)
(4.13) - полный дифференциал
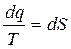 (4.14)
(4.14)
(4.14) - здесь вводится новый параметр - S. Клаузиус назвал его энтропией. В переводе это означает - «преобразование»
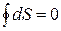 (4.15)
(4.15)
Т.е. энтропия является функцией состояния, также как и внутренняя энергия.
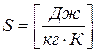
Энтропия является аддитивной величиной (экстенсивной), т.е. ее можно складывать. Пример аддитивных величин: S,U,V, m и др.
Величины, которые нельзя складывать, называют неаддитивными (интенсивными)
Пример: Т, Р, ρ, v.
Формулу (4.13) проинтегрируем:
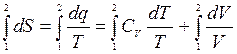 , если
, если 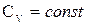 , то
, то
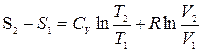 (4.16)
(4.16)
Формула (4.16) служит для вычисления изменения энтропии.
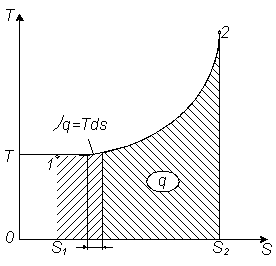
В координатах (T,S) площадь между кривой процесса и осью энтропии численно равна теплоте, поэтому такую диаграмму называют тепловой.
Дата: 2018-12-21, просмотров: 686.